Halogene Gliederung 1 Eigenschaften 2 Vorkommen 3 Herstellung



















- Slides: 29

Halogene

Gliederung 1. Eigenschaften 2. Vorkommen 3. Herstellung 4. Chemisches Verhalten 5. Polyhalogenid-Ionen 6. Halogenwasserstoffe 7. Halogenide 8. Sauerstoffsäuren der Halogene 9. Literatur 2

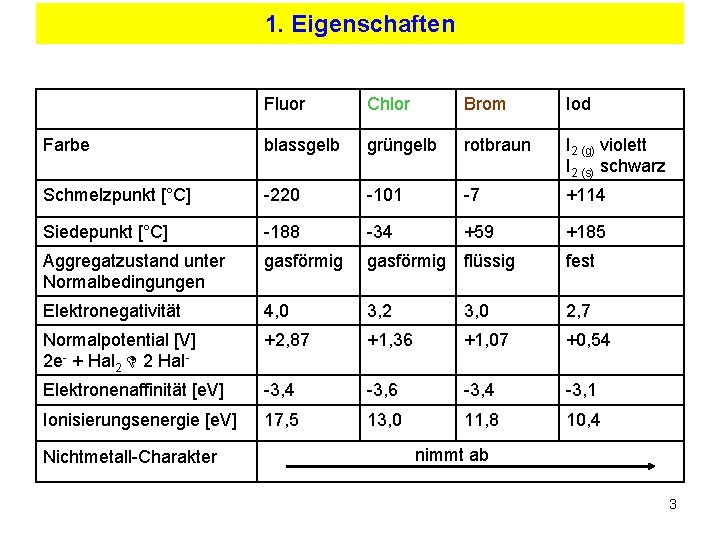
1. Eigenschaften Fluor Chlor Brom Iod Farbe blassgelb grüngelb rotbraun I 2 (g) violett I 2 (s) schwarz Schmelzpunkt [°C] -220 -101 -7 +114 Siedepunkt [°C] -188 -34 +59 +185 Aggregatzustand unter Normalbedingungen gasförmig flüssig fest Elektronegativität 4, 0 3, 2 3, 0 2, 7 Normalpotential [V] 2 e- + Hal 2 D 2 Hal- +2, 87 +1, 36 +1, 07 +0, 54 Elektronenaffinität [e. V] -3, 4 -3, 6 -3, 4 -3, 1 Ionisierungsenergie [e. V] 17, 5 13, 0 11, 8 10, 4 Nichtmetall-Charakter nimmt ab 3

1. 1 Sublimation von Iod 4

1. 2 Verdampfen von Brom 5

1. 3 Reaktionsgeschwindigkeit Hg. Cl 2 + 2 KI D Hg. I 2 + 2 KCl (farblos) (rot) 6

2. Vorkommen Ø Fluor ü Flussspat (Ca. F 2) ü Apatit Ca 5(PO 4)3(OH, F) ü Kryolith Na 3[Al. F 6] Ø Chlor ü als Chlorid-Ionen im Meerwasser ü Steinsalz Na. Cl ü Sylvin KCl Ø Brom ü als Bromid-Ionen im Meerwasser und in Solen ü Bromsylvinit K(Cl, Br) Ø Iod ü Beimengung in Form von Iodat-Ionen Ca(IO 3)2 in Chilesalpeter Na. NO 3 ü Anlagerung in Plankton 7

3. Herstellung Wegen ihrer großen Reaktionsfähigkeit kommen die Halogene in der Natur nicht elementar vor. Aufarbeitung erforderlich 8

3. 1 Fluor Ø Labor: Zerfall eines instabilen Fluorids (z. B. K 2 Mn. F 6) 2 KMn. O 4 + 2 KF + 10 HF + 3 H 2 O 2 → 2 K 2 Mn. F 6 + 8 H 2 O + 3 O 2 Sb. Cl 5 + 5 HF → Sb. F 5 + 5 HCl K 2 Mn. F 6 + 2 Sb. F 5 Ø Technik: 2 KSb. F 6 + Mn. F 3 + ½ F 2↑ wasserfreie Elektrolyse einer KF·x. HF-Schmelze +1 Kathode: 0 2 HF + e- → ½ H 2↑ + HF 2 -1 (Reduktion) 0 Anode: HF 2 → HF + + ½ F 2↑ (Oxidation) ________________________ - HF e- → ½ H 2↑ + ½ F 2↑ 9

3. 2 Chlor Ø Labor: Weldon-Verfahren (1866) Mn. O 2 (s) + 4 HCl(aq) → Mn. Cl 2 (aq) + 2 H 2 O(l) + 2 Cl 2 (g)↑ (Weldon-Verfahren) Ø Technik: (Chloralkali-Elektrolyse) Chloralkali-Elektrolyse 2 Na+ + 2 Cl- + 2 H 2 O → 2 Na+ + 2 OH- + H 2↑ + Cl 2↑ (Amalgam-, Diaphragma-, Membran-Verfahren) 10

3. 3 Brom Ø Labor: Oxidation von KBr mit KMn. O 4 und H 2 SO 4 (cc) 2 Mn. O 4 -(aq) + 10 Br-(aq) + 16 H 3 O+(aq) → 4 Mn 2+(aq) + 5 Br 2 (aq) + 24 H 2 O(l) Ø Technik: Oxidation von gelöstem Bromid in Meerwasser durch Chlor 2 Br-(aq) + Cl 2 (g) D Br 2 (aq) + 2 Cl-(aq) 11

3. 4 Iod Ø Labor: Oxidation von KI mit Na 2 Cr 2 O 7 und H 2 SO 4 (cc) Cr 2 O 72 -(aq) + 6 I-(aq) + 14 H+(aq) → 2 Cr 3+(aq) + 3 I 2 (s) + 7 H 2 O(l) Ø Technik: (I) Oxidation von Iodid-haltigen Sohlen mit Chlor 2 Br-(aq) + Cl 2 (g) D Br 2 (aq) + 2 Cl-(aq) (II) Aufarbeitung von Iodat-haltigem Chilesalpeter HIO 3 + 3 SO 2 + 3 H 2 O D HI + 3 H 2 SO 4 HIO 3 + 5 HI D 3 I 2 + 3 H 2 O 12

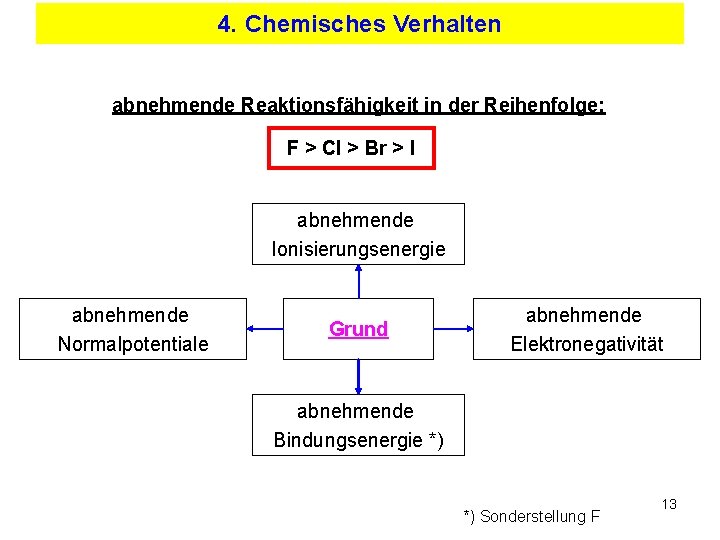
4. Chemisches Verhalten abnehmende Reaktionsfähigkeit in der Reihenfolge: F > Cl > Br > I abnehmende Ionisierungsenergie abnehmende Normalpotentiale Grund abnehmende Elektronegativität abnehmende Bindungsenergie *) *) Sonderstellung F 13

4. 1 Fluor Ø reaktionsfähigstes Element (Ausnahmen: He, Ne, Ar, N 2) Ø Ätzwirkung von Glas: Bildung von Fluorwasserstoff: 2 F 2 (g) + 2 H 2 O(l) → 4 HF(g) + O 2 (g) Ätzwirkung: 2 HF(g/aq) + Si. O 2 (s) → Si. F 4 (g)↑ + 2 H 2 O(l) Si. F 4 (g) + (n+2) H 2 O(l) → (Si. O 2·n. H 2 O)(aq/s) + 2 HF 14

4. 2 Chlor Ø sehr reaktiv Ø Ausbildung von kovalenten Bindungen mit Ni. Me, z. B: Phosphor 2 P(s) + 3 Cl 2 (g) → 2 PCl 3 (s) 15

4. 3 Brom (reagiert analog Chlor; nur mit geringerer Reaktionsfähigkeit) 2 Sb + 3 Br 2 → 2 Sb. Br 3 Cu + Br 2 → Cu. Br 2 Mg + Br 2 → Mg. Br 2 16

4. 4 Iod (noch weniger reaktiv als Brom; reagiert aber noch direkt mit einigen Metallen) 2 Fe + 3 I 2 → 2 Fe. I 3 Zn + I 2 → Zn. I 2 Mg + I 2 → Mg. I 2 17

5. Polyhalogenid-Ionen Bsp: Triiodid (I 3 -) ü Entstehung: I 2 + I - D I 3 - ü Iodstärke-Reaktion: Einschlussverbindung von I 3 - in α-Helix der Amylose → Blaufärbung („Charge-Transfer“) 18

6. Halogenwasserstoffe Ø Darstellung: 1. direkt aus den Elementen H 2 + Hal 2 D 2 HHal 2. Austreiben aus ihren Salzen mit Säuren Ø Bsp. zu 2. HCl: Na. Cl(s) + H 2 SO 4 (aq) D Na. HSO 4 (aq) + HCl(g)↑ Na. Cl + Na. HSO 4 (aq) D Na 2 SO 4 (aq) + HCl(g)↑ 19

Zerlegung der Halogenwasserstoffe durch Elektrolyse am Beispiel von Salzsäure -1 Anode: Cl-(aq) 0 → Cl(g) + +1 e- 2 Cl(g) → Cl 2 (g)↑ │∙ 2 +1 0 Kathode: H 3 O+(aq) + e- → H 2 O(l) + H(g) │∙ 2 2 H(g) → H 2 (g)↑ 20

7. Halogenide Ø Halogenide zu allen Elementen bekannt (Ausnahmen: He, Ne, Ar) Ø Abnahme des ionischen Charakters im Einklang mit der EN: Fluorid > Chlorid > Bromid > Iodid Ø gute Löslichkeit in Wasser (Ausnahme: Fluoride) 21

7. 1 Darstellung 1. Direkte Synthese aus den Elementen Bsp: Me + Hal 2 → Me. Hal 2 (Me = zweiwertig) 1. 2. Reaktion von Halogenwasserstoffen mit Metalloxiden 2. Bsp: Me. O + 2 HCl D Me. Cl 2 + H 2 O (Me = zweiwertig) 3. Umhalogenierung Bsp: Br 2 + 2 I- D 2 Br- + I 2 (violette Farbe in CHCl 3) 22

7. 2 Leitfähigkeit -1 Anode: 0 2 Cl-(l) → Cl 2 (g)↑ + 2 e+1 Kathode: 2 Li+ (Oxidation) 0 (s) +2 e- → 2 Li(s) (Reduktion) 23

7. 3 Nachweis der Halogenide Bildung von Silberhalogenid: Lösen von Silberchlorid mit NH 3: Ag+(aq) + Cl-(aq) D Ag. Cl(s)↓ (weiß) Ag. Cl(s) + 2 NH 3 (aq) D [Ag(NH 3)2]+(aq) + Cl-(aq) Ag+(aq) + Br-(aq) D Ag. Br(s)↓ (blassgelb) Lösen von Silberbromid mit Na 2 S 2 O 3: Ag+(aq) + I-(aq) D Ag. I(s)↓ (gelb) Ag. Br(s) + 2 S 2 O 32 -(aq) D [Ag(S 2 O 3)2]3 -(aq) + Br-(aq) 24

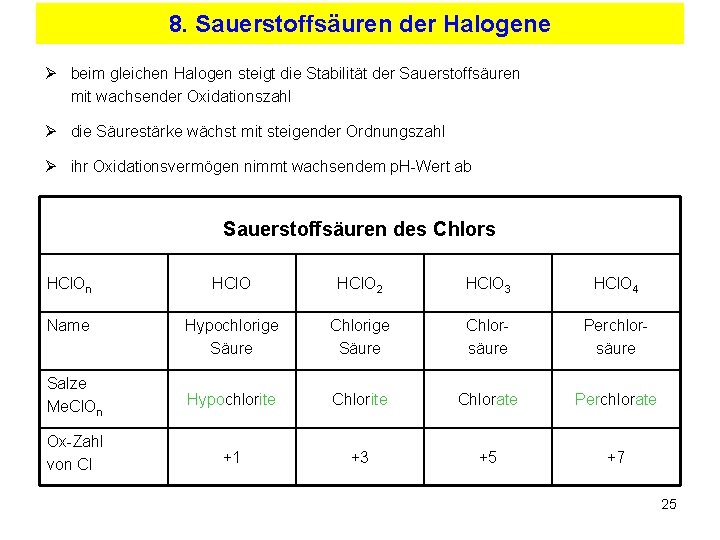
8. Sauerstoffsäuren der Halogene Ø beim gleichen Halogen steigt die Stabilität der Sauerstoffsäuren mit wachsender Oxidationszahl Ø die Säurestärke wächst mit steigender Ordnungszahl Ø ihr Oxidationsvermögen nimmt wachsendem p. H-Wert ab Sauerstoffsäuren des Chlors HCl. On HCl. O 2 HCl. O 3 HCl. O 4 Name Hypochlorige Säure Chlorsäure Perchlorsäure Salze Me. Cl. On Hypochlorite Chlorate Perchlorate Ox-Zahl von Cl +1 +3 +5 +7 25

8. 1 Hypochlorige Säure Ø Eigenschaften ü schwache Säure ü starkes Oxidationsmittel Ø Vergiftungsgefahr: Mischen von Chlorreiniger und Essigreiniger Chlor (!) 2 H 3 O+(aq) + 2 OCl-(aq) D 3 H 2 O(l) + Cl 2 (g)↑ 26

8. 2 Kaliumchlorat +1 +5 Ø Darstellung: 3 Cl. O-(aq) -1 Cl. O 3 -(aq) + 2 Cl-(aq) (Disproportionierung) Ø Verwendung: Feuerwerk, Zündhölzer +5 0 KCl. O 3 (s) + 3 C(s) -1 +2 KCl(s) + 3 CO(g)↑ 27

9. Literaturverzeichnis • • • Fluck, Ekkehard; Mahr, Carl (1985): Anorganisches Grundpraktikum. Für Chemiker und Studierende der Naturwissenschaften. 6. Auflage. Weinheim: VCH. Gerstner, Ernst (1993): Skriptum zum Anorganisch-Chemischen Praktikum für Lehramtskandidaten. Marburg. Hollemann, Nils; Wiberg, Egon (1985): Lehrbuch der Anorganischen Chemie. 100. Auflage. Berlin; New York: De Gruyter. Kuhnert, Rudi; Legall, Wolf-Dieter (1990): Chemische Schulexperimente mit Küvetten. Eine Anleitung für den Lehrer. 2. Auflage. Berlin: Verlag Volk und Wissen. Nöding, Siegfried; Flohr, Fritz (1979): Methodik, Didaktik und Praxis des Chemieunterrichts. 4. Auflage. Heidelberg: Quelle und Meyer. S. 273. Riedel, Erwin (1999): Anorganische Chemie. 4. Auflage. Berlin; New York: Walter de Gruyter. Römpp, Hermann; Raaf, Hermann (1983): Chemische Experimente, die gelingen. Viele gefahrlose Versuche mit einfachen Mitteln. 21. Auflage. Stuttgart: Franckh’sche Verlagshandlung. Struck, Werner (1973): Chemische Demonstrationsversuche in der Projektion. Hannover: Schroedel-Verlag. diverse Artikel aus Fachdidaktik-Zeitschriften 28

das wars 29