Konfiguracja elektronowa powoki walencyjnej na przykadzie atomu Cl










- Slides: 13

Konfiguracja elektronowa powłoki walencyjnej na przykładzie atomu: Cl, S, N, C, O - Stany podstawowe, - Stany wzbudzone, - Hybrydyzacja orbitali

Konfiguracja elektronowa powłoki walencyjnej atomu chloru – rozparowanie eletronów v Stan podstawowy: 3 s 2 3 p 5 3 s 3 p v Pierwszy wzbudzony: 3 s 2 3 p 4 3 d 1 v Drugi wzbudzony: 3 s 2 3 p 3 3 d 2 v Trzeci wzbudzony: 3 s 1 3 p 3 3 d

Konfiguracja elektronowa powłoki walencyjnej atomu siarki – rozparowanie elektronów v Stan podstawowy: 3 s 2 3 p 4 3 s 3 p v Pierwszy wzbudzony: 3 s 2 3 p 3 3 d 1 v Drugi wzbudzony: 3 s 1 3 p 3 3 d 2 3 d

Hybrydyzacja • Hybrydyzacja (operacja matematyczna) – tworzenie superpozycji (orbitali pośrednich – hybryd), czyli dodawanie lub odejmowanie orbitali z tej samej powłoki elektronowej • Teoria hybrydyzacji wyjaśnia powstawanie równocennych energetycznie (o tej samej energii i długości) wiązań kowalencyjnych z różniących się energetycznie orbitali atomowych • Teoria hybrydyzacji umożliwia przewidywanie przestrzennej konfiguracji atomów lub struktury (kształtu) cząsteczek i wieloatomowych jonów

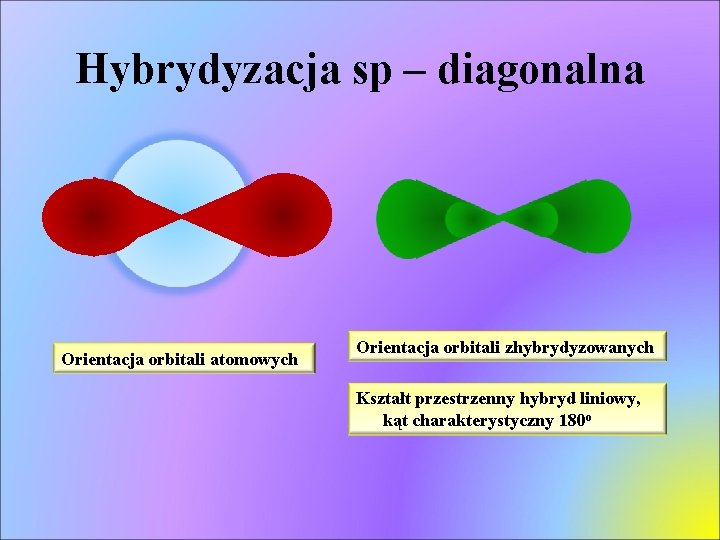
Hybrydyzacja sp – diagonalna Orientacja orbitali atomowych Orientacja orbitali zhybrydyzowanych Kształt przestrzenny hybryd liniowy, kąt charakterystyczny 180 o

Hybrydyzacja sp 2 – trygonalna Orientacja orbitali zhybrydyzowanych Orientacja orbitali atomowych Kształt przestrzenny hybryd trójkątny, kąt charakterystyczny 120 o

Hybrydyzacja sp 3 – tetraedryczna Orientacja orbitali zhybrydyzowanych Orientacja orbitali atomowych Kształt przestrzenny hybryd tetraedryczny , kąt charakterystyczny 109 o 28`

Hybrydyzacja atomu węgla v Stan podstawowy 1 s 2 2 p 2 v Stan wzbudzony 1 s 2 2 s 1 2 p 3 v Hybrydyzacja sp 3 – tetraedryczna (ze stanu wzbudzonego) 1 s 2 4 orbitale sp 3 v Hybrydy sp 3 mogą utworzyć z innym atomami (np. H, C, Cl, Br, O, N ) 4 równocenne energetycznie wiązania sigma ( σ)

Hybrydyzacja atomu węgla cd v Hybrydyzacja sp 2 – trygonalna (ze stanu wzbudzonego) 1 s 2 Hybrydy sp 2 mogą utworzyć z innymi atomami (np. z H, C, O, 2 s 1 2 p 3 Cl, Br) 3 równocenne energetycznie wiązania sigma 1 s 2 (σ) natomiast orbital 2 p 1 utworzy z drugim atomem C 3 orbitale sp 2 lub O o tej samej hybrydyzacji drugie wiązanie pi (π) 2 p 1 v Hybrydyzacja sp – diagonalna (ze stanu wzbudzonego) Hybrydy sp mogą utworzyć z 1 s 2 innymi atomami (np. z H, C, O, 1 3 Cl, Br) 2 równocenne 2 s 2 p energetycznie wiązania sigma 2 1 s (σ) natomiast 2 orbitale 2 p 2 utworzą z drugim at. C o tej 2 orbitale sp samej hybrydyzacji dwa wiązania pi (π) 2 p 2

Hybrydyzacja sp 3 atomu azotu v Konfiguracja elektronowa atomu N w stanie podstawowym: 1 s 2 2 p 3 v Stan zhybrydyzowany 1 s 2 4 orbitale sp 3 Ø jeden z 4 – ch orbitali zhybrydyzowanych sp 3 obsadza para elektronowa v Atom azotu nie może osiągnąć stanu wzbudzonego (rozparowania pary elektronowej na orbitalu 2 p), ponieważ w powłoce L nie może wystąpić orbital d

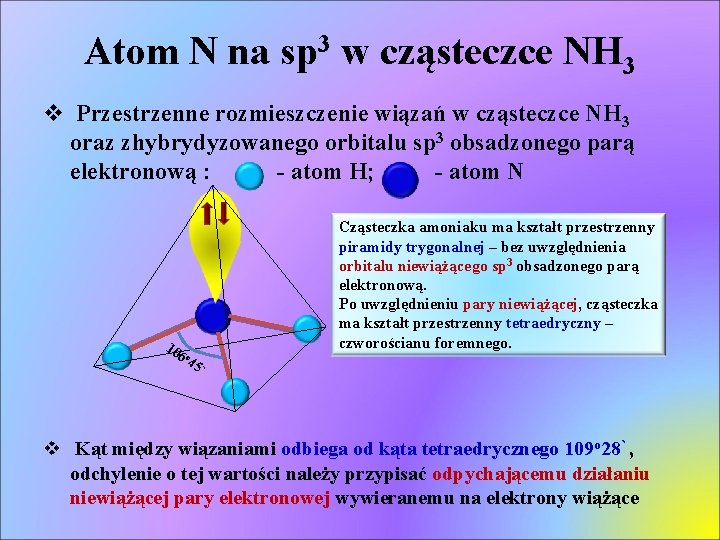
Atom N na sp 3 w cząsteczce NH 3 v Przestrzenne rozmieszczenie wiązań w cząsteczce NH 3 oraz zhybrydyzowanego orbitalu sp 3 obsadzonego parą elektronową : - atom H; - atom N 10 6 o 4 Cząsteczka amoniaku ma kształt przestrzenny piramidy trygonalnej – bez uwzględnienia orbitalu niewiążącego sp 3 obsadzonego parą elektronową. Po uwzględnieniu pary niewiążącej, cząsteczka ma kształt przestrzenny tetraedryczny – czworościanu foremnego. 5` v Kąt między wiązaniami odbiega od kąta tetraedrycznego 109 o 28`, odchylenie o tej wartości należy przypisać odpychającemu działaniu niewiążącej pary elektronowej wywieranemu na elektrony wiążące

Hybrydyzacja sp 3 atomu tlenu v Konfiguracja elektronowa atomu O w stanie podstawowym: 1 s 2 2 p 3 v Stan zhybrydyzowany 1 s 2 4 orbitale sp 3 Ø dwa z 4 – ch orbitali zhybrydyzowanych sp 3 obsadzają pary elektronowe v Atom tlenu nie może osiągnąć stanu wzbudzonego (rozparowania pary elektronowej na orbitalach 2 p), ponieważ w powłoce L nie może wystąpić orbital d

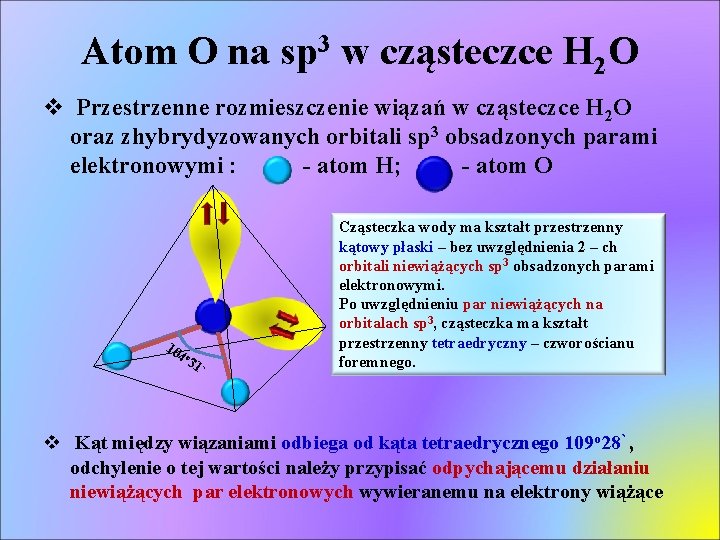
Atom O na sp 3 w cząsteczce H 2 O v Przestrzenne rozmieszczenie wiązań w cząsteczce H 2 O oraz zhybrydyzowanych orbitali sp 3 obsadzonych parami elektronowymi : - atom H; - atom O 10 4 o 3 1` Cząsteczka wody ma kształt przestrzenny kątowy płaski – bez uwzględnienia 2 – ch orbitali niewiążących sp 3 obsadzonych parami elektronowymi. Po uwzględnieniu par niewiążących na orbitalach sp 3, cząsteczka ma kształt przestrzenny tetraedryczny – czworościanu foremnego. v Kąt między wiązaniami odbiega od kąta tetraedrycznego 109 o 28`, odchylenie o tej wartości należy przypisać odpychającemu działaniu niewiążących par elektronowych wywieranemu na elektrony wiążące