Wglowodory aromatyczne areny cz I struktura arenw i





- Slides: 18

Węglowodory aromatyczne – areny (cz. I) Ø struktura arenów i ich homlogi oraz nazewnictwo: ü struktura arenów o pierścieniach skondensowanych, ü struktura węglowodorów o wielu pierścieniach benzenowych połączonych bezpośrednio, ü struktura węglowodorów o wielu pierścieniach benzenowych połączonych łańcuchem węglowym, ü podstawnik fenylowy i benzylowy, ü struktura benzenu ü homologi benzenu i naftalenu, Ø właściwości fizyczne arenów, Ø metody otrzymywania arenów,

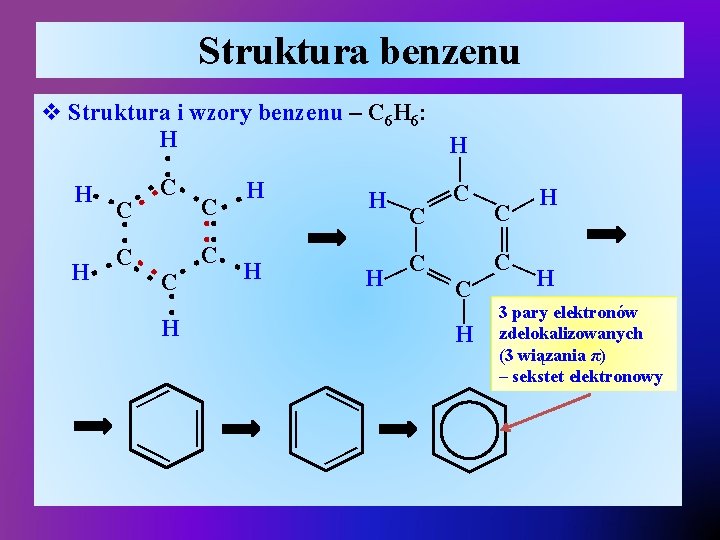
Struktura benzenu : : H— H C— H— — — C— H — C C— H C— — : H H — C — : C: C — — : C — : H C C — H : : : : H : C — v Struktura i wzory benzenu – C 6 H 6: H H — 3 pary elektronów zdelokalizowanych (3 wiązania π) – sekstet elektronowy

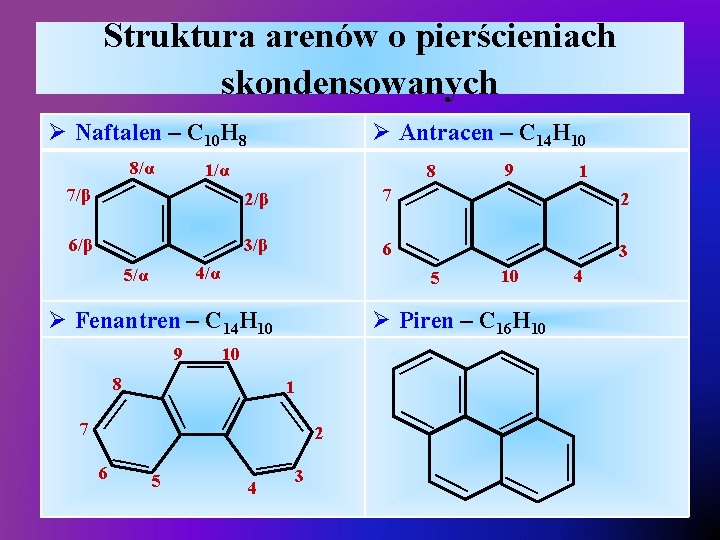
Struktura arenów o pierścieniach skondensowanych 3/β — 4/α 6 5 5 — — — 3 4 — — — 6 2 — — 7 1 2 3 — 4 Ø Piren – C 16 H 10 10 — 8 1 — 10 — Ø Fenantren – C 14 H 10 9 — — 7 — — 2/β 9 — — 5/α 8 — 6/β — — 7/β 1/α — 8/α Ø Antracen – C 14 H 10 — Ø Naftalen – C 10 H 8

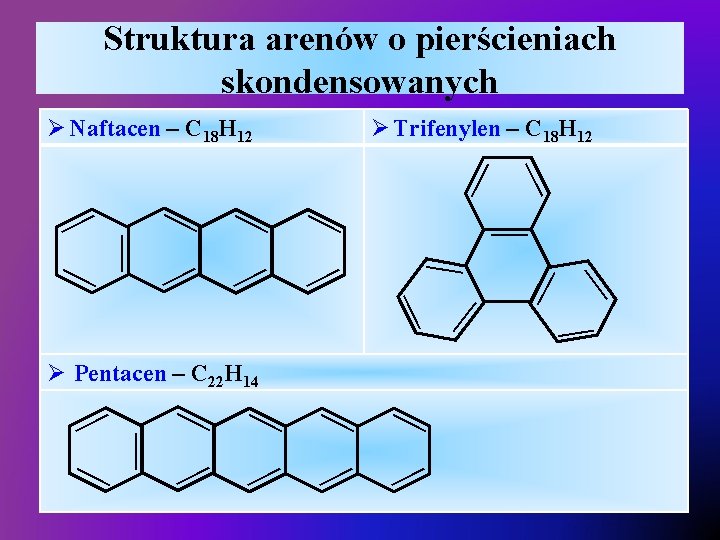
Struktura arenów o pierścieniach skondensowanych Ø Trifenylen – C 18 H 12 Ø Pentacen – C 22 H 14 — — — — — — — Ø Naftacen – C 18 H 12 —

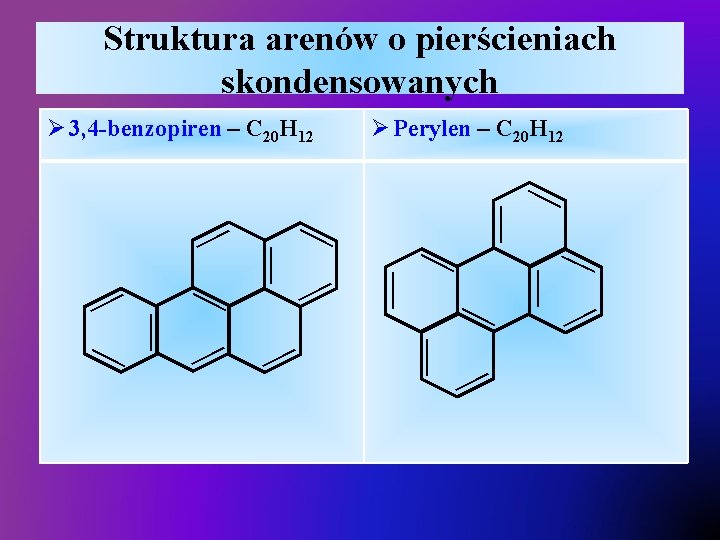
Struktura arenów o pierścieniach skondensowanych Ø 3, 4 -benzopiren – C 20 H 12 Ø Perylen – C 20 H 12 — — — — —

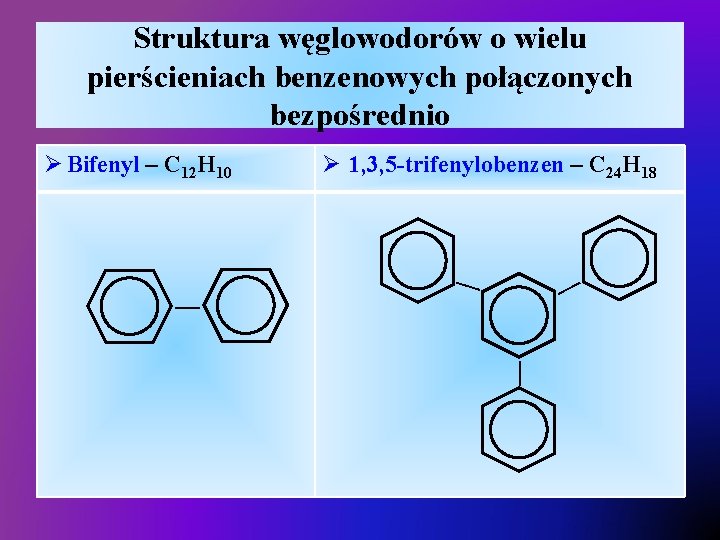
Struktura węglowodorów o wielu pierścieniach benzenowych połączonych bezpośrednio — — — Ø 1, 3, 5 -trifenylobenzen – C 24 H 18 — Ø Bifenyl – C 12 H 10

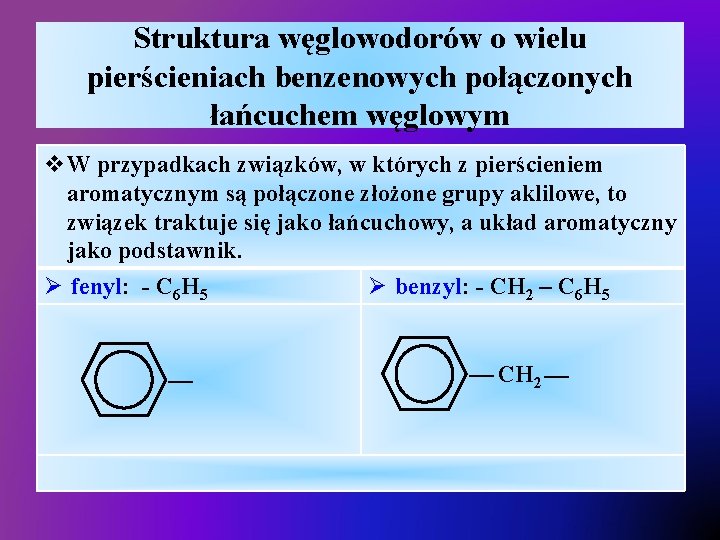
Struktura węglowodorów o wielu pierścieniach benzenowych połączonych łańcuchem węglowym v. W przypadkach związków, w których z pierścieniem aromatycznym są połączone złożone grupy aklilowe, to związek traktuje się jako łańcuchowy, a układ aromatyczny jako podstawnik. Ø fenyl: - C 6 H 5 Ø benzyl: - CH 2 – C 6 H 5 — — CH 2 —

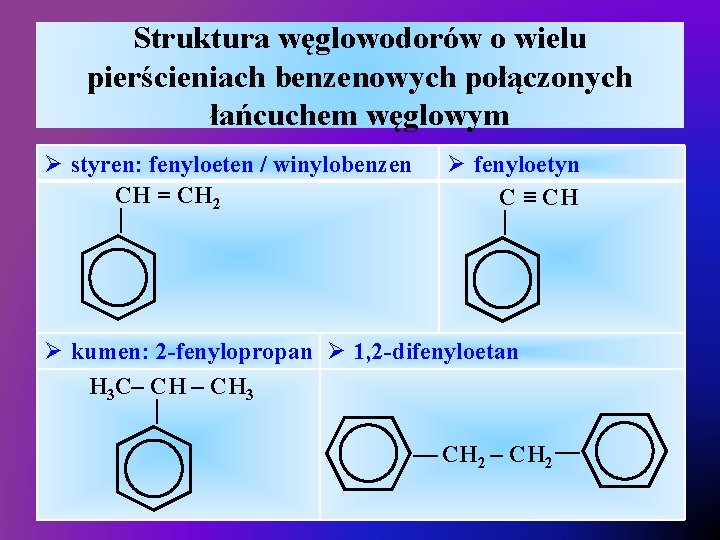
Struktura węglowodorów o wielu pierścieniach benzenowych połączonych łańcuchem węglowym Ø fenyloetyn C ≡ CH — — Ø styren: fenyloeten / winylobenzen CH = CH 2 — Ø kumen: 2 -fenylopropan Ø 1, 2 -difenyloetan H 3 C– CH 3 — CH 2 – CH 2 —

Struktura arenów v Struktura benzenu: Ø cząsteczka jest układem płaskim, w którym atomy węgla tworzą sześciokąt foremny, Ø długość wiązania jest pośrednią wiązania pojedynczego (154 pm) i wiązania podwójnego (134 pm), Ø każdy atom węgla jest związany z jednym atomem wodoru wiązaniem o długości 109 pm, Ø przyjmuje się, że atomy węgla znajdują się stanie hybrydyzacji sp 2, Ø każdy atom węgla tworzy 3 wiązania σ ułożone w jednej płaszczyźnie, z czego: ü dwa wiązania powstają przez nałożenie się z zhybrydyzowanymi orbitalami sp 2 sąsiednich atomów węgla, ü jedno wiązanie tworzy się przez nałożenie się z ortbitalem 1 s atomu wodoru, wszystkie wiązanie σ tworzą kąty 120 o,

Struktura arenów v Struktura benzenu cd. : Ø pozostałych sześć elektronów jest zdelokalizowanych symetrycznie na skutek nałożenia się orbitali pz sześciu atomów węgla, każdy Ø orbital pz pokrywa się z dwoma takimi samymi sąsiednimi orbitalami, Ø układ benzenu z sześcioma zdelokalizowanymi elektronami (sekstet elektronowy) wykazuje niską energię wewnętrzną i tym dużą trwałość, Ø równoważne wzory uproszczone benzenu: — — —

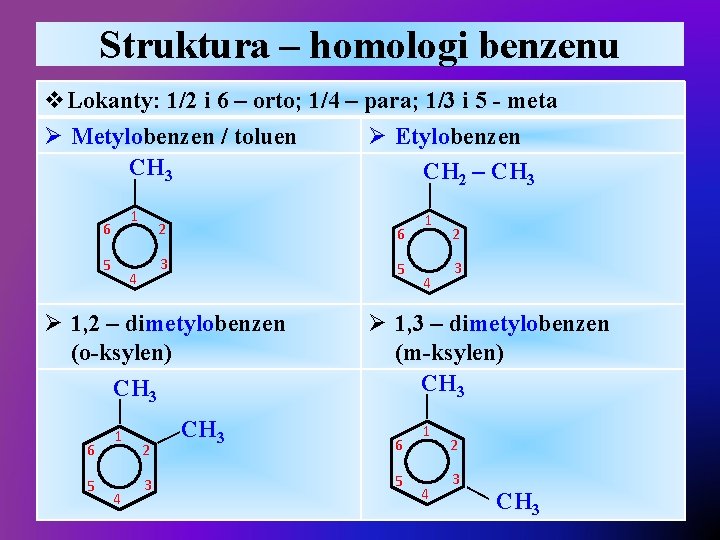
Struktura – homologi benzenu 1 6 5 4 — — v. Lokanty: 1/2 i 6 – orto; 1/4 – para; 1/3 i 5 - meta Ø Metylobenzen / toluen Ø Etylobenzen CH 3 CH 2 – CH 3 2 6 3 5 6 5 1 4 2 3 —CH 3 4 2 3 Ø 1, 3 – dimetylobenzen (m-ksylen) CH 3 — — Ø 1, 2 – dimetylobenzen (o-ksylen) CH 3 1 6 5 1 4 2 3 — CH 3

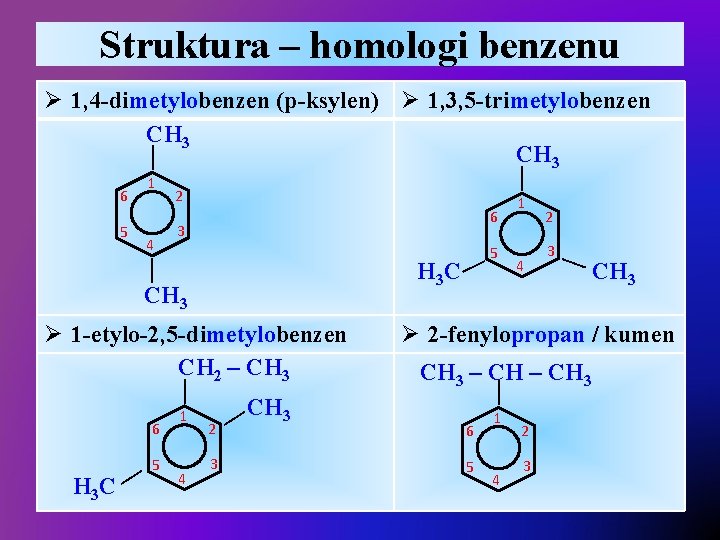
Struktura – homologi benzenu 6 5 1 4 — — Ø 1, 4 -dimetylobenzen (p-ksylen) Ø 1, 3, 5 -trimetylobenzen CH 3 2 6 3 — H 3 C — CH 3 — H 3 C 5 4 2 3 — 6 1 CH 3 4 2 3 — CH 3 Ø 2 -fenylopropan / kumen CH 3 – CH 3 — — Ø 1 -etylo-2, 5 -dimetylobenzen CH 2 – CH 3 5 1 6 5 1 4 2 3

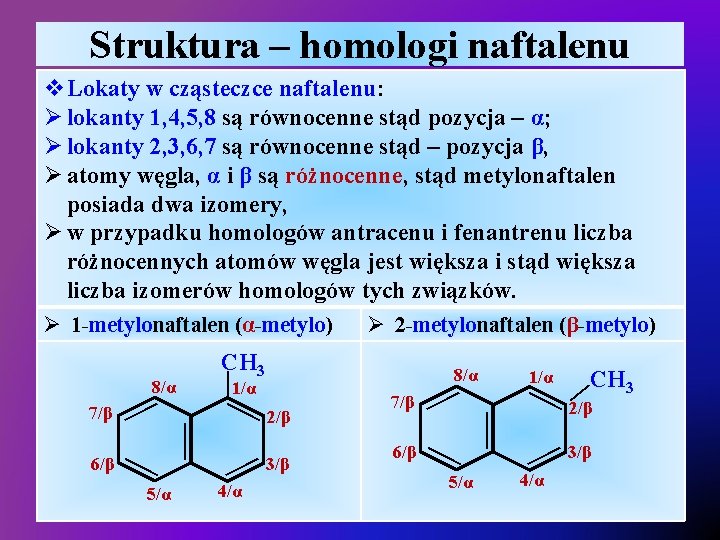
Struktura – homologi naftalenu v. Lokaty w cząsteczce naftalenu: Ø lokanty 1, 4, 5, 8 są równocenne stąd pozycja – α; Ø lokanty 2, 3, 6, 7 są równocenne stąd – pozycja β, Ø atomy węgla, α i β są różnocenne, stąd metylonaftalen posiada dwa izomery, Ø w przypadku homologów antracenu i fenantrenu liczba różnocennych atomów węgla jest większa i stąd większa liczba izomerów homologów tych związków. — 4/α 3/β 6/β — — — 2/β 7/β — — 5/α — 6/β — 8/α 1/α 5/α 1/α — 7/β CH 3 — 8/α Ø 2 -metylonaftalen (β-metylo) — Ø 1 -metylonaftalen (α-metylo) CH 3 2/β 3/β — 4/α

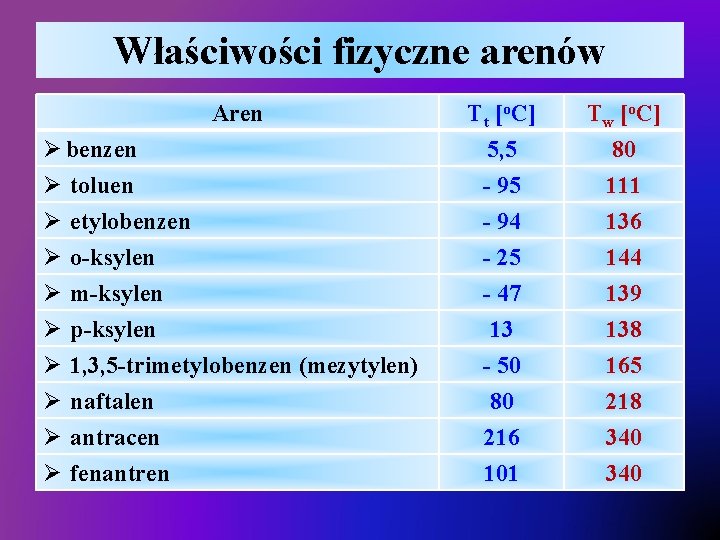
Właściwości fizyczne arenów v Ogólne właściwości fizyczne: Ø w temperaturze pokojowej ciała ciekłe (benzen, toluen) lub ciała stałe (naftalen, antracen), Ø ciała bezbarwne (benzen, toluen, naftalen) lub barwne w przypadku o trzech i więcej pierścieni skondensowanych liniowo (naftacen – żółty, pentacen – niebieski) Ø bardzo trudno rozpuszczalne w wodzie, Ø lotne areny są łatwopalne – spalają się jasnym, silnie kopcącym płomieniem, Ø temperatury wrzenia wzrastają wraz ze wzrostem masy cząsteczkowej, Ø temperatury topnienia zależą od masy cząsteczkowej oraz w dużej mierze od symetrii cząsteczki: ü p-ksylen posiada znacznie wyższą temperaturę topnienia niż jego izomery o-ksylen i m-ksylen,

Właściwości fizyczne arenów Aren Ø benzen Ø toluen Ø etylobenzen Ø o-ksylen Ø m-ksylen Ø p-ksylen Ø 1, 3, 5 -trimetylobenzen (mezytylen) Ø naftalen Ø antracen Ø fenantren Tt [o. C] 5, 5 - 94 Tw [o. C] 80 111 136 - 25 - 47 13 - 50 80 216 101 144 139 138 165 218 340

Metody otrzymywania arenów v. Wyodrębniane w procesie destylacji z produktów ubocznych przemysłu koksowniczego (gaz i smoła pogazowa) oraz gazowniczego (smoła). v Piroliza alkanów i alkenów w podwyższ. temp. (> 800 o. C) v Odwodorowanie (dehydrogenacja) alkanów lub cykloalkanów w podwyższ. temp. w obecności kataliz. : 300 o. C/Pt na Al 2 O 3 + 3 H 2 Ø cykloheksan benzen + wodór v Trimeryzacja acetylenu (etynu) w podwyższonej temp. i obecności węgla aktywnego: T/Caktw. Ø 3 HC ≡ CH C 6 H 6

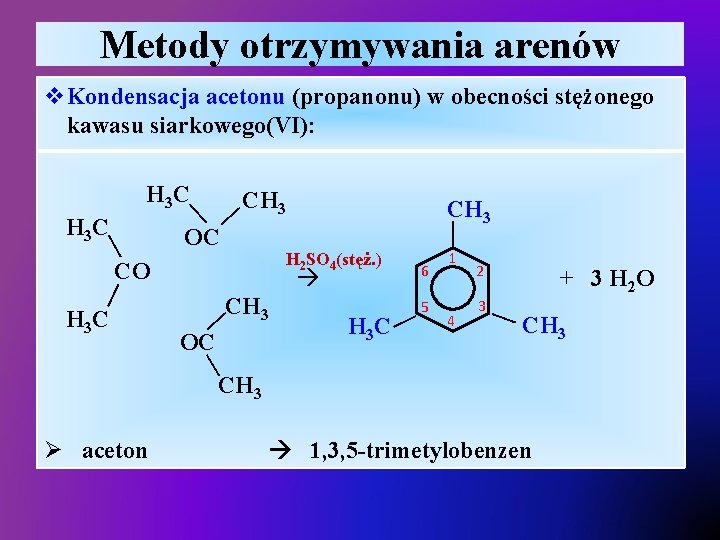
Metody otrzymywania arenów v. Kondensacja acetonu (propanonu) w obecności stężonego kawasu siarkowego(VI): — — H 3 C CH 3 OC H 2 SO 4(stęż. ) — — CO CH 3 OC H 3 C — 6 5 1 4 2 3 + 3 H 2 O — CH 3 — H 3 C CH 3 — — H 3 C CH 3 Ø aceton 1, 3, 5 -trimetylobenzen

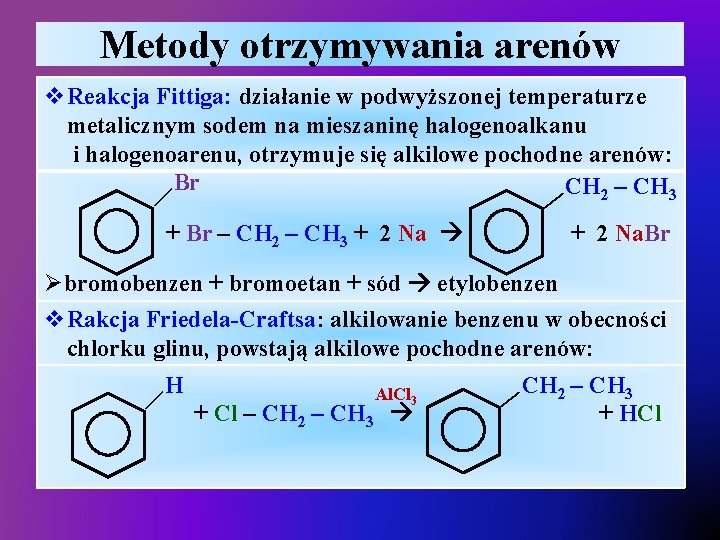
Metody otrzymywania arenów v. Reakcja Fittiga: działanie w podwyższonej temperaturze metalicznym sodem na mieszaninę halogenoalkanu i halogenoarenu, otrzymuje się alkilowe pochodne arenów: Br CH 2 – CH 3 — — + Br – CH 2 – CH 3 + 2 Na. Br — — Øbromobenzen + bromoetan + sód etylobenzen v. Rakcja Friedela-Craftsa: alkilowanie benzenu w obecności chlorku glinu, powstają alkilowe pochodne arenów: CH 2 – CH 3 H Al. Cl 3 + Cl – CH 2 – CH 3 + HCl
 Alkany skupenstvo
Alkany skupenstvo Areny chemie
Areny chemie Areny
Areny Halogenace benzenu
Halogenace benzenu Substituce
Substituce Naftyl
Naftyl Polycyklické areny
Polycyklické areny Struktura raportu
Struktura raportu Brīvā eseja
Brīvā eseja Organizační struktura hotelu hilton
Organizační struktura hotelu hilton Kpp kolbuszowa struktura
Kpp kolbuszowa struktura Samprotavimo rasinys
Samprotavimo rasinys Struktura zatrudnienia w rolnictwie na świecie
Struktura zatrudnienia w rolnictwie na świecie 5 valenčních elektronů
5 valenčních elektronů Struktura hotelu
Struktura hotelu Struktura rzeczowa treningu sportowego
Struktura rzeczowa treningu sportowego Poziomy organizacji białek
Poziomy organizacji białek Struktura rada
Struktura rada Struktura os
Struktura os