Materiay pochodz z Platformy Edukacyjnej Portalu www szkolnictwo














- Slides: 20

Materiały pochodzą z Platformy Edukacyjnej Portalu www. szkolnictwo. pl Wszelkie treści i zasoby edukacyjne publikowane na łamach Portalu www. szkolnictwo. pl mogą być wykorzystywane przez jego Użytkowników wyłącznie w zakresie własnego użytku osobistego oraz do użytku w szkołach podczas zajęć dydaktycznych. Kopiowanie, wprowadzanie zmian, przesyłanie, publiczne odtwarzanie i wszelkie wykorzystywanie tych treści do celów komercyjnych jest niedozwolone. Plik można dowolnie modernizować na potrzeby własne oraz do wykorzystania w szkołach podczas zajęć dydaktycznych.

Białka – właściwości i funkcje

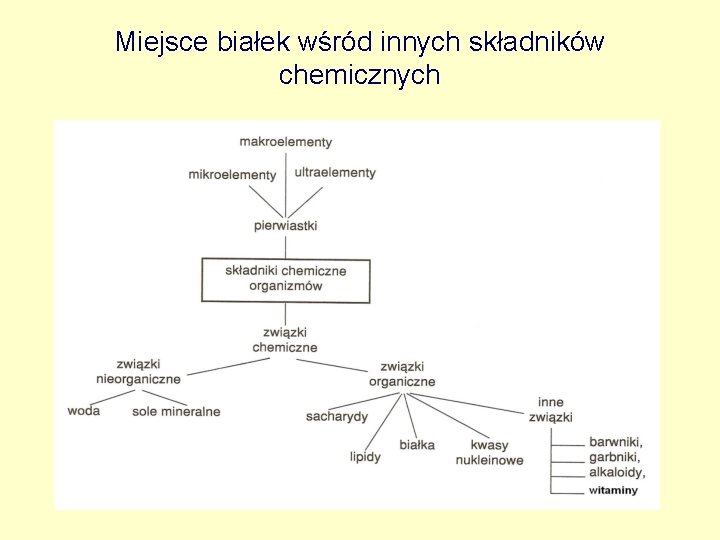
Miejsce białek wśród innych składników chemicznych

Białka • Związki organiczne ogrywające kluczową rolę w świecie istot żywych • Są to wielocząsteczkowe biopolimery, w skład których wchodzą: węgiel, wodór, tlen, azot i często siarka • Zbudowane z mniejszych podjednostek – monomerów- zwanych aminokwasami

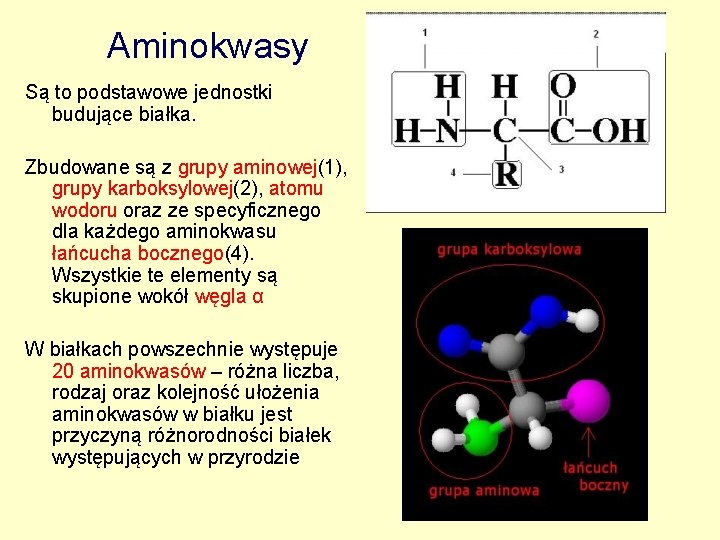
Aminokwasy Są to podstawowe jednostki budujące białka. Zbudowane są z grupy aminowej(1), grupy karboksylowej(2), atomu wodoru oraz ze specyficznego dla każdego aminokwasu łańcucha bocznego(4). Wszystkie te elementy są skupione wokół węgla α W białkach powszechnie występuje 20 aminokwasów – różna liczba, rodzaj oraz kolejność ułożenia aminokwasów w białku jest przyczyną różnorodności białek występujących w przyrodzie

Formy aminokwasów • Centralny węgiel połączony jest z czterema różnymi podstawnikami, co powoduje, że jest on asymetryczny. Związane jest to z dwoma możliwymi ułożeniami grup otaczających węgiel. Te dwie formy nazywa się izomerami optycznymi. Jedna z form lustrzanych nosi nazwę Laminokwasu, druga – D-aminokwasu. W organizmach żywych występują prawie wyłącznie L-aminokwasy

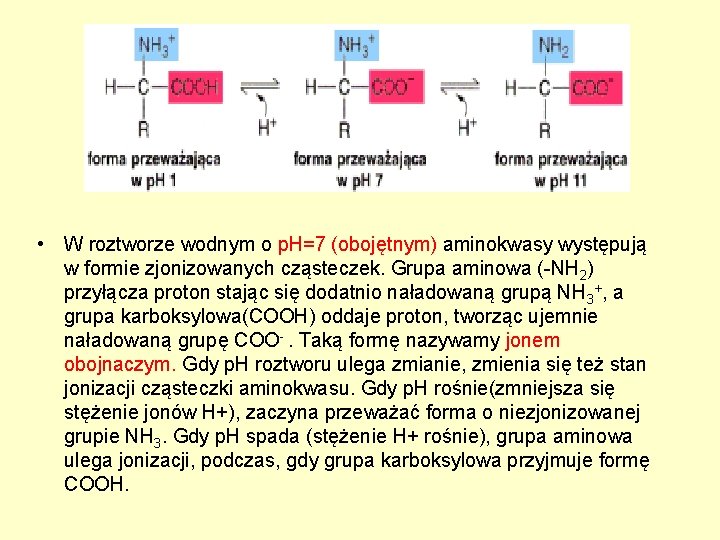
• W roztworze wodnym o p. H=7 (obojętnym) aminokwasy występują w formie zjonizowanych cząsteczek. Grupa aminowa (-NH 2) przyłącza proton stając się dodatnio naładowaną grupą NH 3+, a grupa karboksylowa(COOH) oddaje proton, tworząc ujemnie naładowaną grupę COO-. Taką formę nazywamy jonem obojnaczym. Gdy p. H roztworu ulega zmianie, zmienia się też stan jonizacji cząsteczki aminokwasu. Gdy p. H rośnie(zmniejsza się stężenie jonów H+), zaczyna przeważać forma o niezjonizowanej grupie NH 3. Gdy p. H spada (stężenie H+ rośnie), grupa aminowa ulega jonizacji, podczas, gdy grupa karboksylowa przyjmuje formę COOH.

Aminokwasy różnią się łańcuchami bocznymi (R) - reszta elementów pozostaje niezmieniona. Biorąc pod uwagę właściwości grupy bocznej aminokwasy można podzielić na: hydrofobowe np. alanina, leucyna i izoleucyna, metionina hydrofilowe: cysteina, tyrozyna, treonina Aminokwasy z łańcuchem bocznym niepolarnym, wykazują tendencję do unikania kontaktu z wodą (posiadają właściwości hydrofobowe) Aminokwasy, których łańcuch boczny jest polarny cechuje hydrofilowość (wykazują powinowactwo do wody)

Podział aminokwasów • Bakterie i rośliny potrafią, w większości, same syntetyzować aminokwasy z prostych związków • Ludzie i zwierzęta potrafią syntetyzować niektóre aminokwasy np. glicynę, alaninę – aminokwasy te nazywamy aminokwasami endogennymi • Te aminokwasy, których nie potrafimy sami wytworzyć, które zatem musimy dostarczać z pożywieniem, noszą nazwę aminokwasów egzogennych, np. walina, lizyna • Tylko pokarmy pochodzenia zwierzęcego zawierają białka pełnowartościowe, ponieważ zbudowane są ze wszystkich niezbędnych aminokwasów wykorzystywanych przez organizm

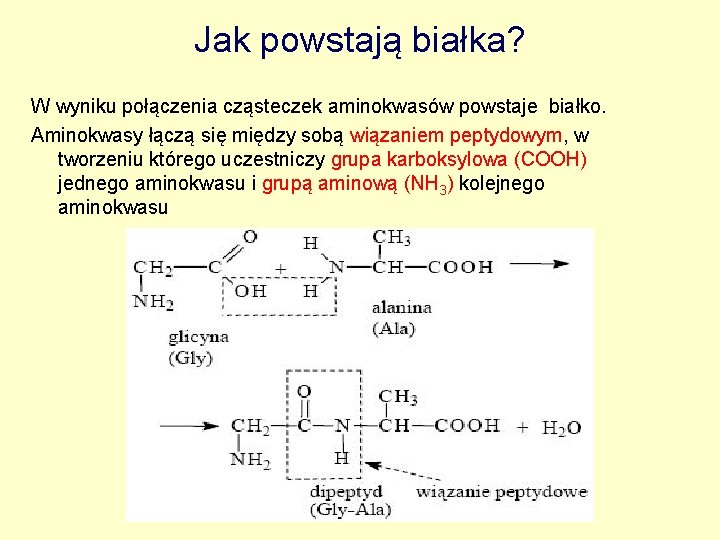
Jak powstają białka? W wyniku połączenia cząsteczek aminokwasów powstaje białko. Aminokwasy łączą się między sobą wiązaniem peptydowym, w tworzeniu którego uczestniczy grupa karboksylowa (COOH) jednego aminokwasu i grupą aminową (NH 3) kolejnego aminokwasu

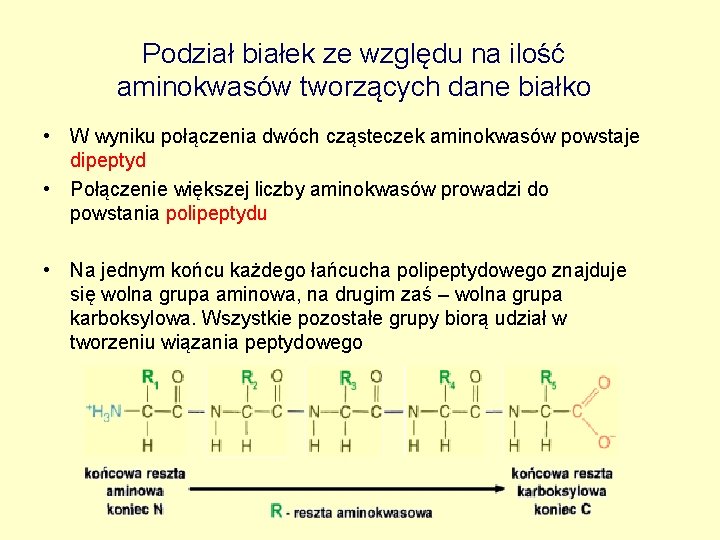
Podział białek ze względu na ilość aminokwasów tworzących dane białko • W wyniku połączenia dwóch cząsteczek aminokwasów powstaje dipeptyd • Połączenie większej liczby aminokwasów prowadzi do powstania polipeptydu • Na jednym końcu każdego łańcucha polipeptydowego znajduje się wolna grupa aminowa, na drugim zaś – wolna grupa karboksylowa. Wszystkie pozostałe grupy biorą udział w tworzeniu wiązania peptydowego

Struktury białkowe: W strukturze cząsteczek białkowych można wyróżnić cztery poziomy organizacji zwane rzędowością. Wyróżniamy następujące struktury białek: Pierwszorzędową Drugorzędową Trzeciorzędową czwartorzędową

Struktura pierwszorzędowa 1 -alanina, 2 -walina, 3 -seryna, 4 -glutaminian, 5 -cysteina, 6 -glutamina, 7 -fenyloalanina, 8 -metionina, 9 histydyna itd Jest to najniższy poziom organizacji strukturalnej cząsteczki, jest wyznaczona przez sekwencję - kolejność aminokwasów w łańcuchu polipeptydowym. Jest ona uwarunkowana genetycznie

Struktura drugorzędowa Jest to typ przestrzennego ułożenia głównego łańcucha polipeptydowego na skutek tworzenia się wiązań wodorowych. Na ogół łańcuchy polipeptydowe białek układają się w kształt α-helisy lub struktury arkusza (harmonijki beta).

Struktura trzeciorzędowa Jest efektem pofałdowania i zwinięcia się łańcucha polipeptydowego, mającego już określoną strukturę dwurzędową. Organizację trzeciorzędową białek stabilizują wiązania wodorowe, mostki dwusiarczkowe oraz jonowe i hydrofobowe siły przyciągania pomiędzy grupami bocznymi aminokwasów

Struktura czwartorzędowa Określa wzajemne ułożenie dwóch lub większej liczby łańcuchów polipeptydowych, z których każdy ma już określoną strukturę pierwszo -, drugo-, trzeciorzędową. Strukturę czwartorzędową ma cząsteczka hemoglobiny – białko czerwonych krwinek, które bierze udział w transporcie tlenu

Denaturacja białek To trwałe uszkodzenie struktury drugo-, trzecio- i czwartorzędowej, w wyniku czego białko traci swoje właściwości biologiczne Czynniki denaturacji: • Wysoka temperatura (powyżej 50°C) • promieniowanie rentgenowskie i jonizujące • sole metali ciężkich • silne kwasy i zasady • rozpuszczalniki organiczne

Podział białek Białka proste A)Białka globularne – rozpuszczalne w wodzie: - Albuminy - Globuliny - Histony B)Białka fibrylarne – włókienkowe nierozpuszczalne w wodzie: - Kolagen – białko tkanki łącznej - Keratyna – białko paznokci, włosów - Fibryna – powstająca w czasie krzepnięcia krwi - - - Białka złożone(proteidy) Posiadają grupę niebiałkową połączoną z łańcuchem polipeptydowym: Fosfoproteidy( do łańcucha białkowego dołączona jest reszta kwasu fosforowego) Glikoproteidy( do łańcucha białkowego dołączone są cukrowce) Metaloproteidy (do łańcucha białkowego dołączone są metale) Chromoproteidy (do łańcucha białkowego dołączone są barwniki)

Funkcja białek • Są podstawowym materiałem budulcowym komórek i tkanek organizmu • Jako tzw. enzymy biorą udział w większości reakcji zachodzących w organizmach żywych • Biorą udział w transporcie różnych substancji np. hemoglobina transportuje tlen i częściowo dwutlenek węgla • Jako przeciwciała dają odporność organizmowi • Są również materiałem energetycznym

Literatura: • • • Villee i inni, 1996. Biologia. Multico, Warszawa Wiśniewski H, 1998. Biologia. Agmen, Warszawa Biologia, 1994, Państwowe Wydawnictwo Rolnicze i Leśne, Warszawa Opracowała: Katarzyna Szymura