Waciwoci chemiczne alkenw Reakcje spalania Reakcje addycji Regua









- Slides: 15

Właściwości chemiczne alkenów -Reakcje spalania, -Reakcje addycji, -Reguła Markownikowa, -Reakcje charakterystyczne alkenów, -Reakcje polimeryzacji

Reakcje spalania alkenów i alkinów • Węglowodory nienasycone: alkeny i alkiny są związkami palnymi tak jak węglowodory nasycone – alkany • W zależności od dostępu tlenu wyróżnia się trzy typy spalania: • - spalanie całkowite, • - półspalanie, • - spalanie niecałkowite

Reakcja addycji – przyłączenia • Reakcja addycji polega na przyłączeniu podstawników do atomu węgla połączonych wiązaniem wielokrotnym (podwójnym, potrójnym) przebiegające z rozerwaniem jednego lub więcej wiązań π • Wiązania π (miejsce bogate w elektrony), jest miejscem ataku substratów elektrofilowych (poszukujących elektronów – posiadających deficyt elektronów) – addycja elektrofilowa. • W reakcjach addycji do wiązania wielokrotnego biorą udział halogeny – X 2 (jod stosunkowo trudno), halogenowodory –HX, wodór–H 2, woda H–OH, kwasy

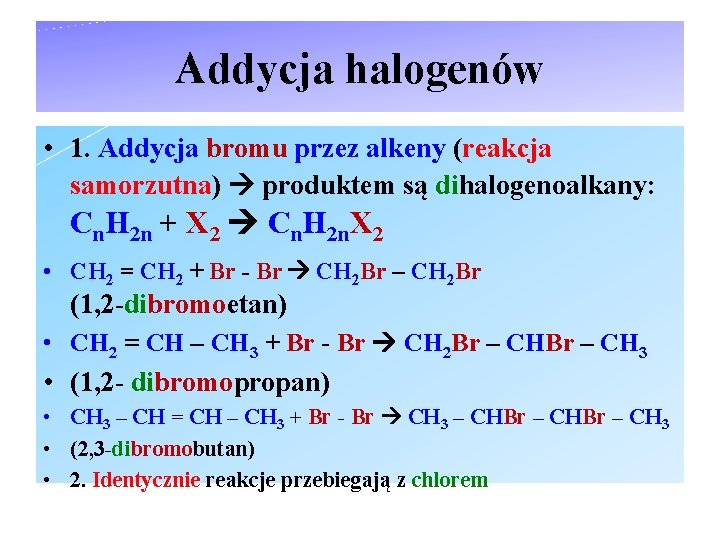
Addycja halogenów • 1. Addycja bromu przez alkeny (reakcja samorzutna) produktem są dihalogenoalkany: Cn. H 2 n + X 2 Cn. H 2 n. X 2 • CH 2 = CH 2 + Br - Br CH 2 Br – CH 2 Br (1, 2 -dibromoetan) • CH 2 = CH – CH 3 + Br - Br CH 2 Br – CH 3 • (1, 2 - dibromopropan) • CH 3 – CH = CH – CH 3 + Br - Br CH 3 – CHBr – CH 3 • (2, 3 -dibromobutan) • 2. Identycznie reakcje przebiegają z chlorem

Addycja wodoru • Addycja wodoru przebiega w obecności katalizatora: Ni, Pd, Pt (reakcja wymuszona) produktem jest zawsze alkan (węglowodór nasycony): Cn. H 2 n + H 2 Cn. H 2 n+2 • CH 2 = CH 2 + H 2 CH 3 – CH 3 ; etan • CH 2 = CH – CH 3 + H 2 CH 3 – CH 2 – CH 3 ; propan • CH 3 – CH = CH – CH 3 + H 2 CH 3 – CH 2 – CH 3 butan

Addycja halogenowodoru i wody (cząsteczek asymetrycznych typu H-X) • W przypadku addycji cząsteczki asymetrycznej typu H-X do alkenu symetrycznego (np. eten, but-2 -en, heks-3 -en, : takie same podstawniki po obu stronach wiązania podwójnego) powstaje zawsze jeden produkt. • W przypadku addycji cząsteczki asymetrycznej typu H-X do alkenu asymetrycznego (np. propen, but-1 -en, pent-2 -en, heks-2 -en: różne podstawniki po obu stronach wiązania podwójnego) mogą teoretycznie powstać dwa różne produkty. • O kierunku przebiegu tego typu reakcji decyduje reguła Markownikowa

Reguła Markownikowa • Addycja cząsteczek typu H-X do wiązania wielokrotnego (podwójnego) alkenu przebiega w taki sposób, że podstawnik wodorowy (atom wodoru) z cząsteczki H-X przyłącza się głównie do atomu C o niższej rzędowości (połączonego z większą liczbą atomów H – bogatszego w wodór) a podstawniki innego rodzaju (-F, -Cl, - Br, -I, - OH) przyłączają się do atomu C o wyższej rzędowości (połączonego z mniejszą liczba atomów H - uboższego w wodór)

Addycja – halogenowodorów • Addycja HF przez propen CH 2 = CH – CH 3 + H – F CH 3 – CH 3 | F (2 -fluoropropan) • Addycja HCl przez but-1 -en CH 2 = CH – CH 2 – CH 3 + H – Cl CH 3 – CH 2 – CH 3 | Cl (2 -chlorobutan)

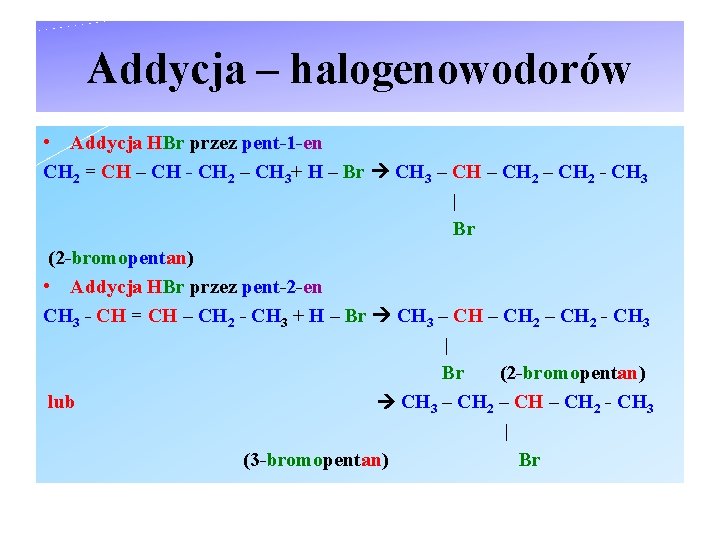
Addycja – halogenowodorów • Addycja HBr przez pent-1 -en CH 2 = CH – CH - CH 2 – CH 3+ H – Br CH 3 – CH 2 - CH 3 | Br (2 -bromopentan) • Addycja HBr przez pent-2 -en CH 3 - CH = CH – CH 2 - CH 3 + H – Br CH 3 – CH 2 - CH 3 | Br (2 -bromopentan) lub CH 3 – CH 2 - CH 3 | (3 -bromopentan) Br

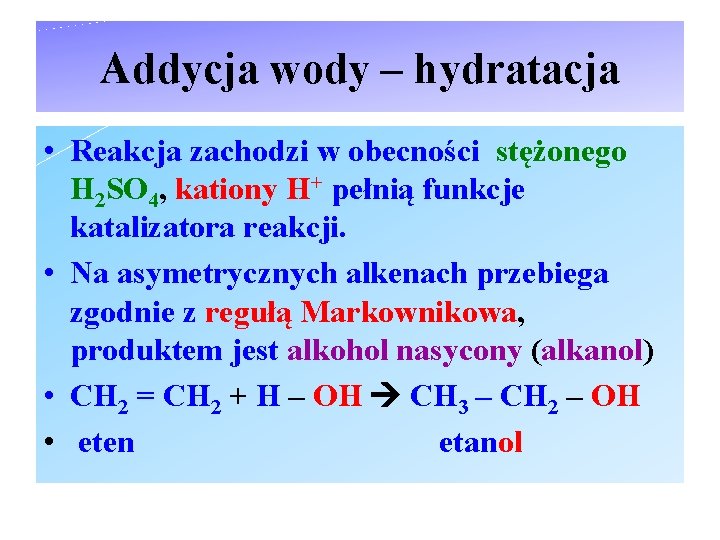
Addycja wody – hydratacja • Reakcja zachodzi w obecności stężonego H 2 SO 4, kationy H+ pełnią funkcje katalizatora reakcji. • Na asymetrycznych alkenach przebiega zgodnie z regułą Markownikowa, produktem jest alkohol nasycony (alkanol) • CH 2 = CH 2 + H – OH CH 3 – CH 2 – OH • eten etanol

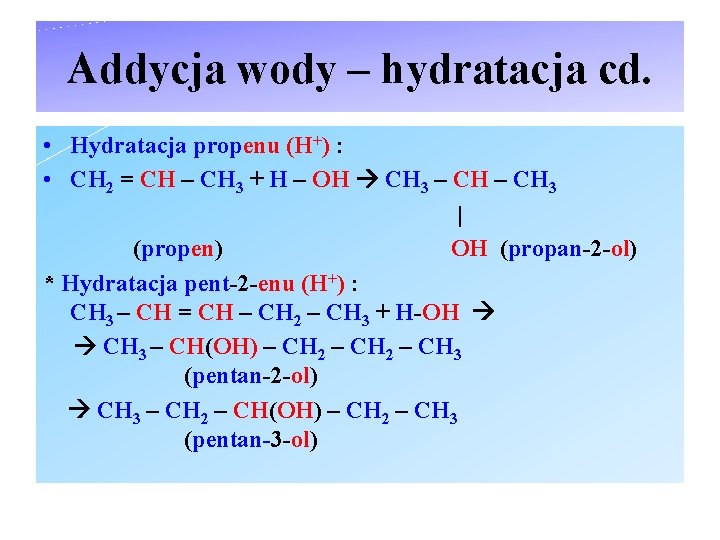
Addycja wody – hydratacja cd. • Hydratacja propenu (H+) : • CH 2 = CH – CH 3 + H – OH CH 3 – CH 3 | (propen) OH (propan-2 -ol) * Hydratacja pent-2 -enu (H+) : CH 3 – CH = CH – CH 2 – CH 3 + H-OH CH 3 – CH(OH) – CH 2 – CH 3 (pentan-2 -ol) CH 3 – CH 2 – CH(OH) – CH 2 – CH 3 (pentan-3 -ol)

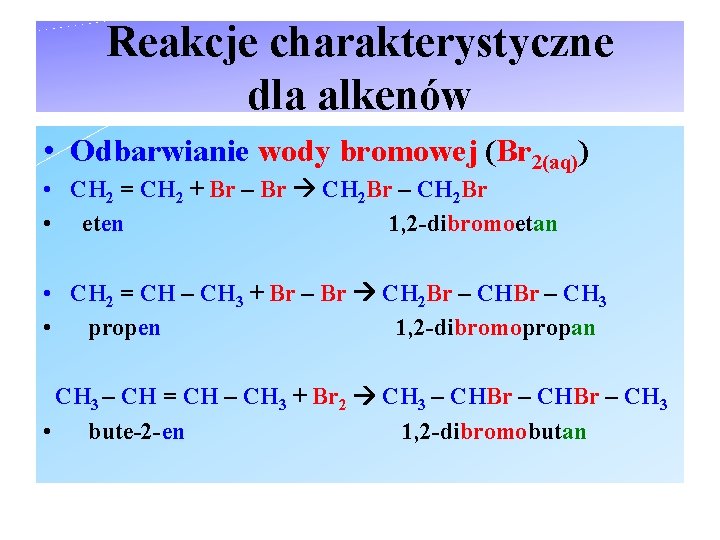
Reakcje charakterystyczne dla alkenów • Odbarwianie wody bromowej (Br 2(aq)) • CH 2 = CH 2 + Br – Br CH 2 Br – CH 2 Br • eten 1, 2 -dibromoetan • CH 2 = CH – CH 3 + Br – Br CH 2 Br – CH 3 • propen 1, 2 -dibromopropan CH 3 – CH = CH – CH 3 + Br 2 CH 3 – CHBr – CH 3 • bute-2 -en 1, 2 -dibromobutan

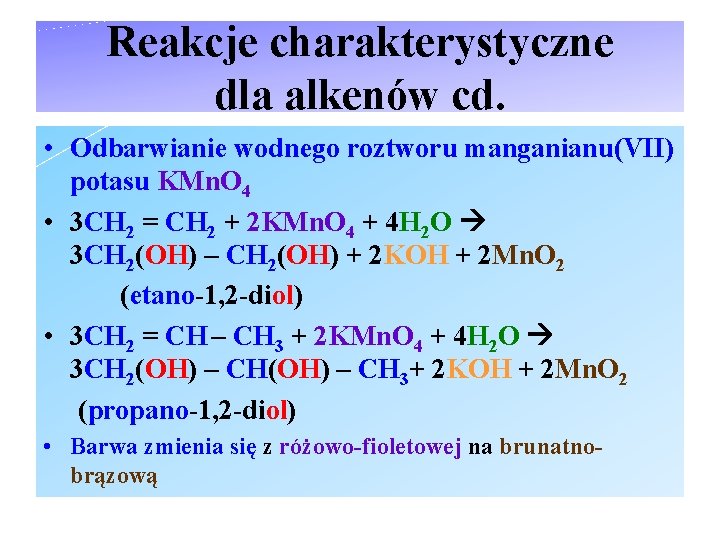
Reakcje charakterystyczne dla alkenów cd. • Odbarwianie wodnego roztworu manganianu(VII) potasu KMn. O 4 • 3 CH 2 = CH 2 + 2 KMn. O 4 + 4 H 2 O 3 CH 2(OH) – CH 2(OH) + 2 KOH + 2 Mn. O 2 (etano-1, 2 -diol) • 3 CH 2 = CH – CH 3 + 2 KMn. O 4 + 4 H 2 O 3 CH 2(OH) – CH 3+ 2 KOH + 2 Mn. O 2 (propano-1, 2 -diol) • Barwa zmienia się z różowo-fioletowej na brunatnobrązową

Reakcje polimeryzacji • Polimeryzacja – reakcja łańcuchowa łączenia się wielu (n) małych cząsteczek alkenów (monomerów) w cząsteczki duże (polimery) • Reakcje przebiegają w podwyższonej temp. lub pod wpływem promieniowania elektromagnetycznego o dużej energii • Reakcji polimeryzacji towarzyszy rozerwanie wiązań podwójnych w cząsteczkach monomerów • n Cn. H 2 n ( Cn. H 2 n )n

Reakcje polimeryzacji • • Dimeryzacja etenu 2 CH 2 = CH 2 - CH 2 – eten dieten (dietylen) Trimeryzacja etenu • 3 CH 2 = CH 2 - CH 2 – CH 2 – • eten trieten (trietylen) • Polimeryzacja etenu • n CH 2 = CH 2 ( CH 2 – CH 2 )n • eten polieten (polietylen)