Reakcje addycji elektrofilowej addycja wodoru addycja halogenw regua








- Slides: 11

Reakcje addycji elektrofilowej - addycja wodoru, - addycja halogenów - reguła Markownikowa - addycja halogenowodorów - addycja wody - katalityczne utlenianie alkenów i alkinów - polimeryzacja alkenów

Reakcje addycji v Reakcje polegające na przyłączeniu podstawników do atomów węgla połączonych wiązaniem wielokrotnym (podwójnym, potrójnym) z jednoczesnym rozerwaniem wiązań π v Reakcje addycji są charakterystyczne dla : Ø węglowodorów nienasyconych – alkenów i alkinów ü oraz innych nienasyconych związków organicznych np. : alkadieny, cykloalkiny, areny, ü nienasycone kwasy karboksylowe, tłuszcze zawierające reszty nienasyconych kwasów karboksylowych v Reakcje przyłączenia podstawników do wiązania wielokrotnego jest reakcją addycji elektrofilowej – pary wiążące π są atakowane przez substraty elektrofilowe (posiadających deficyt elektronów – poszukujących elektronów.

Ogólny zapis równań reakcji addycji v Ø Ø Ø v Ø Addycja wodoru: Cn. H 2 n + H 2 Cn. H 2 n+2 (alkan) Cn. H 2 n-2 + H 2 Cn. H 2 n (alken) Cn. H 2 n-2 + 2 H 2 Cn. H 2 n+2 (alkan) Addycja halogenów (X 2: F 2; Cl 2; Br 2; I 2; ): Cn. H 2 n + X 2 Cn. H 2 n. X 2 (dihalogenoalkan) Cn. H 2 n-2 + X 2 Cn. H 2 n-2 X 2 (dihalogenoalken) Cn. H 2 n-2 + 2 X 2 Cn. H 2 n-2 X 4 (tetrahologenoalkan) Addycja halogenowodorów (HX: HF; HCl; HBr; HI): Cn. H 2 n + HX Cn. H 2 n+1 X (monohalogenoalkan) Cn. H 2 n-2 + HX Cn. H 2 n-1 X (monohalogenoalken) Cn. H 2 n-2 + 2 HX Cn. H 2 n. X 2 (dihalogenoalkan) Addycja wody H – OH Cn. H 2 n + H – OH Cn. H 2 n+1 OH (alkohol – alkanol)

Addycja wodoru – uwodorowanie – hydrogenacja (reakcja wymuszona katalizatorem: Ni, Pt, Pd) CH 3 + CH H+ CH 2 H - Ni Ni v CH 3 – CH = CH 2 + H 2 CH 3 – CH 2 – CH 3 propen wodór propan Ni v CH 3 – C ≡ CH + 2 H 2 CH 3 – CH 2 – CH 3 propyn wodór propan

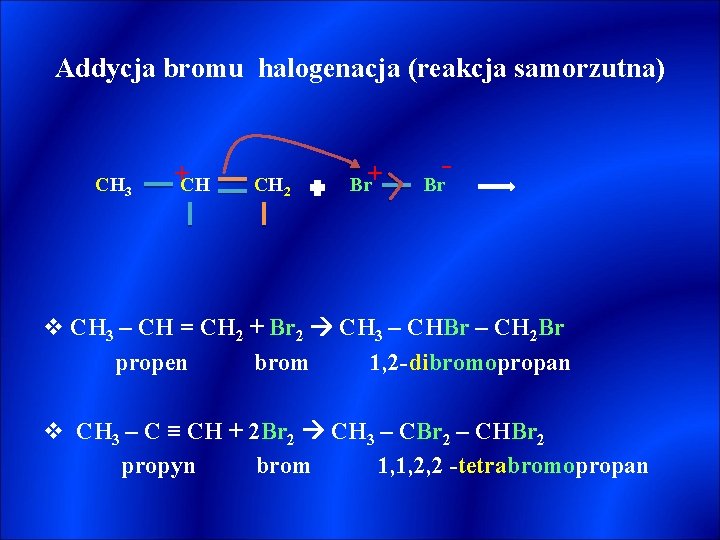
Addycja bromu halogenacja (reakcja samorzutna) CH 3 +CH CH 2 Br+ - Br v CH 3 – CH = CH 2 + Br 2 CH 3 – CHBr – CH 2 Br propen brom 1, 2 -dibromopropan v CH 3 – C ≡ CH + 2 Br 2 CH 3 – CBr 2 – CHBr 2 propyn brom 1, 1, 2, 2 -tetrabromopropan

Reguła Markownikowa v Addycja cząsteczek typu H – X (lub innej cząsteczki asymetrycznej polarnej np. H – OH) do wiązania wielokrotnego przebiega w taki sposób, że atom wodoru z cząsteczki H – X jest przyłączany do atomu węgla o niższej rzędowości (bogatszego w wodór), natomiast podstawniki innego rodzaju: - X, - OH, do atomu węgla o wyższej rzędowości (uboższego w wodór) v Addycja przebiega z udziałem produktu pośredniego – karbokationu, im wyższej rzędowości karbokation (atom C wyższej rzędowości obdarzony ładunkiem dodatnim w karbokationie) tym jest on trwalszy.

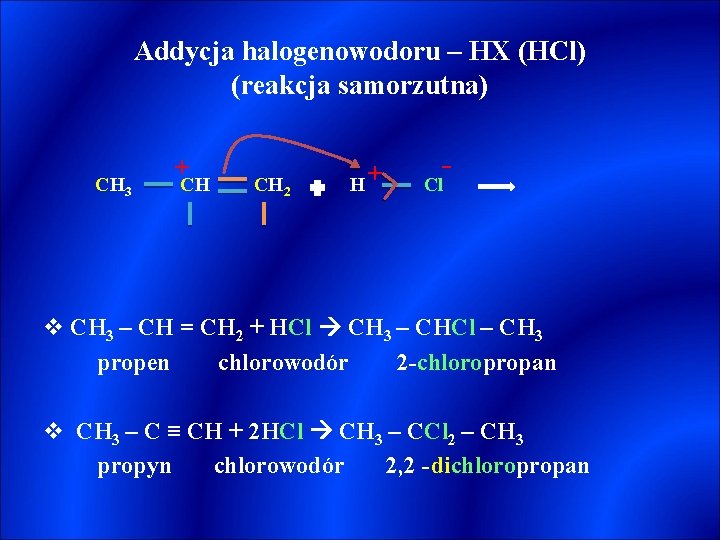
Addycja halogenowodoru – HX (HCl) (reakcja samorzutna) CH 3 + CH CH 2 H+ - Cl v CH 3 – CH = CH 2 + HCl CH 3 – CHCl – CH 3 propen chlorowodór 2 -chloropropan v CH 3 – C ≡ CH + 2 HCl CH 3 – CCl 2 – CH 3 propyn chlorowodór 2, 2 -dichloropropan

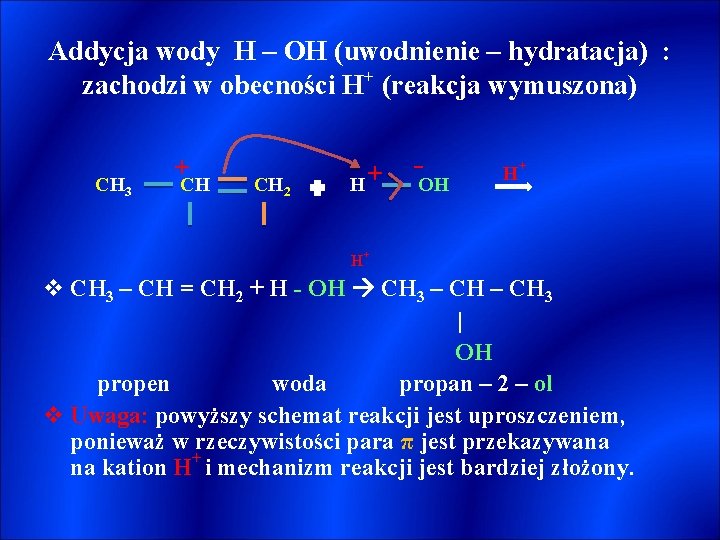
Addycja wody H – OH (uwodnienie – hydratacja) : zachodzi w obecności H+ (reakcja wymuszona) CH 3 + CH CH 2 H+ - OH H+ H+ v CH 3 – CH = CH 2 + H - OH CH 3 – CH 3 | OH propen woda propan – 2 – ol v Uwaga: powyższy schemat reakcji jest uproszczeniem, ponieważ w rzeczywistości para π jest przekazywana na kation H+ i mechanizm reakcji jest bardziej złożony.

Katalityczne utlenianie alkenów KMn. O 4 v Katalityczne utlenianie propenu wodnym roztworem KMn. O 4 – odbarwianie roztworu jest reakcją charakterystyczną dla węglowodorów nienasyconych: Ø 3 CH 3 – CH = CH 2 + 2 KMn. O 4 + 4 H 2 O 3 CH 3 – CH(OH) – CH 2(OH) + 2 Mn. O 2 + 2 KOH v Katalityczne utleniania propenu wodnym roztworem KMn. O 4 w obecności H 2 SO 4 , reakcja przebiega z zerwaniem wiązania podwójnego w alkenie – odbarwianie roztworu jest reakcją charakterystyczną dla węglowodorów nienasyconych: Ø 5 CH 3 – CH = CH 2 + 8 KMn. O 4 + 12 H 2 SO 4 5 CH 3 – COOH + 5 H - COOH + 8 Mn. SO 4 + 4 K 2 SO 4 +12 H 2 O

Katalityczne utlenianie alkenów i alkinów KMn. O 4 (cd) v 3 CH 2 = CH 2 + 2 KMn. O 4 + 4 H 2 O 3 CH 2(OH) – CH 2(OH) + 2 Mn. O 2 + 2 KOH v 5 CH 2 = CH 2 + 8 KMn. O 4 + 12 H 2 SO 4 10 H - COOH + 8 Mn. SO 4+ 4 K 2 SO 4 + 12 H 2 O v 3 CH ≡ CH + 2 KMn. O 4 + 4 H 2 O 6 H – CHO + 2 Mn. O 2 + 2 KOH v 5 CH ≡ CH + 6 KMn. O 4 + 9 H 2 SO 4 10 H – COOH + 6 Mn. SO 4 + 3 K 2 SO 4 + 4 H 2 O

Reakcje polimeryzacji v Polimeryzacja – reakcja łańcuchowa polegająca na łączeniu się wielu małych cząsteczek (monomerów) w cząsteczki duże (polimery) z jednoczesnym zerwaniem wiązań wielokrotnych, reakcja zachodzi w warunkach podwyższonej temp. , promieniowania elektromagnetycznego lub starterów) CH 2 CH 2 v n CH 2 = CH 2 ( - CH 2 – CH 2 - )n ( polietylen – polieten) v n CH = CH 2 ( - CH – CH 2 - )n | | C 6 H 5 (polistyren – polifenyloeten)