Staa rwnowagowa reakcji odwracalnych Przykadowe zadania z rozwizaniami
























- Slides: 25

Stała równowagowa reakcji odwracalnych Ø Przykładowe zadania z rozwiązaniami Ø Uzupełnienie - stała równowagowa w układach heterogenicznych (stały i gazowy)

Zadanie 1 i rozwiązanie v. W reakcji H 2(g) + I 2(g) ↔ 2 HI(g) przy początkowym stężeniu wodoru 0, 7 mol/dm 3 i jodu 0, 5 mol/dm 3, ustalił się stan równowagi, w którym stężenie HI wyniosło 0, 9 mol/dm 3. v. Oblicz stężenia równowagowe wodoru i jodu w stanie równowagi, oblicz stałą równowagową reakcji. v Analiza i założenia do zadania Ø H 2 + I 2 ↔ 2 HI ü 1 mol + 1 mol 2 mol Ø obl. liczby moli substratów, które przeszyły w produkty: ü 1 mol H 2 ------ 2, 0 mol HI ü 1 mol I 2 ------ 2, 0 mol HI x ------ 0, 9 mol HI y ------ 0, 9 mol HI -------------------------------x = 0, 45 mol H 2 y = 0, 45 mol I 2

Zadanie 1 i rozwiązanie / cd Ø obliczenie stężeń równowagowych wodoru i jodu: Stężenia H 2 I 2 HI reagentów [mol/dm 3] początkowe 0, 7 0, 5 0, 0 równowag. 0, 7 – x = 0, 5 – y = 0, 9 0, 7 – 0, 45 = 0, 25 0, 5 – 0, 45 = 00, 5 przeszły 0, 45 0, 0 w produkty Ø Obliczenie stałej równowagowej reakcji:

Zadanie 2 i rozwiązanie v. W reakcji 3 H 2(g) + N 2(g) ↔ 2 NH 3(g) stężenia równowagowe wynosiły: stężeniu wodoru 4, 0 mol/dm 3; azotu 1, 5 mol/dm 3, amoniaku wyniosło 5, 0 mol/dm 3. v. Oblicz stężenia wyjściowe wodoru i azotu i oblicz stałą równowagową reakcji. v Analiza i założenia do zadania Ø 3 H 2 + N 2 ↔ 2 NH 3 ü 3 mol + 1 mol 2 mol Ø obl. liczby moli substratów, które przeszyły w produkty: ü 3 mol H 2 ------ 2, 0 mol NH 3 ü 1 mol N 2 ----- 2, 0 mol NH 3 x ------ 5, 0 mol NH 3 y ------ 5, 0 mol NH 3 -------------------------------x = 7, 5 mol H 2 y = 2, 5 mol N 2

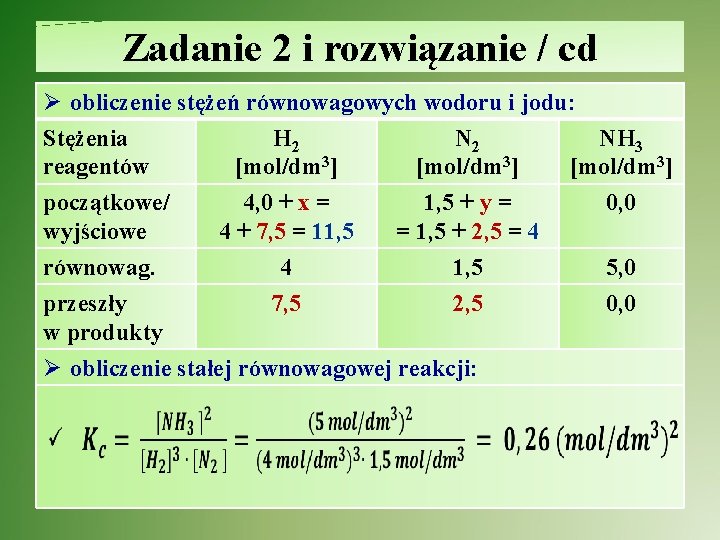
Zadanie 2 i rozwiązanie / cd Ø obliczenie stężeń równowagowych wodoru i jodu: Stężenia H 2 NH 3 reagentów [mol/dm 3] początkowe/ 4, 0 + x = 1, 5 + y = 0, 0 wyjściowe 4 + 7, 5 = 11, 5 = 1, 5 + 2, 5 = 4 równowag. 4 1, 5 5, 0 przeszły 7, 5 2, 5 0, 0 w produkty Ø obliczenie stałej równowagowej reakcji:

Zadanie 3 i rozwiązanie v. Stała równowagowa reakcji: CO 2(g) + H 2(g) ↔ CO(g) + H 2 O(g) w temperaturze 1100 K wynosi Kc = 1. v. Obliczbę moli CO w zamkniętym zbiorniku jeżeli po zmieszaniu 1 mola wodoru z 1 molem tlenku węgla(IV) ustaliła się równowaga. v Analiza i założenia do zadania: Ø CO 2(g) + H 2(g) ↔ CO(g) + H 2 O(g) ü 1 mol + 1 mol Ø ilości moli reagentów w stanie równowagi: [CO 2] = 1 mol – x; [H 2] = 1 mol – x; [CO] = x; [H 2 O] = x. Ø wyrażenie na stałą równowagową reakcji:

Zadanie 3 i rozwiązanie Ø obliczenie liczby moli CO w reaktorze po ustaleniu się równowagi: ü wyrażenie na stałą równowagową reakcji: ü x 2 + 1 mol 2 – 2 x mol = x 2 - 2 x mol = - 1 mol 2 x = 0, 5 mol CO

Zadanie 4 i rozwiązanie v. W pewnej temperaturze z 2 moli amoniaku ulega rozkładowi połowa substratu. v. Oblicz stałą równowagi rozkładu amoniaku w temperaturze doświadczenia, jeżeli objętość naczynia reakcyjnego wynosi 10 dm 3. v Analiza i założenia do zadania: Ø 2 NH 3(g) ↔ N 2(g) + 3 H 2(g) ü 2 mol 1 mol + 3 mol Ø ilości moli reagentów w stanie równowagi: ü n. NH 3 = ½ ∙ 2 mol = 1 mol; n. N 2 = ½ ∙ 1 mol = 0, 5 mol; n. H 2 = 3 ∙ n. N 2= 3 ∙ 0, 5 mol = 1, 5 mol Ø łączna liczba moli gazów w objętości 10 dm 3: ü nc = n. NH 3 + n. N 2 +n. H 2 = 1 mol + 0, 5 mol + 1, 5 mol = 3 mol

Zadanie 4 i rozwiązanie / cd Ø obliczenie stężeń molowych reagentów reakcji w stanie równowagi: Ø obliczenie stałej równowagowej reakcji:

Zadanie 5 i rozwiązanie v Zmieszano 3 mole pewnego fluorowca (X) z 6 molami wodoru. Po ustaleniu się stanu równowagi stwierdzono 4 mole fluorowcowodoru obok nieprzereagowanych substratów reakcji. v Oblicz stałą równowagową reakcji. v Analiza i założenia do zadania: Ø można przyjąć, że objętość naczynia reakcyjnego wynosi 1 dm 3, co jest równoznaczne z ich stężeniem molowym, Ø X 2(g) + H 2(g) ↔ 2 HX(g) ü 1 mol + 1 mol 2 mol ü 1 mol X 2 ----- 2 mole HX 1 mol H 2 ---- 2 mol HX x ----- 4 mole HX y ---- 2 mol HX ---------------------------------x = 2 mol X 2 y = 2 mol H 2

Zadanie 5 i rozwiązanie Ø obliczenie stężeń reagentów w stanie równowagi: Stężenia X 2 HX reagentów [mol/dm 3] początkowe/ 3 6 0, 0 wyjściowe równowag. 3–x=3– 2=1 6–y=6– 2=4 4, 0 przeszły 2, 0 0, 0 w produkty Ø obliczenie stałej równowagowej reakcji: ü stała bezwymiarowa

Zadanie 6 i rozwiązanie v 4, 6 g mieszaniny równowagowej: 2 NO 2(g) ↔ N 2 O 4(g) zajmuje objętość 1, 34 dm 3. v Oblicz stałą równowagową reakcji. v Analiza i założenia do zadania: Ø masy mole reagentów: MNO 2 = 46 g/mol; MN 2 O 4 = 92 g/mol, Ø obliczenie liczby moli gazowych reagentów: ü 1 mol ------ 22, 40 dm 3 x ------- 1, 34 dm 3 --------------0, 06 mol Ø obliczenie liczby moli reagentów: x = n. NO 2; n. N 2 O 4 = 0, 06 mol - x ü 4, 6 g = MN 2 O 4 ∙ (0, 06 mol – x) + MNO 2 ∙ x = = 92 g/mol ∙ (0, 06 mol – x) + 46 g/mol ∙ x ü x = n. NO 2 = 0, 02 mol; ü n. N 2 O 4 = 0, 06 mol – x = 0, 06 mol – 0, 02 mol = 0, 04 mol.

Zadanie 6 i rozwiązanie Ø obliczenie stężeń molowych reagentów w stanie równowagi przy objętości mieszaniny poreakcyjnej 1, 34 dm 3: Ø obliczenie stałej równowagowej reakcji:

Zadanie 7 i rozwiązanie v Zmieszano 3 mole octanu etylu z 5 molami wody i 1 molem kwasu etanowego. Stała równowagowa estru wynosi 0, 25. v Oblicz stałą równowagową reakcji. v Analiza i założenia do zadania: Ø hydroliza estru: ü CH 3–COO-C 2 H 5(c) + H 2 O(c) ↔ CH 3 -COOH(c) + C 2 H 5 -OH(c) ü 1 mol + 1 mol ↔ 1 mol + 1 mol Ø liczba moli /stężenia molowe reagentów w stanie równowagi: ü n. CH 3 COOC 2 H 5 = 3 mol – x, ü n. CH 3 COOH = 1 mol + x, ü n. H 2 O = 5 mol – x, ü n. C 2 H 5 OH = x.

Zadanie 7 i rozwiązanie Ø obliczenie liczby moli powstałego etanolu w reakcji: ü 0, 25 ∙ x 2 – 2 ∙ x + 3, 75 = x 2 + x ; - 0, 75 x 2 – 3 x + 3, 75 = 0 ü wartość nie może być ujemna, pierwiastek należy odrzucić,

Zadanie 8 i rozwiązanie v. Stała równowagowa reakcji: CO(g) + H 2 O(g) ↔ CO 2(g) + H 2(g) w temp. 1100 K jest równa 1. 1 dm 3 mieszaniny wyjściowej, w której znajdowało się 3 mole CO i 6 moli wody ogrzano w zamkniętym naczyniu do w/w temp. v. Obliczbę moli reagentów w stanie równowagi. v Analiza i założenia do zdania: Ø liczba moli przy objętości 1 dm 3 jest równoznaczna z stężeniem molowym reagentów: liczba moli CO(g) H 2 O(g) CO 2(g) H 2(g) [mol] wyjściowe 3 6 0, 0 równowagowe 3 -x 6 -x x x

Zadanie 8 i rozwiązanie / cd Ø obliczenie liczby moli reagentów w stanie równowagi: ü ü ü x 2 = x 2 + 18 mol 2 – 9 mol ∙ x - 9 mol ∙ x = - 18 mol 2 x = 2 mol n. CO = 3 mol – x = 3 mol – 2 mol = 1 mol n. H 2 O = 6 mol – x = 6 mol – 2 mol = 4 mol n. CO 2 = n. H 2 = x = 2 mol

Zadanie 9 i rozwiązanie v. Po zmieszaniu 3 g propanolu z 2, 4 g kwasu etanowego i ustaleniu się równowagi powstało 2, 04 g octanu propylu. v. Oblicz, ile gramów octanu propylu powstanie po ustaleniu się równowagi, jeżeli zmiesza się w tych samych warunkach 180 g propanolu i 120 g kwasu etanowego. v. Analiza i założenia do zadania: Ø CH 3 -COOH + HO-CH 2 -CH 3 ↔ CH 3 -COO-CH 2 -CH 3 + H 2 O ü 1 mol + 1 mol ↔ 1 mol + 1 mol Ø obliczenie liczby moli substratów w pierwszym przypadku: ü MCH 3 COOH = 60 g/ mol; MC 3 H 7 OH = 60 g/mol

Zadanie 9 i rozwiązanie / cd Ø obliczenie liczby moli produktów w pierwszym przypadku: ü MCH 3 COOC 3 H 7 = 102 g/ mol; MH 2 O = 18 g/mol, ü liczba moli wody jest równa liczbie moli estru Ø stężenia molowe / liczba moli reagentów w stanie równowagi w pierwszym przypadku: ü n. CH 3 COOH = 0, 04 mol – 0, 02 mol = 0, 02 mol, ü n. C 3 H 7 OH = 0, 05 mol – 0, 02 mol = 0, 03 mol, ü n. CH 3 COOC 3 H 7 = 0, 02 mol, ü n. H 2 O = 0, 02 mol,

Zadanie 9 i rozwiązanie / cd Ø obliczenie stałej równowagowej reakcji: Ø wyjściowe stężenia molowe / liczba moli w reagentów w drugim przypadku:

Zadanie 9 i rozwiązanie / cd Ø stężenia molowe / liczba moli reagentów w stanie równowagi w drugim przypadku: ü n. CH 3 COOH = 2 mol – x ü n. CH 3 COOC 3 H 7 = x ü n. C 3 H 7 OH = 3 mol – x ü n. H 2 O = x Ø obliczenie liczby moli propanolu ü x 2 = 0, 67 ∙ x 2 – 3, 35 ∙ x + 4, 02 ü - 0, 33 x 2 – 3, 35 x + 4 = 0

Zadanie 9 i rozwiązanie / cd ü pierwiastek drugi należy odrzucić ze względu na ujemną wartość, Ø obliczenie masy octanu propylu: ü m. CH 3 COOC 3 H 7 = n. CH 3 COOC 3 H 7 ∙ MCH 3 COOC 3 H 7 = =1, 076 mol ∙ 102 g/mol = 109, 75 g

Zadanie 10 i rozwiązanie v. Stała równowagi reakcji: A(g) + B(g) ↔ 2 C(g) wynosi 0, 25. W stanie równowagi ciśnienie cząstkowe / parcjalne produktu C jest równe 10 k. Pa. v. Oblicz wartości ciśnień cząstkowych / parcjalnych substratów A i B w stanie równowagi, jeżeli mieszanina wyjściowa zawierała substraty wyłącznie w ilościach stechiometrycznych. v. Analiza i założenia do zadania: Ø ciśnienia cząstkowe / parcjalne reagentów w stanie równowagi: ü PC = 10 k. Pa, ü PA = PB = x, ü KP – gazowa stała równowagowa.

Zadanie 10 i rozwiązanie / cd Ø obliczenie ciśnień cząstkowych / parcjalnych substratów A i B w stanie równowagi: ü 0, 25 ∙ x 2 = 100 (k. Pa)2 ü x 2 = 400 (k. Pa)2

Uzupełnienie v W układach heterogenicznych substraty o stałym stopniu skupienia nie mają wpływu na stałą równowagową reakcji, dla poniższych przykładów wyrażenia na stałą równowagową przyjmą postać: Ø Ca. CO 3(s) ↔ Ca. O(s) + CO 2(g) Ø Fe 2 O 3(s) + 3 CO(g) ↔ 2 Fe(s) + 3 CO 2(g) Ø 3 Fe(s) + 4 H 2 O(g) ↔ Fe 3 O 4(s) + 4 H 2(g)
 Staa mata
Staa mata Obliczanie entalpii spalania
Obliczanie entalpii spalania 15g magnezu poddano reakcji chemicznej z kwasem etanowym
15g magnezu poddano reakcji chemicznej z kwasem etanowym Reakcja chemiczna opisana równaniem 4hcl
Reakcja chemiczna opisana równaniem 4hcl Entalpia reakcji wzór
Entalpia reakcji wzór Równowaga chemiczna reakcji 2so3
Równowaga chemiczna reakcji 2so3 Macierz reakcji łańcucha dostaw
Macierz reakcji łańcucha dostaw Fosfor występuje w czterech odmianach alotropowych
Fosfor występuje w czterech odmianach alotropowych Kwas lewisa
Kwas lewisa Rodzaje entalpii
Rodzaje entalpii Monopochodne
Monopochodne Wydajność reakcji
Wydajność reakcji Termodynamika
Termodynamika Postulat hammonda
Postulat hammonda Estry
Estry Prawo hooke'a zadania
Prawo hooke'a zadania Formowanie jednostek ładunkowych
Formowanie jednostek ładunkowych Kalkulacja doliczeniowa zadania
Kalkulacja doliczeniowa zadania Moc jednostka
Moc jednostka Zadania kas
Zadania kas Zmieszano 1 5 mola gazowego fluorowca z 3 molami wodoru
Zmieszano 1 5 mola gazowego fluorowca z 3 molami wodoru Badania marketingowe zadania
Badania marketingowe zadania Wartość bezwzględna liczby rzeczywistej
Wartość bezwzględna liczby rzeczywistej Podzial logiczny
Podzial logiczny Otrzymywanie soli zadania
Otrzymywanie soli zadania Zadania gimnastyki wyrównawczej
Zadania gimnastyki wyrównawczej