Procesy wieloetapowe cz II Przykadowe zadania z rozwizaniem
























- Slides: 32

Procesy wieloetapowe – cz. II Przykładowe zadania z rozwiązaniem: - reakcje z udziałem Fe i jego związków, - reakcje z udziałem Mn i jego związków, - reakcje z udziałem Zn i jego związków, - reakcje z udziałem Ag i jego związków, - reakcje z udziałem Pb i jego związków, - reakcje z udziałem Sn i jej związków, - reakcje z udziałem Hg i jego związków.

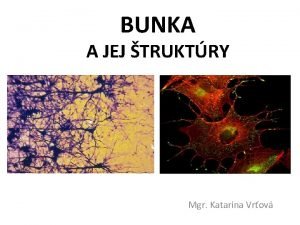
Zadanie 6 v Dobierając ewentualnie niezbędny substrat i konieczne warunki zapisz równania reakcji w formie cząsteczkowej, lub jonowej jeżeli reakcja zachodzi miedzy jonami, lub między jonem a cząsteczką. IX Fe. S 2 XIII XIV I Fe 2 O 3 II Fe 3 O 4 Fe. O XVI Fe 2(SO 4)3 XV Fe. SO 4 Na. Fe. O 2 III XII Fe Fe(OH)3 X XVIII Fe(OH)2 XI IV VIII XVII Na 2 Fe. O 4 VI Fe. Cl 2 V Fe. Cl 3 VII

Zadanie 6 – rozwiązanie Ø I. spalenie pirytu: T ü 4 Fe. S 2 + 11 O 2 4 Fe 2 O 3 + 8 SO 2 Ø II. redukcja tlenku żelaza(II) tlenkiem węgla(II): T ü Fe 2 O 3 + CO 2 Fe. O + CO 2 Ø III. redukcja tlenku żelaza(II) CO / C / H 2: T ü Fe. O + CO Fe + CO 2 lub T ü Fe. O + C Fe + CO T ü Fe. O + H 2 Fe + H 2 O

Zadanie 6 – rozwiązanie / cd Ø IV. roztwarzanie żelaza w kwasie chlorowodorowym: ü Fe + 2 H+ + 2 Cl- Fe 2+ + 2 Cl- + H 2↑ Ø V. synteza chlorku żelaza(III) z pierwiastków: T ü 2 Fe + 3 Cl 2 2 Fe. Cl 3 VI. strącanie wodorotlenku żelaza(II) wodnym roztworem mocnej zasady: ü Fe 2+ + 2 Cl- + 2 Na+ + 2 OH- Fe(OH)2↓ + 2 Na+ + 2 Cl. VII. strącanie wodorotlenku żelaza(III) wodnym roztworem mocnej zasady: ü Fe 3+ + 3 Cl- + 3 Na+ + 3 OH- Fe(OH)3↓ + 3 Na+ + 3 Cl-

Zadanie 6 – rozwiązanie / cd Ø VIII. utlenienie Fe(OH)2 do wodorotlenku żelaza(III): ü 4 Fe(OH)2 + O 2 + 2 H 2 O 4 Fe(OH)3 Ø IX. usuwanie wody konstytucyjnej w podwyższonej temperaturze: T ü Fe(OH)2 Fe. O + H 2 O Ø X. usuwanie wody konstytucyjnej w podwyższonej temperaturze: T ü 2 Fe(OH)3 Fe 2 O 3 + 3 H 2 O XI. utlenienie żelaza przegrzaną parą wodną: T ü 3 Fe + 4 H 2 O Fe. O∙Fe 2 O 3 + 4 H 2 lub

Zadanie 6 – rozwiązanie / cd Ø lub spalanie sproszkowanego żelaza: T ü 3 Fe + 2 O 2 Fe. O∙Fe 2 O 3 Ø XII. redukcja Fe 3 O 4 tlenkiem węgla(II): T ü Fe. O∙Fe 2 O 3 + 4 CO 3 Fe + 4 CO 2 Ø XIII. częściowa redukcja Fe 2 O 3 w podwyższonej temp. : T ü 6 Fe 2 O 3 4 Fe 3 O 4 + O 2 Ø XIV. synteza siarczku żelaza(II) z pierwiastków w podwyższonej temperaturze: T ü Fe + S Fe. S

Zadanie 6 – rozwiązanie / cd Ø XV. roztwarzanie żelaza w rozcieńczonym roztworze kwasu siarkowego(VI): ü Fe + 2 H+ + SO 42 - Fe 2+ + SO 42 - + H 2 Ø XVI. roztwarzanie żelaza w stężonym roztworze kwasu siarkowego(VI) na gorąco: T ü 2 Fe + 12 +6 2 Fe 3+ + 3 SO 42 - + 3 SO 2 + 6 H 2 O Ø XVII. utlenienie tlenku żelaza(III) do żelazianu(VI): ü Fe 2 O 3 + 4 K+ + 4 OH- + 3 K+ + 3 NO 3 - 2 K 2 Fe. O 4 + 3 K+ + 3 NO 2 - + 2 H 2 O Ø XVIII. spiekanie Fe(OH)3 (lub Fe 2 O 3) ze stałym Na. OH H+ SO 42 - T ü Fe(OH)3 + Na. OH Na. Fe. O 2 + 2 H 2 O (żelazian(III) sodu

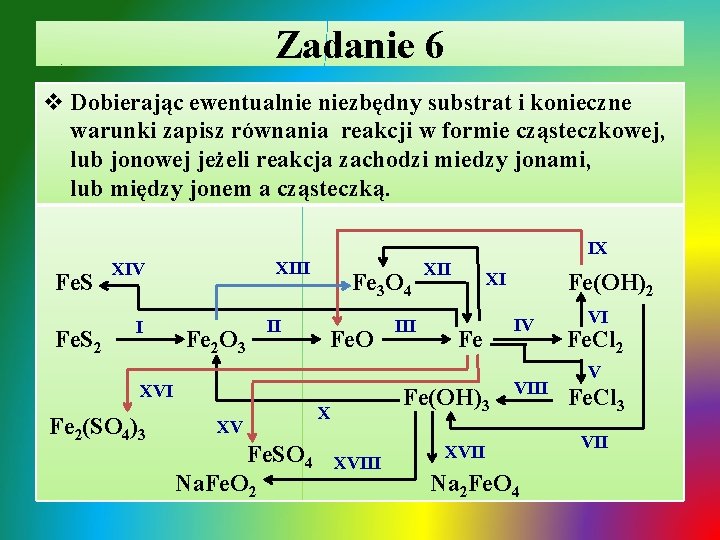
Zadanie 7 v. Zapisz równania reakcji w formie cząsteczkowej, lub jonowej jeżeli reakcja zachodzi miedzy jonami, lub między jonem a cząsteczką. Podaj barwy związków manganu. Mn 2 O 7 KMn. O 4 VI/T Mn. O 2 XIV/T, H CO K 2 Mn. O 4 X/H 2 SO 4 Mn. CO 3 I/T Mn. O II/T, CO 2 Mn III/T, Al XII/H 2 O Mn 3 O 4 IV/HCl(aq) V/T, HCl(aq) Mn. Cl 2 3 XV/T Mn 2 O 3 VII/Na. OH IX/T VIII/H 2 O HMn. O 4 XIII/H 2 SO 4 Ba. SO 4 2 XI/T Mn. S XVI/T Mn(OH)2 XIX/H 2 SO 4 XX/(NH 4)2 S XVIII/ HCl(aq) XVII/H 2 O Mn. SO 4 KMn. O 4 + Mn. O 2

Zadanie 7 - rozwiązanie Ø I. termiczny rozkład węglanu manganu(II), tlenek manganu(II) - szarozielona: T ü Mn. CO 3 Mn. O + CO 2↑ Ø II. częściowe utlenienie Mn. O w atmosferze CO 2 do (Mn. O)2∙Mn. O 2 /Mn 3 O 4 - brunatnoczerwona T ü 3 Mn. O + CO 2 Mn 3 O 4 + CO↑ Ø III. otrzymywanie manganu w procesie aluminotermii – redukcja tlenku dwumanganu(II) manganu(IV): ü 3 Mn 3 O 4 + 8 Al 9 Mn + 4 Al 2 O 3 Ø IV. roztwarzanie Mn. O w kwasie – Mn. Cl 2 - bladoróżowa ü Mn. O + 2 H+ + Cl- Mn 2+ + 2 Cl- + H 2 O

Zadanie 7 - rozwiązanie / cd Ø V. roztwarzanie tlenku manganu(IV) w kwasie HCl: ü Mn. O 2 + 4 H+ + 4 Cl- Mn 2+ + 2 Cl- + Cl 2 + H 2 O Ø VI. termiczny rozkład KMn. O 4 - fioletoworóżowa do Mn. O 2 - czarna i K 2 Mn. O 4 - zielona: T ü 2 KMn. O 4 K 2 Mn. O 4 + Mn. O 2 + O 2↑ Ø VII. strącanie wodorotlenku manganu(II) - biała roztworem zasady: ü Mn 2+ + 2 Cl- + 2 Na+ + 2 OH- Mn(OH)2↓ + 2 Na+ + 2 ClØ VIII. roztwarzanie manganu w wodzie: ü Mn + 2 H 2 O Mn(OH)2↓ + H 2↑

Zadanie 7 - rozwiązanie / cd Ø IX. usuwanie wody konstytucyjnej w podwyższonej temp. : T ü Mn(OH)2 Mn. O + H 2 O Ø X. wypieranie bezwodnika kwasowego Mn 2 O 7 – ciemnozielony, pary fioletowe - z soli przez mocniejszy kwas siarkowy(VI): ü 2 KMn. O 4 + H 2 SO 4 Mn 2 O 7 + 2 K+ + SO 42 - + H 2 O Ø XI. termiczny rozkład tlenku manganu(VII): T ü 2 Mn 2 O 7 4 Mn. O 2 + 3 O 2 Ø XII. roztwarzanie tlenku manganu(VII) w wodzie: ü Mn 2 O 7 + H 2 O 2 H+ + 2 Mn. O 4 - (fioletoworóżowa)

Zadanie 7 - rozwiązanie / cd Ø XIII. wypieranie kwasu manganowego(VII) z soli przez mocniejszy kwas siarkowy(VI): ü Ba(Mn. O 4)2 + 2 H+ + SO 42 - 2 H+ + 2 Mn. O 4 - + Ba. SO 4↓ Ø XIV. spiekanie Mn. O 2 ze stałym K 2 CO 3, powstaje manganian(VI) potasu – zielony T ü Mn. O 2 + K 2 CO 3 K 2 Mn. O 4 + CO↑ Ø XV. termiczny rozkład tlenku manganu(IV): T ü 4 Mn. O 2 2 Mn 2 O 3 + O 2↑ Ø XVI. termiczny rozkład tlenku manganu(III): T ü 6 Mn 2 O 3 4 Mn 3 O 4 + O 2↑

Zadanie 7 - rozwiązanie / cd Ø XVII. przejście manganianu(VI) w manganian(VII) w środowisku obojętnym: ü 6 K+ + 3 Mn. O 42 - + 2 H 2 O 2 K+ + 2 Mn. O 4 - + 4 K+ + 4 OH- + Mn. O 2↓ Ø XVIII. przejście manganianu(VI) w manganian(VII) w środowisku kwasowym: ü 6 K+ + 3 Mn. O 42 - + 4 H+ + 4 Cl- 2 K+ + 2 Mn. O 4 - + 4 K+ + 4 Cl- + 2 H 2 O + Mn. O 2↓ Ø XIX. wypieranie z soli kwasu HCl bardziej lotnego przez kwas mocny mniej lotny H 2 SO 4: ü Mn. Cl 2(s) + 2 H+ + SO 42 - Mn 2+ + SO 42 - + 2 HCl↑ Ø XX. strącanie siarczku manganu(II) – cielistoróżowy: ü Mn 2+ + SO 42 - + 2 NH 4+ + S 2 - Mn. S↓ + 2 NH 4+ + SO 42 -

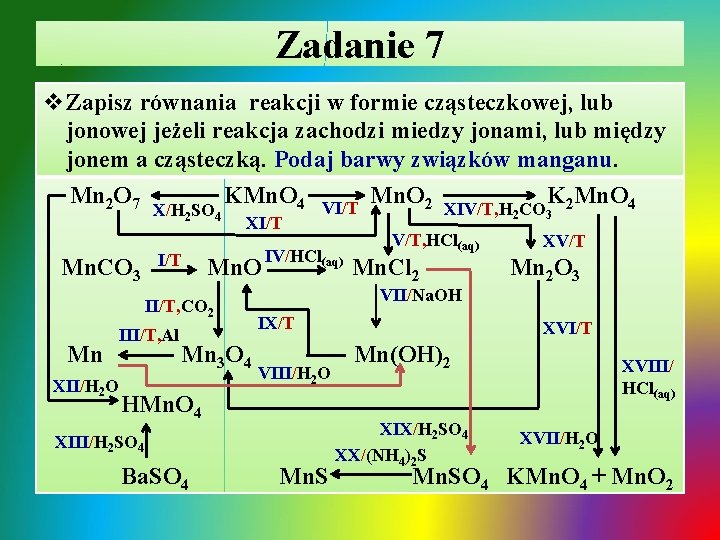
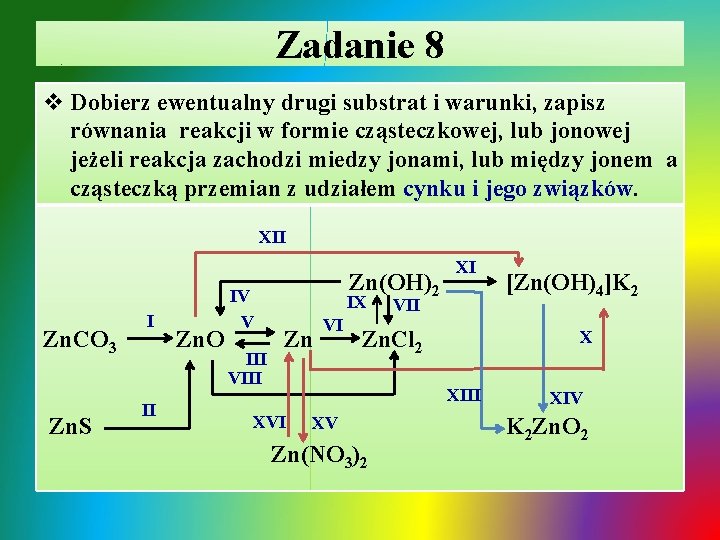
Zadanie 8 v Dobierz ewentualny drugi substrat i warunki, zapisz równania reakcji w formie cząsteczkowej, lub jonowej jeżeli reakcja zachodzi miedzy jonami, lub między jonem a cząsteczką przemian z udziałem cynku i jego związków. XII Zn. CO 3 Zn. S I II Zn. O IV V III VIII Zn(OH)2 IX Zn VI XI VII Zn. Cl 2 X XIII XV Zn(NO 3)2 [Zn(OH)4]K 2 XIV K 2 Zn. O 2

Zadanie 8 - rozwiązanie Ø I. termiczny rozkład węglanu cynku: T ü Zn. CO 3 Zn. O + CO 2 Ø II. spalanie siarczku cynku: T ü 2 Zn. S + 3 O 2 2 Zn. O + 2 SO 2 Ø III. spalanie cynku: T ü 2 Zn + O 2 2 Zn. O Ø IV. termiczny rozkład wodorotlenku cynku: T üZn(OH)2 Zn. O + H 2 O↑

Zadanie 8 - rozwiązanie / cd Ø V. redukcja tlenku cynku węglem lub tlenkiem węgla(II): T ü Zn. O + C Zn + CO ü Ø ü Ø ü T Zn. O + CO Zn + CO 2 VI. roztwarzanie cynku w roztworze kwasu: Zn + 2 H+ + 2 Cl- Zn 2+ + 2 Cl- + H 2↑ VII. roztwarzanie wodorotlenku cynku w kwasie: Zn(OH)2 + 2 H+ + 2 Cl- Zn 2+ + 2 Cl- + 2 H 2 O VIII. roztwarzanie tlenku cynku w kwasie: Zn. O + 2 H+ + 2 Cl- Zn 2+ + 2 Cl- + H 2 O

Zadanie 8 - rozwiązanie / cd Ø IX. strącanie wodorotlenku cynku roztworem mocnej zasady: ü Zn 2+ + 2 Cl- + 2 Na+ + 2 OH- Zn(OH)2↓ + 2 Na+ + 2 ClØ X. roztwarzanie cynku w nadmiarze roztworu mocnej zasady: ü Zn + 2 K+ + 2 OH- + 2 H 2 O [Zn(OH)4]2 - + 2 K+ + H 2↑ Ø XI. roztwarzanie wodorotlenku cynku w nadmiarze roztworu mocnej zasady: ü Zn(OH)2 + 2 K+ + 2 OH- [Zn(OH)4]2 - + 2 K+ Ø XII. roztwarzanie tlenku cynku w nadmiarze roztworu mocnej zasady w podwyższonej temperaturze: T üZn. O + 2 K+ + 2 OH- + H 2 O [Zn(OH)4]2 - + 2 K+

Zadanie 8 - rozwiązanie / cd Ø XIII. stapianie wodorotlenku cynku ze stałym KOH: T ü Zn(OH)2 + 2 KOH K 2 Zn. O 2 + 2 H 2 O↑ Ø XIV. usuwanie wody konstytucyjnej [Zn(OH)4]K 2: T + 2ü 2 K + [Zn(OH)4] K 2 Zn. O 2 + 2 H 2 O↑ Ø XV. roztwarzanie cynku w roztworze kwasu azotowego(V) w zależności od stężenia roztworu kwasu: ü 4 Zn + 10 H+ + 10 NO 3 - NH 4+ + 4 Zn 2+ + 9 NO 3 - + 3 H 2 O ü Zn + 4 H+ + 4 NO 3 - Zn 2+ + 2 NO 3 - + 2 NO 2↑ + 2 H 2 O ü 3 Zn + 8 H+ + 8 NO 3 - 3 Zn 2+ + 6 NO 3 - + 2 NO↑ + 4 H 2 O Ø XVI. wypieranie z soli metalu mniej aktywnego Zn przez metal aktywniejszy np. Mg: ü Zn 2+ + 2 NO 3 - + Mg Zn↓ + Mg 2+ + 2 NO 3 -

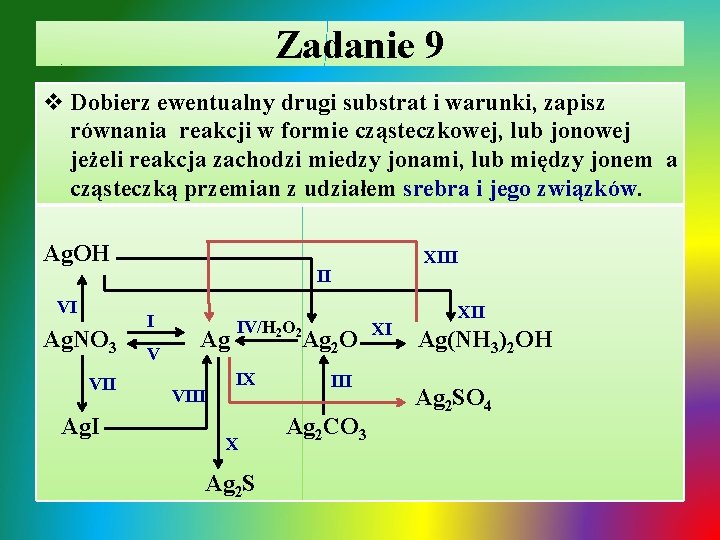
Zadanie 9 v Dobierz ewentualny drugi substrat i warunki, zapisz równania reakcji w formie cząsteczkowej, lub jonowej jeżeli reakcja zachodzi miedzy jonami, lub między jonem a cząsteczką przemian z udziałem srebra i jego związków. Ag. OH VI Ag. NO 3 VII Ag. I XIII II I V Ag VIII IV/H 2 O 2 Ag 2 O IX X Ag 2 S III Ag 2 CO 3 XI XII Ag(NH 3)2 OH Ag 2 SO 4

Zadanie 9 - rozwiązanie Ø I. wypieranie srebra z soli przez aktywniejszy metal – Cu: ü 2 Ag+ + 2 NO 3 - + Cu 2 Ag↓ + Cu 2+ + 2 NO 3Ø II. termiczny rozkład wodorotlenku srebra: T ü 2 Ag(OH)2 Ag 2 O + H 2 O Ø III. termiczny rozkład węglanu srebra: ü Ø ü T Ag 2 CO 3 Ag 2 O + CO 2↑ IV. katalityczny rozkład nadtlenku wodoru: Ag 2 O + H 2 O 2 2 Ag + O 2↑+ H 2 O V. roztwarzanie srebra w roztworze kwasu azotowego(V): stęż. : Ag + 2 H+ + 2 NO 3 - Ag+ + NO 3 - + NO 2↑ + H 2 O

Zadanie 9 - rozwiązanie / cd ü rozc. : 3 Ag + 4 H+ + 4 NO 3 - 3 Ag+ + 3 NO 3 - + NO↑ + 2 H 2 O Ø VI. strącanie wodorotlenku srebra roztworem mocnej zasady lub hydroliza stężonego roztworu Ag. NO 3: ü Ag+ + NO 3 - + Na+ + OH- Ag. OH↓ + Na+ + NO 3ü Ag+ + NO 3 - + H 2 O ↔ Ag. OH↓ + H+ + NO 3ü VII. strącanie jodku srebra roztworem KI: ü Ag+ + NO 3 - + K+ + I- Ag. I↓ + K+ + NO 3Ø VIII. rozkład soli pod wpływem światła: św. ü 2 Ag. I 2 Ag + I 2 Ø IX. roztwarzanie srebra w stężonym roztworze H 2 SO 4: ü 2 Ag + 4 H+ + 2 SO 42 - 2 Ag 2+ + SO 42 - + SO 2↑ + 2 H 2 O

Zadanie 9 - rozwiązanie / cd Ø X. czernienie srebra pod wpływem siarkowodoru w warunkach tlenowych: ü 4 Ag + 2 H 2 S(g) + O 2(g) 2 Ag 2 S + 2 H 2 O Ø XI i XII. otrzymywanie odczynnika Tollensa – rozpuszczanie wodorotlenku i tlenku srebra w środowisku zasadowym rozpuszczanie w wodzie amoniakalnej : ü Ag. OH + 2 NH 3(aq) Ag(NH 3)2 OH(aq) ü Ag 2 O + 4 NH 3(aq) + H 2 O 2 Ag(NH 3)2 OH(aq) Ø XIII. reakcja (próba) Tollensa / wykrywanie grupy aldehydowej –CHO: T ü CH 3 – CHO + 2 Ag(NH 3)2 OH 2 Ag↓+ CH 3 -COO- + NH 4+ + 3 NH 3↑+ H 2 O

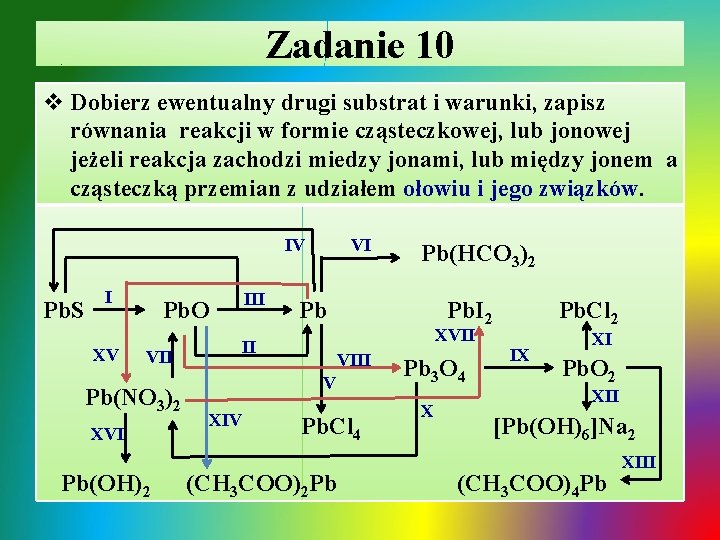
Zadanie 10 v Dobierz ewentualny drugi substrat i warunki, zapisz równania reakcji w formie cząsteczkowej, lub jonowej jeżeli reakcja zachodzi miedzy jonami, lub między jonem a cząsteczką przemian z udziałem ołowiu i jego związków. VI IV Pb. S I XV III Pb. O VII Pb(NO 3)2 XVI Pb(OH)2 Pb Pb. I 2 Pb. Cl 2 XVII II VIII V XIV Pb(HCO 3)2 Pb. Cl 4 (CH 3 COO)2 Pb Pb 3 O 4 X IX XI Pb. O 2 XII [Pb(OH)6]Na 2 (CH 3 COO)4 Pb XIII

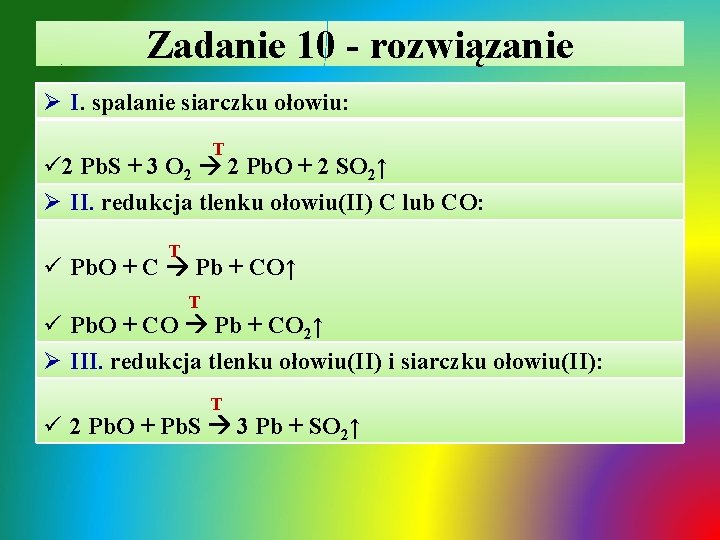
Zadanie 10 - rozwiązanie Ø I. spalanie siarczku ołowiu: T ü 2 Pb. S + 3 O 2 2 Pb. O + 2 SO 2↑ Ø II. redukcja tlenku ołowiu(II) C lub CO: T ü Pb. O + C Pb + CO↑ T ü Pb. O + CO Pb + CO 2↑ Ø III. redukcja tlenku ołowiu(II) i siarczku ołowiu(II): T ü 2 Pb. O + Pb. S 3 Pb + SO 2↑

Zadanie 10 - rozwiązanie / cd Ø IV. synteza siarczku ołowiu z pierwiastków: T ü 2 Pb + S Pb. S Ø V. synteza chlorku ołowiu(IV) z pierwiastków: ü Ø T Pb + 2 Cl 2 Pb. Cl 4 VI. roztwarzanie ołowiu pod wpływem O 2, H 2 O i CO 2: 2 Pb + O 2 + 2 H 2 O + 4 CO 2 2 Pb 2+ + 4 HCO 3 VII. termiczny rozkład azotanu(V) ołowiu(II): T ü 2 Pb(NO 3)2 2 Pb. O + O 2↑ + 4 NO 2↑ T

Zadanie 10 - rozwiązanie / cd Ø VIII. utlenienie tlenku ołowiu(II) do tlenku podwójnego: T ü 6 Pb. O + O 2 2 Pb 3 O 4 / (Pb. O)2∙Pb. O 2 Ø IX i X. roztwarzanie tlenku podwójnego w roztworze Ø HNO 3 : ü Pb 3 O 4 + 4 H+ + 4 NO 3 - 2 Pb 2+ + 4 NO 3 - + Pb. O 2↓ + 2 H 2 O Ø XI. otrzymywanie chlorku ołowiu(II): T üPb. O 2 + 4 H+ + 4 Cl- Pb. Cl 2↓+ Cl 2↑ + 2 H 2 O Ø XII. roztwarzanie tlenku ołowiu(IV) roztworem mocnej zasady / amfoteryczny charakter tlenku, powstaje heksahdroksyołowian(IV) sodu: ü Pb. O 2 + 2 Na+ + 2 OH- + 2 H 2 O [Pb(OH)6]2 - + 2 Na+

Zadanie 10 - rozwiązanie / cd Ø XIII i XIV. roztwarzanie tlenków ołowiu w kwasie octowym : ü Pb. O 2 + 4 H+ + 4 CH 3 COO- Pb 4+ + 4 CH 3 COO- + 2 H 2 O ü Pb. O + 2 H+ + 2 CH 3 COO- Pb 2+ + 2 CH 3 COO- + H 2 O Ø XV. ołowiu w roztworze HNO 3 : ü Pb + 2 H+ + NO 3 - Pb 2+ + 2 NO 3 - + H 2 O Ø XVI. strącanie wodorotlenku ołowiu(II) roztworem mocnej zasady lub w reakcji hydrolizy soli: ü Pb 2+ + 2 NO 3 - + 2 Na+ + 2 OH- Pb(OH)2↓ + 2 Na+ + 2 NO 3ü Pb 2+ + 2 NO 3 - + 2 H 2 O ↔ Pb(OH)2↓ + 2 H+ + 2 NO 3Ø XVII. strącanie jodku ołowiu(II) roztworem soli jodkowej: ü Pb 2+ + 2 NO 3 - + 2 Na+ + 2 I- Pb. I 2↓ + 2 Na+ + 2 NO 3 -

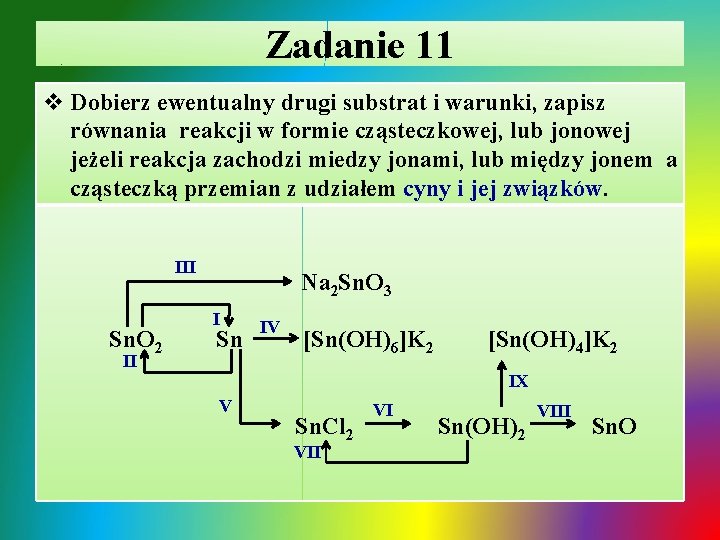
Zadanie 11 v Dobierz ewentualny drugi substrat i warunki, zapisz równania reakcji w formie cząsteczkowej, lub jonowej jeżeli reakcja zachodzi miedzy jonami, lub między jonem a cząsteczką przemian z udziałem cyny i jej związków. III Sn. O 2 II Na 2 Sn. O 3 I Sn IV [Sn(OH)6]K 2 [Sn(OH)4]K 2 IX V Sn. Cl 2 VII VI Sn(OH)2 VIII Sn. O

Zadanie 11 - rozwiązanie Ø I. redukcja tlenku cyny(IV) węglem: T ü Sn. O 2 + 2 C Sn + 2 CO↑ Ø II. utlenianie cyny do tlenku cyny(IV): T ü Sn + O 2 Sn. O 2 Ø III. spiekanie tlenku cyny(IV) z stałym wodorotlenkiem: T ü Sn. O 2 + 2 Na(OH)2 Na 2 Sn. O 3 + H 2 O Ø IV. roztwarzanie cyny w roztworze mocnej zasady: ü Sn + 2 K+ + 2 OH- + 4 H 2 O [Sn(OH)6]2 - + 2 K+ + 2 H 2↑

Zadanie 11 - rozwiązanie / cd Ø ü ü Ø V. roztwarzanie cyny w roztworze kwasu: Sn + 2 H+ + 2 Cl- Sn 2+ + 2 Cl- + H 2↑ VI. strącanie Sn(OH)2 roztworem zasady lub hydroliza: Sn 2+ + 2 Cl- + 2 Na+ + 2 OH- Sn(OH)2↓ + 2 Na+ + 2 Cl. Sn 2+ + 2 Cl- + 2 H 2 O ↔ Sn(OH)2↓ + 2 H+ + 2 Cl. VII. roztwarzanie wodorotlenku w roztworze kwasu: Sn(OH)2 + 2 H+ + 2 Cl- Sn 2+ + 2 Cl- + 2 H 2 O VIII. usuwanie wody konstytucyjnej z wodorotlenku: T üSn(OH)2 Sn. O + H 2 O Ø IX. roztwarzanie Sn(OH)2 w roztworze mocnej zasady: ü Sn(OH)2 + 2 K+ + 2 OH- [Sn(OH)]2 - + 2 K+

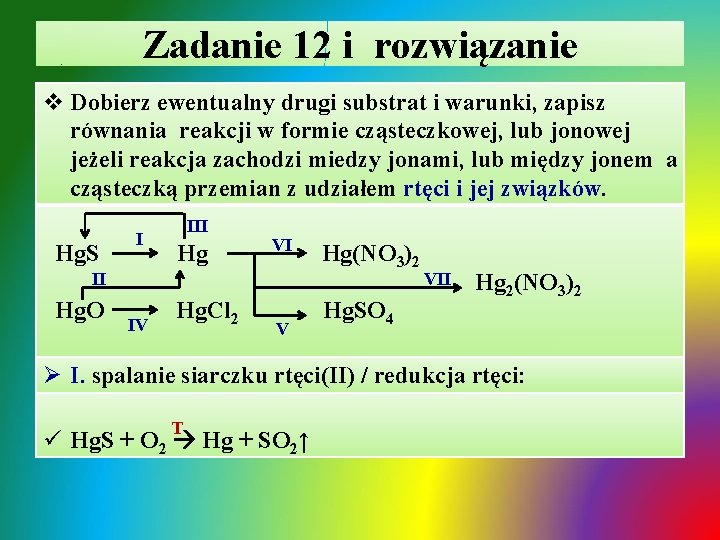
Zadanie 12 i rozwiązanie v Dobierz ewentualny drugi substrat i warunki, zapisz równania reakcji w formie cząsteczkowej, lub jonowej jeżeli reakcja zachodzi miedzy jonami, lub między jonem a cząsteczką przemian z udziałem rtęci i jej związków. Hg. S I III Hg VI II Hg. O IV Hg. Cl 2 V Hg(NO 3)2 Hg. SO 4 VII Hg 2(NO 3)2 Ø I. spalanie siarczku rtęci(II) / redukcja rtęci: T ü Hg. S + O 2 Hg + SO 2↑

Zadanie 12 - rozwiązanie / cd Ø II. termiczny rozkład tlenku rtęci: ü Ø ü Ø ü ü ü T 2 Hg. O 2 Hg + O 2↑ III. synteza siarczku rtęci(II) w temperaturze pokojowej: Hg + S Hg. S IV. roztwarzanie tlenku rtęci(II) w roztworze kwasu: Hg. O + 2 H+ + 2 Cl- Hg 2+ + 2 Cl- + H 2 O V, VI i VIII. roztwarzanie rtęci w kwasach utleniających: Hg + 4 H+ + 2 SO 42 - Hg 2+ + SO 42 - + SO 2↑ + 2 H 2 O Hg + 4 H+ + 4 NO 3 - Hg 2+ + 2 NO 3 - + 2 NO 2↑ + 2 H 2 O 6 Hg + 8 H+ + 8 NO 3 - 3 Hg 22+ + 6 NO 3 - + 2 NO↑ + 4 H 2 O
 Doświadczenia wieloetapowe metoda drzewka
Doświadczenia wieloetapowe metoda drzewka Procesy informacyjne w zarządzaniu
Procesy informacyjne w zarządzaniu Procesy uczenia się
Procesy uczenia się Procesy katalityczne
Procesy katalityczne Procesy cieplne
Procesy cieplne Centrom bunkového dýchania sú:
Centrom bunkového dýchania sú: Vonkajšie geologické procesy
Vonkajšie geologické procesy Logistyka zaopatrzenia i produkcji
Logistyka zaopatrzenia i produkcji Katabolické procesy
Katabolické procesy Procesy informacyjne
Procesy informacyjne Psychické vlastnosti
Psychické vlastnosti Procesy przeduwagowe
Procesy przeduwagowe Lejek krasowy – uwał – polje
Lejek krasowy – uwał – polje Endogenne procesy
Endogenne procesy Vnútorné geologické procesy
Vnútorné geologické procesy Katastrofické geologické procesy
Katastrofické geologické procesy Procesy anaboliczne przykłady
Procesy anaboliczne przykłady Co to jest wartość energetyczna
Co to jest wartość energetyczna Ergonomia koncepcyjna
Ergonomia koncepcyjna Zadania na dowodzenie cke
Zadania na dowodzenie cke Zadania obrony cywilnej
Zadania obrony cywilnej Próg rentowności
Próg rentowności Oblicz iloczyn rozpuszczalności
Oblicz iloczyn rozpuszczalności Zadania własne gminy
Zadania własne gminy Przodownik roty pierwszej
Przodownik roty pierwszej Zadania wielkanocne
Zadania wielkanocne Miareczkowanie alkacymetryczne zadania
Miareczkowanie alkacymetryczne zadania Obliczanie momentu dipolowego
Obliczanie momentu dipolowego Różniczkowe prawo ohma
Różniczkowe prawo ohma O co konrad oskarża boga
O co konrad oskarża boga Pochyła maszyna prosta
Pochyła maszyna prosta Niepewność typu a excel
Niepewność typu a excel Zadania addytywne
Zadania addytywne