Procesy wieloetapowe cz IV Przykadowe zadania z rozwizaniem
















- Slides: 19

Procesy wieloetapowe – cz. IV Przykładowe zadania z rozwiązaniem: - reakcje z udziałem azotu i jego związków, - reakcje z udziałem siarki i jej związków.

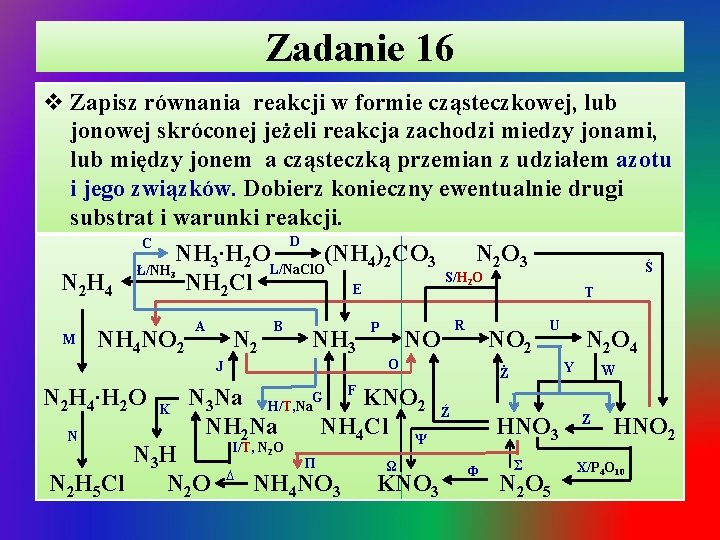
Zadanie 16 v Zapisz równania reakcji w formie cząsteczkowej, lub jonowej skróconej jeżeli reakcja zachodzi miedzy jonami, lub między jonem a cząsteczką przemian z udziałem azotu i jego związków. Dobierz konieczny ewentualnie drugi substrat i warunki reakcji. D C NH 3∙H 2 O (NH 4)2 CO 3 N 2 O 3 Ś L/Na. Cl. O Ł/NH S/H O N 2 H 4 NH 2 Cl E T 3 M NH 4 NO 2 2 A N 2 B NH 3 J N 2 H 4∙H 2 O N K P NO I/T, N 2 O ∆ Π NH 4 NO 3 NO 2 O N 3 Na H/T, Na. G F KNO 2 NH 2 Na NH 4 Cl Ψ N 3 H N 2 H 5 Cl N 2 O R Ω KNO 3 U Y Ż Ź HNO 3 Φ N 2 O 4 Σ N 2 O 5 W Z HNO 2 X/P 4 O 10

Zadanie 16 – rozwiązanie Ø A. Termiczny rozkład azotanu(III) amonu: T NH 4 NO 2(s) N 2↑+ 2 H 2 O Ø B. Synteza amoniaku z pierwiastków w podwyższonej temperaturze i zwiększonym ciśnieniem: T, p 3 H 2(g) + N 2(g) 2 NH 3↑ Ø C. Rozpuszczanie amoniaku w wodzie: ü NH 3(g) + H 2 O(c) NH 3∙H 2 O(c) / NH 4+ + OHØ D. Wysycanie wody amoniakalnej tlenkiem węgla(IV): ü 2 NH 3∙H 2 O + CO 2(g) 2 NH 4+ + CO 32 - + H 2 O ü E. Termiczny rozkład węglanu amonu: T ü (NH 4)2 CO 3(s) 2 NH 3↑ + CO 2↑ + H 2 O

Zadanie 16 – rozwiązanie / cd Ø F. Synteza chlorku amonu fazie gazowej lub w reakcji wody amoniakalnej z roztworem kwasu: ü NH 3(g) + HCl(g) NH 4 Cl(s) ü NH 3∙H 2 O + H+ + Cl- NH 4+ + Cl- + H 2 O Ø G. Termiczny rozkład chlorku amonu: T ü NH 4 Cl(s) NH 3↑ + HCl↑ Ø H. Otrzymywanie amidku sodu – przepuszczanie amoniaku nad sodem w podwyższonej temperaturze: T ü 2 NH 3(g) + 2 Na 2 NH 2 Na + H 2↑ Ø I. Otrzymywanie azydku sodu w reakcji tlenku azotu(I) z amidkiem sodowym w podwyższonej temperaturze: T ü 2 NH 2 Na + N 2 O(g) N 3 Na + Na. OH + NH 3↑

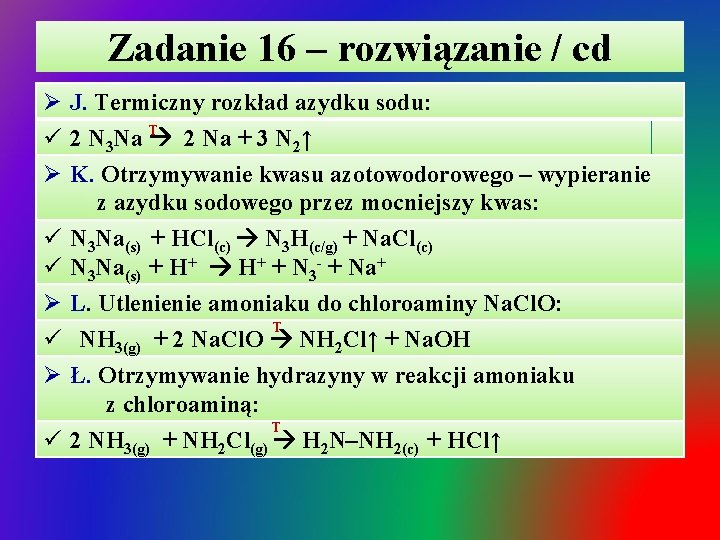
Zadanie 16 – rozwiązanie / cd Ø J. Termiczny rozkład azydku sodu: ü 2 N 3 Na T 2 Na + 3 N 2↑ Ø K. Otrzymywanie kwasu azotowodorowego – wypieranie z azydku sodowego przez mocniejszy kwas: ü N 3 Na(s) + HCl(c) N 3 H(c/g) + Na. Cl(c) ü N 3 Na(s) + H+ + N 3 - + Na+ Ø L. Utlenienie amoniaku do chloroaminy Na. Cl. O: T ü NH 3(g) + 2 Na. Cl. O NH 2 Cl↑ + Na. OH Ø Ł. Otrzymywanie hydrazyny w reakcji amoniaku z chloroaminą: T ü 2 NH 3(g) + NH 2 Cl(g) H 2 N–NH 2(c) + HCl↑

Zadanie 16 – rozwiązanie / cd Ø M. Rozpuszczanie hydrazyny w wodzie – wykazuje ona, tak jak amoniak słabe właściwości zasadowe: ü N 2 H 4 + H 2 O (NH 2 -NH 2)∙H 2 O / NH 2 -NH 3+ + OHØ N. Otrzymywanie chlorku hydrazyny: ü (NH 2 -NH 2)∙H 2 O + HCl NH 2 -NH 3 Cl + H 2 O ü (NH 2 -NH 2)∙H 2 O + H+ NH 2 -NH 3+ + H 2 O ü 2 NH 2 Cl(g) + N 2 H 4(c) 2 NH 2 -NH 3 Cl(s) + N 2↑ Ø O. Utlenienie azotu w łuku elektrycznym: łuk elektr. ü N 2(g) + O 2(g) 2 NO(g) Ø P. Spalanie amoniaku w obecności kat. Pt: Pt ü 4 NH 3(g) + 5 O 2 4 NO↑ + 6 H 2 O

Zadanie 16 – rozwiązanie / cd Ø R. Utlenienie tlenku azotu(II) do tlenku azotu(IV): ü 2 NO(g) + O 2(g) 2 NO 2↑ Ø S. Reakcja synproporcjonowania tlenków azotu II i IV w obniżonej temperaturze do tlenku azotu(III): -T ü IINO + IVNO IIIN O o. C ulega rozkładowi / T > -13 2 2 3(c) Ø Ś. Roztwarzanie tlenku azotu(III) w wodzie: ü N 2 O 3(g) ) + H 2 O 2 H+ + NO 2Ø T. Otrzymywanie azotanu(III) amonu: ü NH 3∙H 2 O + HNO 2 NH 4 NO 2 + H 2 O ü NH 3∙H 2 O + H+ NH 4+ + H 2 O Ø U. Dimeryzacja NO 2 w podwyższonej temperaturze: T ü 2 NO 2(g) N 2 O 4(g)

Zadanie 16 – rozwiązanie / cd Ø W i Y. Roztwarzanie tlenku azotu(IV) w wodzie – reakcja dysproporcjonowania: ü IVN 2 O 4(g) + H 2 O 2 H+ + VNO 3 - + IIINO 2ü 2 IVNO 2(g) + H 2 O 2 H+ + VNO 3 - + IIINO 2Ø Z. Rozkład nietrwałego kwasu azotowego(III) – reakcja dysproporcjonowania: ü 3 H+ + 3 IIINO 2 - H+ + VNO 3 - + 2 IINO↑ + H 2 O Ø Ż. Rozkład kwasu azotowego(V) pod wpływem uv lub reakcja metalu leżącego w szeregu aktywności za wodorem ze stężonym kwasem azotowym(V): uv + ü 4 H + 4 NO 3 - O 2↑ + 4 NO 2↑ + 2 H 2 O ü Bi + 6 H+ + 3 NO 3 - Bi 3+ + 3 NO 2↑ + 3 H 2 O

Zadanie 16 – rozwiązanie / cd Ø Ź. Częściowy rozkład rozcieńczonego kwasu azotowego(V) w reakcji z metalem leżącym w szeregu aktywności metali za wodorem Cu, Bi, Ag, Hg: ü Bi + 4 H+ + NO 3 - Bi 3+ + NO↑ + 2 H 2 O Ø X. Odwadnianie kwasu azotowego(V) tlenkiem fosforu(V): ü 4 H+ + 4 NO 3 - + P 4 O 10 2 N 2 O 5↓ + 4 H+ + 4 PO 3Ø Σ. Roztwarzanie tlenku azotu(V) w wodzie: ü N 2 O 5(s) + H 2 O 2 H+ + 2 NO 3Ø Φ. Roztwarzanie N 2 O 5 w wodnym roztworze zasady potasowej: ü N 2 O 5 + 2 KOH 2 KNO 3 + H 2 O ü N 2 O 5 + 2 OH- 2 NO 3 - + H 2 O

Zadanie 16 – rozwiązanie / cd Ø Ψ. Otrzymywanie azotanu(V) potasu: 2 K + 2 HNO 3 2 KNO 3 + H 2↑ ü 2 K + 2 H+ 2 K+ + H 2↑ K 2 O + 2 HNO 3 2 KNO 3 + H 2 O ü K 2 O + 2 H+ 2 K+ + H 2 O KOH + HNO 3 KNO 3 + H 2 O ü OH- + H+ H 2 O Ø ü ü ü Ø ü Ω. Termiczny rozkład azotanu(V) potasu: 2 KNO 3(s) T 2 KNO 2 + O 2↑ Σ. Otrzymywanie azotanu(V) amonu: NH 3∙H 2 O + HNO 3 NH 4 NO 3 + H 2 O NH 3∙H 2 O + H+ NH 4+ + H 2 O NH 4 Cl(s) + H+ NH 4+ + + HCl↑ ∆. Termiczny rozkład azotanu(V) amonu: NH 4 NO 3(s) T N 2 O↑ + 2 H 2 O

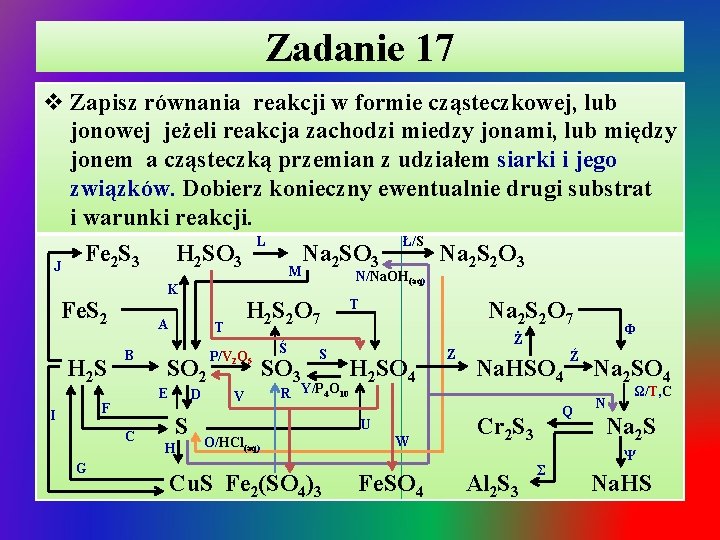
Zadanie 17 v Zapisz równania reakcji w formie cząsteczkowej, lub jonowej jeżeli reakcja zachodzi miedzy jonami, lub między jonem a cząsteczką przemian z udziałem siarki i jego związków. Dobierz konieczny ewentualnie drugi substrat i warunki reakcji. L Ł/S Fe 2 S 3 H 2 SO 3 Na 2 S 2 O 3 J M N/Na. OH(aq) K Fe. S 2 H 2 S A B C G T SO 2 E F I H 2 S 2 O 7 D S H P/V 2 O 5 V Ś SO 3 S R Y/P 4 O 10 T Na 2 S 2 O 7 H 2 SO 4 U O/HCl(aq) Cu. S Fe 2(SO 4)3 W Fe. SO 4 Z Φ Ż Na. HSO 4 Q Cr 2 S 3 Al 2 S 3 Ź Σ Na 2 SO 4 N Ω/T, C Na 2 S Ψ Na. HS

T Ø ü Ø ü Ø Zadanie 17 – rozwiązanie / cd A. Spalanie pirytu: 4 Fe. S 2 + 11 O 2 2 Fe 2 O 3 + 8 SO 2↑ B. Spalanie siarkowodoru w nadmiarze tlenu: 2 H 2 S + 3 O 2 2 H 2 O + 2 SO 2↑ C. Spalanie siarkowodoru w niedoborze tlenu: 2 H 2 S + O 2 2 H 2 O + 2 S D. Redukcja tlenku siarki(IV) węglem w podwyższonej temperaturze: T ü SO 2 + C S + CO 2↑ ü E. Spalanie siarki w powietrzu atmosferycznym: ü S + O 2 SO 2↑

Zadanie 17 – rozwiązanie / cd Ø F. Synteza siarkowodoru z pierwiastków w podwyższonej temperaturze: ü S + H 2 T H 2 S↑ Ø G. Wpieranie siarkowodoru z soli siarczkowej przez mocny kwas: ü Cu. S(s) + 2 H+ + SO 42 - Cu 2+ + SO 42 - + H 2 S↑ Ø H. Synteza siarczku miedzi(II) w pierwiastków w podwyższonej temperaturze: T ü S + Cu Cu. S Ø I. Strącanie siarczku miedzi(II) z roztworu soli przez wysycanie roztworu siarkowodorem: ü Cu 2+ + SO 42 - + H 2 S(g) Cu. S↓ + 2 H+ + SO 42 -

Zadanie 17 – rozwiązanie / cd Ø J. Strącanie siarczku żelaza(III) z roztworu soli w reakcji z kwasem siarkowodorowym (uwaga – metoda nie ma zastosowania dla strącania Al 2 S 3 i Cr 2 S 3): ü 2 Fe 3+ + 6 Cl- + + 6 H+ + 3 S 2 - Fe 2 S 3↓ + 6 H+ + 6 ClØ K. Roztwarzanie tlenku siarki(IV) w wodzie: ü SO 2(g) + H 2 O H+ + HSO 3Ø L. Otrzymywanie siarczanu(IV) sodu: ü 2 Na + 2 H+ + SO 32 - 2 Na+ + SO 32 - + H 2↑ ü Na 2 O + 2 H+ + SO 32 - 2 Na+ + SO 32 - + H 2 O ü 2 Na+ + 2 OH- + SO 32 - 2 Na+ + SO 32 - + 2 H 2 O Ø Ł. Synteza w podwyższonej temp. tiosiarczanu sodu: T ü Na 2 SO 3(s) + S Na 2 S 2 O 3

Zadanie 17 – rozwiązanie / cd Ø M. Wypieranie tlenku siarki(IV) z soli przez mocny kwas: ü Na 2 SO 3(s) + 2 H+ + SO 42 - 2 Na+ + SO 42 - + SO 2↑ + H 2 O Ø N. Roztwarzanie siarki w roztworze mocnej zasady reakcja dysproporcjonowania: ü 3 0 S + 6 Na+ + 6 OH- 6 Na+ + 2 -IIS 2 - + IVSO 32 - + 3 H 2 O Ø O. Otrzymywanie siarki koloidalnej w reakcji tiosiarczanu sodu z kwasem chlorowodorowym (Na 2 VI/-IIS 2 O 3): ü 2 Na+ + S 2 O 32 - + 2 H+ + 2 Cl- S↓ + SO 2↑ + 2 Na++2 Cl- +H 2 O Ø P. Utlenienie tlenku siarki(IV) wobec katalizatora: VO ü 2 SO 2(g) + O 2 2 SO 3(g/c) / krzepnie w temp. < 17 o. C Ø R. Termiczny rozkład siarczanu(VI) żelaza(III): ü Fe 2(SO 4)3(s) T 3 SO 3↑ + Fe 2 O 3(s) 2 5

Zadanie 17 – rozwiązanie / cd Ø ü Ø S. Roztwarzanie tlenku siarki(VI) w wodzie: SO 3 + H 2 O 2 H+ + SO 42Ś. Roztwarzanie SO 3 w kwasie siarkowym(VI): SO 3 + 2 H+ + SO 42 - 2 H+ + S 2 O 72 T. Rozcieńczanie kwasu dwusiarkowego(VI) / pirosiarkowego(VI) wodą: ü 2 H+ + S 2 O 72 - + H 2 O 4 H+ + 2 SO 42Ø U. Roztwarzanie / utlenienie siarki stężonym HNO 3: ü 0 S + 2 H+ + 2 VNO - 2 H+ + VISO 2 - + 2 IINO↑ 3 4 Ø V. Fe 2(SO 4)3(s) 3 SO 3↑ + Fe 2 O 3(s)

Zadanie 17 – rozwiązanie / cd Ø W. Roztwarzanie żelaza rozcieńczony H 2 SO 4 : ü Fe + 2 H+ + SO 42 - Fe 2+ + SO 42 - + H 2↑ Ø Y. Odwodnienie – usuwanie wody konstytucyjnej z użyciem P 4 O 10: ü 4 H+ + 2 SO 42 - + P 4 O 10 4 H+ + 4 PO 3 - + 2 SO 3 Ø Z. Otrzymywanie wodorosiarczanu(VI) sodu: ü Na+ + OH- + H+ + HSO 4 - Na+ + HSO 4 - + H 2 O ü 2 Na + 2 H+ + 2 HSO 4 - 2 Na+ + 2 HSO 4 - + H 2↑ ü Na 2 O + 2 H+ + 2 HSO 4 - 2 Na+ + 2 HSO 4 - + H 2 O Ø Ż. Eliminacja wody konstytucyjnej z Na. HSO 4 w podwyższonej temperaturze: T ü 2 Na. HSO 4(s) Na 2 S 2 O 7 + H 2 O

Zadanie 17 – rozwiązanie / cd Ø Ź. Otrzymywanie siarczanu(VI) sodu: ü Na+ + H+ + SO 4 - + Na+ + OH- 2 Na+ + SO 42 - + H 2 O ü 2 Na+ + 2 H+ + 2 SO 4 - + 2 Na 4 Na+ + 2 SO 42 - + H 2↑ ü 2 Na+ + 2 H+ + 2 SO 4 - + Na 2 O 4 Na+ + 2 SO 42 - + H 2 O Ø Φ. Termiczny rozkład dwusiarczanu(VI) sodu / pirosiarczanu(VI) sodu : T ü Na 2 S 2 O 7(s) Na 2 SO 4 + SO 3↑ Ø Ω. Redukcja siarczanu(VI) sodu węglem w podwyższonej temperaturze: T ü Na 2 SO 4(s) + 4 C Na 2 S(s) + 4 CO↑

Zadanie 17 – rozwiązanie / cd Ø Q i Σ. Strącanie siarczków chromu oraz glinu z wodnych roztworów soli: ü 2 Cr 3+ + 6 Cl- + 6 Na+ + 3 S 2 - Cr 2 S 3↓ + 6 Na+ + 6 Clü 2 Al 3+ + 3 SO 42 - + 6 Na+ + 3 S 2 - Al 2 S 3↓ + 6 Na+ + 3 SO 42Ø Ψ. Otrzymywanie wodorosiarczku sodu: ü Na+ + HS- + Na+ + OH- 2 Na+ + S 2 - + H 2 O ü 2 Na+ + 2 HS- + 2 Na 4 Na+ + 2 S 2 - + H 2↑ ü 2 Na+ + 2 HS- + Na 2 O 4 Na+ + 2 S 2 - + H 2 O
 W pewnej firmie pracuje 36 mężczyzn i 12
W pewnej firmie pracuje 36 mężczyzn i 12 Procesy cieplne
Procesy cieplne Centrom bunkového dýchania sú:
Centrom bunkového dýchania sú: Vonkajšie geologické procesy
Vonkajšie geologické procesy Logistyka zaopatrzenia i produkcji
Logistyka zaopatrzenia i produkcji Katabolické procesy
Katabolické procesy Typologie osobnosti
Typologie osobnosti Procesy informacyjne
Procesy informacyjne Teoria filtra broadbenta
Teoria filtra broadbenta Procesy egzogeniczne tabela
Procesy egzogeniczne tabela Endogenne procesy
Endogenne procesy Sopečné vyvrhliny
Sopečné vyvrhliny Katastrofické geologické procesy na slovensku
Katastrofické geologické procesy na slovensku Procesy kataboliczne przykłady
Procesy kataboliczne przykłady Procesy informacyjne w organizacji
Procesy informacyjne w organizacji Procesy uczenia się
Procesy uczenia się Procesy katalityczne
Procesy katalityczne Wzory brył obrotowych
Wzory brył obrotowych Wielkości odwrotnie proporcjonalne
Wielkości odwrotnie proporcjonalne Prawo hooke'a zadania
Prawo hooke'a zadania