Procesy wieloetapowe Przykadowe zadania z rozwizaniem z udziaem

















- Slides: 19

Procesy wieloetapowe Przykładowe zadania z rozwiązaniem: Ø z udziałem fosforu i jego związków, Ø z udziałem krzemu i jego związków, Ø z udziałem chloru i jego związków.

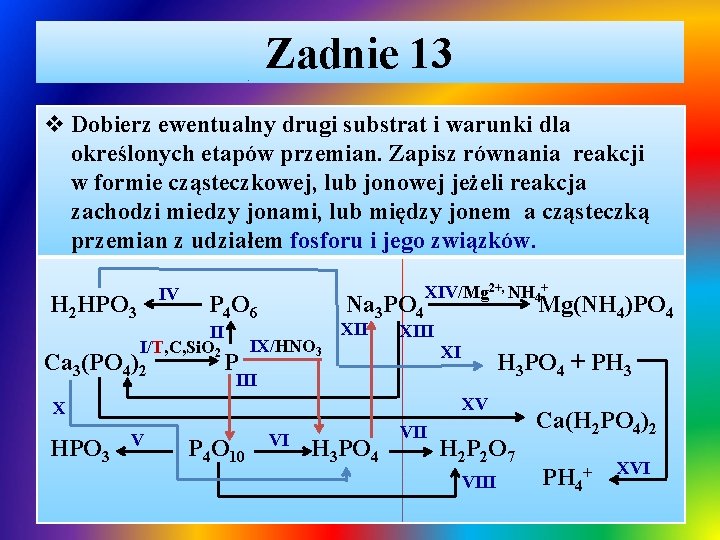
Zadnie 13 v Dobierz ewentualny drugi substrat i warunki dla określonych etapów przemian. Zapisz równania reakcji w formie cząsteczkowej, lub jonowej jeżeli reakcja zachodzi miedzy jonami, lub między jonem a cząsteczką przemian z udziałem fosforu i jego związków. IV H 2 HPO 3 P 4 O 6 II I/T, C, Si. O 2 Ca 3(PO 4)2 P Na 3 PO 4 IX/HNO 3 XII XIV/Mg 2+, NH 4+ XIII XI H 3 PO 4 + PH 3 III XV X HPO 3 Mg(NH 4)PO 4 V P 4 O 10 VI H 3 PO 4 VII H 2 P 2 O 7 VIII Ca(H 2 PO 4)2 PH 4+ XVI

Zadnie 13 - rozwiązanie Ø I. redukcja w podwyższonej temperaturze fosforanu(V) / ortofosforanu(V) C z udziałem Si. O 2: T ü 2 Ca 3(PO 4)2 + 10 C + 6 Si. O 2 P 4 + 6 Ca. Si. O 3 + 10 CO↑ II i III. spalanie fosforu przy różnym dostępie tlenu: ü P 4 + 3 O 2 P 4 O 6 ü P 4 + 5 O 2 P 4 O 10 IV. roztwarzanie tlenku fosforu(III) w wodzie: ü P 4 O 6 + 6 H 2 O 4 H+ + 4 HPHO 3ü HPHO 3 - + H 2 O H 3 O+ + PHO 32ü kwas fosfonowy(III), dwuprotonowy (dwuwodorowy)

Zadnie 13 - rozwiązanie / cd Ø ü ü ü Ø ü Ø ü V, VI i VII. roztwarzanie tlenku fosforu(V) w wodzie: P 4 O 10 + 2 H 2 O 4 HPO 3 / kwas metafosforowy(V) P 4 O 10 + 6 H 2 O 4 H 3 PO 4 / kwas ortofosforowy(V) P 4 O 10 + 4 H 2 O 2 H 4 P 2 O 7 / kwas pirofosforowy(V) VIII. kondensacja H 3 PO 4 w podwyższonej temperaturze: T 2 H 3 PO 4 H 4 P 2 O 7 + H 2 O IX. utlenienie fosforu w stężonym roztworem HNO 3 P 4 + 20 H+ + 20 NO 3 - 4 H+ + 4 H 2 PO 4 - + 20 NO 2↑+ 4 H 2 O X. wypieranie kwasu H 3 PO 4 z soli przez kwas mocniejszy: Ca 3(PO 4)2 + 6 H+ + 3 SO 42 - 2 H+ + 2 H 2 PO 4 - + 3 Ca. SO 4↓

Zadnie 13 - rozwiązanie / cd Ø XI. termiczny rozkład kwasu H 2 PHO 3: ü Ø ü ü ü Ø T 4 H 2 PHO 3 3 H 3 PO 4 + PH 3↑ XII. otrzymywanie ortofosforanu(V) sodu: 6 H+ + 2 PO 43 - + 6 Na+ + 2 PO 43 - + 3 H 2↑ 3 H+ + PO 43 - + 3 Na+ + 3 OH- 3 Na+ + PO 43 - + 3 H 2 O 6 H+ + 2 PO 43 - + 3 Na 2 O 6 Na+ + 2 PO 43 - + 3 H 2 O XIII. strącanie osadu ortofosforanu(V) wapnia, reakcja stosowna w procesie zmiękczania wody – usuwanie twardości trwałej / nieprzemijającej: ü 3 Ca 2+ + 6 Cl- + 6 Na+ + 2 PO 43 - Ca 3(PO 4)2↓+ 6 Na+ + 6 Cl-

Zadnie 13 - rozwiązanie / cd Ø XIV. identyfikacja / wykrywanie anionów PO 43 -, wytraca się biały osad krystaliczny osad: ü 3 Na+ + PO 43 - + Mg 2+ + 2 Cl- + NH 4+ + Cl- Mg(NH 4)PO 4↓ + 3 Na+ + 3 ClØ XV. otrzymywanie dwuwodoroortofosforanu(V) wapnia – składnika rozpuszczalnych w wodzie nawozów wapniowo-fosforowych: ü Ca 3(PO 4)2 + 4 H+ + 2 SO 42 - Ca 2+ + 2 H 2 PO 4 - + 2 Ca. SO 4↓ ü Ca 3(PO 4)2 + 4 H+ + 4 H 2 PO 4 - 3 Ca 2+ + 6 H 2 PO 4Ø XVI. jonizacja fosfiny w wodzie, która wykazuje bardzo słabe właściwości zasadowe, słabsze niż amoniak: ü PH 3 + H 2 O ↔ PH 4+ + OH-

Zadnie 14 v Dobierz ewentualny drugi substrat i warunki dla określonych etapów przemian. Zapisz równania reakcji w formie cząsteczkowej, lub jonowej jeżeli reakcja zachodzi miedzy jonami, lub między jonem cząsteczką przemian z udziałem krzemu i jego związków. XI K 4 Si. O 4 X Si. O 2 III Si. F 4 I II V H 4 Si. O 4 Si VI IV Si. O 2∙n. H 2 O VII Ca. Si. O 3 IX Na 2 Si. O 3 VIII H 2 Si. O 3

Zadnie 14 - rozwiązanie Ø I. redukcja tlenku krzemu w podwyższonej temperaturze – Mg lub Al, C, Ca. C 2: T üSi. O 2 + 2 Mg Si + 2 Mg. O T ü 3 Si. O 2 + 4 Al 3 Si + 2 Al 2 O 3 T üSi. O 2 + 2 C Si + 2 CO T üSi. O 2 + Ca. C 2 Si + 2 CO + Ca Ø II. utlenianie krzemu w podwyższonej temperaturze: T ü Si + O 2 Si. O 2

Zadnie 14 – rozwiązanie / cd Ø III. utlenianie krzemu w atmosferze fluoru w temperaturze pokojowej: ü Si + 2 F 2 Si. F 4↑ Ø IV. roztwarzanie tlenku krzemu(IV) w roztworze kwasu – trawienie szkła: ü Si. O 2 + 4 H+ + 4 F- Si. F 4↑ + 2 H 2 O Ø V. hydroliza czterofluorku krzemu: ü Si. F 4 + (n+2)H 2 O Si. O 2∙n. H 2 O + 4 HF↑ Ø VI. roztwarzanie krzemu w roztworze mocnej zasady: ü Si + 2 Na+ + 2 OH- + H 2 O 2 Na+ + Si. O 32 - + 2 H 2↑

Zadnie 14 – rozwiązanie / cd Ø VII. roztwarzanie tlenku krzemu(IV) w roztworze mocnej zasady – trawienie szkła: ü Si. O 2 + 2 Na+ + 2 OH- 2 Na+ + Si. O 32 - + H 2 O Ø VIII. wypieranie kwasu metakrzemowego(IV) z soli roztworem mocniejszego kwasu, lub hydroliza soli w roztworze wodnym: ü 2 Na+ + Si. O 32 - + 2 H+ + 2 Cl- H 2 Si. O 3↓+ 2 Na+ + 2 Clü 2 Na+ + Si. O 32 - + 2 H 2 O H 2 Si. O 3↓+ 2 Na+ + 2 OHØ IX. strącanie osadu metakrzemianu(IV) wapnia roztworem rozpuszczalnej soli wapniowej : ü 2 Na+ + Si. O 32 - + Ca 2+ + 2 Cl- Ca. Si. O 3↓+ 2 Na+ + 2 Cl-

Zadnie 14 – rozwiązanie / cd Ø X. spiekanie tlenku krzemu(IV) ze stałym wodorotlenkiem potasu: T üSi. O 2 + 4 KOH K 4 Si. O 4 + 2 H 2 O Ø XI. wypieranie kwasu ortokrzemowego(IV) z soli roztworem mocniejszego kwasu, lub hydroliza soli w stężonym roztworze wodnym: ü 4 K+ + Si. O 44 - + 4 H+ + 4 Cl- H 4 Si. O 4↓+ 4 K+ + 4 Clü 4 K+ + Si. O 44 - + 4 H 2 O H 4 Si. O 4↓+ 4 K+ + 4 OH-

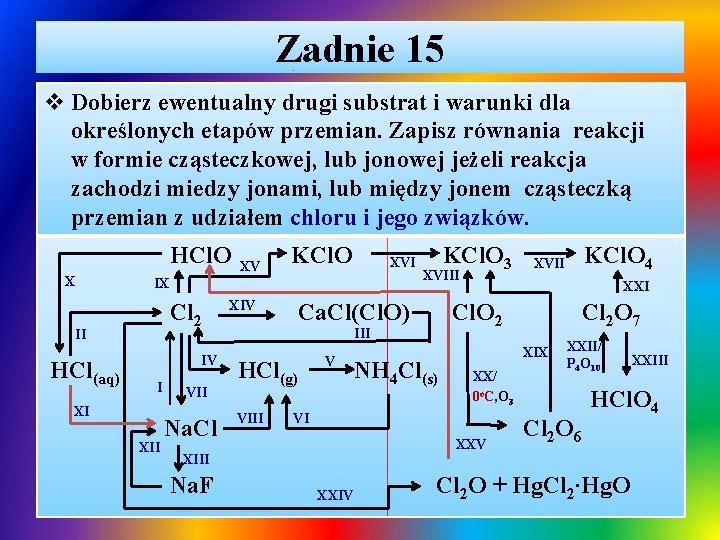
Zadnie 15 v Dobierz ewentualny drugi substrat i warunki dla określonych etapów przemian. Zapisz równania reakcji w formie cząsteczkowej, lub jonowej jeżeli reakcja zachodzi miedzy jonami, lub między jonem cząsteczką przemian z udziałem chloru i jego związków. HCl. O X XV KCl. O XVI IX Cl 2 II HCl(aq) IV I XI XII VII Na. Cl XIV XVIII Ca. Cl(Cl. O) HCl(g) VIII V NH 4 Cl(s) XXI Cl 2 O 7 XIX XX/ 0 o. C, O 3 VI XXV XXIV KCl. O 4 XVII Cl. O 2 III XIII Na. F KCl. O 3 XXII/ P 4 O 10 Cl 2 O 6 XXIII HCl. O 4 Cl 2 O + Hg. Cl 2∙Hg. O

Zadnie 15 – rozwiązanie Ø I. otrzymywanie chloru w procesie elektrolizy stopionego Na. Cl lub jego wodnego roztworu: ü K(-): Na+ + 1 e- Na T ü Na. Cl Na+ + Cl- ü A(+): 2 Cl- Cl 2 + 2 e. H 2 O ü Na. Cl ↔ Na+ + Cl- ü K(-): 2 H 2 O + 2 e- H 2 + 2 OHü A(+): 2 Cl- Cl 2 + 2 e- Ø II. otrzymywanie chloru w procesie elektrolizy roztworu HCl lub jego utlenienie w reakcji z KMn. O 4, Mn. O 2: H 2 O üHCl ↔ H+ + Cl- ü K(-): 2 H+ + 2 e- Cl 2 ü A(+): 2 Cl- Cl 2 + 2 e- ü 2 KMn. O 4(s) + 16 H+ + 16 Cl- 2 Mn 2+ + 2 K+ + 6 Cl- + 8 H 2 O + 5 Cl 2↑ ü Mn. O 2 + 4 H+ + 4 Cl- Mn 2+ + 2 Cl- + 2 H 2 O + Cl 2↑

Zadnie 15 – rozwiązanie / cd Ø III. rozkład wapna chlorowanego – chloranu(I) i chlorku wapnia w reakcji z kwasem chlorowodorowym: ü Ca-ICl (ICl. O)(s)+ 2 H++ 2 -ICl- Ca 2+ + 2 -ICl- + 0 Cl 2↑ + H 2 O Ø IV. otrzymywanie gazowego HCl w syntezie z pierwiastków w obecności światła lub podwyższonej temperaturze: ü 0 Cl 2(g) + 0 H T 2(g) 2 IH-ICl(g) Ø V. synteza chlorku amonu przebiegającej w fazie gazowej: ü HCl(g) + NH 3(g) NH 4 Cl↓ Ø VI. termiczny rozkład chlorku amonu: T ü NH 4 Cl(s) HCl(g) + NH 3(g)

Zadnie 15 – rozwiązanie / cd Ø VII. spalanie sodu w atmosferze chloru: ü 2 Na + 0 Cl 2 2 Na-ICl Ø VIII. wypieranie chlorowodoru z soli przez roztwór mocnego i mniej lotnego kwasu siarkowego(VI) w temperaturze pokojowej lub podwyższonej: ü Na. Cl(s) + 2 H+ + SO 42 - HCl↑ + Na+ + H+ + SO 42 T ü 2 Na. Cl(s) + 2 + 2 HCl↑ + 2 Na+ + SO 42Ø IX. reakcja dysproporcjonowania w trakcie rozpuszczania gazowego chloru w wodzie: ü 0 Cl -I I 2(g) + H 2 O(c) H Cl + H Cl. O ü 0 Cl + + -ICl- + H+ + ICl. O+ H O H 2(g) 2 (c) H+ SO 42 -

Zadnie 15 – rozwiązanie / cd Ø X. rozkład kwasu chlorowego(I) pod wpływem uv: uv ü 2 H+ + 2 ICl. O- 2 H+ + 2 -ICl- + O 2↑ Ø XI. otrzymywanie chlorku sodu z użyciem kwasu HCl: ü ü Ø Na+ + OH- + H+ + Cl- Na+ + Cl- + H 2 O 2 Na + 2 H+ + 2 Cl- 2 Na+ + 2 Cl- + H 2↑ Na 2 O + 2 H+ + 2 Cl- 2 Na+ + 2 Cl- + H 2 O 2 Na+ + CO 32 - + 2 H+ + 2 Cl- 2 Na+ + 2 Cl- + CO 2↑ + H 2 O XII. wypieranie z soli fluorowodoru przez kwas HCl: ü Na. F(s) + H+ + Cl- Na. Cl + HF(c/g)↑ Ø XIII. wypieranie chloru z soli przez fluor: ü 2 Na+ + 2 -ICl- + 0 F 2(g) 2 Na+ + 2 -IF- + 0 Cl 2↑

Zadnie 15 – rozwiązanie / cd Ø XIV. reakcja dysproporcjonowania – reakcja gazowego chloru z zasadą wapniową: ü Ca 2+ + 2 OH- + 0 Cl 2(g) Ca-ICl(ICl. O) + H 2 O Ø XV. reakcja dysproporcjonowania – reakcja gazowego chloru z zasadą potasową: ü 2 K+ + 2 OH- + 0 Cl 2(g) 2 K+ + -ICl- + ICl. O- + H 2 O Ø XVI. termiczny rozkład chloranu(I): T ü 3 KICl. O 2 K-ICl + KVCl. O 3 Ø XVII. termiczny rozkład chloranu(V): T ü 4 KVCl. O 3 K-ICl + 3 KVIICl. O 4

Zadnie 15 – rozwiązanie / cd Ø XVIII. reakcja dysproporcjonowania – gazowego tlenku chloru(IV) z zasadą potasową: ü 2 K+ + 2 OH- + 2 IVCl. O 2(g) 2 K+ + IIICl. O 2 - + VCl. O 3 - + H 2 O Ø XIX. reakcja dysproporcjonowania – tlenku chloru(VI) z zasadą potasową: ü 2 K+ + 2 OH- + VICl 2 O 6(c) 2 K+ + VCl. O 3 - + VIICl. O 4 - + H 2 O Ø XX. utlenianie tlenku chloru(IV) ozonem w obniżonej temperaturze: -T VI ü 6 2(g) + 2 O 3(g) 3 Cl 2 O 6(c) Ø XXI. reakcja tlenku chloru(VII) z zasadą potasową: IVCl. O ü Cl 2 O 7(c) + 2 K+ + 2 OH- 2 K+ + 2 Cl. O 4 - + H 2 O

Zadnie 15 – rozwiązanie / cd Ø XXII. odwadnianie kwasu chlorowego(VII) tlenkiem fosforu(V): P 4 O 10 ü 2 H+ + 2 VIICl. O 4 - VIICl 2 O 7(c) + H 2 O Ø XXIII. roztwarzanie tlenku chloru(VII) w wodzie: ü VIICl 2 O 7(c) + H 2 O 2 H+ + 2 VIICl. O 4 - Ø XXIV. dysproporcjonowanie chloru - przepuszczanie chloru gazowego nad podgrzanym Hg. O: T -I I ü 2 2(g) + 2 Hg. O Hg Cl 2∙Hg. O + Cl 2 O(g) Ø XXV. roztwarzanie tlenku chloru(I) w wodzie: 0 Cl ü ICl 2 O(g) + 2 H 2 O 2 H+ + 2 ICl. O-
 W pewnej firmie pracuje 36 mężczyzn i 12
W pewnej firmie pracuje 36 mężczyzn i 12 Katabolické procesy
Katabolické procesy Procesy informacyjne
Procesy informacyjne Psychické vlastnosti
Psychické vlastnosti Model filtra uwagi broadbenta
Model filtra uwagi broadbenta Procesy egzogeniczne tabela
Procesy egzogeniczne tabela Exogenne procesy
Exogenne procesy Sopečné vyvrhliny
Sopečné vyvrhliny Katastrofické geologické procesy na slovensku
Katastrofické geologické procesy na slovensku Procesy anaboliczne przykłady
Procesy anaboliczne przykłady Procesy informacyjne w organizacji
Procesy informacyjne w organizacji Procesy uczenia się
Procesy uczenia się Procesy katalityczne
Procesy katalityczne Co riadi zivotne procesy bunky
Co riadi zivotne procesy bunky Przenikanie ciepła przez ściankę cylindryczną
Przenikanie ciepła przez ściankę cylindryczną Vonkajšie geologické procesy
Vonkajšie geologické procesy Logistyka zaopatrzenia i dystrybucji
Logistyka zaopatrzenia i dystrybucji Zadania gimnastyki wyrównawczej
Zadania gimnastyki wyrównawczej Redukcja clemmensena
Redukcja clemmensena Moc jednostka
Moc jednostka