TECHNOLOGICK PROCESY CHEMICK PROCESY TAKOV TECHNOLOGICK POSTUPY PI
















- Slides: 20

TECHNOLOGICKÉ PROCESY CHEMICKÉ PROCESY: TAKOVÉ TECHNOLOGICKÉ POSTUPY, PŘI KTERÝCH DOCHÁZÍ K CHEMICKÉ PŘEMĚNĚ SUROVINY, VZNIKÁ MEZIPRODUKT ČI FINÁLNÍ PRODUKT PROBÍHAJÍCÍ CHEMICKÝ DĚJ JE CHARAKTERIZOVÁN CHEMICKOU ROVNICÍ A MECHANISMEM, REAKČNÍMI PODMÍNKAMI, TĚMITO CHARAKTERISTIKAMI SE ŘÍDÍ CELKOVÝ TECHNOLOGICKÝ REŽIM Základy chemických technologií 2014

KATALYTICKÉ PROCESY VŠECHNY PROCESY VYUŽÍVAJÍCÍ ÚČINKU KATALYZÁTORU NA RYCHLOST REAKCE KATALYZÁTOR: SNIŽUJE AKTIVAČNÍ ENERGII REAKCE NEMŮŽE REAKCI VYVOLAT, KDYŽ JE TATO TERMODYNAMICKY NEMOŽNÁ OVLIVŇUJE RYCHLOST PŘÍMÉ I ZPĚTNÉ REAKCE, CHEMICKÁ ROVNOVÁHA SE NEMĚNÍ KATALYZÁTORY: RŮZNĚ SELEKTIVNÍ ENZYMY: NEJSELEKTIVNĚJŠÍ Základy chemických technologií 2014

KATALÝZA 1) HOMOGENNÍ: VÝCHOZÍ LÁTKY, MEZIPRODUKTY, PRODUKTY I KATALYZÁTOR JSOU VE STEJNÉ FÁZI 2) HETEROGENNÍ: ZÚČASTNĚNÉ LÁTKY JSOU V RŮZNÝCH FÁZÍCH PRŮMYSLOVÝ KATALYZÁTOR 1) VLASTNÍ KATALYTICKY AKTIVNÍ LÁTKA 2) NOSIČ: ODOLNÁ, LACINÁ LÁTKA S DOSTATEČNĚ VELKÝM POVRCHEM (KŘEMELINA, SILIKAGEL, ALUMINA) 3) AKTIVÁTOR: ZVYŠUJE AKTIVITU KATALYZÁTORU KATALYTICKÝ JED: SNIŽUJE ÚČINNOST KATALYZÁTORU, RUŠÍ PRŮBĚH KATALÝZY Základy chemických technologií 2014

VÝROBA H 2 SO 4 SUROVINY: TĚŽBA SÍRY: SÍRA ELEMENTÁRNÍ-TĚŽENÁ 60% REKUPEROVANÁ 40% USA, MEXIKO, RUSKO, POLSKO NEROSTNÁ LOŽISKA MAJÍ OBSAH 10 -70% SÍRY ÚPRAVA: DRCENÍ, MLETÍ, FLOTACE→OBOHACENÍ NA 85% ZBAVENÍ VODY ODSTŘEDĚNÍM VYTAVENÍ V AUTOKLÁVU (150°C) →ČISTÁ SÍRA (99, 7%) SÍRA Z JINÝCH ZDROJŮ: ZE SULFANU (ROPA, ZEMNÍ PLYN) PRAŽENÍ PYRITU Základy chemických technologií 2014

VÝROBA H 2 SO 4 - POSTUPY 1) HISTORICKÝ: RETORTOVÝ – DESTILACE TZV. VITROLOVÝCH BŘIDLIC (Fe. SO 4) V KERAMICKÝCH NÁDOBÁCH 2) NITRÓZNÍ: HOMOGENNÍ KATALÝZA NITRÓZNÍMI PLYNY 3) KONTAKTNÍ: HETEROGENNÍ KATALÝZA KOVY NEBO JEJICH OXIDY V SOUČASNOSTI 90% SVĚTOVÉ VÝROBY Základy chemických technologií 2014

KONTAKTNÍ ZPŮSOB 1) VÝROBA SIŘIČITÉHO PLYNU (SO 2) SPALOVÁNÍ SÍRY: S + O 2 → SO 2 PRAŽENÍ PYRITU: 4 Fe. S 2 + 11 O 2 → 2 Fe 2 O 3 (VÝPRAŽKY) + 8 SO 2 POKUD JE POTŘEBA, SIŘIČITÝ PLYN SE ČISTÍ – ELEKTROFILTRY, ROZTOKEM H 2 SO 4 VE VĚŽÍCH ZAŘÍZENÍ: HOŘÁKOVÁ PEC NA SPALOVÁNÍ ROZTAVENÉ SÍRY FLUIDNÍ PEC NA PRAŽENÍ PYRITU VEDLEJŠÍ PRODUKT: VÝPRAŽKY – ŽELEZNÁ RUDA SPALNÉ TEPLO – VÝROBA PÁRY Základy chemických technologií 2014

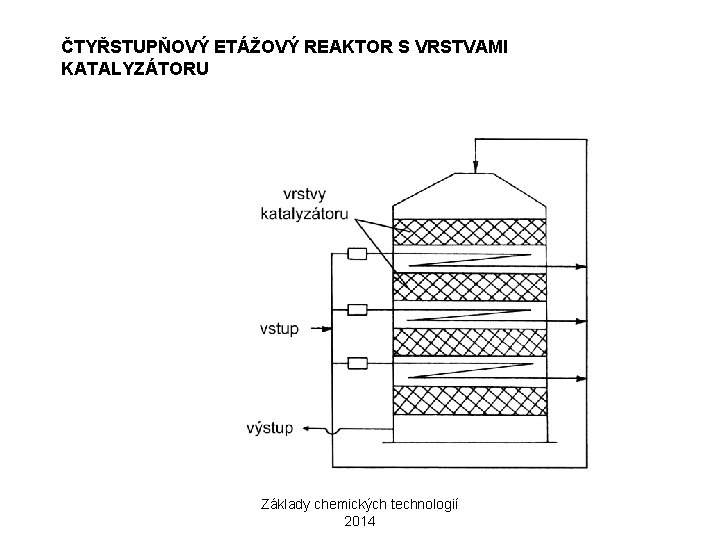
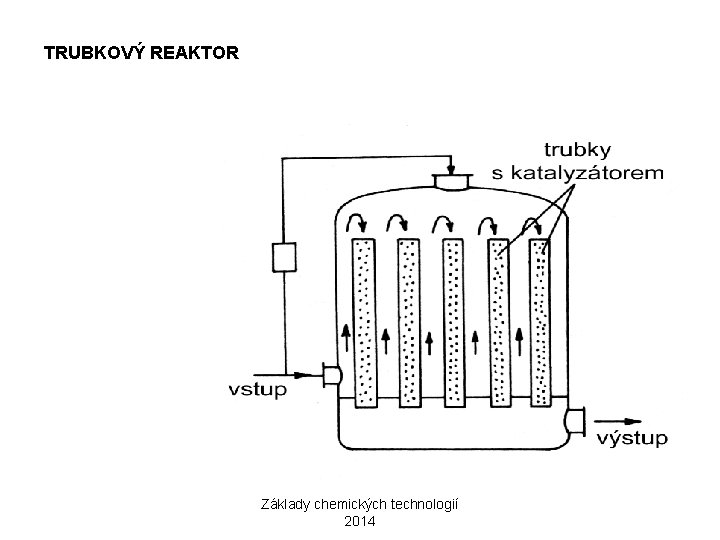
KONTAKTNÍ ZPŮSOB 2) OXIDACE SO 2 NA SO 3 2 SO 2 + O 2 2 SO 3 REAKCE MÁ VYSOKOU AKTIVAČNÍ ENERGII A PROBÍHÁ POMALU → KATALÝZA OPTIMÁLNÍ PRŮBĚH REAKCE: 10% SO 2, 11% O 2, 79% N 2 KATALYZÁTOR: KONTAKTNÍ HMOTA V 2 O 5 NA KŘEMELINĚ NEBO SILIKAGELU AKTIVÁTOR: K 2 O ZAŘÍZENÍ: ETÁŽOVÝ NEBO TRUBKOVÝ REAKTOR Základy chemických technologií 2014

ČTYŘSTUPŇOVÝ ETÁŽOVÝ REAKTOR S VRSTVAMI KATALYZÁTORU Základy chemických technologií 2014

TRUBKOVÝ REAKTOR Základy chemických technologií 2014

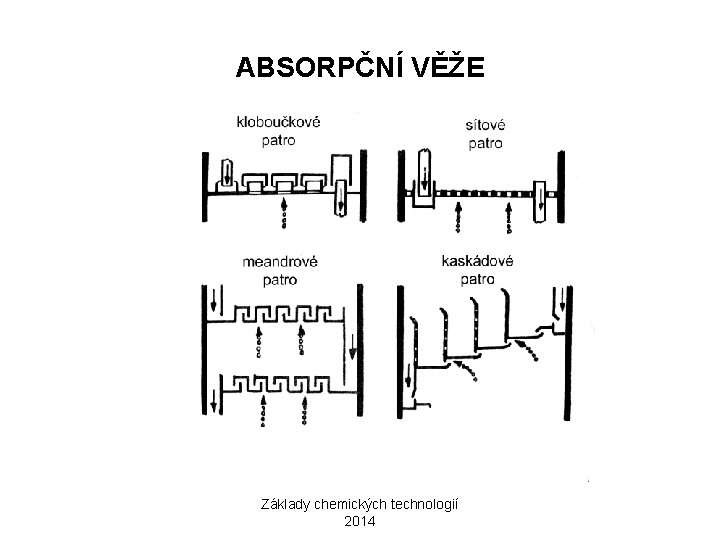
KONTAKTNÍ ZPŮSOB 3) ABSORPCE SO 3 H 2 O + SO 3 → H 2 SO 4 ZAŘÍZENÍ: ABSORPČNÍ VĚŽ S VÝPLNÍ Z ODOLNÉHO MATERIÁLU ABSORPČNÍ MÉDIUM: 98, 3% H 2 SO 4 ? ? ? TENTO ROZTOK MÁ NEJNIŽŠÍ TENZI VODNÍ PÁRY, SO 3 MÁ TENDENCI VYTVÁŘET KYSELINU V PARNÍ FÁZI, ČÍMŽ VZNIKÁ MLHA H 2 SO 4, KTERÁ JE ABSORPCÍ NEZACHYTITELNÁ POTŘEBNÝ VZDUCH MUSÍ BÝT VYSUŠENÝ Základy chemických technologií 2014

ABSORPČNÍ VĚŽE Základy chemických technologií 2014

VÝROBA H 2 SO 4 V ČR VYRÁBÍ SE VÝHRADNĚ KONTAKTNÍM ZPŮSOBEM, SUROVINOU JE VĚTŠINOU ELEMENTÁRNÍ SÍRA ROČNĚ SE VYROBÍ ASI 230 000 TUN (ÚDAJ Z R. 2004) NEJVĚTŠÍ VÝROBCI: SPOLANA NERATOVICE PRECHEZA PŘEROV SYNTHESIA PARDUBICE Základy chemických technologií 2014

POUŽITÍ H 2 SO 4 ZÁKLADNÍ CHEMIKÁLIE CHEMICKÉHO PRŮMYSLU PRŮMYSLOVÁ HNOJIVA – FOSFÁTY (PRECHEZA) ANORGANICKÉ PIGMENTY ŽELEZITÉ ČERVENĚ, HNĚDĚ, TITANOVÁ BĚLOBA (PRECHEZA) VISKÓZOVÁ VLÁKNA Základy chemických technologií 2014

VÝROBA NH 3 VÝCHOZÍ LÁTKA PRO VŠECHNY OSTATNÍ SLOUČENINY DUSÍKU KLASICKÉ ZDROJE (LEDKY) MAJÍ DNES UŽ MALÝ VÝZNAM SUROVINY SYNTÉZNÍ PLYN – SMĚS N 2 A H 2 1: 3 N 2: VZDUCH H 2: Z ORGANICKÝCH TECHNOLOGIÍ, NAPŘ. ODPADÁ PŘI PARNÍM REFORMOVÁNÍ UHLOVODÍKŮ H 2 Z METHANU: t= 800 -900°C, kat. Ni na alumině kat. jed: S CH 4 + H 2 O → CO + H 2 2 CH 4 + O 2 → 2 CO + 4 H 2 Základy chemických technologií 2014

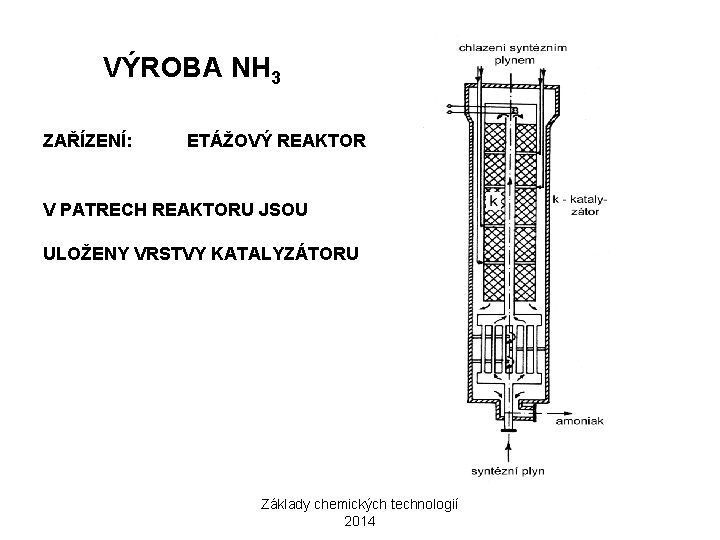
VÝROBA NH 3 PRINCIP: PŘÍMÁ SYNTÉZA Z PRVKŮ (HABERŮV POSTUP, FRITZ HABER, 1918 NOBELOVA CENA) N 2 + 3 H 2 2 NH 3 EXOTERMNÍ REAKCE REAKCI PODPORUJE: NÍZKÁ TEPLOTA A VYŠŠÍ TLAK OPTIMÁLNÍ PODMÍNKY PRO KATALYZÁTOR: STUPEŇ KONVERZE: 300 -400°C KOLEM 20% SYNTÉZNÍ PLYN SE VEDE PŘES KATALYZÁTOR OPAKOVANĚ A VYROBENÝ AMONIAK SE PRŮBĚŽNĚ ODSTRAŇUJE OCHLAZENÍM A KONDENZACÍ (TZV. SYNTÉZNÍ OKRUH) KATALYZÁTOR: ELEMENTÁRNÍ Fe AKTIVOVANÉ Al 2 O 3 A K 2 O KATALYTICKÉ JEDY: SLOUČENINY S a As, O 2 Základy chemických technologií 2014

VÝROBA NH 3 ZAŘÍZENÍ: ETÁŽOVÝ REAKTOR V PATRECH REAKTORU JSOU ULOŽENY VRSTVY KATALYZÁTORU Základy chemických technologií 2014

VÝROBA NH 3 V ČR UNIPETROL PRAHA POUŽITÍ: ZÁKLADNÍ SLOUČENINA N 2 VÝROBA HNO 3 MOČOVINA HNOJIVA PRŮMYSLOVÉ CHLADIVO Základy chemických technologií 2014

VÝROBA HNO 3 HISTORICKÉ VÝROBY: Z LEDKU ZE VZDUŠNÉHO N 2 V ELEKTRIC. OBLOUKU NEPOUŽÍVAJÍ SE SUROVINA: PRINCIP: NH 3 KATALYTICKÁ OXIDACE NH 3 NA OXIDY DUSÍKU NH 3 → NO 2 + H 2 O → HNO 3 PRO 1. REAKČNÍ KROK JE NUTNO POUŽÍT SELEKTIVNÍ KATALYZÁTOR, ABY NEPROBÍHALY JINÉ (TERMODYNAMICKY VÝHODNĚJŠÍ) REAKCE A JE NUTNO PŘESNĚ DODRŽOVAT TECHNOLOGICKÉ PODMÍNKY (TLAK, TEPLOTA) Základy chemických technologií 2014

VÝROBA HNO 3 KATALYZÁTOR: Pt + Rh + Pd KATALYZUJE OXIDACI NH 3 NA NO VZDUŠNÝM KYSLÍKEM VHODNÉ VLASTNOSTI KATALYZÁTORU (KOV) UMOŽŇUJÍ FORMOVAT HO DO TVARU SÍT Z JEMNÝCH DRÁTKŮ A USPOŘÁDAT DO TVARU SÍT REAKTOR: KONTAKTNÍ PEC POČET SÍT V REAKTORU: 3 -25 DALŠÍ REAKČNÍ KROKY PROBÍHAJÍ V ABSORPČNÍCH VĚŽÍCH Základy chemických technologií 2014

VÝROBA HNO 3 V ČR SYNTHESIA PARDUBICE POUŽITÍ: PRŮMYSLOVÁ HNOJIVA - DUSIČNANY BARVIVA - AZOBARVIVA VÝBUŠNINY - NITROCELULÓZA PESTICIDY Základy chemických technologií 2014