Moment dipolowy moment dipolowy wizania moment dipolowy czsteczki

![Moment dipolowy wiązana μ [Cm] v Asymetryczny rozkład ładunku wywołuje powstanie momentu dipolowego elektrycznego Moment dipolowy wiązana μ [Cm] v Asymetryczny rozkład ładunku wywołuje powstanie momentu dipolowego elektrycznego](https://slidetodoc.com/presentation_image_h/319dbed1e8270929f405bf1c11e84939/image-2.jpg)


![Momenty dipolowe wybranych drobin Wzór drobiny μ [C ∙ m] H 2 O 6, Momenty dipolowe wybranych drobin Wzór drobiny μ [C ∙ m] H 2 O 6,](https://slidetodoc.com/presentation_image_h/319dbed1e8270929f405bf1c11e84939/image-7.jpg)



- Slides: 10

Moment dipolowy Ø Ø Ø moment dipolowy wiązania, moment dipolowy cząsteczki, sposoby określania momentu dipolowego cząsteczki, wartość momentów dipolowych dla wybranych drobin, przykładowe zadania z rozwiązaniem.
![Moment dipolowy wiązana μ Cm v Asymetryczny rozkład ładunku wywołuje powstanie momentu dipolowego elektrycznego Moment dipolowy wiązana μ [Cm] v Asymetryczny rozkład ładunku wywołuje powstanie momentu dipolowego elektrycznego](https://slidetodoc.com/presentation_image_h/319dbed1e8270929f405bf1c11e84939/image-2.jpg)
Moment dipolowy wiązana μ [Cm] v Asymetryczny rozkład ładunku wywołuje powstanie momentu dipolowego elektrycznego – iloczyn (wektorowy) ładunku i odległości na jaką ten ładunek jest przesunięty: Ø μ = | q | · l gdzie (q – cząstkowy ładunek elektryczny w kulombach [C], l odległość miedzy środkami ciężkości ładunków elektrycznych w metrach [m] Ø jednostką momentu dipolowego jest kulombometr [C∙m] lub debaj (1 D = 3, 333·10 -30 Cm). v Moment dipolowy wiązania – miara przesunięcia elektronów tworzących wiązanie chemiczne w kierunku jądra pierwiastka bardziej elektroujemnego w heterocząsteczkach

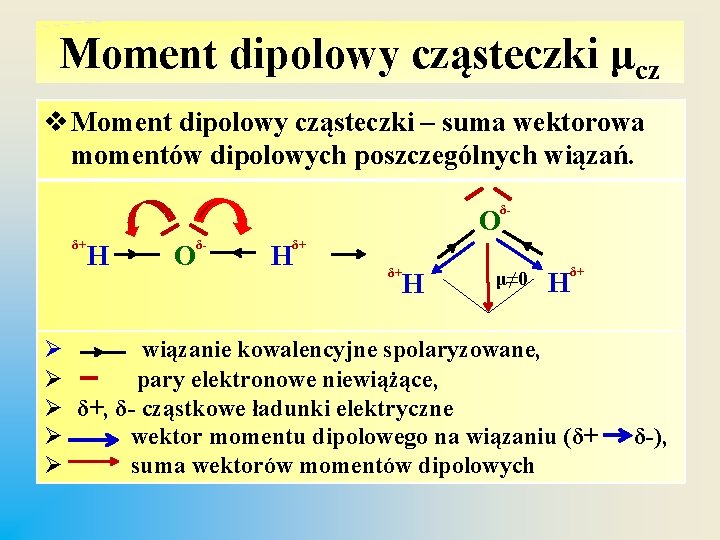
Moment dipolowy cząsteczki μcz v Moment dipolowy cząsteczki – suma wektorowa momentów dipolowych poszczególnych wiązań. O δ+ H O δ- H δ- δ+ δ+ H μ≠ 0 H δ+ Ø wiązanie kowalencyjne spolaryzowane, Ø pary elektronowe niewiążące, Ø δ+, δ- cząstkowe ładunki elektryczne Ø wektor momentu dipolowego na wiązaniu (δ+ Ø suma wektorów momentów dipolowych δ-),

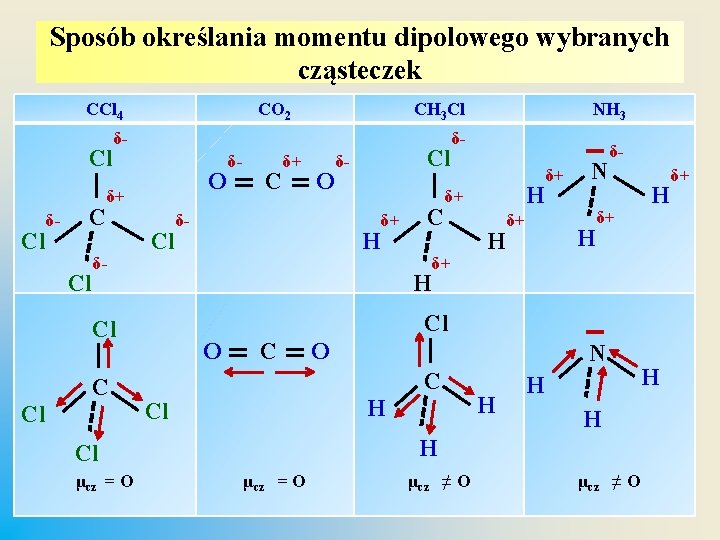
Sposób określania momentu dipolowego wybranych cząsteczek CCl 4 Cl Cl δ- C Cl CO 2 CH 3 Cl δ- O δ+ δ- Cl Cl C δ+ δ- H δ+ C δ- H δ+ δ+ N H δ- δ+ H Cl O C O N C H Cl H H Cl μcz = O O Cl δ- H Cl C δ- NH 3 μcz = O μcz ≠ O H δ+

Cząsteczka polarna – dipolowa v Moment dipolowy wiązania nie jest równoznaczny z momentem dipolowym cząsteczki: Ø cząsteczki CO 2, SO 3, CH 4, CCl 4 są apolarne / nie są dipolami, chociaż momenty dipolowe wiązań są różne od zera (μw ≠ 0), jednak rozkład ładunku elektrycznego jest symetryczny – momenty dipolowe wiązań są przeciwnie skierowane i znoszą się (μcz = 0), Ø cząsteczki H 2 O, H 2 S mają budowę kątową – momenty dipolowe wiązań (μw ≠ 0) nie znoszą się , cząsteczka ma niesymetryczny rozkład ładunków elektrycznych są dipolami / polarne (μcz ≠ 0).

Cząsteczka polarna – dipolowa v Cząsteczki dwuatomowe heterojądrowe (HF, HCl, HBr, HI) posiadają trwałe elektryczne momenty dipolowe – są dipolami (μw ≠ 0 i μcz ≠ 0). v Cząsteczka NH 3 ma budową czworościanu: Ø moment dipolowy na wiązaniu N – H jest różny od zera (μw ≠ 0 ), Ø dzięki wolnej parze elektronowej na atomie N rozkład ładunków elektrycznych jest asymetryczny / niesymetryczny, suma wektorowa momentów dipolowych wiązań jest różna od zera (μcz ≠ 0), Ø cząsteczka jest dipolem - cząsteczką polarną.
![Momenty dipolowe wybranych drobin Wzór drobiny μ C m H 2 O 6 Momenty dipolowe wybranych drobin Wzór drobiny μ [C ∙ m] H 2 O 6,](https://slidetodoc.com/presentation_image_h/319dbed1e8270929f405bf1c11e84939/image-7.jpg)
Momenty dipolowe wybranych drobin Wzór drobiny μ [C ∙ m] H 2 O 6, 184 SO 2 5, 447 CH 3 -OH 5, 671 NH 3 4, 907 SO 3 0, 000 C 2 H 5 -OH 5, 637 H 2 S 3, 236 Se. O 2 8, 739 C 6 H 5 -OH 4, 083 HF 6, 091 CO 0, 367 H-CHO 7, 779 HCl 3, 636 CO 2 0, 000 CH 3 -CHO 9, 173 HBr 2, 759 CH 4 0, 000 H-COOH 4, 703 O 3 1, 781 CH 3 F 6, 198 CH 3 -COOH 5, 671 N 2 O 0, 537 CH 2 F 2 6, 598 C 6 H 5 -NO 2 14, 076 NO 0, 530 CHF 3 5, 507 C 6 H 5 -NH 2 3, 769 N 2 O 3 7, 078 CH 3 Cl 6, 311 CH 3 -NH 2 4, 370 NO 2 1, 054 CH 3 Br 6, 078 C 2 H 5 -NH 2 4, 069 H 3 C-CO-CH 3 9, 607 [C ∙ m] = μ ∙ 10 -30

Przykładowe zadania z momentem dipolowym Ø Wyznaczony doświadczalnie moment dipolowy może być wykorzystany do obliczenia przybliżonego % udziału wiązań jonowych w drobinie. Ø Do obliczenia stosuje się iloraz wyznaczonego eksperymentalnie momentu dipolowego (μ) danej cząsteczki do wartości teoretycznego momentu dipolowego (e 0 ∙ l) hipotetycznej cząsteczki zbudowanej z jonów o takiej samej długości wiązania:

Zad. 1 - obliczenie % udziału wiązań jonowych v Oblicz procentowy udział wiązań jonowych w cząsteczce HF, jeżeli moment dipolowy cząsteczki wyznaczony doświadczalnie wnosi μ = 1, 98 D, a długość wiązania l = 0, 92 Å v Dane do zadania: Ø μ = 1, 98 D ∙ 3, 33 ∙ 10 -30 C ∙ m / D = 6, 59 ∙ 10 -30 C ∙ m Ø l = 0, 92 Å = 92 pm = 92 ∙ 10 -12 m Ø 1Å = 10 -10 m = 100 pm, 1 pm = 10 -12 m Ø 1 c 0 = 1, 602 ∙ 10 -19 C v Rozwiązanie – obliczenie % udziału wiązań jonowych Ø Uwaga: ∆E, jak i również zastosowanie wyrażenia % = 16 ∙ | x. F – x. H | + 3, 5 ∙ | x. F – x. H |2 nie wskazuje na właściwy charakter wiązań w cząsteczce HF, nie jest on związkiem jonowym.

Zadanie 2 - obliczenie % udziału wiązań jonowych v Oblicz procentowy udział wiązań jonowych w cząsteczce KBr, jeżeli moment dipolowy cząsteczki wyznaczony doświadczalnie wnosi μ = 35, 45 ∙ 10 -30 C∙ m , a długość wiązania l = 282 pm v Dane do zadania: Ø μ = 35, 45 ∙ 1 0 -30 C ∙ m Ø l = 282 ∙ 10 -12 m Ø 1 c 0 = 1, 602 ∙ 10 -19 C v Rozwiązanie – obliczenie % udziału wiązań jonowych Ø Uwaga: ∆E szacuje na ok. 63% wiązań jonowych, natomiast zastosowanie wyrażenia % = 16 ∙ | x. K – x. Br | + 3, 5 ∙ | x. K – x. Br |2 daje przybliży udział wiązań jonowych 46%.