chemia stosowana I temat rwnowaga chemiczna reakcja chloru







- Slides: 16

chemia stosowana I temat: równowaga chemiczna

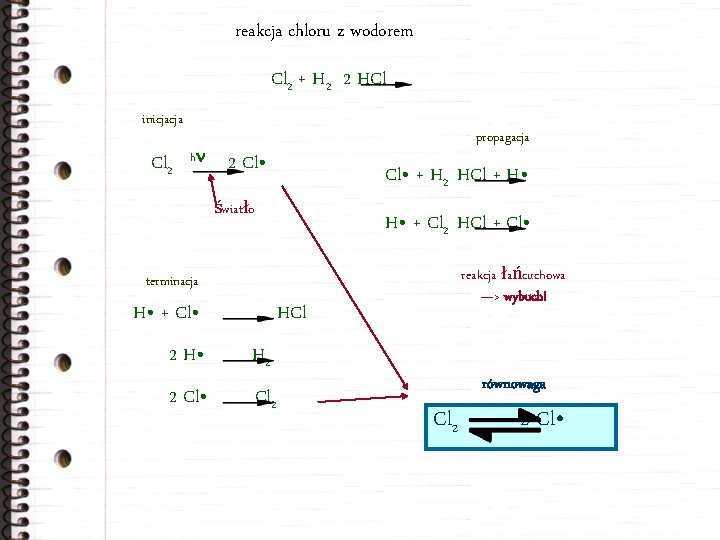
reakcja chloru z wodorem Cl 2 + H 2 2 HCl inicjacja Cl 2 hn propagacja 2 Cl • + H 2 HCl + H • światło H • + Cl 2 HCl + Cl • reakcja łańcuchowa —> wybuch! terminacja H • + Cl • HCl 2 H • H 2 2 Cl • Cl 2 równowaga Cl 2 2 Cl •

reakcja fotolitycznej dysocjacji chloru Cl 2 2 Cl • Ciepło dysocjacji Cl 2 wynosi 243, 5 k. J/mol co odpowiada 4, 044× 10– 19 J/cząsteczkę Cl 2. Energia do cząsteczki może być dostarczona wyłącznie w postaci kwantowej. Kwant energii promienistej wynosi E = hn. Wartość stałej Plancka wynosi h = 6, 626× 10– 34 Js. Podstawiając E i h oraz uwzględniając, że n = c/l można wyznaczyć długość fali światła: l = 491 nm Światło o większej energii (krótszych falach) może pobudzić reakcję w mieszaninie chloru i wodoru: nadfiolet, niebieskie. Światło żółte, czerwone i podczerwień nie dadzą efektu.

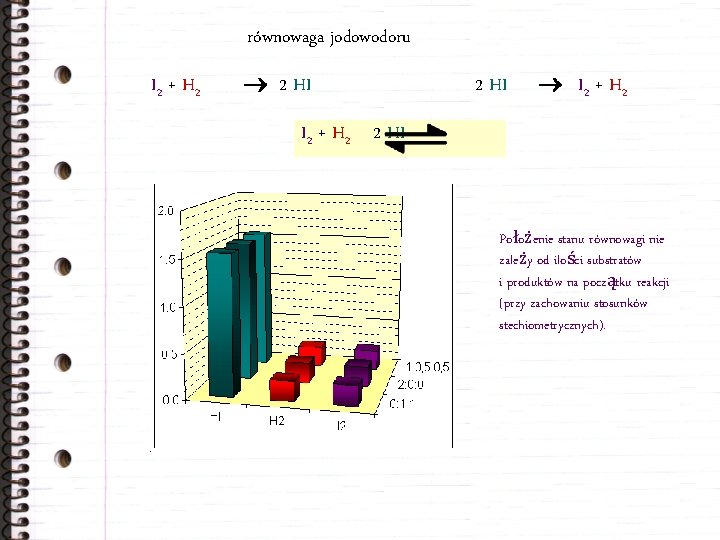
równowaga jodowodoru I 2 + H 2 2 HI I 2 + H 2 2 HI Położenie stanu równowagi nie zależy od ilości substratów i produktów na początku reakcji (przy zachowaniu stosunków stechiometrycznych).

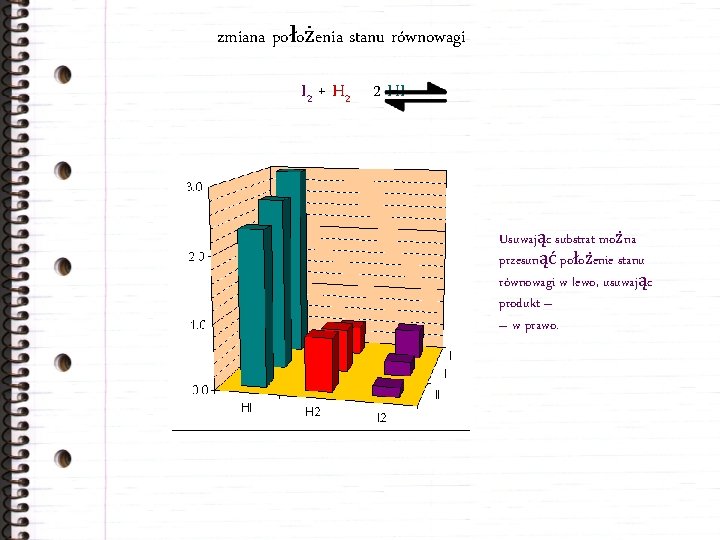
zmiana położenia stanu równowagi I 2 + H 2 2 HI Usuwając substrat można przesunąć położenie stanu równowagi w lewo, usuwając produkt – – w prawo.

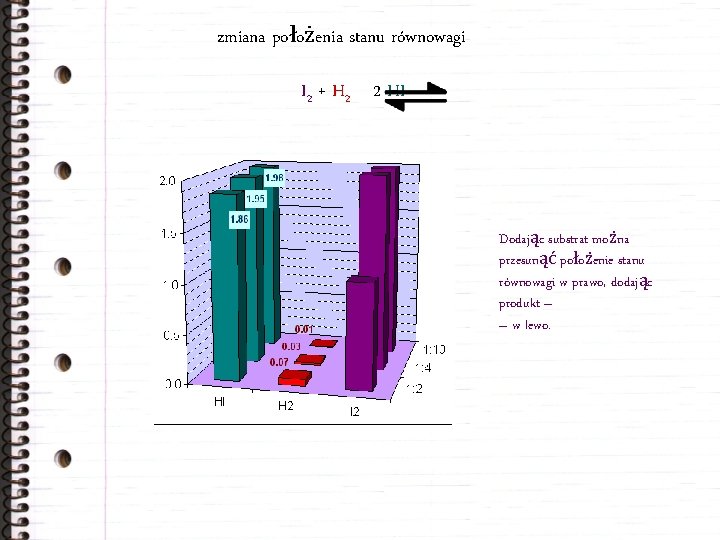
zmiana położenia stanu równowagi I 2 + H 2 2 HI Dodając substrat można przesunąć położenie stanu równowagi w prawo, dodając produkt – – w lewo.

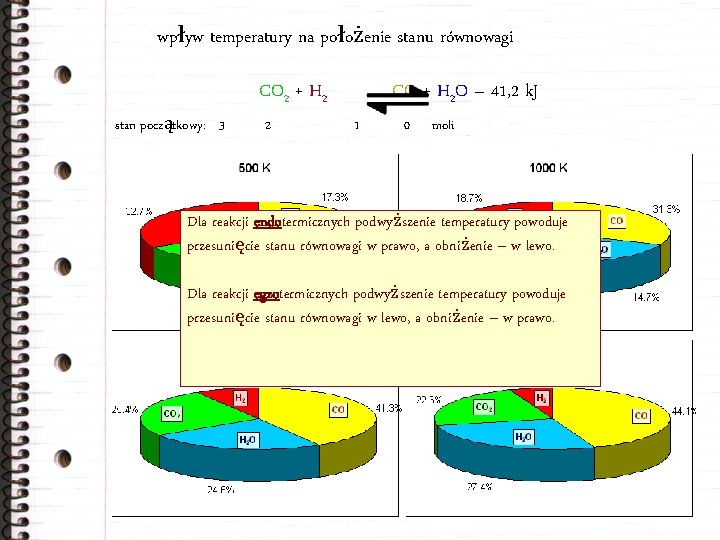
wpływ temperatury na położenie stanu równowagi reakcje chemiczne: egzotermiczne – endotermiczne – CO 2 + H 2 CO + H 2 O przebiegające z wydzieleniem energii z układu do otoczenia (lub wzrostem temperatury) ciepło reakcji Q < 0 przebiegające z pobraniem energii przez układ z otoczenia (lub obniżeniem temperatury) ciepło reakcji Q > 0 CO + H 2 O – 41, 2 k. J; CO 2 + H 2 + 41, 2 k. J; Q = +41, 2 k. J/mol Q = – 41, 2 k. J/mol

wpływ temperatury na położenie stanu równowagi CO 2 + H 2 stan początkowy: 3 2 CO + H 2 O – 41, 2 k. J 1 0 moli Dla reakcji endotermicznych podwyższenie temperatury powoduje przesunięcie stanu równowagi w prawo, a obniżenie – w lewo. Dla reakcji egzotermicznych podwyższenie temperatury powoduje przesunięcie stanu równowagi w lewo, a obniżenie – w prawo.

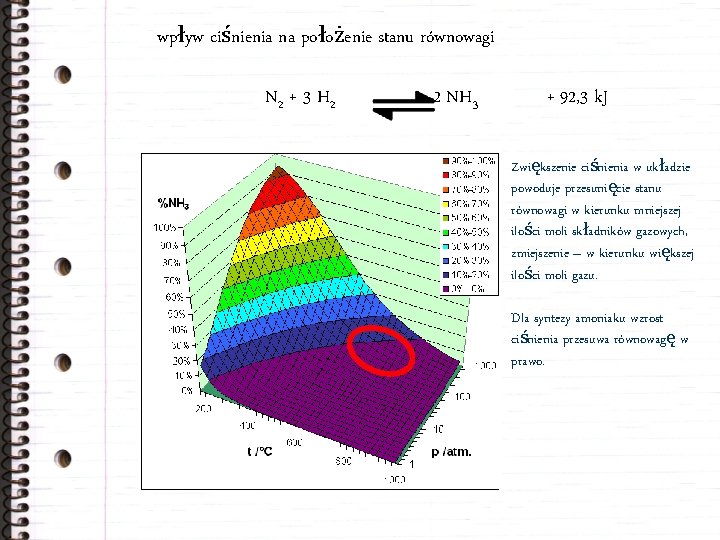
wpływ ciśnienia na położenie stanu równowagi N 2 + 3 H 2 2 NH 3 + 92, 3 k. J Zwiększenie ciśnienia w układzie powoduje przesunięcie stanu równowagi w kierunku mniejszej ilości moli składników gazowych, zmiejszenie – w kierunku większej ilości moli gazu. Dla syntezy amoniaku wzrost ciśnienia przesuwa równowagę w prawo.

reguła „przekory” le Chateliera Jeżeli w dowolnym układzie znajdującym się w stanie równowagi zmieni się parametr opisujący ten układ (ciśnienie, temperatura, stężenia składników) stan równowagi w układzie przesunie się, tak aby przeciwdziałać tej zmianie.

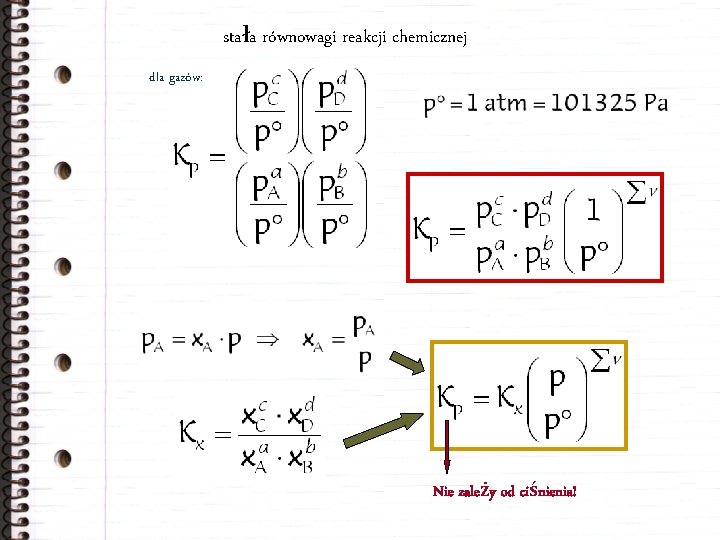
stała równowagi reakcji chemicznej a. A+b. B c. C+d. D a. A+b. B = c. C+d. D Wartość stałej równowagi zależy od temperatury i ciśnienia! 0 = n. A A + n. B B + n. C C + n. D D

stała równowagi reakcji chemicznej a. A+b. B = c. C+d. D 0 = n. A A + n. B B + n. C C + n. D D dla roztworów:

stała równowagi reakcji chemicznej dla gazów: Nie zależy od ciśnienia!

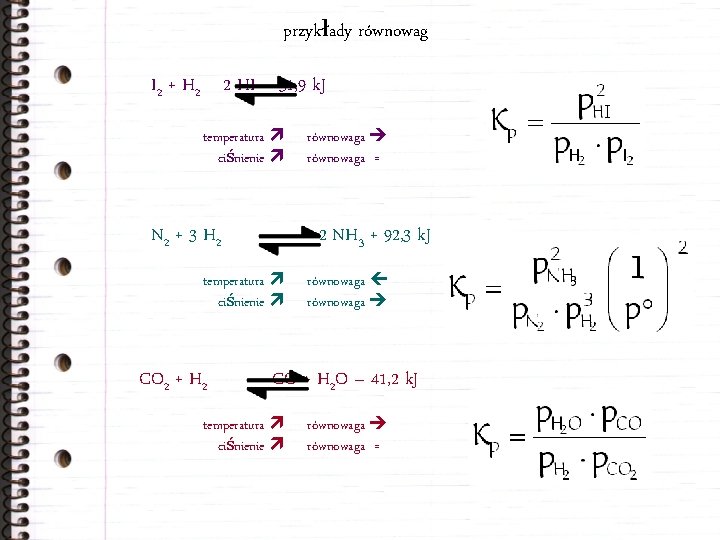
przykłady równowag I 2 + H 2 2 HI – 51, 9 k. J temperatura ciśnienie N 2 + 3 H 2 2 NH 3 + 92, 3 k. J temperatura ciśnienie CO 2 + H 2 równowaga = równowaga CO + H 2 O – 41, 2 k. J temperatura ciśnienie równowaga =

przykłady równowag N 2 O 4 temperatura ciśnienie 2 NO 2 – 58, 4 k. J równowaga 2 SO 2 + O 2 temperatura ciśnienie 2 SO 3 + 191, 4 k. J równowaga

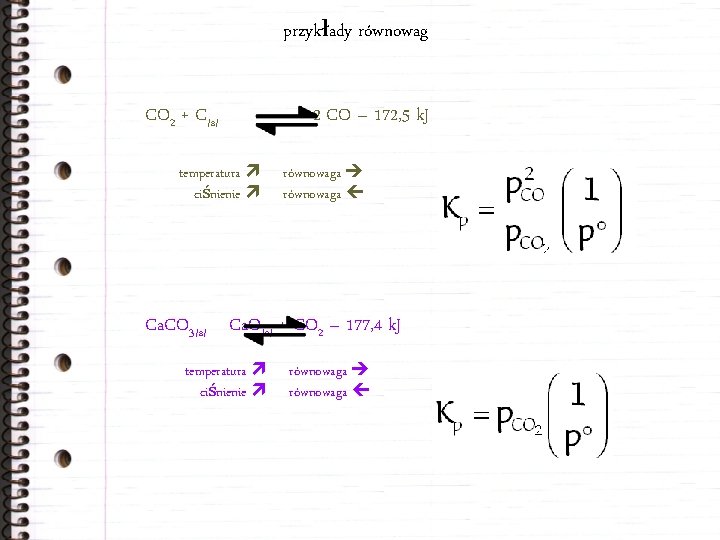
przykłady równowag CO 2 + C/s/ temperatura ciśnienie 2 CO – 172, 5 k. J równowaga Ca. CO 3/s/ Ca. O/s/ + CO 2 – 177, 4 k. J temperatura ciśnienie równowaga
 Zjawisko fizyczne a reakcja chemiczna klasa 7
Zjawisko fizyczne a reakcja chemiczna klasa 7 Zadania na szybkość reakcji
Zadania na szybkość reakcji Ekonomia stosowana
Ekonomia stosowana Psychologia kliniczna
Psychologia kliniczna Model sita i kapitału ludzkiego
Model sita i kapitału ludzkiego Maszyna stosowana przy produkcji kaszy
Maszyna stosowana przy produkcji kaszy Klasyczne czynniki produkcji
Klasyczne czynniki produkcji Fluorowce
Fluorowce Stany wzbudzone siarki
Stany wzbudzone siarki Alkany
Alkany Ciekawostki z życia stefana wyszyńskiego
Ciekawostki z życia stefana wyszyńskiego Esej na temat
Esej na temat Temat do prezentacji
Temat do prezentacji Rodzina wyrazow dom
Rodzina wyrazow dom Liryka pośrednia i bezpośrednia
Liryka pośrednia i bezpośrednia Budowa łodygi
Budowa łodygi Bernadetta izydorczyk
Bernadetta izydorczyk































