chemia stosowana I temat stany skupienia materii Dlaczego









- Slides: 17

chemia stosowana I temat: stany skupienia materii

Dlaczego płatki śniegu są sześciokątne? Czy gęste ciecze mają dużą gęstość? Dlaczego krople wody są kuliste? Dlaczego nie woskuje się szyb w samochodach?

podział materii wg stanów skupienia gazy ciecze ciała stałe brak określonego kształtu i objętości brak określonego kształtu określona objętość określony kształt i objętość krystaliczne bezpostaciowe (amorficzne) „prawdziwe” ciała stałe anizotropowe ciała szkliste (ciecze przechłodzone) izotropowe

ciała krystaliczne: uporządkowana sieć przestrzenna wyróżnione kierunki w przestrzeni (np. właściwości optyczne, magnetyczne, łupliwość, rozszerzalność termiczna) elementy symetrii (2 -, 3 -, 4 - i 6 -krotne)

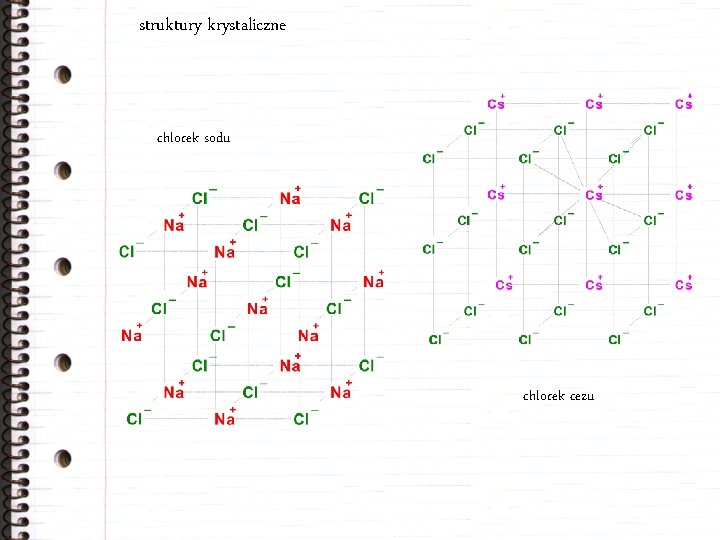
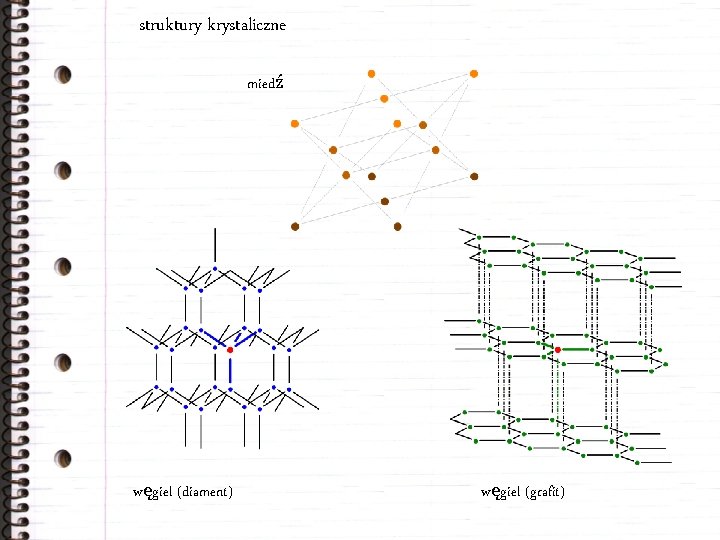
kryształy molekularne – pojedyncze cząsteczki nie powiązane ze sobą (gazy szlachetne, O 2, N 2, CO, CH 4, CCl 4, SF 6, siarka, związki organiczne) kowalencyjne – wszystkie atomy połączone wiązaniami (węgiel - diament, krzem, german, węgliki, borazon) jonowe – cząsteczki występują w postaci pojedynczych jonów, anionów i kationów przyciąganych siłami Coulomba (większość soli) metaliczne – w sieci występują pojedyncze atomy i kationy, pomiędzy nimi tzw. „gaz elektronowy”

struktury krystaliczne chlorek sodu chlorek cezu

struktury krystaliczne miedź węgiel (diament) węgiel (grafit)

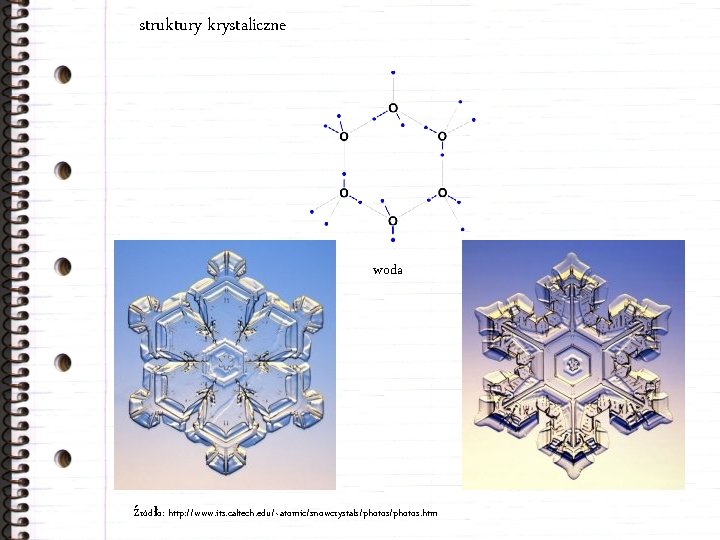
struktury krystaliczne woda źródło: http: //www. its. caltech. edu/~atomic/snowcrystals/photos. htm

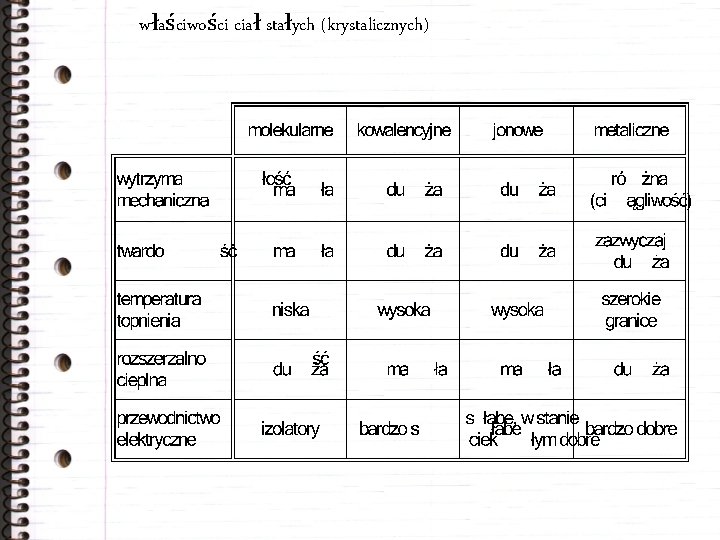
właściwości ciał stałych (krystalicznych)

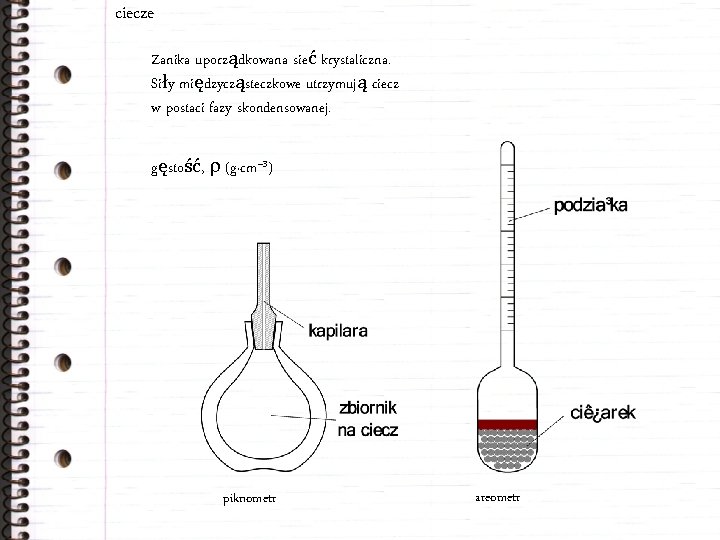
ciecze Zanika uporządkowana sieć krystaliczna. Siły międzycząsteczkowe utrzymują ciecz w postaci fazy skondensowanej. gęstość, r (g·cm– 3) piknometr areometr

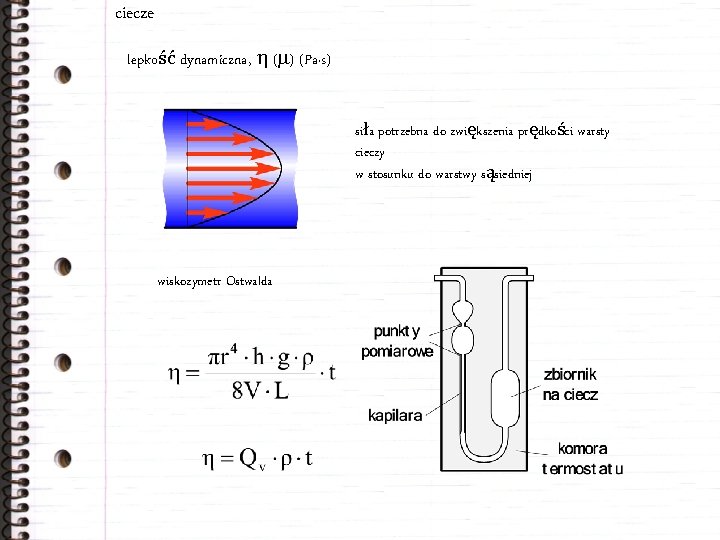
ciecze lepkość dynamiczna, h (m) (Pa·s) siła potrzebna do zwiększenia prędkości warsty cieczy w stosunku do warstwy sąsiedniej wiskozymetr Ostwalda

ciecze napięcie powierzchniowe, s (J·m-2) praca zwiększenia powierzchni swobodnej cieczy Najmniejszy stosunek powierzchni do masy ma kula. źródło: http: //www. arbiter. pl/galeria/stock-photo

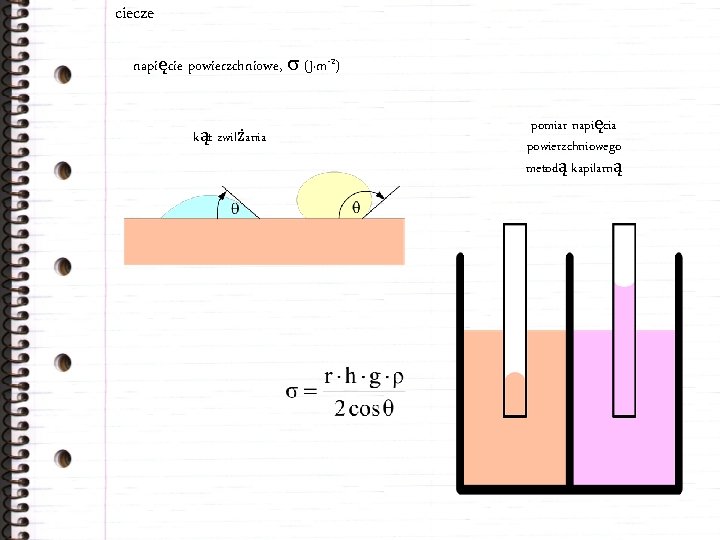
ciecze napięcie powierzchniowe, s (J·m-2) kąt zwilżania pomiar napięcia powierzchniowego metodą kapilarną

gazy Model gazu doskonałego: 1) 2) 3) 4) 5) 6) cząsteczki mają zerową objętość, masa cząsteczek jest skupiona w punktach matematycznych, cząsteczki nie oddziałują na siebie, zderzenia są doskonale sprężyste, ruch cząsteczek jest jednostajny i prostoliniowy, w gazie nie zachodzą reakcje chemiczne. równanie stanu: p·V = n·R·T p·Vm = R·T stała gazowa R = 8, 3144 J·mol– 1 K– 1

gazy objętość molowa gazu doskonałego: pod ciśnieniem 1 atm (101325 Pa): R·T p Vm = 22, 41 dm 3/mol w 0°C (273, 15 K) 24, 47 dm 3/mol w 25°C (298 K) 30, 62 dm 3/mol w 100°C (373 K) warunki „normalne” gęstość gazów: r= =m V = M Vm M·p R·T w warunkach normalnych: wodór, H 2 tlen, O 2 azot, N 2 0, 090 kg/m 3, 1, 428 kg/m 3, 1, 250 kg/m 3, metan, CH 4 chlor, Cl 2 etanol 0, 716 kg/m 3, 3, 163 kg/m 3, 2, 011 kg/m 3,

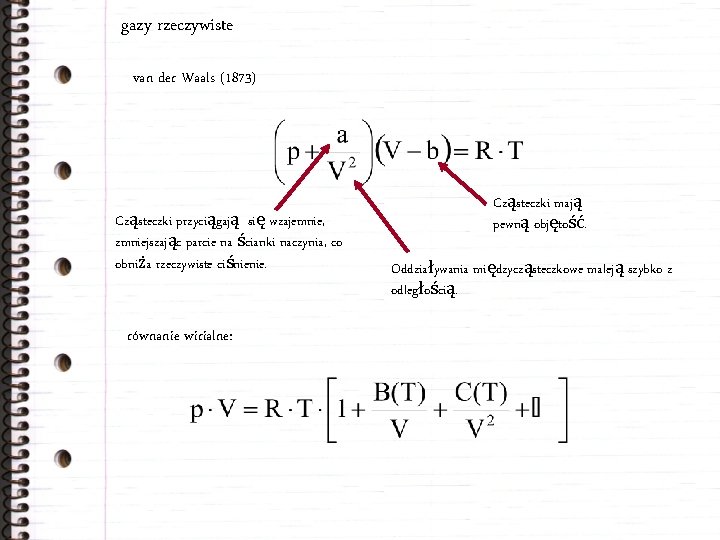
gazy rzeczywiste van der Waals (1873) Cząsteczki przyciągają się wzajemnie, zmniejszając parcie na ścianki naczynia, co obniża rzeczywiste ciśnienie. równanie wirialne: Cząsteczki mają pewną objętość. Oddziaływania międzycząsteczkowe maleją szybko z odległością.

Dlaczego płatki śniegu są sześciokątne? Czy gęste ciecze mają dużą gęstość? Dlaczego krople wody są kuliste? Dlaczego nie woskuje się szyb w samochodach?
 Alkanw
Alkanw Fala materii
Fala materii Natura falowa
Natura falowa Catalog online scolar
Catalog online scolar Zadanie domowe
Zadanie domowe Podział materii
Podział materii Fala materii
Fala materii Importanta limbii franceze
Importanta limbii franceze Ekonomia stosowana
Ekonomia stosowana Psychologia teoretyczna
Psychologia teoretyczna Modele polityki personalnej
Modele polityki personalnej Maszyna stosowana przy produkcji kaszy
Maszyna stosowana przy produkcji kaszy Ekonomia stosowana
Ekonomia stosowana Cl konfiguracja elektronowa
Cl konfiguracja elektronowa Tranzystor bc211 dane katalogowe
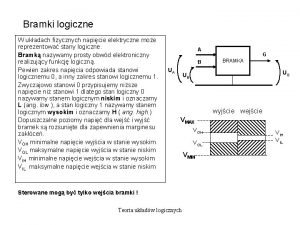
Tranzystor bc211 dane katalogowe Bramka logiczna teoria
Bramka logiczna teoria Klin odłamu jak obliczyć
Klin odłamu jak obliczyć Stany pracy tranzystora
Stany pracy tranzystora