chemia stosowana I temat utlenianie i redukcja stopie














- Slides: 17

chemia stosowana I temat: utlenianie i redukcja

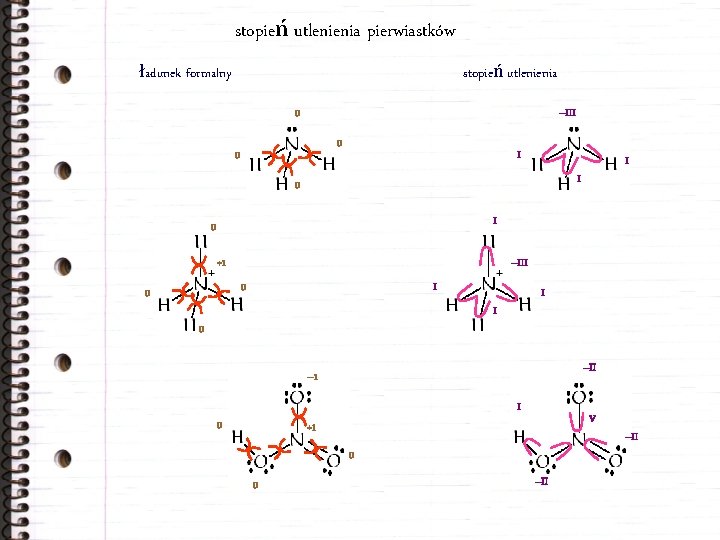
stopień utlenienia pierwiastków Stopień utlenienia atomu określa jaki ładunek miałby atom, gdyby elektrony były przekazywane między atomami (nie-uwspólniane). Reguły • dla prostych jonów stopień utlenienia = ładunek • dla pierwiastków stopień utlenienia = 0 • dla związków kowalencyjnych każdą uwspólnioną parę elektronową przypisuje się do atomu o większej elektroujemności • identyczne atomy dzielą parę elektronową wiązania między siebie Wnioski • F-I • HI (z niemetalami) lub H-I (z metalami) • O-II (reguła) O-I (nadtlenki, np. H 2 O 2) OII (OF 2) Jeśli stopień utlenienia rośnie - zachodzi reakcja utleniania. Jeśli stopień utlenienia maleje - zachodzi reakcja redukcji.

stopień utlenienia pierwiastków ładunek formalny stopień utlenienia 0 –III 0 0 I I I 0 +1 –III 0 0 I I I 0 –II – 1 I 0 V +1 0 0 –II

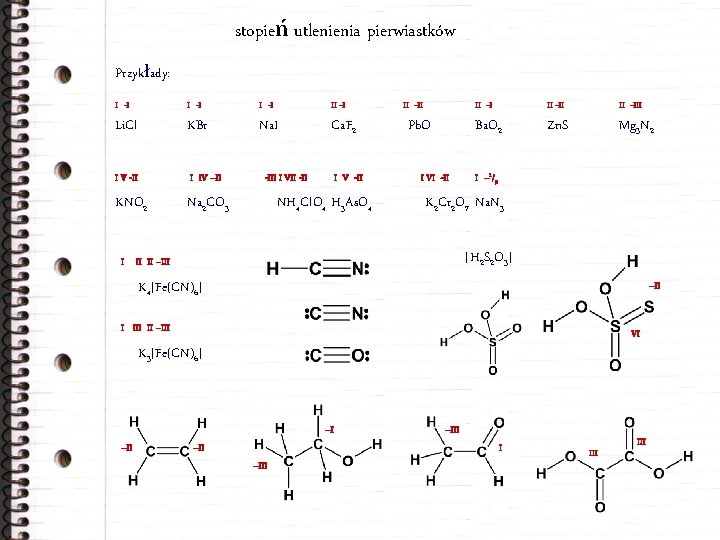
stopień utlenienia pierwiastków Przykłady: I -I II -I Li. Cl KBr Na. I Ca. F 2 I V -II I IV –II KNO 2 Na 2 CO 3 -III I VII -II I V -II NH 4 Cl. O 4 H 3 As. O 4 II -II Pb. O I VI -II II -III Ba. O 2 Zn. S Mg 3 N 2 I – 1/3 K 2 Cr 2 O 7 Na. N 3 [H 2 S 2 O 3] I II II –III K 4[Fe(CN)6] –II I II –III VI K 3[Fe(CN)6] –I –II –III III

reakcje utleniania - redukcji (redoks) Mg 0 + Cl 02 Mg. IICl–I 2 Zn 0 + 2 HICl–I Zn. IICl–I 2 + H 02 Mg 0 Mg 2+ + 2 e /× 1 Zn 0 Zn 2+ + 2 e /× 1 Cl 02 + 2 e 2 Cl– /× 1 2 H+ + 2 e H 02 /× 1 2 Fe 3+ + 2 I– 2 Fe 2+ + I 02 3 Cu 2+ + 2 Al 0 3 Cu 0 + 2 Al 3+ 2 Fe 3+ + 2 e Fe 2+ /× 1 2 I– I 02 + 2 e Al 0 Al 3+ + 3 e /× 2 Cu 2+ + 2 e Cu 0 /× 3 /× 1 2 Mn. VIIO 4– + 5 Sn 2+ + 16 H+ 2 Mn 2+ + 5 Sn 4+ + 8 H 2 O Mn. VIIO 4– + 5 e + 8 H+ Mn 2+ + 4 H 2 O /× 2 Sn 2+ Sn 4+ + 2 e /× 5

reakcje utleniania - redukcji (redoks) 2 NVO 3– + 3 Cu 0 + 8 H+ 3 Cu 2+ + 2 NIIO + 4 H 2 O NVO 3– + 3 e + 4 H+ NIIO + 2 H 2 O /× 2 Cu 0 Cu 2+ + 2 e /× 3 2 NVO 3– + Cu 0 + 4 H+ Cu 2+ + 2 NIIO 2 + 2 H 2 O NVO 3– + e + 2 H+ NIVO 2 + H 2 O /× 2 Cu 0 Cu 2+ + 2 e /× 1 2 Mn. VIIO 4– + 5 H 2 O–I 2 + 6 H+ 2 Mn 2+ + 5 O 02 + 8 H 2 O Mn. VIIO 4– + 5 e + 8 H+ Mn 2+ + 4 H 2 O /× 2 H 2 O–I 2 2 H+ + O 02 + 2 e /× 5

reakcje utleniania - redukcji (redoks) 2 Cr 3+ + 3 H 2 O–I 2 + 10 O–IIH– 2 Cr. VIO 42– + 8 H 2 O–II H 2 O–I 2 + 2 e 2 O–IIH– /× 3 Cr 3+ + 8 OH– Cr. VIO 42– + 4 H 2 O + 3 e /× 2 Cr. VI 2 O 72– + 3 H 2 CIII 2 O 4 + 8 H+ 2 Cr 3+ + 6 CIVO 2 + 7 H 2 O Cr. VI 2 O 72– + 6 e + 14 H+ 2 Cr 3+ + 7 H 2 O /× 1 H 2 CIII 2 O 4 2 CIVO 2 + 2 H+ + 2 e /× 3 Pb. IVO 2 + 2 Cl– + 4 H+ Pb 2+ + Cl 02 + 2 H 2 O Pb. IVO 2 + 2 e + 4 H+ Pb 2+ + 2 H 2 O /× 1 2 Cl– Cl 02 + 2 e /× 1

wpływ środowiska na reakcje redoks kwaśne 2 Mn. VIIO 4– + 5 H 2 S–II + 6 H+ 2 Mn 2+ + 5 S 0 + 8 H 2 O Mn. VIIO 4– + 5 e + 8 H+ Mn 2+ + 4 H 2 O /× 2 H 2 S–II 2 H+ + S 0 + 2 e /× 5 obojętne 2 Mn. VIIO 4– + 3 H 2 S–II 2 Mn. IVO 2 + 3 S 0 + 2 OH– + 2 H 2 O Mn. VIIO 4– + 3 e + 2 H 2 O Mn. IVO 2 + 4 OH– /× 2 H 2 S–II + 2 OH– S 0 + 2 H 2 O + 2 e zasadowe 2 Mn. VIIO 4– + H 2 S–II + 2 OH– 2 Mn. VIO 42– + S 0 + 2 H 2 O Mn. VIIO 4– + e Mn. VIO 42– H 2 S–II + 2 OH– S 0 + 2 H 2 O + 2 e /× 1 /× 2 /× 3

reakcje synproporcjonowania (redoks) Hg 2+ + Hg 0 Hg 22+ S 2– + S 0 S 22– 2 S 0 + 2 e S 22– /×(1/2) 2 Hg 2+ + 2 e Hg 22+ /×(1/2) 2 S 2– S 22– + 2 e /×(1/2) 2 Hg 0 Hg 22+ + 2 e Cl– + Cl. IO– + 2 H+ Cl 02 + H 2 O 2 Cl. IO– + 4 H+ + 2 e Cl 02 + 2 H 2 O /×(1/2) 2 Cl– Cl 02 + 2 e /×(1/2) 5 Br– + Br. VO 3– + 6 H+ 3 Br 02 + 3 H 2 O 2 Br. VO 3– + 12 H+ + 10 e Br 02 + 6 H 2 O /×(1/2) 2 Br– Br 02 + 2 e /×(5/2)

reakcje dysproporcjonowania (redoks) 2 Cu+ Cu 0 + Cu 2+ Hg 22+ + S 2– Hg. IIS + Hg 0 Hg 22+ + 2 e 2 Hg 0 Cu+ + e Cu 0 /× 1 Cu+ Cu 2+ + e /× 1 /×(1/2) Hg 22+ + 2 S 2– 2 Hg. IIS + 2 e /×(1/2) 3 Cl. IO– 2 Cl– + Cl. IO 3– Cl. IO– + 2 H+ + 2 e Cl– + H 2 O /× 2 Cl. IO– + 2 H 2 O Cl. IO 3– + 4 H+ + 2 e /× 1 3 Mn. VIO 42– + 4 H+ 2 Mn. VIIO 4– +Mn. IVO 2 + 2 H 2 O Mn. VIO 42– + 4 H+ + 2 e Mn. IVO 2 + 2 H 2 O /× 1 Mn. VIO 42– Mn. VIIO 4– + e /× 2

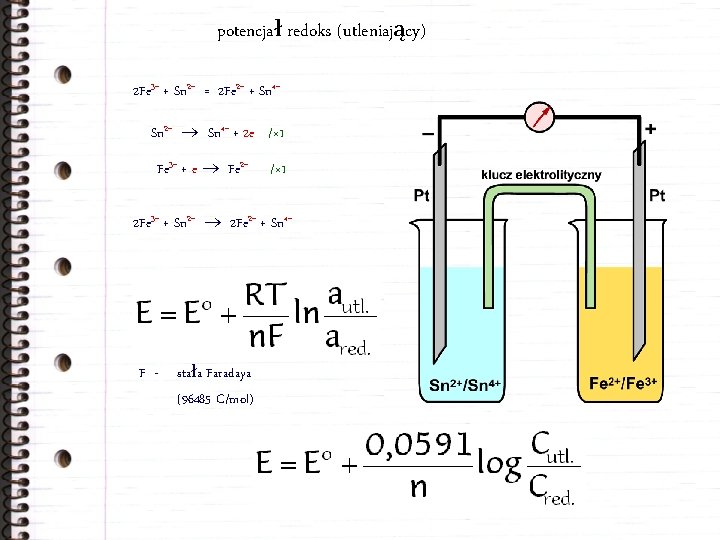
potencjał redoks (utleniający) 2 Fe 3+ + Sn 2+ = 2 Fe 2+ + Sn 4+ Sn 2+ Sn 4+ + 2 e /× 1 Fe 3+ + e Fe 2+ /× 1 2 Fe 3+ + Sn 2+ 2 Fe 2+ + Sn 4+ F - stała Faradaya (96485 C/mol)

potencjał redoks (utleniający) Li+/Li K+/K Ca 2+/Ca Na+/Na Mg 2+/Mg Al 3+/Al Zn 2+/Zn Cr 3+/Cr Fe 2+/Fe Ni 2+/Ni Pb 2+/Pb H+/H 2/Pt Cu 2+/Cu Ag+/Ag Au+/Au E° = – 3, 045 V E° = – 2, 925 V E° = – 2, 866 V E° = – 2, 714 V E° = – 2, 363 V E° = – 1, 662 V E° = – 0, 763 V E° = – 0, 744 V E° = – 0, 440 V E° = – 0, 250 V E° = – 0, 126 V E° = 0, 000 V E° = +0, 337 V E° = +0, 799 V E° = + 1, 50 V SO 42–/SO 32–, OH– NO 3–/NO 2– Sn 4+/Sn 2+ Cu 2+/Cu+ I 2/I– Mn. O 4–/Mn. O 2, OH– Fe 3+/Fe 2+ Cl. O–/Cl–, OH– NO 3–, H+/NO Br 2/Br– Mn. O 2, H+/Mn 2+ Cr 2 O 72–, H+/Cr 3+ Cl 2/Cl– Mn. O 4–, H+/Mn 2+ Co 3+/Co 2+ F 2/F– E° = – 1, 12 V E° = +0, 01 V E° = +0, 153 V E° = +0, 536 V E° = +0, 588 V E° = +0, 771 V E° = +0, 89 V E° = +0, 96 V E° = +1, 065 V E° = +1, 23 V E° = +1, 360 V E° = +1, 51 V E° = +1, 81 V E° = +2, 87 V

potencjał redoks (utleniający) Dla układu H+/H 2/g//Pt przyjmuje się, że E° = 0 V. Potencjały innych układów wyznacza się porównawczo. Sn 4+ + 2 e = Sn 2+ E° = 0, 15 V 2 Fe 3+ + Sn 2+ 2 Fe 2+ + Sn 4+ Fe 3+ + e = Fe 2+ E° = 0, 77 V E Fe 3+/Fe 2+ = E° E Fe 3+/Fe 2+ Sn 4+/Sn 2+ w stanie równowagi: SEM = 0, 62 + 0, 0591 log 1 + = E° SEM = EFe 3+/Fe 2+ – ESn 4+/Sn 2+ + CFe 3+ CFe 2+ 0, 0591 log 2 CSn 4+ CSn 2+ SEM = 0, 62 + 0, 0591 log 1 · 2 C 2 Fe 3+ · CSn 2+ C 2 Fe 2+ · CSn 4+ C 2 Fe 3+ · CSn 2+ =0! C 2 Fe 2+ · CSn 4+ log K = 0, 62 · 1 · 2 = 21, 0 0, 0591

przewidywanie kierunku reakcji 2 Fe 2+ + 2 Hg 2+ =? = 2 Fe 3+ + Hg 22+ Fe 3+ + e = Fe 2+ E° = 0, 77 V 2 Hg 2+ + 2 e = Hg 22+ E° = 0, 91 V 2 Fe 2+ + 2 Hg 2+ 2 Fe 3+ + Hg 22+ Mn. VIIO 4– + e = Mn. VIO 42– E° = 0, 54 V 2 Mn. VIO 42– + Cl 0 + Br 0 2 Mn. VIO 42– I 0 2 Mn. VIO 42– + 2 2 Mn. VIIO 4– + Cl– Cl 02 + 2 e = 2 Cl– E° = 1, 358 V + Br– Br 02 + 2 e = 2 Br– E° = 1, 065 V + I– I 02 + 2 e = 2 I– E° = 0, 53 V

wpływ p. H na potencjał redoks utl. + m. H+ + ne red + 0, 5 m. H 2 O utl + 0, 5 m. H 2 O + ne red. + m. OH– dla stężeń utl. /red. = 1 M p. H = 0 3 7 11 14 E= 1, 52 1, 24 0, 86 0, 48 0, 20 E= 1, 26 0, 96 0, 57 0, 18 – 0, 12 Mn. VIIO 4– + 5 e + 8 H+ Mn 2+ + 4 H 2 O Cr. VIO 42– + 4 H 2 O + 3 e Cr 3+ + 8 OH– Wzrost p. H zwiększa potencjał redoks.

wpływ kompleksowania na potencjał redoks W przypadku kompleksowania formy utlenionej potencjał się obniża. W przypadku kompleksowania formy zredukowanej potencjał się podwyższa. Fe 3+/Fe 2+ Co 3+/Co 2+ Au+/Au E° = +0, 771 V [Fe(CN)6]3–/[Fe(CN)6]4– E° = +0, 36 V [Co(CN)6]3–/[Co(CN)6]4– E° = +0, 83 V [Au(CN)2]–/Au E° = – 0, 76 V E° = +1, 81 V E° = + 1, 50 V

chemia stosowana I KONIEC
 Hydroliza nitryli
Hydroliza nitryli Trietanian glicerolu
Trietanian glicerolu Addycja wody
Addycja wody Maszyna stosowana przy produkcji kaszy
Maszyna stosowana przy produkcji kaszy Klasyczne czynniki produkcji
Klasyczne czynniki produkcji Ekonomia stosowana
Ekonomia stosowana Psychologia teoretyczna i stosowana
Psychologia teoretyczna i stosowana Ekonomia stosowana
Ekonomia stosowana Temat prezentacji
Temat prezentacji Potok płynie doliną nad potokiem jawory
Potok płynie doliną nad potokiem jawory Zredaguj krótki tekst informacyjny na temat jakiegoś
Zredaguj krótki tekst informacyjny na temat jakiegoś Pęd budowa i funkcje łodygi karta pracy
Pęd budowa i funkcje łodygi karta pracy Wymiary boiska piłkarskiego
Wymiary boiska piłkarskiego Esej na temat
Esej na temat Kliniczne wykłady na temat teorii klein i teorii bion
Kliniczne wykłady na temat teorii klein i teorii bion Prymas wyszyński ciekawostki
Prymas wyszyński ciekawostki Esej na temat
Esej na temat Redukcja bircha
Redukcja bircha