chemia stosowana I temat p H roztworw pojcia












- Slides: 29

chemia stosowana I temat: p. H roztworów

pojęcia kwasu i zasady wg Brönsteda substancja zawierająca cząsteczki zdolne do oddawania protonów (donory protonów) kwas zasada A substancja zawierająca cząsteczki zdolne do przyjmowania protonów (akceptory protonów) B+ H+ Kwas oddając proton przechodzi w zasadę, sprzężoną z tym kwasem. Zasada przyjmując proton przechodzi w kwas sprzężony z tą zasadą. Do zajścia reakcji potrzebne są dwie pary sprzężone kwas-zasada. A 1 B 2 + H+ A 1 + B 2 B 1 + A 2 B 1 + H+ A 2

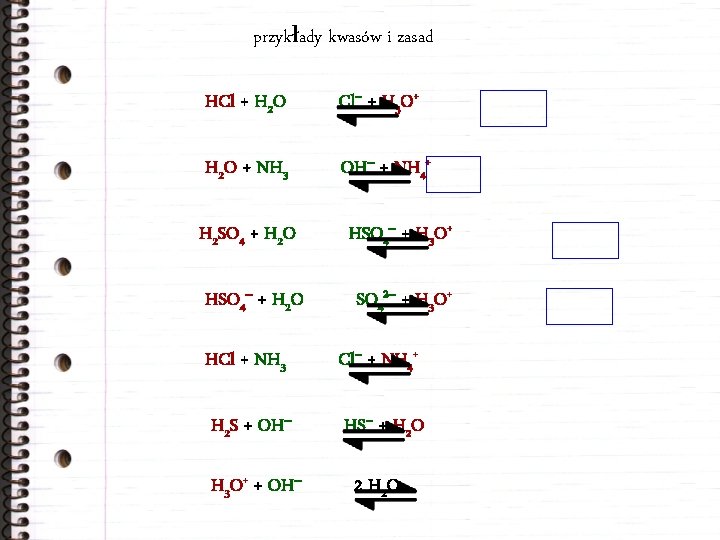
przykłady kwasów i zasad HCl + H 2 O Cl– + H 3 O+ H 2 O + NH 3 OH– + NH 4+ H 2 SO 4 + H 2 O HSO 4– + H 3 O+ HSO 4– + H 2 O SO 42– + H 3 O+ HCl + NH 3 Cl– + NH 4+ H 2 S + OH– HS– + H 2 O H 3 O+ + OH– 2 H 2 O

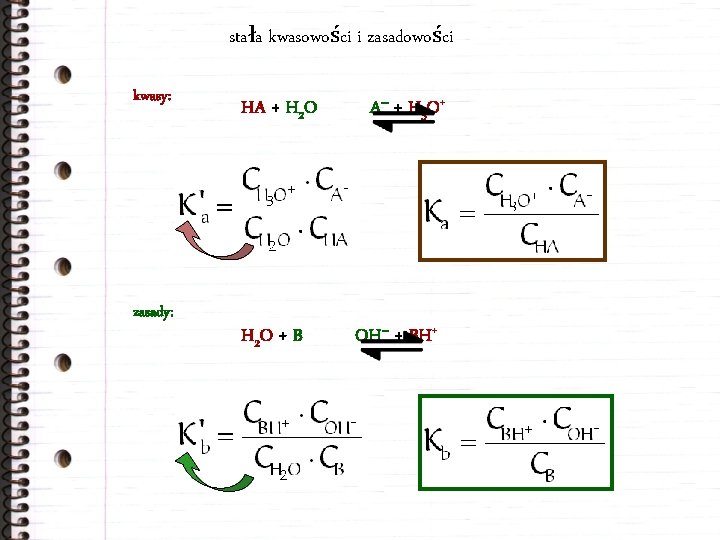
stała kwasowości i zasadowości kwasy: zasady: HA + H 2 O + B A – + H 3 O + OH– + BH+

skala p. Ka = – log. Ka = 1× 107 p. Ka = – 7. 0 HCl Ka = 10000000 p. Ka = – 1. 4 HNO 3 Ka = 25 p. Ka = 2. 0 HCl. O 2 Ka = 0, 01 = 1× 10– 2 p. Ka = 3. 2 HF Ka = 0, 00063 = 6, 3× 10– 4 p. Ka = 7. 0 H 2 S Ka = 0, 0000001 = 1× 10– 7 p. Ka = 8. 7 HBr. O Ka = 0, 00002 = 2, 0× 10– 9 p. Kw = 14. 0 H 2 O Kw = 1× 10– 14 p. Ka = 39. 2 NH 3 Ka = 5, 7× 10– 40 NH 3 + H 2 O NH 2– + H 3 O+

kwasy wieloprotonowe H 2 SO 4 + H 2 O HSO 4– + H 3 O+ HSO 4– + H 2 O SO 42– + H 3 O+ H 3 PO 4 + H 2 O H 2 PO 4– + H 3 O+ H 2 PO 4– + H 2 O HPO 42– + H 3 O+ HPO 42– + H 2 O PO 43– + H 3 O+

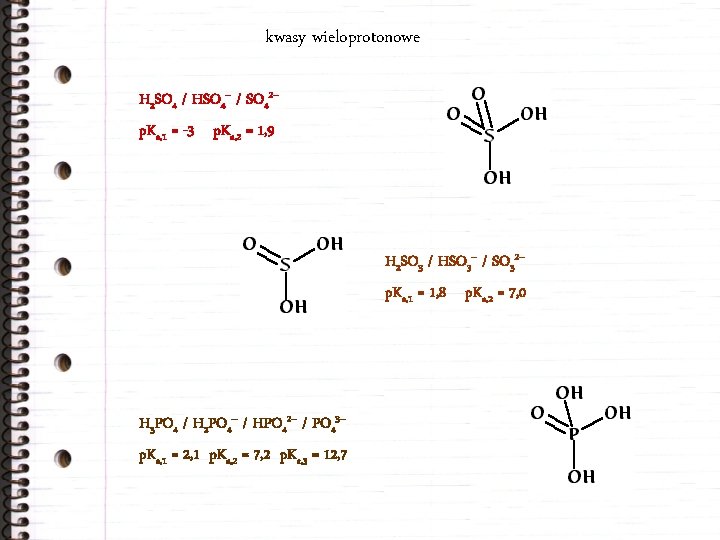
kwasy wieloprotonowe H 2 SO 4 / HSO 4– / SO 42– p. Ka, 1 = -3 p. Ka, 2 = 1, 9 H 2 SO 3 / HSO 3– / SO 32– p. Ka, 1 = 1, 8 p. Ka, 2 = 7, 0 H 3 PO 4 / H 2 PO 4– / HPO 42– / PO 43– p. Ka, 1 = 2, 1 p. Ka, 2 = 7, 2 p. Ka, 3 = 12, 7

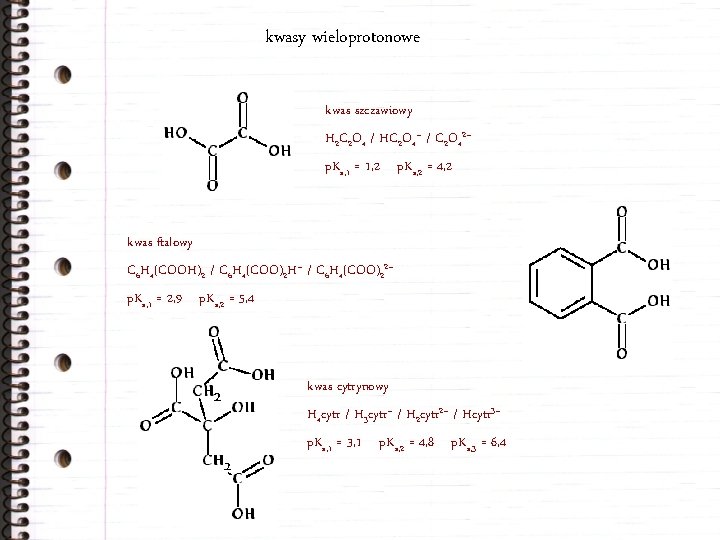
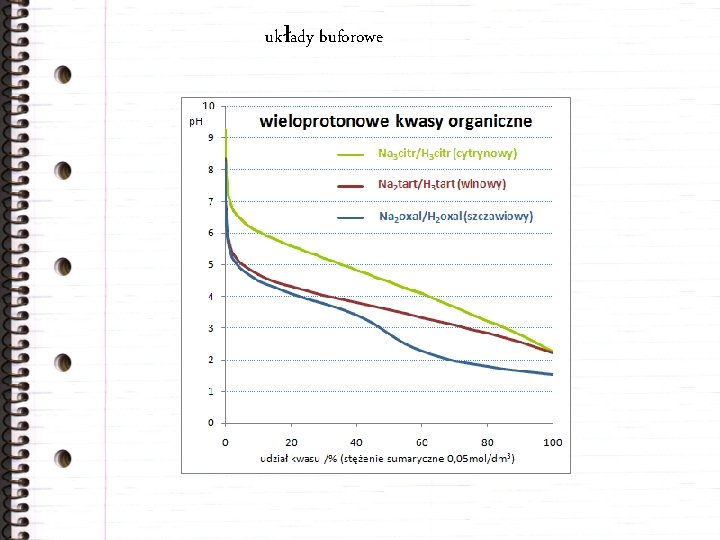
kwasy wieloprotonowe kwas szczawiowy H 2 C 2 O 4 / HC 2 O 4– / C 2 O 42– p. Ka, 1 = 1, 2 p. Ka, 2 = 4, 2 kwas ftalowy C 6 H 4(COOH)2 / C 6 H 4(COO)2 H– / C 6 H 4(COO)22– p. Ka, 1 = 2, 9 p. Ka, 2 = 5, 4 kwas cytrynowy H 4 cytr / H 3 cytr– / H 2 cytr 2– / Hcytr 3– p. Ka, 1 = 3, 1 p. Ka, 2 = 4, 8 p. Ka, 3 = 6, 4

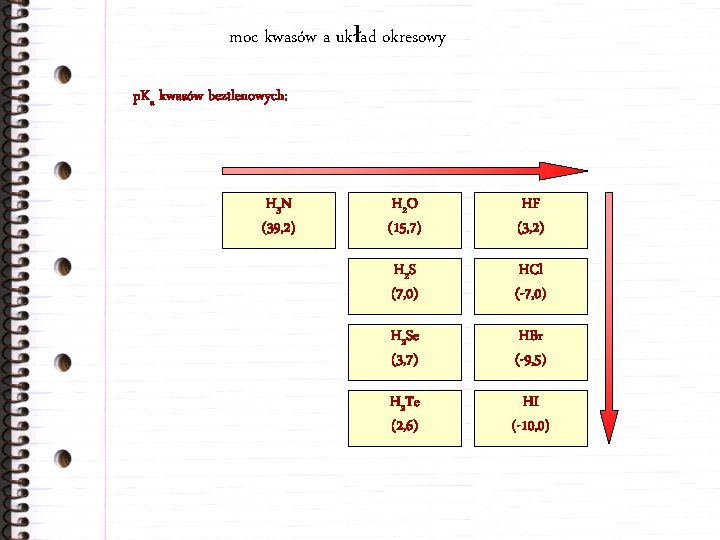
moc kwasów a układ okresowy p. Ka kwasów beztlenowych: H 3 N (39, 2) H 2 O (15, 7) HF (3, 2) H 2 S (7, 0) HCl (-7, 0) H 2 Se (3, 7) HBr (-9, 5) H 2 Te (2, 6) HI (-10, 0)

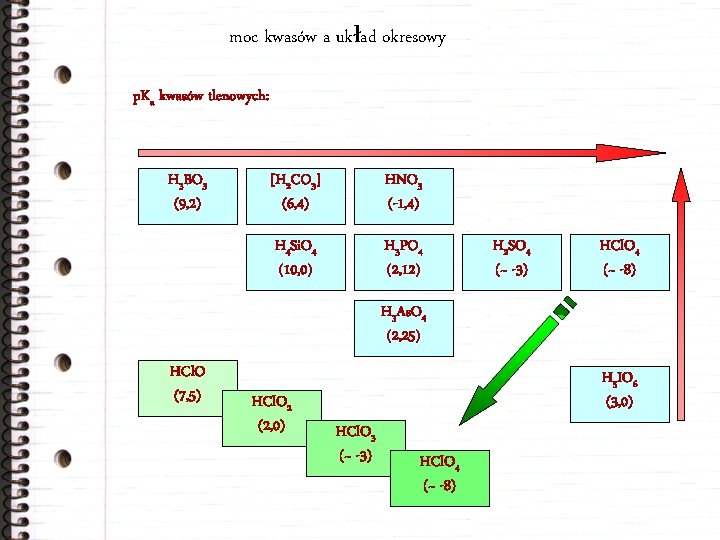
moc kwasów a układ okresowy p. Ka kwasów tlenowych: H 3 BO 3 (9, 2) [H 2 CO 3] (6, 4) HNO 3 (-1, 4) H 4 Si. O 4 (10, 0) H 3 PO 4 (2, 12) H 2 SO 4 (~ -3) HCl. O 4 (~ -8) H 3 As. O 4 (2, 25) HCl. O (7, 5) HCl. O 2 (2, 0) H 5 IO 6 (3, 0) HCl. O 3 (~ -3) HCl. O 4 (~ -8)

kwasy i zasady sprzężone NH 4+ + OH– NH 3 + H 2 O NH 4+ + H 2 O p. Kb = 4, 76 NH 3 + H 3 O+ + OH– p. Ka* = ? p. Kw = 14, 0 Kb·Ka* = Kw p. Kb + p. Ka* = p. Kw 9, 24

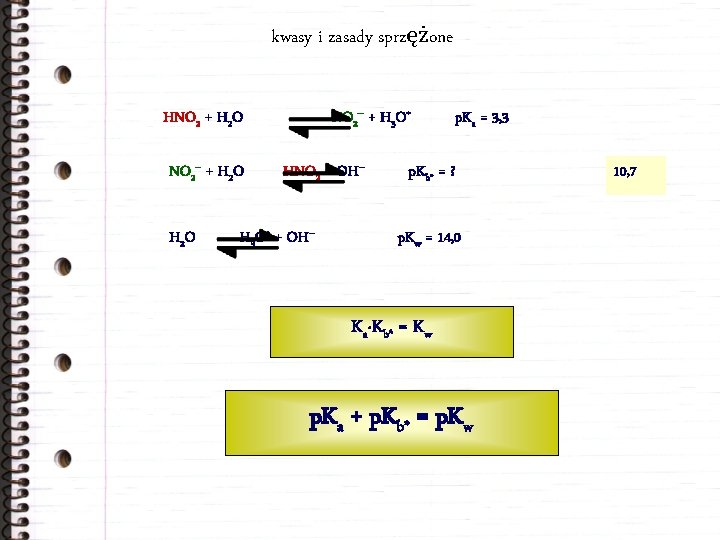
kwasy i zasady sprzężone NO 2– + H 3 O+ HNO 2 + H 2 O NO 2– + H 2 O HNO 2 + OH– H 3 O+ + OH– p. Ka = 3, 3 p. Kb* = ? p. Kw = 14, 0 Ka·Kb* = Kw p. Ka + p. Kb* = p. Kw 10, 7

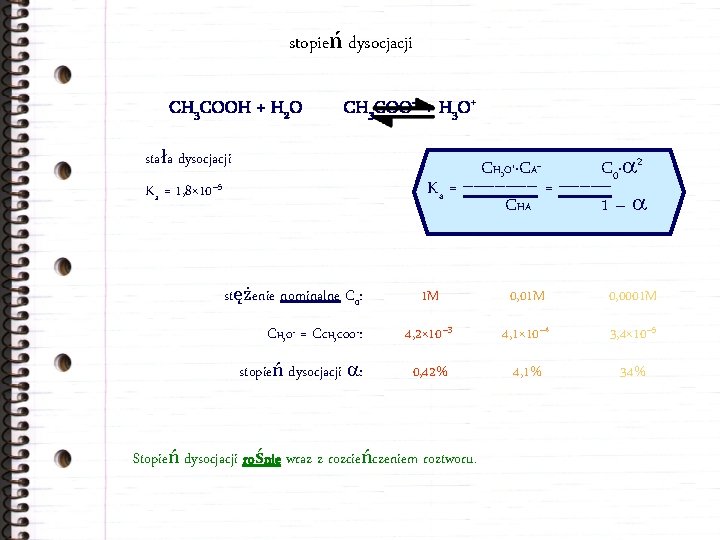
stopień dysocjacji CH 3 COO– + H 3 O+ CH 3 COOH + H 2 O stała dysocjacji 2 C H O ·CA C · 0 Ka = _______ = _____ CHA 1– 3 Ka = 1, 8× 10– 5 stężenie nominalne C 0: + – 1 M 0, 0001 M CH O = CCH COO : 4, 2× 10– 3 4, 1× 10– 4 3, 4× 10– 5 stopień dysocjacji : 0, 42% 4, 1% 34% 3 + 3 – Stopień dysocjacji rośnie wraz z rozcieńczeniem roztworu.

stopień dysocjacji CH 3 COOH + H 2 O CH 3 COONa CH 3 COO– + H 3 O+ CH 3 COO– + Na+ stała dysocjacji stopień dysocjacji Ka = 1, 8× 10– 5 CH O = C 0· 3 + 0, 1 M CH 3 COOH: 1, 35% 0, 1 M CH 3 COOH + 0, 1 M CH 3 COONa: 0, 018% Dodatek soli zmniejsza stopień dysocjacji kwasów.

p. H roztworów kwasy mocne - całkowicie zdysocjowane: 1 M HCl CH O = 1 mol/dm 3 p. H = 0 0, 1 M HCl. O 4 CH O = 0, 1 mol/dm 3 p. H = 1 0, 001 M HI CH O = 0, 001 mol/dm 3 p. H = 3 0, 03 M HBr CH O = 0, 03 mol/dm 3 p. H = 1, 52 3 3 + + kwasy słabe - częściowo zdysocjowane: CH O = 0, 0042 mol/dm 3 1 M CH 3 COOH p. Ka = 4, 75 0, 01 M CH 3 COOH CH O = 0, 00041 mol/dm 3 0, 01 M HCl. O 2 p. Ka = 1, 96 CH O = 0, 0063 mol/dm 3 p. H 2, 20 0, 01 M HCl. O p. Ka = 7, 5 CH O = 1, 8× 10– 5 mol/dm 3 p. H 4, 75 0, 01 M HIO p. Ka = 11, 0 CH O = 3, 4× 10– 7 mol/dm 3 p. H 6, 47 3 3 p. H 2, 38 + p. H 3, 39 + 3 3 3 C 0 = CIO + CHIO – + + + CH O = CIO + COH 3 + – –

kwasy wieloprotonowe H 2 SO 4 / HSO 4– / SO 42– p. Ka, 1 = -3 p. Ka, 2 = 1, 9 CSO + CHSO = C 0 4 2– 4 – 2 CSO + CHSO = CH O 4 C 0 1 M 0, 01 M 0, 0001 M 0, 00001 M 2– 4 – CH O 3 3 + + 1, 012 mol/dm 3 0, 110 mol/dm 3 0, 0145 mol/dm 3 0, 00191 mol/dm 3 0, 00020 mol/dm 3 0, 000020 mol/dm 3 p. H -0, 005 0, 96 1, 84 2, 72 3, 70 4, 70 (0) (1) (2) (3) (4) (5)

p. H roztworów zasady mocne - całkowicie zdysocjowane: 1 M Na. OH COH = 1 mol/dm 3 p. OH = 0 p. H = 14 0, 1 M KOH COH = 0, 1 mol/dm 3 p. OH = 1 p. H = 13 0, 001 M KOH COH = 0, 001 mol/dm 3 p. OH = 3 p. H = 11 0, 03 M Na. OH COH = 0, 03 mol/dm 3 p. OH = 1, 52 p. H = 12, 48 – – zasady słabe - częściowo zdysocjowane: p. OH p. H 1 M NH 3 COH = 0, 0042 M 2, 38 11, 62 COH = 0, 00041 M 3, 39 10, 61 p. Kb = 4, 75 0, 01 M NH 3 – – 0, 01 M N 2 H 4 p. Kb = 6, 0 COH = 9, 95× 10– 5 M 4, 00 10, 00 0, 01 M NH 2 OH p. Kb = 7, 9 COH = 1, 12× 10– 5 M 4, 95 9, 25 0, 01 M Ph. NH 2 p. Kb = 9, 4 COH = 2, 00× 10– 7 M 5, 70 8, 30 – – –

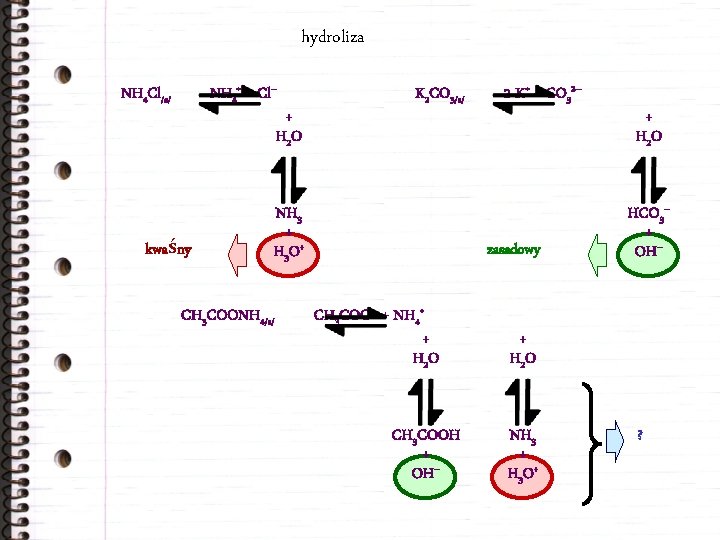
hydroliza NH 4+ + Cl– NH 4 Cl/s/ + H 2 O kwaśny K 2 CO 3/s/ NH 3 + H 3 O+ CH 3 COONH 4/s/ 2 K+ + CO 32– zasadowy CH 3 COO– + NH 4+ + H 2 O CH 3 COOH + OH– + H 2 O HCO 3– + OH– + H 2 O NH 3 + H 3 O+ ?

p. H roztworów soli mocny kwas - słaba zasada Cl– + NH 4+ NH 3 + HCl H 2 O + HCl NH 3 + H 3 O+ Cl– + H 3 O+ H 2 O + NH 4+ VNH 0, 1 M VHCl 0, 1 M p. H 50 100 1, 48 100 5, 13 100 80 8, 65 100 60 9, 07 100 40 9, 45 100 30 9, 62 100 0 11, 13 3

p. H roztworów soli słaby kwas - mocna zasada CH 3 COOH + Na. OH CH 3 COO– + Na+ + H 2 O Na. OH CH 3 COOH + OH– + Na+ H 2 O + CH 3 COO– VCH COOH 0, 1 M VNa. OH 0, 1 M p. H 50 100 12, 52 100 8, 87 100 80 5, 35 100 60 4, 93 100 40 4, 55 100 30 4, 38 100 0 2, 87 3

p. H roztworów soli słaby kwas - słaba zasada mrówczan amonu: HCOO– + NH 4+ HCOOH + NH 3 p. Ka = 3, 8 p. Kb = 4, 75 octan amonu: CH 3 COOH + NH 3 p. Ka = 4, 75 p. Ka* = 9, 25 p. H = 6, 5 CH 3 COO– + NH 4+ p. Kb = 4, 75 p. Ka* = 9, 25 p. H = 7, 0 p. Ka* = 9, 25 p. H = 8, 1 wodorosiarczek amonu: H 2 S + NH 3 HS– + NH 4+ p. Ka = 7, 0 p. Kb = 4, 75 Dla roztworów niezbyt rozcieńczonych p. H nie zależy od stężenia!

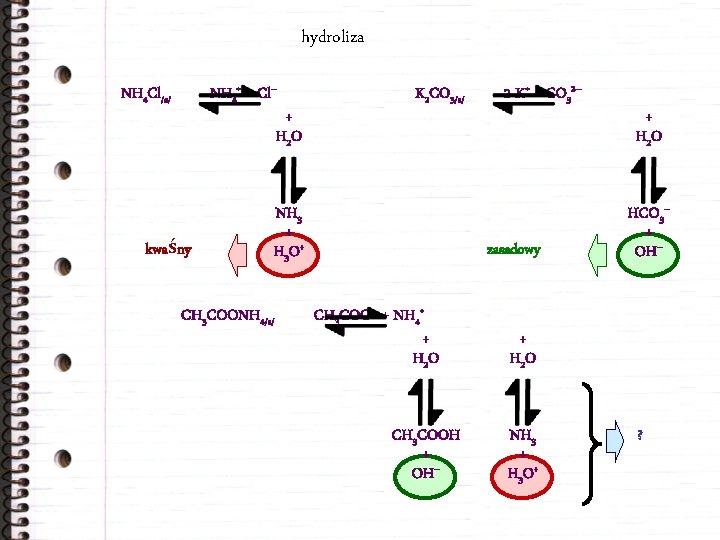
hydroliza NH 4+ + Cl– NH 4 Cl/s/ + H 2 O kwaśny K 2 CO 3/s/ NH 3 + H 3 O+ CH 3 COONH 4/s/ 2 K+ + CO 32– zasadowy CH 3 COO– + NH 4+ + H 2 O CH 3 COOH + OH– + H 2 O HCO 3– + OH– + H 2 O NH 3 + H 3 O+ ?

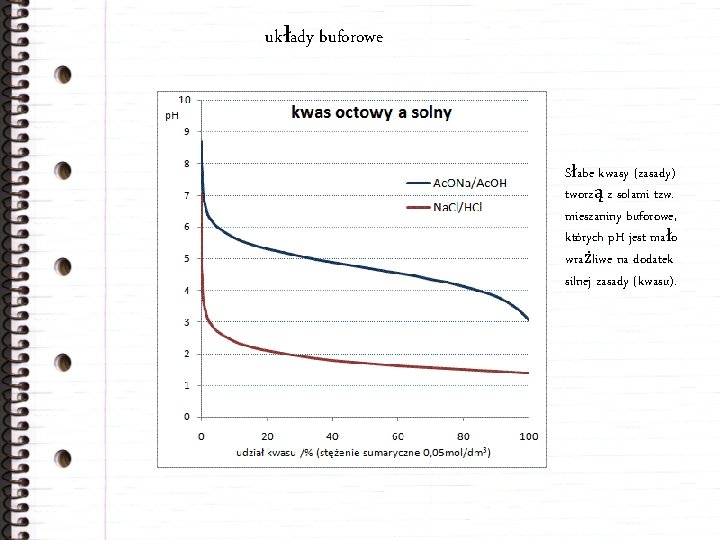
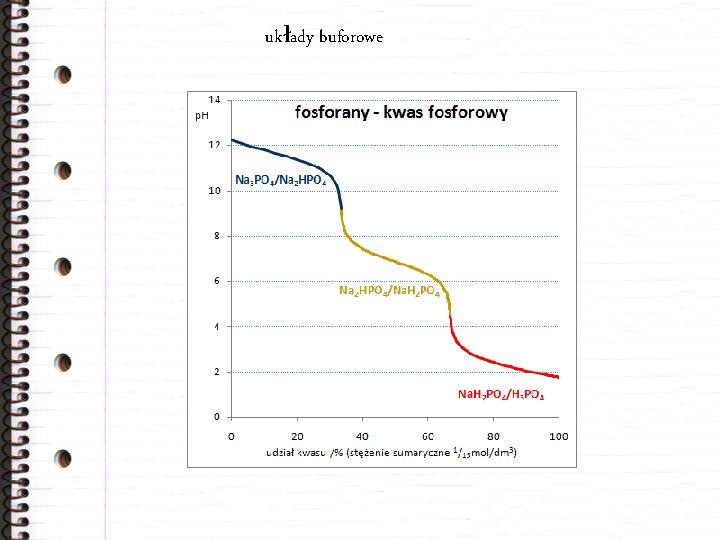
układy buforowe Słabe kwasy (zasady) tworzą z solami tzw. mieszaniny buforowe, których p. H jest mało wrażliwe na dodatek silnej zasady (kwasu).

układy buforowe

układy buforowe

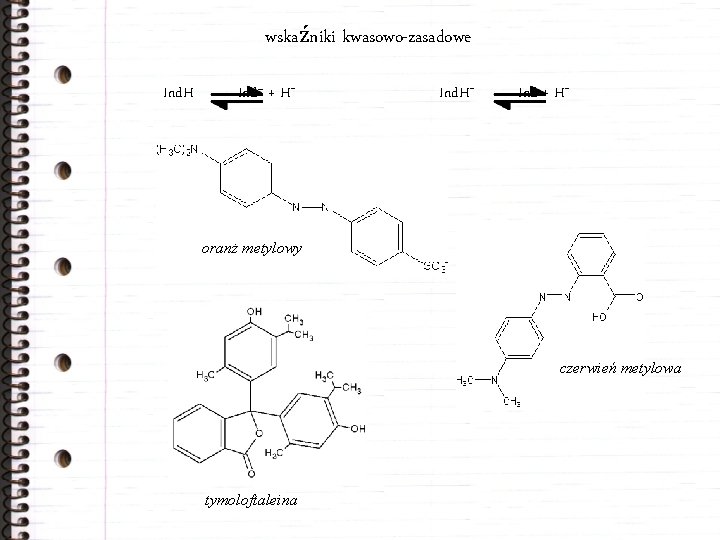
wskaźniki kwasowo-zasadowe Ind. H Ind– + H+ Ind + H+ oranż metylowy czerwień metylowa tymoloftaleina

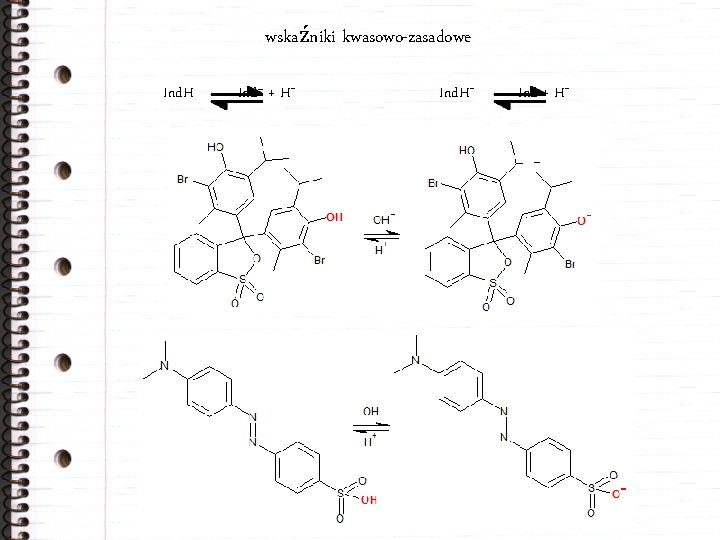
wskaźniki kwasowo-zasadowe Ind. H Ind– + H+ Ind + H+

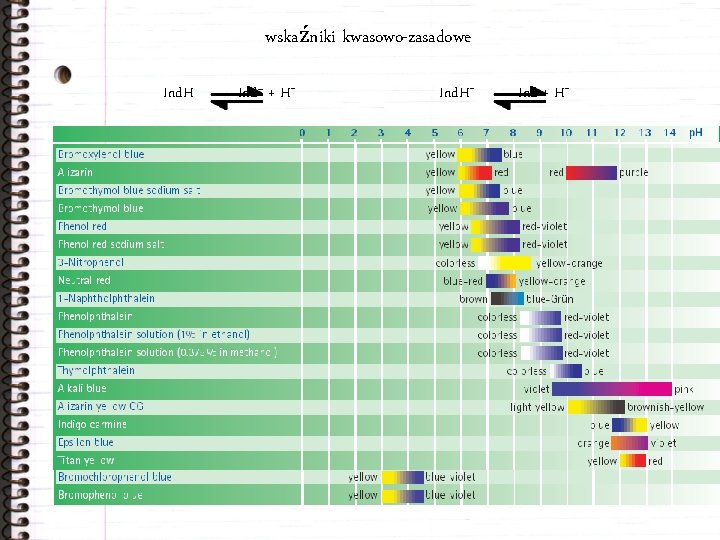
wskaźniki kwasowo-zasadowe Ind. H Ind– + H+ Ind + H+

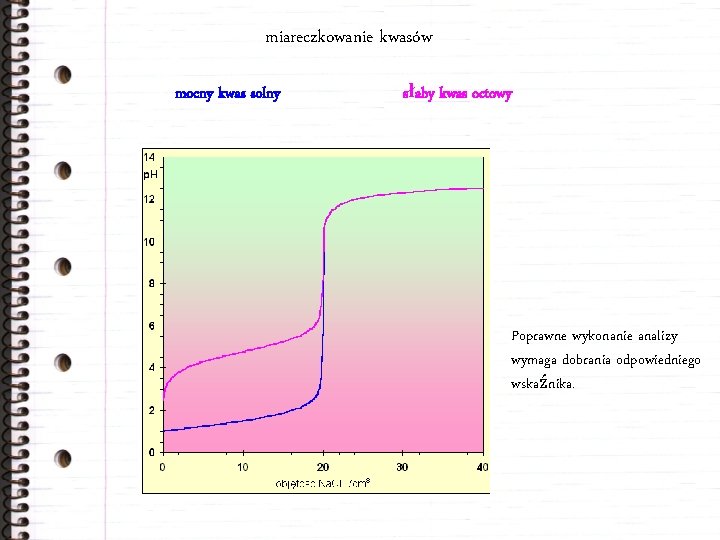
miareczkowanie kwasów mocny kwas solny słaby kwas octowy Poprawne wykonanie analizy wymaga dobrania odpowiedniego wskaźnika.
 Prewencja pierwotna caplan
Prewencja pierwotna caplan Ekonomia stosowana
Ekonomia stosowana Maszyna stosowana przy produkcji kaszy
Maszyna stosowana przy produkcji kaszy Klasyczne czynniki produkcji
Klasyczne czynniki produkcji Ekonomia stosowana
Ekonomia stosowana Ciekawostki o prymasie wyszyńskim
Ciekawostki o prymasie wyszyńskim Esej na temat
Esej na temat Temat prezentacji
Temat prezentacji Wyrazy o znaczeniu przeciwnym klasa 2
Wyrazy o znaczeniu przeciwnym klasa 2 Typ liryki
Typ liryki Budowa i funkcje łodygi
Budowa i funkcje łodygi Izydorczyk bernadetta
Izydorczyk bernadetta Wymiary boiska piłkarskiego
Wymiary boiska piłkarskiego Esej na temat
Esej na temat Homogenne zmesi
Homogenne zmesi Prawo rozcieńczeń ostwalda
Prawo rozcieńczeń ostwalda Ustalanie wzorów węglowodorów zadania
Ustalanie wzorów węglowodorów zadania 2-bromopropan + koh
2-bromopropan + koh Walidacja chemia
Walidacja chemia Hbr chemia
Hbr chemia Wielcy rewolucjoniści nauki chemia
Wielcy rewolucjoniści nauki chemia Bielkoviny test
Bielkoviny test Lipidy chemia
Lipidy chemia Dehydratacja alkoholi
Dehydratacja alkoholi Sztuczna krew chemia
Sztuczna krew chemia Dakujem za pozornost chemia
Dakujem za pozornost chemia Uam chemia plan
Uam chemia plan Autodysocjacja metanolu
Autodysocjacja metanolu Oblicz jaka objetosc etynu powstanie z 80
Oblicz jaka objetosc etynu powstanie z 80 Moc kwasów jak rośnie
Moc kwasów jak rośnie

















































