Ustalanie wzoru empirycznego i rzeczywistego zwizku chemicznego Zadania





















































- Slides: 58

Ustalanie wzoru empirycznego i rzeczywistego związku chemicznego Zadania z rozwiązaniami

Zadanie 1 v. W trakcie analizy chemicznej ustalono, że otrzymany z roztworu uwodniony chlorek baru zawiera 56, 15 % baru. v. Ustal wzór rzeczywisty hydratu. v. Analiza i założenia do zadania: Ø wzór empiryczny Ba. Cl 2 ∙ n H 2 O Ø m. Ba = 137 g w 1 molu hydratu Ø m. Cl = 2 mol ∙ 35, 5 g/mol = 71 g chloru w 1 molu hydratu

Zadanie 1 – rozwiązanie Ø obliczenie masy molowej hydratu chlorku baru w której bar stanowi 56, 15 % : ü 137 g Ba ------ 56, 15 % masy Ba. Cl 2 ∙ n H 2 O x ------ 100, 00 % x = 244 g / mol Ba. Cl 2 ∙ n H 2 O Ø obliczenie masy wody w 1 molu hydratu: ü m. H 2 O = MBa. Cl 2∙n. H 2 O – m. Ba – m. Cl = = 244 g/mol – 137 g – 71 g = 36 g Ø obliczenie liczby moli wody: Ø wzór rzeczywisty hydratu: Ba. Cl 2 ∙ 2 H 2 O

Zadanie 2 v Próbkę hydratu siarczanu(VI) magnezu o masie 2, 46 g rozpuszczono w wodzie i dodano w nadmiarze roztwór chlorku baru, otrzymany osad wysuszono oraz zważono, jego masa wyniosła 2, 33 g. v Ustal wzór rzeczywisty hydratu siarczanu(VI) magnezu. v Analiza i złożenia do zadania: Ø w zadaniu należy pominąć KSO, Ø Mg 2++SO 42 -+Ba 2++2 Cl-+n. H 2 O Ba. SO 4+Mg 2++2 Cl-+n. H 2 O, 1 mol(120 g) + 1 mol +n mol 1 mol(233 g) +1 mol+n mol, Ø MMg. SO 4 = 120 g/mol Ø MBa. SO 4 = 233 g/mol

Zadanie 2 - rozwiązanie Ø Obliczenie masy i moli bezwodnego siarczan(VI) magnezu w próbce: ü 120 g Mg. SO 4 ------ 233 g Ba. SO 4 x -----2, 33 g Ba. SO 4 x = 1, 2 g Mg. SO 4 Ø Obliczenie masy wody w próbce Mg. SO 4∙n. H 2 O ü m. H 2 O = m – m. Mg. SO 4 = 2, 46 g – 1, 2 g = 1, 26 g ü 0, 01 mol hydratu ----- 1, 26 g H 2 O 1, 00 mol hydratu ----- x x = 126 g H 2 O

Zadanie 2 – rozwiązanie / cd Ø obliczenie liczby moli / cząsteczek wody w 1 molu / cząsteczce hydratu siarczanu(VI) magnezu: Ø ustalenie wzoru rzeczywistego: ü Mg. SO 4 ∙ n H 2 O ü Mg. SO 4 ∙ 7 H 2 O

Zadanie 3 v Próbkę hydratu jodku baru o masie 10, 407 g ogrzewano do momentu całkowitego usunięcia wody, masa bezwodnej próbki wyniosła 9, 525 g. v Ustal wzór hydratu jodku baru. v Analiza i założenia do zadania: Ø Ba. I 2 ∙ n H 2 O Ba. I 2 + n H 2 O ü 1 mol(391 g + n ∙ 18 g) mol (391 g) + n ∙ 18 g Ø masa wody w ogrzewanej próbce hydratu: ü m. H 2 O= m. Ba. I 2∙n. H 2 O – m. Ba. I 2=10, 407 g – 9, 525 g = 0, 882 g

Zadanie 3 – rozwiązanie Ø obliczenie liczby moli Ba. I 2: Ø obliczenie masy i liczby cząsteczek wody w hydracie: ü 0, 02436 mol Ba. SO 4∙n. H 2 O ---- 0, 882 g H 2 O 1, 00000 mol Ba. SO 4∙n. H 2 O ---- x --------------------------x = 36, 2 g ≈ 36 g H 2 O Ø ustalenie wzoru rzeczywistego: ü Ba. I 2 ∙ n H 2 O ü Ba. I 2 ∙ 2 H 2 O

Zadanie 4 v Skład pierwiastkowy związku chemicznego jest następujący: sód – 14, 29%; siarka – 9, 94%; wodór – 6, 21%; tlen – 69, 56%. v Ustal wzór rzeczywisty hydratu: v Analiza i założenia do zadania: Ø wzór empiryczny: Nax. Sy. Oz ∙ n H 2 O / Nax. Sy. Oz. Ha Ø Założenie, że masa molowa / masa cząsteczkowa wynosi 100 g/mol / 100 u stąd: ü m. Na = 14, 29 g; ü m. S = 9, 94 g ü m. H = 6, 21 g ü m. O = 69, 56 g

Zadanie 4 – rozwiązanie Ø obliczenie liczby moli atomów Na, S, H i O w 1 molu hydratu: ü wszystkie ilości należy podzielić przez najmniejszy wspólny dzielnik, tj. 0, 31

Zadanie 4 – rozwiązanie / cd Ø ustalony wzór empiryczny: ü Na 2 S 1 O 14 H 20 Ø ustalenie wzoru rzeczywistego hydratu: ü w związku wodór wchodzi w skład tylko wody, stąd n = 10 H 2 O, natomiast pozostałe atomy O wchodzą w skład reszty kwasowej, z = 14 – 10 = 4 ü Na 2 SO 4 ∙ 10 H 2 O

Zadanie 5 v Wzory niektórych soli można formalnie przedstawić w postaci tlenkowej: Ca. Si. O 3 Ca. O ∙ Si. O 2. v Ustal wzór rzeczywisty soli i wzór „tlenkowej” soli o zawartości: Ca. O – 34, 56%; CO 2 – 54, 32%; H 2 O – 11, 12%. v Analiza i założenia do zadania: Ø wzór empiryczny: (Ca. O)x ∙ (CO 2)y ∙ (H 2 O)z Ø pozostałe założenia jak w zadaniu 4: ü przyjeta masa molowa związku 100 g / mol ü MCa. O = 56 g/mol; MCO 2 = 44 g/mol, MH 2 O = 18 g/mol

Zadanie 5 – rozwiązanie Ø obliczenie liczby moli / cząsteczek tlenków w związku: Ø wzór soli w postaci tlenkowej: Ca. O ∙ (CO 2)2 ∙ H 2 O Ø wzór rzeczywisty soli: Ca(HCO 3)2

Zadanie 6 v Mangan tworzy kilka różnych tlenków, których charakter chemiczny zmienia się wraz ze stopniem utlenienia manganu. v Ustal wzór rzeczywisty tlenku manganu w którym stosunek mas Mn : O wynosi w przybliżeniu 7 : 2, określ chemiczny tlenku. v Analiza i założenia do zadania: Ø należy przyjąć, że masa analizowanego tlenku manganu wynosi 100 u / 100 g/mol, Ø wzór empiryczny tlenku: Mnx. Oy

Zadanie 6 – rozwiązanie Ø obliczenie liczby at. Mn i O w tlenku: ü 7 ∙ x + 2 ∙ x = 100 u 9 x = 100 u x = 11, 11 u 1 : 1, 39 1 Ø wzór rzeczywisty tlenku: Mn. O Ø charakter chemiczny tlenku: zasadowy

Zadanie 7 v Mangan tworzy kilka różnych tlenków, których charakter chemiczny zmienia się wraz ze stopniem utlenienia manganu. v Ustal wzór rzeczywisty tlenku manganu w którym stosunek mas Mn : O wynosi w przybliżeniu 1 : 1, 02, określ chemiczny tlenku. v Analiza i założenia do zadania: Ø należy przyjąć, że masa analizowanego tlenku manganu wynosi 100 u / 100 g/mol, Ø wzór empiryczny tlenku: Mnx. Oy Ø w przypadku otrzymania wartości ułamkowej liczby atomów należy pomnożyć wszystkie wartości, tak aby otrzymać liczby całkowite: 0, 5 ∙ 2; 0, 33 ∙ 3; 0, 25 ∙ 4.

Zadanie 7 – rozwiązanie Ø obliczenie liczby at. Mn i O w tlenku: ü 1 ∙ x + 1, 02 ∙ x = 100 u 2, 02 x = 100 u x = 49, 5 u ü x=1 2 : 0, 9 ∙ 2 ü y = 3, 5 7 Ø wzór rzeczywisty tlenku: Mn 2 O 7 Ø charakter chemiczny tlenku: kwasowy

Zadanie 8 v Analiza pewnego związku organicznego wykazała, że na 2, 1 g węgla przypada 0, 35 g wodoru i 2, 8 g tlenu. Gęstość par tego związku względem wodoru wynosi 45. v Ustal wzór sumaryczny tego związku oraz wzory grupowe związków organicznych, które są wobec siebie izomerami funkcjonalnymi oraz podaj ich nazwy systematyczne. v Analiza i założenie do zadania: Ø wzór empiryczny związku: Cx. Hy. Oz Ø gęstość wodoru: Ø gęstość analizowanego związku: d = 45 ∙ d. H 2 = 45 ∙ 0, 0893 g/dm 3 ≈ 4, 0185 g/dm 3.

Zadanie 8 – rozwiązanie Ø ü ü obliczenie masy molowej związku organicznego: M = Vmol ∙ d = 22, 4 dm 3/mol ∙ 4, 0185 g/dm 3 = 90 g/mol obliczenie procentowego C, H i O w związku chemicznym: m = m. C + m. H + m. O = 2, 1 g + 0, 35 g + 2, 8 g = 5, 25 g ------ 100% 5, 2 g ------ 100% 2, 10 g C --- x 0, 35 g H --- x 2, 8 g O --- x x = 40 % C x = 6, 6 % H x = 53, 3 % O Ø obliczenie masy C, H i O w 1 molu związku: ü 90 g ------ 100% x ------ 40% C x ------ 6, 6% H x ------ 53, 3% O x ≈ 36 g C x≈6 g. H x ≈ 48 g O

Zadanie 8 – rozwiązanie / cd Ø obliczenie liczby moli atomów C, H i O w cząsteczce związku: Ø wzór sumaryczny związku: C 3 H 6 O 3

Zadanie 8 – rozwiązanie / cd Ø wzory grupowe izomerów funkcjonalnych i pozycyjnych związków o wzorze sumarycznym C 3 H 6 O 3 : ü HO-CH 2 - COOH kwas 3 -hydroksypropanowy / β-hydroksypropanowy, ü CH 3 -CH(OH)-COOH kwas 2 -hydroksypropanowy / α – hydroksypropanowy / kwas mlekowy, ü CH 2(OH)-CHO aldehyd glicerynowy / 2, 3 -dihydroksypropanal, ü HO-CH 2 -CO-CH 2 -OH keton: 1, 3 -dihydroksypropanon / aceton dihydroksylowy

Zadanie 9 v W pewnym alkoholu alifatycznym o masie molowej 62 g/mol stosunek masowy C : H : O wynosi 1, 2 : 0, 3 : 1, 6. v Oblicz i podaj, ile moli grup hydroksylowych zwiera 1 mol tego alkoholu, zapisz wzór grupowy tego alkoholu. v Analiza i założenia do zadania: Ø wzór empiryczny alkoholu: ü Cx. Hy. Oz, Ø na 62 g alkoholu przypada 3, 1 części masowych: ü 62 g = 1, 2 ∙ x + 0, 3 ∙ x + 1, 6 ∙ x = 3, 1 x

Zadanie 9 – rozwiązanie Ø obliczenie liczby atomów C, H i O w cząsteczce alkoholu: Ø wzór sumaryczny alkoholu: C 2 H 6 O 2, Ø wzór rzeczywisty alkoholu: HO-CH 2 -OH Ø alkohol alifatyczny dihydroksylowy.

Zadanie 10 v Analizowany węglowodór zawiera 82, 8 % węgla i 17, 2 % wodoru a jego gęstość par względem gęstości powietrza atmosferycznego wynosi 2, 0. v Podaj wzór sumaryczny i nazwy systematyczne izomerów tego węglowodoru. v Analiza i założenia do zadania: Ø powietrze atmosferyczne zawiera 80% części objętościowych / masowych azotu i 20% części tlenu. Ø masa molowa powietrza: ü M = 0, 8 ∙ 28 g/mol + 0, 2 ∙ 32 g/mol = 28, 8 g/mol Ø gęstość molowa powietrza:

Zadanie 10 - rozwiązanie Ø obliczenie gęstości węglowodoru: ü dw = 2 ∙ dp = 2 ∙ 1, 2857 g/dm 3 = 2, 57 g/dm 3, Ø obliczenie masy molowej węglowodoru: ü Mw = Vmol ∙ dw = 22, 4 dm 3/mol ∙ 2, 57 g/dm 3 ≈ 58 g/mol Ø obliczenie liczby atomów węgla i wodoru w cząsteczce o ogólnym wzorze Cx. Hy:

Zadanie 10 – rozwiązanie / cd Ø wzór sumaryczny węglowodoru: ü C 4 H 10 Ø izomery węglowodoru i ich nazwy systematyczne: ü CH 3 -CH 2 -CH 3 n-butan, ü CH 3 -CH-CH 3 | CH 3 izo-butan / metylopropan

Zadanie 11 v W pewnej temp. i pod pewnym ciśnieniem 0, 506 dm 3 gazu zwierającego 90, 32 % krzemu i 9, 68 % wodoru ma masę równą w przybliżeniu masie 1, 12 dm 3 azotu. v Oblicz i podaj wzór sumaryczny cząsteczki gazu. v Analiza i założenia do zadania: Ø mol dowolnego gazu w tych samych warunkach temp. i ciśnienia zajmuje identyczną objętość, stąd można rozpatrywać objętość w warunkach normalnych azotu i analizowanego gazu, Ø masa azotu zawarta w 1, 12 dm 3:

Zadanie 11 – rozwiązanie Ø obliczenie masy molowej analizowanego gazu: ü 0, 506 dm 3 ------- 1, 4 g 22, 400 dm 3/mol ------- x x = 62 g/mol = Msilanu Ø obliczenie liczby atomów krzemu i wodoru w gazie o wzorze ogólnym Six. Hy: Ø Wzór analizowanego gazu: Si 2 H 6

Zadanie 12 v Na całkowite wytrącenie kationów srebra w 15 cm 3 0, 1 molowego roztworu Ag. NO 3 zużyto 10 cm 3 0, 05 molowego roztworu soli chlorkowej. v Podaj ogólny wzór soli chlorkowej. v Analiza i założenia do zadania: Ø należy pominąć iloczyn rozpuszczalności Ag. Cl, Ø Ag+ + Cl- Ag. Cl ü 1 mol + 1 mol 1 mol Ø wzór empiryczny soli chlorkowej Me. Clx.

Zadanie 12 - rozwiązanie Ø obliczenie liczby moli kationów Ag+ w roztworze: ü 1000 cm 3 roztworu Ag. NO 3 ----- 0, 1 mol Ag+ 15 cm 3 roztworu Ag. NO 3 ----x x = 0, 0015 mol Ag+ Ø obliczenie liczby anionów Cl- w soli Me. Clx: ü 1000 cm 3 roztworu Me. Clx ----- x ∙ 0, 05 mol Cl 10 cm 3 roztworu Me. Clx ----- 0, 0015 mol Clx=3 Ø wzór ogólny soli chlorkowej: Me. Cl 3

Zadanie 13 v Do całkowitego spalenia próbki pewnego węglowodoru zużyto 112 cm 3 tlenu a otrzymany tlenek węgla(IV) przepuszczono przez płuczkę wapienną i otrzymano 0, 3 g osadu. v Wyznacz wzór elementarny węglowodoru. v Analiza i założenia do zadania: Ø mol dowolnego gazu w tych samych warunkach temp. i ciśnienia zajmuje identyczną objętość, stąd można rozpatrywać objętość w warunkach normalnych tlenu i analizowanego gazu Ø Ca(OH)2 + CO 2 Ca. CO 3 + H 2 O ü 1 mol + 1 mol (44 g) 1 mol (100 g) + 1 mol

Zadanie 13 - rozwiązanie Ø obliczenie masy węgla w próbce węglowodoru: ü 100, 0 g Ca. CO 3 ----- 12 g C 0, 3 g Ca. CO 3 ----- x x = 0, 036 g C = mc Ø obliczenie liczby gramów tlenu zużytego do utlenienia węgla i liczby gramów wodoru w próbce gazu: ü 22, 400 dm 3 O 2 ------ 32 g O 2 ü m. O 2 = 0, 16 g – 0, 096 g = 0, 112 dm 3 O 2 ----- x 0, 064 g tlenu zużytego do x = 0, 16 g O 2 spalenia wodoru ü 12, 000 g C ---- 32 g O 2 0, 036 g C ---- x x = 0, 096 g O 2 ü 2 g H 2 ------ 16, 000 g O 2 x ------- 0, 064 g O 2 x = 0, 008 g H 2 = m. H

Zadanie 13 – rozwiązanie / cd Ø obliczenie masy próbki analizowanego gazu: Ø m. C + m. H = 0, 036 g + 0, 008 g = 0, 044 g Ø obliczenie liczby atomów C i H w węglowodorze Cx. Hy: ü 0, 044 g -------- 100 % 0, 036 g C ---- x 0, 008 g H ---- x x = 81, 8 % C / 81, 8 g x = 18, 2 % H / 18, 2 g : 6, 82 ∙ 3 lub C : H = (0, 036 g : 12 g/mol) : (0, 008 g : 1 g/mol) = 3 : 8 Ø wzór sumaryczny węglowodoru: C 3 H 8

Zadanie 14 v W trakcie hydrolizy pewnego estru otrzymano monohydroksylowy nasycony alkohol o masie cząsteczkowej 46 u i nasycony monokarboksylowy kwas o masie cząsteczkowej 60 u. v Ustal wzór grupowy i nazwę analizowanego estru. v Analiza i założenia do zadania: O // Ø R – C – O – R + H 2 O R-COOH + R-OH Ø wzory ogólne produktów hydrolizy estru: ü Cn. H 2 n+1 - COOH; Cn. H 2 n+1 -OH

Zadanie 14 - rozwiązanie Ø ustalenie wzoru rzeczywistego monohydroksylowego alkoholu Cn. H 2 n+1 -OH o masie cząsteczkowej 46 u: ü n ∙ 12 u + (2 n + 1) ∙ 1 u + 16 u + 1 u = 46 u 14 n = 46 u – 18 u = 28 u, n = 2, CH 3 – CH 2 – OH Ø Ustalenie wzoru rzeczywistego monokarboksylowego kwasu Cn. H 2 n+1 -COOH o masie cząsteczkowej 60 u: ü n ∙ 12 u + (2 n + 1) ∙ 1 u + 12 u + 32 u + 1 u = 60 u 14 n = 60 u – 46 u = 14 u, n = 1, CH 3 – COOH Ø wzór grupowy estru – etanianu (octanu) etanolu: O // ü CH 3 – C – O – CH 2 – CH 3

Zadanie 15 v W wyniku spalenia całkowitego 1 mola pewnego węglowodoru otrzymano 4 mole wody a całkowite zużycie tlenu wyniosło 7 moli. v Ustal grupy do jakich może należeć analizowany węglowodór, zapisz wszystkie możliwe wzory grupowe izomerów i nadaj im nazwy systematyczne. v Analiza i założenia do zadania: Ø ogólny wzór węglowodoru: Cx. Hy Ø 4 mole wody 4 mole H 2 i 2 mole O 2, y = 8, Ø pozostałe ilości moli tlenu: 7 mol – 2 mole = 5 moli, Ø 1 mol O 2 1 mol CO 2, 5 mol O 2 5 mol CO 2: x = 5.

Zadanie 15 – rozwiązanie Ø wzór ogólny węglowodoru: C 5 H 8 Ø grupa węglowodorów: alkiny (Cn. H 2 n-2): ü 1 CH≡C-CH -CH pent-1 -yn 2 2 3 ü CH 3 -2 C≡C-CH 2 -CH 3 / pent-2 -yn ü CH≡C-3 CH-CH 3 / 3 -metylobut-1 -yn | CH 3

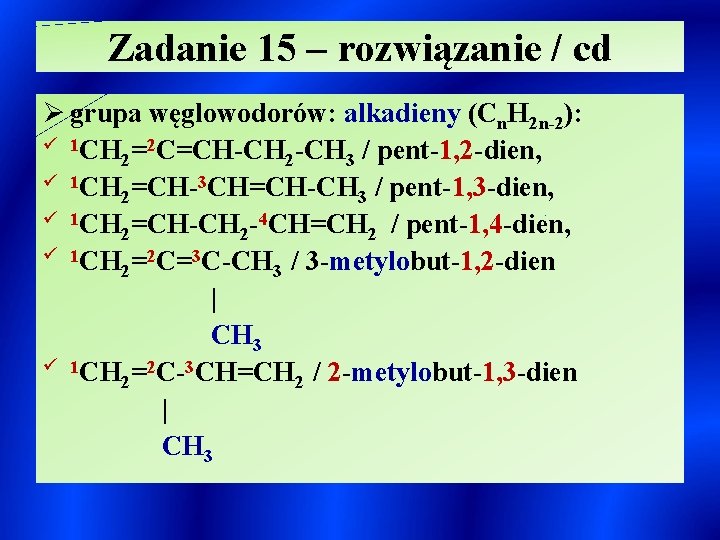
Zadanie 15 – rozwiązanie / cd Ø grupa węglowodorów: alkadieny (Cn. H 2 n-2): ü 1 CH =2 C=CH-CH / pent-1, 2 -dien, 2 2 3 ü 1 CH =CH-3 CH=CH-CH / pent-1, 3 -dien, 2 3 ü 1 CH =CH-CH -4 CH=CH / pent-1, 4 -dien, 2 2 2 ü 1 CH =2 C=3 C-CH / 3 -metylobut-1, 2 -dien 2 3 | CH 3 ü 1 CH =2 C-3 CH=CH / 2 -metylobut-1, 3 -dien 2 2 | CH 3

Zadanie 15 – rozwiązanie / cd Ø grupa węglowodorów: cykloalkeny (Cn. H 2 n-2): 1 CH ü HC cyklopenten H 2 C CH H 3 C CH 2 H 2 C CH 2 H 3 C 3 -metylocykolbuten ü H 3 C 1 C CH H 3 C CH 3 CH 2 3 C 1 CH H C 2 C 1 C CH H 2 C CH 2 H 2 C 3 3 1 -metylocyklobuten 3, 3 -dimetylocyklopropen 1, 2 -dimetylocyklopropen

Zadanie 16 v Spalono 20 cm 3 pewnego gazowego węglowodoru, zużywając 10 cm 3 tlenu. Po skropleniu wody pozostało 100 cm 3 gazu, którego objętość po przepuszczeniu przez wodny roztwór Na. OH nie uległa zmianie. Objętości gazów mierzono w tych samych warunkach ciśnienia i temperatury. v Ustal i podaj wzory grupowe izomerów spalonego węglowodoru. v Analiza i założenia do zadania: Ø produktami spalania są H 2 O i CO, Ø mol dowolnego gazu w tych samych warunkach temp. i ciśnienia zajmuje identyczną objętość, stąd można rozpatrywać objętość w warunkach normalnych tlenu, tlenku węgla(II) i analizowanego gazu.

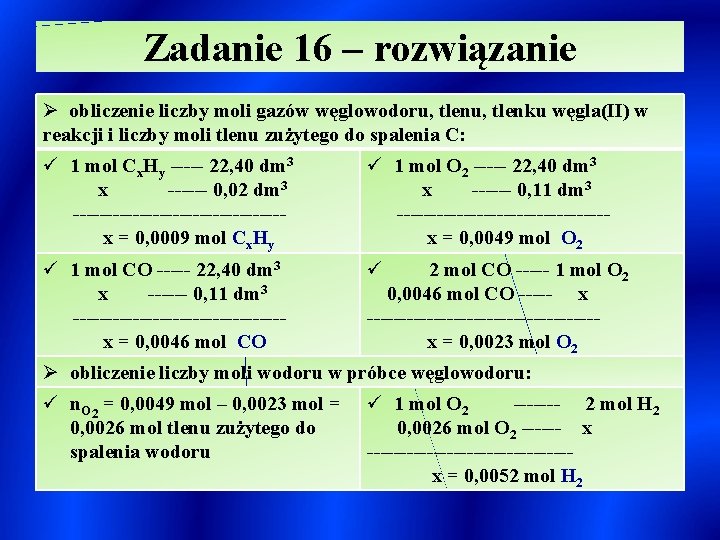
Zadanie 16 – rozwiązanie Ø obliczenie liczby moli gazów węglowodoru, tlenku węgla(II) w reakcji i liczby moli tlenu zużytego do spalenia C: ü 1 mol Cx. Hy ----- 22, 40 dm 3 x ------ 0, 02 dm 3 ----------------x = 0, 0009 mol Cx. Hy ü 1 mol O 2 ----- 22, 40 dm 3 x ------ 0, 11 dm 3 ----------------x = 0, 0049 mol O 2 ü 1 mol CO ----- 22, 40 dm 3 x ------ 0, 11 dm 3 ----------------x = 0, 0046 mol CO ü 2 mol CO ----- 1 mol O 2 0, 0046 mol CO ----- x -----------------x = 0, 0023 mol O 2 Ø obliczenie liczby moli wodoru w próbce węglowodoru: ü n. O 2 = 0, 0049 mol – 0, 0023 mol = 0, 0026 mol tlenu zużytego do spalenia wodoru ü 1 mol O 2 ------- 2 mol H 2 0, 0026 mol O 2 ------ x ---------------x = 0, 0052 mol H 2

Zadanie 16 – rozwiązanie / cd Ø obliczenie liczby atomów C i H w analizowanym węglowodorze: Ø wzór sumaryczny analizowanego węglowodoru: ü C 5 H 12 Ø wzory grupowe izomerów węglowodorów: ü CH 3 – CH 2 – CH 3 / n-pentan

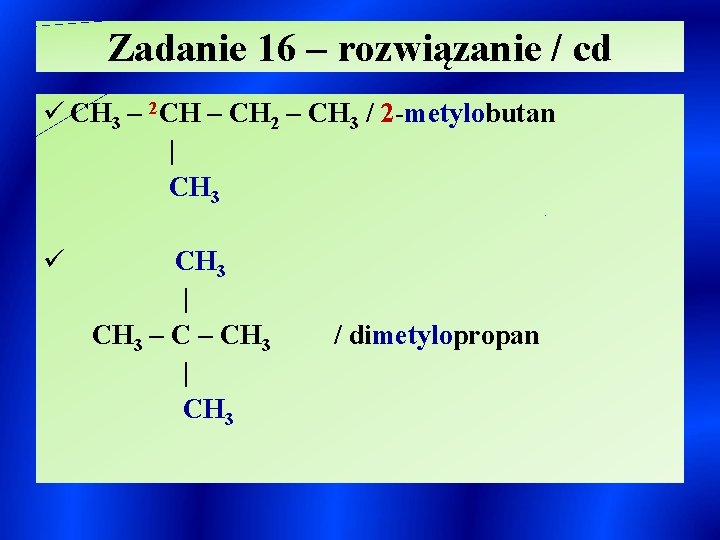
Zadanie 16 – rozwiązanie / cd ü CH 3 – 2 CH – CH 2 – CH 3 / 2 -metylobutan | CH 3 ü CH 3 | CH 3 – CH 3 | CH 3 / dimetylopropan

Zadanie 17 v Zmieszano 20 cm 3 pewnego gazowego węglowodoru ze 120 cm 3 tlenu i mieszaninę zapalono. Po zakończeniu spalania wodę skroplono a produkty gazowe o objętości 80 cm 3 przepuszczono przez płuczkę z wodnym roztworem Na. OH i ich objętość zmniejszyła się do 20 cm 3 (wszystkie objętości gazów mierzono w tych samych warunkach temperatury i ciśnienia) v Ustal i podaj wzory grupowe możliwych izomerów analizowanego węglowodoru, podaj nazwy związków otrzymanych w reakcji chlorowania tych izomerów, zapisz wzory grupowe produktów reakcji izomerów z sodem w podwyższonej temp.

Zadanie 17 / cd v Analiza i założenia do zadania: Ø mol dowolnego gazu w tych samych warunkach temp. i ciśnienia zajmuje identyczną objętość, stąd można rozpatrywać objętość w warunkach normalnych tlenu, tlenku węgla(II), tlenku węgla(IV) i analizowanego gazu, Ø produktami gazowymi są tlenki węgla II i węgla IV, z 80 cm 3 produktów gazowych: ü VCO 2 = 60 cm 3, VCO = 20 cm 3. Ø chlorowanie przebiega w obecności uv/temp. zgodnie z regułą Zajcewa, Ø reakcje monochloropochodnych węglowodorów z sodem / reakcje Würtza są reakcjami alkilowania.

Zadanie 17 – rozwiązanie Ø obliczenie liczby moli gazów: węglowodoru – Cx. Hy, CO 2 i O 2 : ü 1 mol Cx. Hy ----- 22, 40 dm 3 ü 1 mol O 2 ----- 22, 40 dm 3 x ------ 0, 02 dm 3 x ------ 0, 12 dm 3 -------------------------------x ≈ 0, 0009 mol Cx. Hy x ≈ 0, 00536 mol O 2 ü 1 mol CO 2 ----- 22, 40 dm 3 x ------ 0, 06 dm 3 ----------------x ≈ 0, 0027 mol CO 2 ü 1 mol CO ----- 22, 40 dm 3 x ------ 0, 02 dm 3 ----------------x ≈ 0, 0009 mol CO

Zadanie 17 – rozwiązanie / cd Ø obliczenie liczby moli tlenu do spalenia węglowodoru do H 2 O, CO 2: ü 1 mol O 2 ----- 1 mol CO 2 ü 1 mol O 2 ----- 2 mol CO x ------ 0, 0027 mol x ------ 0, 0009 mol -------------------------------x ≈ 0, 0027 mol O 2 x ≈ 0, 00045 mol O 2 Ø liczba moli tlenu zużytego do spalenia wodoru: ü n = 0, 00536 mol – 0, 0027 mol – 0, 00045 mol ≈ 0, 0022 mol Ø obliczenie moli wodoru w próbce węglowodoru: ü 2 mol H 2 ---- 1 mol O 2 x ---- 0, 00221 mol O 2 -----------------------x = 0, 0044 mol H 2

Zadanie 17 – rozwiązanie / cd Ø obliczenie liczby atomów węgla i wodoru w cząsteczce analizowanego węglowodoru Cx. Hy: Ø Wzór sumaryczny węglowodoru: ü C 4 H 10

Zadanie 17 rozwiązanie / cd Ø izomery butanu: ü CH 3 – CH 2 – CH 3 / n – butan, ü CH 3 – CH 3 / metylopropan | CH 3 Ø monochloropochodne butanu: ü 1 CH – CH / 1 -chlorobutan, 2 2 2 3 | Cl ü CH 3 – 2 CH – CH 2 – CH 3 / 2 -chlorobutan | Cl

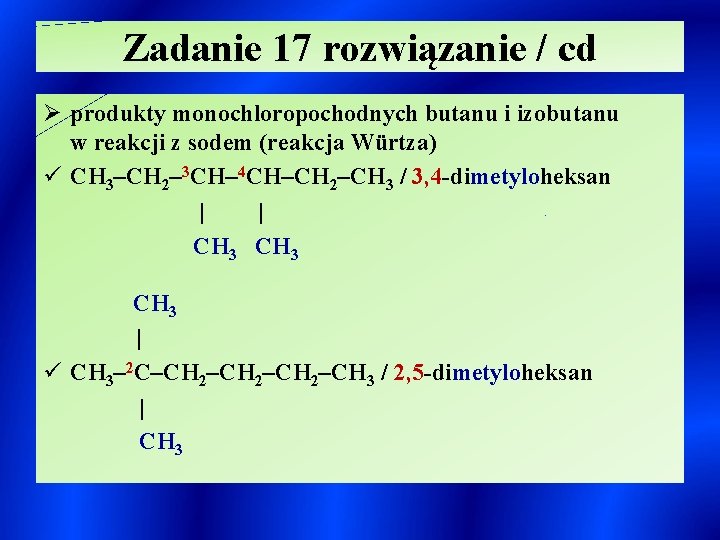
Zadanie 17 rozwiązanie / cd Ø produkty monochloropochodnych butanu i izobutanu w reakcji z sodem (reakcja Würtza) ü CH 3–CH 2– 3 CH– 4 CH–CH 2–CH 3 / 3, 4 -dimetyloheksan | | CH 3 | ü CH 3– 2 C–CH 2–CH 3 / 2, 5 -dimetyloheksan | CH 3

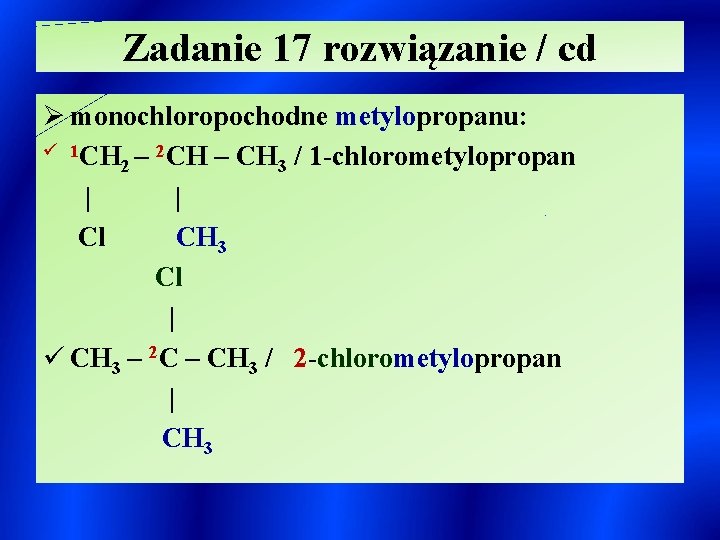
Zadanie 17 rozwiązanie / cd Ø monochloropochodne metylopropanu: ü 1 CH – 2 CH – CH / 1 -chlorometylopropan 2 3 | | Cl CH 3 Cl | ü CH 3 – 2 C – CH 3 / 2 -chlorometylopropan | CH 3

Zadanie 17 rozwiązanie / cd Ø produkty monochloropochodnych butanu i izobutanu w reakcji z sodem (reakcja Würtza) ü CH 3–CH 2–CH 2–CH 3 / n-oktan ü CH 3– 2 CH–CH 2–CH 3 / 2 -metyloheptan | CH 3 ü CH 3– 2 CH–CH 2– 4 CH–CH 2–CH 3 / 2, 4 -dimetyloheksan | | CH 3 ü CH 3– 2 CH–CH 2– 5 CH–CH 3 / 2, 5 -dimetyloheksan | | CH 3

Zadanie 17 rozwiązanie / cd Ø produkty monochloropochodnych butanu i izobutanu w reakcji z sodem (reakcja Würtza) CH 3 | ü CH 3– 2 C – 3 CH–CH 2–CH 3 / 2, 2, 5 -trimetylopentan | | CH 3 | | ü CH 3– 2 C – 3 C–CH 3 / 2, 2, 3, 3 -tetrametylobutan | | CH 3

Zadanie 18 v Zmieszano 20 cm 3 pewnego gazowego węglowodoru ze 150 cm 3 tlenu i mieszaninę zapalono. Po zakończeniu całkowitego spalania wodę skroplono a produkty gazowe o objętości 100 cm 3 przepuszczono przez płuczkę z wodnym roztworem Na. OH i ich objętość zmniejszyła się do 20 cm 3 (wszystkie objętości gazów mierzono w tych samych warunkach temperatury i ciśnienia) v Ustal i podaj wzory grupowe możliwych izomerów analizowanego węglowodoru jeżeli izomery tego węglowodoru ulegają reakcji substytucji – halogenowania dając monohalogenowęglowodory alifatyczne nasycone.

Zadanie 18 / cd v Analiza i założenia do zadania: Ø mol dowolnego gazu w tych samych warunkach temp. i ciśnienia zajmuje identyczną objętość, stąd można rozpatrywać objętość w warunkach normalnych tlenu, tlenku węgla(II), tlenku węgla(IV) i analizowanego gazu, Ø produktami gazowymi jest tlenek węgla IV, z 100 cm 3 produktów gazowych: ü VCO 2 = 80 cm 3, VO 2 = 20 cm 3 - użyty w nadmiarze, Ø analizowanym jest węglowodór nasycony o wzorze ogólnym Cn. H 2 n+2, wynika to z reakcji substytucji, której ulega ten związek (w określnych warunkach substytucji mogą ulec również węglowodory nienasycone).

Zadanie 18 - rozwiązanie / cd Ø obliczenie liczby moli węglowodoru Cn. H 2 n+2, CO 2, ü 1 mol ----- 22, 4 dm 3 Cn. H 2 n+2 ü 1 mol ----- 22, 4 dm 3 CO 2 x ----- 0, 02 dm 3 x ----- 0, 08 dm 3 -------------------n. Cn. H 2 n+2 = x = 0, 00089 mol n. CO 2 = x = 0, 00357 mol Ø obliczenie liczby atomów węgla w węglowodorze Cn. H 2 n+2 Ø wzór sumaryczny analizowanego węglowodoru: ü C 4 H 10

Zadanie 18 - rozwiązanie / cd Ø sprawdzenie założenia o całkowitym spaleniu węglowodoru i użyciu tlenu w nadmiarze: ü 1 mol C ------- 22, 4 dm 3 O 2 0, 00357 mol C ----x -------------------x = 0, 07997 dm 3 ≈ 80 cm 3 O 2 ü 2 mole H 2 ---- 22, 4 dm 3 O 2 0, 0089 mol H : 2 ---- x --------------------x = 0, 4984 dm 3 ≈ 50 cm 3 O 2 Ø obliczenie objętości nadmiaru tlenu: ü VO 2 = 150 cm 3 – 80 cm 3 – 50 cm 3 = 20 cm 3

Zadanie 18 - rozwiązanie c/d Ø izomery konstytucyjne – szkieletowe butanu: ü CH 3 – CH 2 – CH 3 n – butan, ü CH 3 – CH 3 | CH 3 ü izobutan / metylopropan
 Wzory rzeczywiste i empiryczne
Wzory rzeczywiste i empiryczne Cd dla chemika
Cd dla chemika Schemat zastępczy kondensatora rzeczywistego
Schemat zastępczy kondensatora rzeczywistego Ustalanie wzorów sumarycznych
Ustalanie wzorów sumarycznych Ustalanie wyniku finansowego
Ustalanie wyniku finansowego 4 4 dietylo 5 propylononan
4 4 dietylo 5 propylononan Izomeria konstytucyjna alkanów
Izomeria konstytucyjna alkanów Oblicz według wzoru a) pierwiastek 49
Oblicz według wzoru a) pierwiastek 49 Pole trapezu wzór
Pole trapezu wzór Wyrazy pochodne od słowa żagiel
Wyrazy pochodne od słowa żagiel Kongruencja
Kongruencja Twierdzenie talesa zadania
Twierdzenie talesa zadania Zadania strażaków w zastępie
Zadania strażaków w zastępie Wielkości fizyczne jednostki pomiary
Wielkości fizyczne jednostki pomiary Kinematyka wzory
Kinematyka wzory Cerometria
Cerometria Onz tomaszewska
Onz tomaszewska Wartość energetyczna pożywienia
Wartość energetyczna pożywienia Niepewność typu a excel
Niepewność typu a excel Iloczyn rozpuszczalności zadania z rozwiązaniami
Iloczyn rozpuszczalności zadania z rozwiązaniami Elektrochemia zadania z rozwiązaniami
Elektrochemia zadania z rozwiązaniami Zadania na podchody
Zadania na podchody Zadania własne gminy
Zadania własne gminy Twierdzenie pitagorasa zadania gimnazjum
Twierdzenie pitagorasa zadania gimnazjum Eoq zadania
Eoq zadania Moment dipolowy zadania
Moment dipolowy zadania Zadania gimnastyki wyrównawczej
Zadania gimnastyki wyrównawczej Zadania na dowodzenie klasa 8
Zadania na dowodzenie klasa 8 Kalkulacja doliczeniowa asortymentowa
Kalkulacja doliczeniowa asortymentowa Maszyny proste w życiu codziennym
Maszyny proste w życiu codziennym Cele i zadania gimnastyki korekcyjnej
Cele i zadania gimnastyki korekcyjnej Termochemia priklady
Termochemia priklady Zadania strażaków w zastępie
Zadania strażaków w zastępie Alkacymetria zadania
Alkacymetria zadania Równaniem pierwszego stopnia z jedną niewiadomą jest
Równaniem pierwszego stopnia z jedną niewiadomą jest Wielkości odwrotnie proporcjonalne przykłady
Wielkości odwrotnie proporcjonalne przykłady Woda i roztwory wodne test
Woda i roztwory wodne test Wzór na pole powierzchni modułu magazynowego
Wzór na pole powierzchni modułu magazynowego żądania konrada
żądania konrada Deindywiduacja
Deindywiduacja Zadania kas
Zadania kas Solver zadania z rozwiązaniami
Solver zadania z rozwiązaniami Rozwiąż
Rozwiąż Otrzymywanie soli cwiczenia
Otrzymywanie soli cwiczenia Wzór na stożek
Wzór na stożek Maszyny proste wzory
Maszyny proste wzory Prawo hooke'a zadania
Prawo hooke'a zadania Paulina wróbel psycholog
Paulina wróbel psycholog Cele i zadania przedszkola
Cele i zadania przedszkola Moc fizyka
Moc fizyka Jakub maj
Jakub maj Zmieszano 1 5 mola gazowego fluorowca z 3 molami wodoru
Zmieszano 1 5 mola gazowego fluorowca z 3 molami wodoru Dla dowolnej liczby rzeczywistej x wyrażenie x20
Dla dowolnej liczby rzeczywistej x wyrażenie x20 Rozwiąż
Rozwiąż Podział logiczny wyczerpujący przykład
Podział logiczny wyczerpujący przykład Zadania zamknięte przykłady
Zadania zamknięte przykłady Elektrochemia zadania z rozwiązaniami
Elektrochemia zadania z rozwiązaniami Redukcja ketonu do alkoholu
Redukcja ketonu do alkoholu Zadania systemu wykrywania skażeń i alarmowania
Zadania systemu wykrywania skażeń i alarmowania