Kwasy nieorganiczne Podzia kwasw Rozkad mocy kwasw Otrzymywanie












- Slides: 14

Kwasy nieorganiczne -Podział kwasów - Rozkład mocy kwasów -Otrzymywanie kwasów

Kwasy nieorganiczne • Wiadomości ogólne: substancje stałe lub ciekłe, w cząsteczkach których atomem centralnym jest najczęściej atom niemetalu, ale może być to atom półmetalu lub metalu • Klasyfikacja kwasów oparta jest na obecności w ich cząsteczkach tlenu, czyli ugrupowania atomów E – O - H

Podział kwasów ze względu na obecność tlenu w cząsteczce Kwasy beztlenowe Kwasy tlenowe HCN, HN 3, H 2 Se, H 2 Te, H 2 F 2 (HF), HCl, HBr, HI H 3 BO 3, H 2 CO 3, HNO 2, HNO 3, H 3 PO 4, H 2 SO 4, HCl. O 4 HN 3 – kwas azotowodorowy, jest kwasem wyjątkowym, słaby, jest lotna cieczą, toksyczną o nieprzyjemnym zapachu, łatwo ulega wybuchowemu rozkładowi, jego sole to azydki. Azydki litowców i berylowców są związkami jonowymi (N 3 -), azydki rtęci, ołowiu i srebra wybuchają w skutek uderzenia. H 3 PO 3 – kwas fosforowy(III) jest kwasem dwuprotonowym, jeden z atomów wodoru jest związany bezpośrednio z atomem centralnym (P) O–H / O=P–H O–H

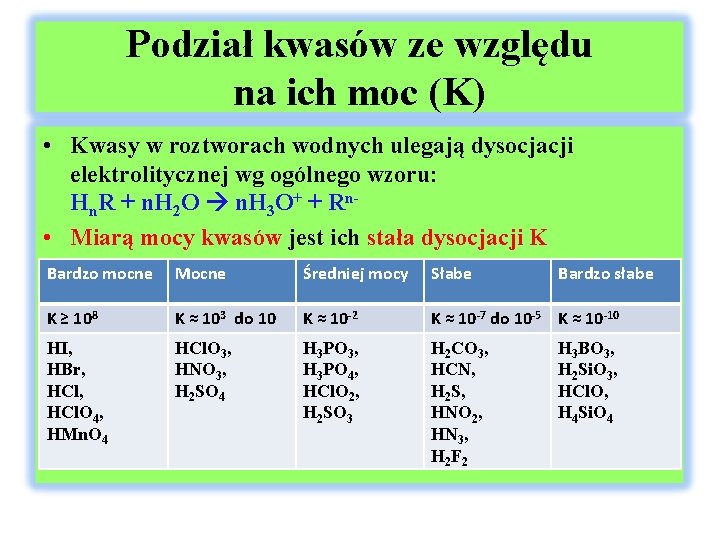
Podział kwasów ze względu na ich moc (K) • Kwasy w roztworach wodnych ulegają dysocjacji elektrolitycznej wg ogólnego wzoru: Hn. R + n. H 2 O n. H 3 O+ + Rn • Miarą mocy kwasów jest ich stała dysocjacji K • Bardzo mocne Mocne Średniej mocy Słabe K ≥ 108 K ≈ 103 do 10 K ≈ 10 -2 K ≈ 10 -7 do 10 -5 K ≈ 10 -10 HI, HBr, HCl. O 4, HMn. O 4 HCl. O 3, HNO 3, H 2 SO 4 H 3 PO 3, H 3 PO 4, HCl. O 2, H 2 SO 3 H 2 CO 3, HCN, H 2 S, HNO 2, HN 3, H 2 F 2 Bardzo słabe H 3 BO 3, H 2 Si. O 3, HCl. O, H 4 Si. O 4

Rozkład mocy kwasów beztlenowych • Moc kwasów beztlenowych w grupie: wzrasta wraz ze wzrostem liczby atomowej Z (ze spadkiem elektroujemności pierwiastka), ponieważ wzrasta promień jonowy, rośnie długość wiązania E –H a zmniejsza się jego trwałość a tym samym zmniejsza się trwałość cząsteczki: HF < HCl < HBr < HI H 2 O < H 2 Se < He 2 Te • Moc kwasów beztlenowych w okresie: wzrasta wraz ze wzrostem liczby atomowej Z (ze wzrostem elektroujemności pierwiastka): H 2 S < HCl H 2 Se < HBr H 2 Te < HI

Rozkład mocy kwasów tlenowych • Wzór ogólny kwasów tlenowych: Hn. EO(n+m) lub EOm(OH)n • O mocy kwasu decyduje stopień polarności wiązania O – H w ugrupowaniu E – O – H, stopień polarności zależy od elektroujemności atomu centralnego, im większa polaryzacja wiązana E – O, tym silniejsza polaryzacja wiązania O – H (efekt indukcyjności) i tym samym zmniejszenie trwałości wiązania O – H

• Moc kwasów o identycznych wartościach n i m w danej grupie maleje wraz ze wzrostem liczby atomowej Z (wraz ze spadkiem elektroujemności atomu centralnego), np. : H 2 EO 3 [EO(OH)2]; n = 2, m = 1 H 2 Te(2, 1)O 3 < H 2 Se(2, 4)O 3 < H 2 S(2, 5)O 3 HEO [EO(OH)]; n = 1, m = 0 HI(2, 5)O < HBr(2, 8)O < HCl(3, 0)O • Moc kwasów o identycznych wartościach n i m w różnych grupach rośnie wraz ze wzrostem liczby atomowej Z, np. : H 2 C(2, 5) O 3 < H 2 S(2, 5)O 3 HN(3, 0)O 2 < HCl(3, 0)O 2

Rozkład mocy kwasów tlenowych - cd • Moc kwasów tlenowych danego pierwiastka: wzrasta wraz ze wzrostem wartości m, czyli liczby atomów tlenu w cząsteczce kwasu niezwiązanych z atomami wodoru (wraz wzrostem stopnia utlenienia atomu centralnego) H 2 SO 3 < H 2 SO 4 HNO 2 < HNO 3 HCl. O < HCl. O 2 < HCl. O 3 < HCl. O 4

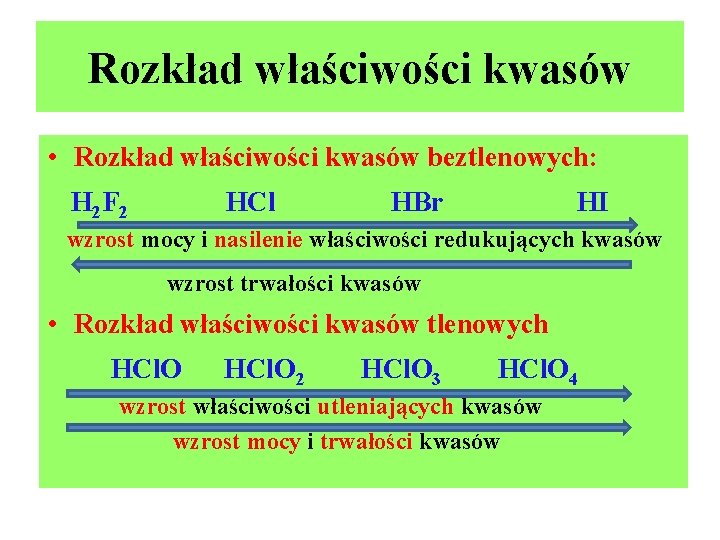
Rozkład właściwości kwasów • Rozkład właściwości kwasów beztlenowych: H 2 F 2 HCl HBr HI wzrost mocy i nasilenie właściwości redukujących kwasów wzrost trwałości kwasów • Rozkład właściwości kwasów tlenowych HCl. O 2 HCl. O 3 HCl. O 4 wzrost właściwości utleniających kwasów wzrost mocy i trwałości kwasów

Dysocjacja elektrolityczna kwasów wieloprotonowych (wielowodorowych) • Kwasy wieloprotonowe dysocjują stopniowo: kationy wodorowe powstałe w I etapie dysocjacji, zgodnie z regułą przekory zmniejszają ilość kationów powstających w kolejnych etapach dysocjacji, w związku z tym o mocy kwasu w zasadzie decyduje pierwszy stopień dysocjacji: np. H 3 PO 4 I etap: H 3 PO 4 + H 2 O H 3 O+ + H 2 PO 4 II etap: H 2 PO 4 - + H 2 O H 3 O+ + HPO 42 III etap: HPO 4 - + H 2 O H 3 O+ + PO 43 • Stężenie jonów kwasu ortofosforowego w roztworze: H 3 O+ > H 2 PO 4 - > HPO 42 - > PO 43 -

Otrzymywanie kwasów • Kwasy beztlenowe: rozpuszczanie w wodzie wodorków kwasowych HCl(g) + H 2 O(c) H 3 O+(c) + Cl-(c) Kwasy tlenowe: rozpuszczanie w wodzie tlenków kwasowych P 4 O 10 + 6 H 2 O 4 H 3 PO 4 As 2 O 5 + 3 H 2 O 2 H 3 As. O 4 Mn 2 O 7 + H 2 O 2 HMn. O 4 SO 2 + H 2 O H 2 SO 3

Otrzymywanie kwasów - cd • Otrzymywanie kwasów tlenowych cd: N 2 O 3 + H 2 O 2 HNO 2 N 2 O 4 + H 2 O HNO 2 + HNO 3 N 2 O 5 + H 2 O 2 HNO 3 • Rozpuszczanie tlenków kwasowych w kwasie [tlenek siarki(VI) bardzo trudno rozpuszcza się w wodzie, ale bardzo dobrze rozpuszcza się w kwasie siarkowym(VI)] SO 3 + H 2 SO 4 H 2 S 2 O 7 rozcieńczanie w wodzie kwasu pirosiarkowego(VI) H 2 S 2 O 7 + H 2 O 2 H 2 SO 4

Otrzymywanie kwasów - cd • Kwasy słabe, lotne lub trudno rozpuszczalne w wodzie otrzymuje się w reakcjach wymiany: Na 2 Si. O 3(aq) + H 2 SO 4(aq) Na 2 SO 4(aq) + H 2 Si. O 3(s) Na. NO 2(aq) + HCl(aq) Na. Cl(aq) + HNO 2(aq) 2 KCN(aq) + H 2 SO 4(aq) HCN(g) + K 2 SO 4(aq) HCN(g) + H 2 O(c) H 3 O+(aq) + CN-(aq)

Rozkład kwasów tlenowych • Przez podniesienie temperatury: 2 H 3 BO 3 B 2 O 3 + 3 H 2 O • Pod wpływem promieniowana uv: 4 HNO 3 O 2 + 4 NO 2 + 2 H 2 O 2 HCl. O 2 HCl + O 2 • W reakcji z innymi związkami: 12 HCl. O 4 + P 4 O 10 4 H 3 PO 4 + 6 Cl 2 O 7
 Nieelektrolity
Nieelektrolity Rozkad jazdy mpk
Rozkad jazdy mpk Rozkad jazdy mpk
Rozkad jazdy mpk Rozkad jazdy
Rozkad jazdy Mocne kwasy
Mocne kwasy Tabela mocy kwasów
Tabela mocy kwasów Zmiana przydziału mocy
Zmiana przydziału mocy Wzmacniacz mocy schemat
Wzmacniacz mocy schemat Wypowiedzenie umowy o pracę na mocy porozumienia stron
Wypowiedzenie umowy o pracę na mocy porozumienia stron Uwielbiamy cię wychwalamy cię miłosierny boże
Uwielbiamy cię wychwalamy cię miłosierny boże Wypowiedzenie umowy o pracę na mocy porozumienia stron
Wypowiedzenie umowy o pracę na mocy porozumienia stron Każdy spragniony i słaby dziś
Każdy spragniony i słaby dziś Aldehydy ketony kwasy karboksylowe
Aldehydy ketony kwasy karboksylowe Otrzymywanie kwasów
Otrzymywanie kwasów Uczeń wlał do cylindra miarowego
Uczeń wlał do cylindra miarowego


























