Kwasy i zasady Kwasy i zasady wg Arrheniusa








- Slides: 11

Kwasy i zasady - Kwasy i zasady wg Arrheniusa - Kwasy i zasady wg teorii protonowej Brőnsteda i Lowry`ego - Kwasy i zasady wg teorii elektronowej Lewisa

Podstawowe pojęcia v Dysocjacja jonowa – rozpad elektrolitu na jony (dodatnie – kationy, ujemne – aniony) pod wpływem wody lub innych rozpuszczalników polarnych v Elektrolity – to związki, które po rozpuszczeniu w wodzie lub w innych rozpuszczalnikach polarnych oraz w stanie stopionym przewodzą prąd elektryczny v Nieelektrolity – to związki, które nie ulegają dysocjacji jonowej v Suma ładunków dodatnich na kationach w roztworze jest równa sumie ładunków ujemnych na anionach

Kwasy i zasady wg Arrheniusa v Kwasy – eletrolity, które ulegają całkowitej lub częściowej dysocjacji na kation(y) wodoru i anion reszty kwasowej: H n. R n H 2 O n H 3 O + Rn- v Kwasy wieloprotonowe (wielowodorowe) ulegają dysocjacji stopniowo, np. H 3 PO 4 dysocjuje trójstopniowo: Ø I stopień: + - H 3 PO 4 Ø II stopień: Ø III stopień: H 2 PO 4 2 HPO 4 H 2 O H 3 O H 2 PO 4 H PO 42 - + H 3 O + PO 4 3 -

Kwasy i zasady wg Arrheniusa v Zasady – wodorotlenki, które ulegają całkowitej lub częściowej dysocjacji na kation metalu i anion(y) wodorotlenowe (wodorotlenkowe) H 2 O Me(OH)m Me m+ m OH - v Wodorotlenki wielowodorotlenowe dysocjują wielostopniowo, np. Ca(OH)2 dysocjuje dwustopniowo: Ø I stopień: Ca(OH) H 2 O + - Ca. OH 2 Ø II stopień: Ca. OH + H 2 O Ca 2+ OH OH -

Kwasy i zasady wg Arrheniusa v Sole – elektrolity, które dysocjują całkowicie na kation(y) metalu(i) (wyjątek + NH 4 - kation amonowy) i anion(y) reszty kwasowej Men. Rm Al 2(SO 4)3 H 2 O n Mem+ 2 Al 3+ m Rn 3 SO 42 -

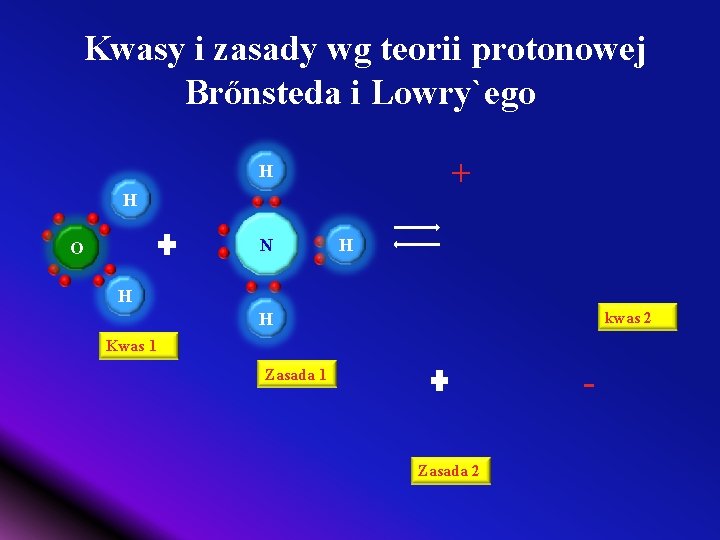
Kwasy i zasady wg teorii protonowej Brőnsteda i Lowry`ego + H Br H Kwas 1 O H Zasada 1 kwas 2 Zasada 2

Kwasy i zasady wg teorii protonowej Brőnsteda i Lowry`ego v Kwas – związek chemiczny lub jon zdolny do oddania protonów (kationu wodorowego) – protonodonor (protonodawca) HBr(g) kwas 1 H 2 O(c) zasada 1 H 3 O(c) kwas 2 zasada 1 sprzężona z kwasem 2 kwas 1 sprzężony z zasadą 2 + Br(c)zasada 2

Kwasy i zasady wg teorii protonowej Brőnsteda i Lowry`ego + H H N O H H H kwas 2 Kwas 1 - Zasada 1 Zasada 2

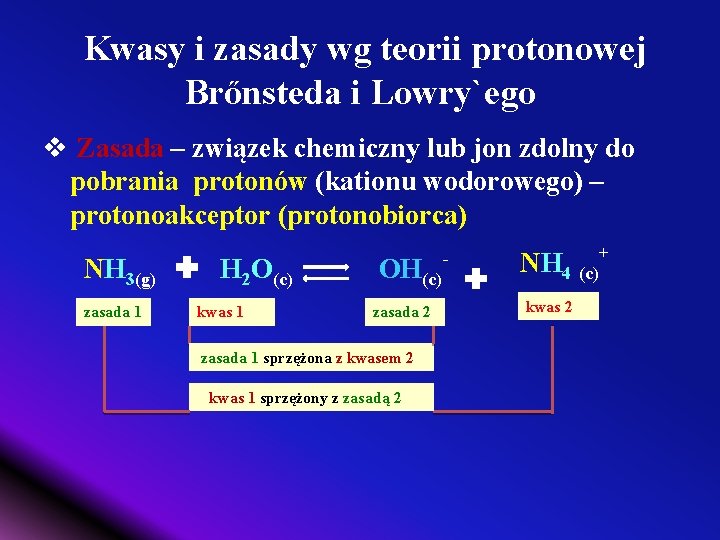
Kwasy i zasady wg teorii protonowej Brőnsteda i Lowry`ego v Zasada – związek chemiczny lub jon zdolny do pobrania protonów (kationu wodorowego) – protonoakceptor (protonobiorca) NH 3(g) zasada 1 H 2 O(c) kwas 1 OH(c) zasada 2 zasada 1 sprzężona z kwasem 2 kwas 1 sprzężony z zasadą 2 - NH 4 (c) kwas 2 +

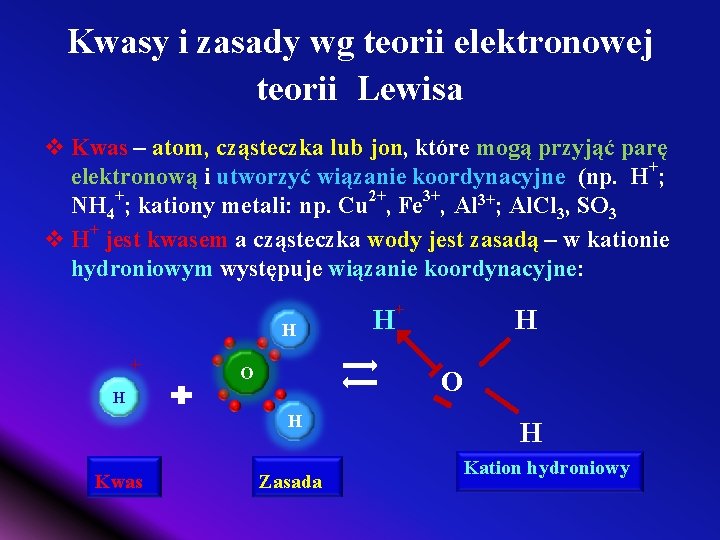
Kwasy i zasady wg teorii elektronowej teorii Lewisa v Kwas – atom, cząsteczka lub jon, które mogą przyjąć parę elektronową i utworzyć wiązanie koordynacyjne (np. H+; NH 4+; kationy metali: np. Cu 2+, Fe 3+, Al 3+; Al. Cl 3, SO 3 v H+ jest kwasem a cząsteczka wody jest zasadą – w kationie hydroniowym występuje wiązanie koordynacyjne: H + O H H Kwas H + Zasada H Kation hydroniowy

Kwasy i zasady wg teorii elektronowej teorii Lewisa v. Zasada – atom, cząsteczka lub jon dysponujące wolną parą elektronową 2(np. OH , Cl , Br , H ; F , SO 4 , H 2 O) Kwas Ø Ø Al(OH)3 + Al. Cl 3 + SO 3 + + H + Zasada - OH Cl. H 2 O NH 3 ↔ [Al(OH)4] ↔ [Al. Cl 4]↔ H 2 SO 4 ↔ NH 4+ -
 Kwasy według arrheniusa
Kwasy według arrheniusa Dysocjacja hcl
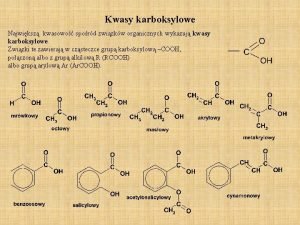
Dysocjacja hcl Wyższe kwasy karboksylowe nasycone i nienasycone
Wyższe kwasy karboksylowe nasycone i nienasycone Interestryfikacja
Interestryfikacja Otrzymywanie wodorkow
Otrzymywanie wodorkow Kwasy karboksylowe i estry
Kwasy karboksylowe i estry Papierek uniwersalny kolory
Papierek uniwersalny kolory Kwasy tłuszczowe
Kwasy tłuszczowe Dehydratacja celulozy
Dehydratacja celulozy Pochodna kwasu karboksylowego
Pochodna kwasu karboksylowego Otrzymywanie kwasów karboksylowych
Otrzymywanie kwasów karboksylowych Kwasy w gospodarstwie domowym
Kwasy w gospodarstwie domowym