Wodorotlenki i kwasy Zna podzia tlenkw na tlenki






































- Slides: 40

Wodorotlenki i kwasy

Zna podział tlenków na: tlenki metali i niemetali �Tlenki metali to związki chemiczne składające się z tlenu i metalu. Metale to głównie pierwiastki I (oprócz wodoru) i II grupy układu okresowego np. Na 2 O (tlenek sodu), Ca. O (tlenek wapnia). �Tlenki niemetali to związki tlenu i niemetalu. Niemetale położone są częściowo w IV (węgiel, krzem), V (azot, fosfor), VI (tlen, siarka, selen) i całkowicie w VII grupie układu okresowego np. CO 2 (tlenek węgla IV), CO (tlenek węgla II), N 2 O 5 (tlenek azotu V), tlenek siarki (VI) SO 3, tlenek chloru (VII)

2. Zna pojęcie wskaźnika i wie jak barwią się : fenoloftaleina, oranż metylowy, papierek uniwersalny i wywar z czerwonej kapusty w roztworach wodorotlenków i kwasów �Wskaźnik to związek chemiczny, który w zależności od p. H (odczynu) roztworu zmienia swoje zabarwienie.

3. Odróżnia pojęcie: zasada i wodorotlenek �Wodorotlenki, które rozpuszczają się w wodzie, nazywamy zasadami. �Każda zasada jest wodorotlenkiem, ale nie każdy wodorotlenek może być zasadą!

4. Tworzy nazwę wodorotlenku na podstawie podanego wzoru �UWAGA: wartościowość metalu w grupach głównych jest równa numerowi grupy!!! �KOH wiemy, że jest to wodorotlenek, gdyż posiada grupę wodorotlenową OH , oprócz tego we wzorze jest potas K, czyli jest to wodorotlenek potasu

Fe(OH)3 wiemy, że jest to wodorotlenek, gdyż posiada grupę wodorotlenową OH , oprócz tego we wzorze jest żelazo Fe, czyli jest to wodorotlenek żelaza, ale aby nazwa był pełna należy podać wartościowość żelaza, czyli pełna nazwa to: wodorotlenek żelaza III. Wartościowość metalu w nazwie wodorotlenków podajemy, kiedy metal ma więcej niż jedną wartościowość, żelazo posiada wartościowość II i III, a ponieważ grupa wodorotlenowa ma wartościowość I to nazwa wodorotlenku Fe(OH)3 będzie: wodorotlenek żelaza III. Fe(OH)2 – wodorotlenek żelaza II Ca(OH)2 wodorotlenek wapnia Al. (OH)3 – wodorotlenek glinu

5. Zapisuje wzory sumaryczne najprostszych wodorotlenków: KOH, Na. OH, Ca(OH)2 Al(OH)3 �Wodorotlenek potasu – symbol potasu to K, wartościowość potasu wynosi I, piszemy KOH �Wodorotlenek wapnia – symbol wapnia Ca, wartościowość wapnia II, piszemy Ca. IIOHI, następnie „spuszczamy” wartościowości na krzyż na dół i mamy prawidłowy wzór Ca(OH)2

Wodorotlenek glinu – symbol glinu Al, wartościowość glinu III, piszemy Al. IIIOHI, następnie „spuszczamy” wartościowości na krzyż na dół i mamy prawidłowy wzór Al. (OH)3 Wodorotlenek magnezu – symbol magnezu Mg, wartościowość magnezu II, piszemy Mg. IIOHI, następnie „spuszczamy” wartościowości na krzyż na dół i mamy prawidłowy wzór Mg(OH)2

6. Wymienia poznane sposoby otrzymywania wodorotlenków �reakcja metali I i II grupy układu okresowego z wodą – powstaje wodorotlenek + wodór �reakcja tlenków metali z wodą – powstaje wodorotlenek

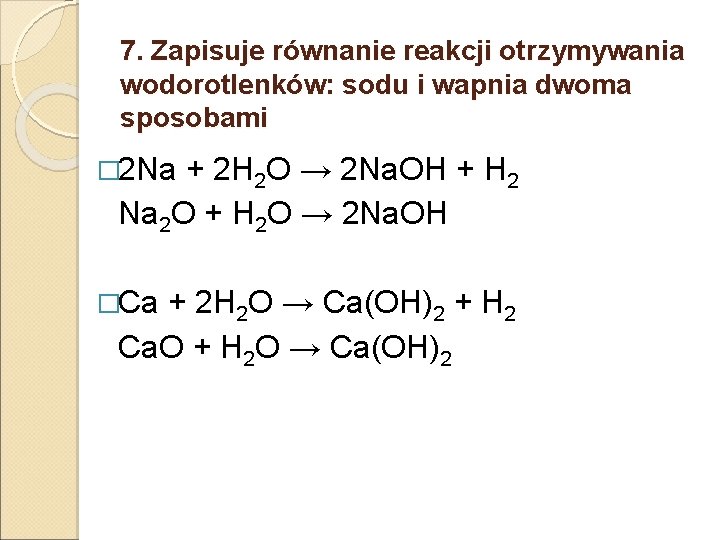
7. Zapisuje równanie reakcji otrzymywania wodorotlenków: sodu i wapnia dwoma sposobami � 2 Na + 2 H 2 O → 2 Na. OH + H 2 Na 2 O + H 2 O → 2 Na. OH �Ca + 2 H 2 O → Ca(OH)2 + H 2 Ca. O + H 2 O → Ca(OH)2

8. Wymienia właściwości i zastosowanie wodorotlenków: sodu, potasu i wapnia. �Wodorotlenek sodu ◦ Cechy charakterystyczne: ciało stałe, krystaliczne, dobrze rozpuszczane w wodzie, higroskopijna budowa (pochłania wilgoć), żrący, parzący Zastosowanie: przemysł petrochemiczny, produkcja gum, barwniki, przemysł papierniczy, sztuczny jedwab, środki piorące,

�Wodorotlenek potasu ◦ Cechy charakterystyczne: ciało stało, krystaliczne, rozpuszcza się w wodzie, higroskopijna budowa (pochłania wilgoć), Zastosowanie: produkcja mydła, środek suszący, bielący, do pochłaniania gazów np. CO 2

�Wodorotlenek wapnia ◦ Cechy charakterystyczne: ciało stało, substancja żrąca, słabo rozpuszcza się w wodzie, Zastosowanie: budownictwo, bielenie wnętrz mieszkalnych, drzew itp. cukrownictwo, nawozy sztuczne, garbarstwo, Tlenek wapnia (Ca. O) zwie się potocznie wapnem palonym. Jego reakcja z wodą to proces nazywany "gaszeniem wapna". Wapno gaszone Ca(OH)2 to gęsta substancja która po zmieszaniu z piaskiem i wodą tworzy zaprawę wapienną.

Wodorotlenek sodu i potasu dobrze się rozpuszcza w wodzie, wodorotlenek wapnia słabiej jednak wodorotlenek miedzi(II) i wodorotlenek żelaza(III) wytrącają się w roztworach wodnych w postaci osadów, czyli w wodzie się nie rozpuszczają. Wodorotlenki, które są rozpuszczalne w wodzie, noszą nazwę zasad, np. zasada sodowa, zasada potasowa, zasada wapniowa. Przykłady innych wodorotlenków: wodorotlenek magnezu Mg(OH)2 wodorotlenek miedzi(II) Cu(OH)2 wodorotlenek żelaza(III) Fe(OH)3

9. Opisuje budowę wodorotlenków i kwasów �Wodorotlenki są zbudowane z metalu i grupy wodorotlenowej �Kwasy są zbudowane z wodoru i reszty kwasowej

10. Pisze równania reakcji otrzymywania kwasu węglowego i siarkowego (VI). �Kwas węglowy ◦ CO 2 + H 2 O → H 2 CO 3 �Kwas siarkowy VI ◦ SO 3 + H 2 O → H 2 SO 4

11. Pisze wzory sumaryczne kwasów: siarkowego(IV), siarkowego(VI), azotowego(V), fosforowego(V), węglowego, chlorowodorowego i siarkowodorowego. �Kwas siarkowy (IV) H 2 SO 3 �Kwas siarkowy (VI) H 2 SO 4 �Kwas azotowy (V) HNO 3 �Kwas fosforowy (V) H 3 PO 4 �Kwas węglowy H 2 CO 3 �Kwas chlorowodorowy (roztwór wodny tego kwasu nazywa się kwasem solnym) HCl �Kwas siarkowodorowy H 2 S

12. Podaje wzory kwasów na podstawie nazwy. �Wzory kwasów i ich nazwy niestety trzeba się nauczyć na pamięć, tak samo jak symboli pierwiastków!!!

13. Umie dzielić kwasy na tlenowe i beztlenowe. �Wszystkie kwasy, które zawierają w swojej cząsteczce tlen są kwasami tlenowymi, czyli do kwasów tlenowych należą: Kwas siarkowy (IV) H 2 SO 3 , Kwas siarkowy (VI) H 2 SO 4 , Kwas azotowy (V) HNO 3 , Kwas fosforowy (V) H 3 PO 4 , Kwas węglowy H 2 CO 3 �Kwasy, które nie posiadają tlenu w cząsteczce nazywamy kwasami beztlenowymi czyli należą do nich: Kwas chlorowodorowy HCl, Kwas siarkowodorowy H 2 S

14. Określa wartościowość reszt kwasowych. � Wartościowość reszt kwasowych wynosi tyle ile dany kwas zawiera w swej cząsteczce atomów wodoru i tak: � H 2 SO 4 – 2 atomy wodoru wartościowość reszty kwasowej SO 4 wynosi II � HCl – 1 atom wodoru – wartościowość reszty kwasowej Cl wynosi I � H 3 PO 4 – 3 atomy wodoru – wartościowość reszty kwasowej PO 4 wynosi III � HNO 3 – 1 atom wodoru – wartościowość reszty kwasowej NO 3 wynosi I � H 2 S – 2 atomy wodoru – wartościowość reszty kwasowej S wynosi II � H 2 CO 3 – 2 atomy wodoru – wartościowość reszty kwasowej CO 3 wynosi II

15. Wymienia właściwości i zastosowanie kwasów : siarkowego(IV), azotowego (V), węglowego i chlorowodorowego.

16. Wyjaśnia pojęcie dysocjacji jonowej. �Dysocjacja jest to rozpad elektrolitów, czyli kwasów, zasad, soli w roztworach wodnych na jony (jony dodatnie to kationy, jony ujemne to aniony)

17. Wyjaśnia pojęcie: zasada i kwas według teorii Arrheniusa � Kwasy – są to substancje, które w roztworze wodnym dysocjują z wydzieleniem jednododatnich kationów wodorowych oraz ujemnych anionów reszt kwasowych np. kwas chlorowodorowy Zasady – są to substancje, które w roztworze wodnym dysocjują z wydzieleniem jednoujemnych anionów wodorotlenowych i dodatnich kationów metali Np. zasada sodowa Na. OH →Na+ + OH

18. Wyjaśnia pojęcie elektrolit i nieelektrolit. �Elektrolity to roztwory wodne, które przewodzą prąd elektryczny, nieelektrolity to roztwory wodne, które nie przewodzą prądu elektrycznego. Do elektrolitów zaliczamy wodorotlenki, kwasy, sole.

19. Zna wartość ładunku kationu wodoru i anionu wodorotlenowego. �Kation wodoru ma ładunek (+1) H+, �anion wodorotlenowy ma ładunek ( 1) OH

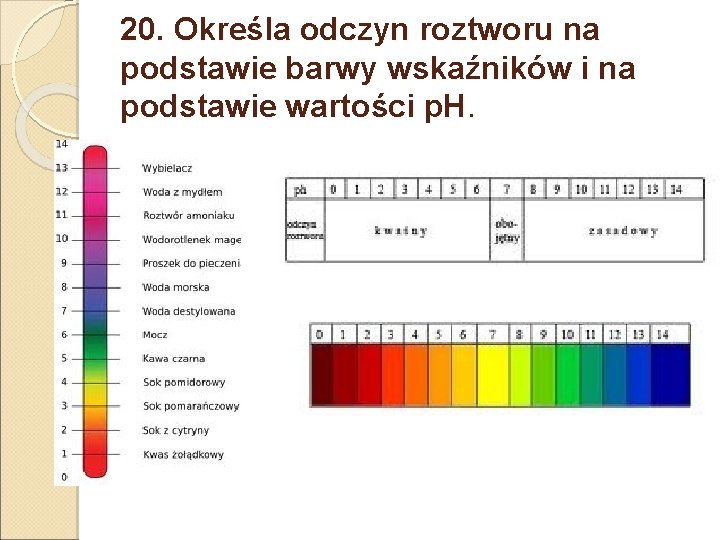
20. Określa odczyn roztworu na podstawie barwy wskaźników i na podstawie wartości p. H.

21. Wymienia tlenki, które powodują powstawanie kwaśnych opadów �tlenki siarki, głównie tlenek siarki (IV) SO 2 �tlenki azotu �tlenek węgla (IV) �tlenki te w reakcji z wodą (deszcze, para wodna w powietrzu) dają kwasy

SOLE

1. Dzieli sole na sole kwasów tlenowych i beztlenowych. �Sole kwasów tlenowych to: ◦ Siarczany (IV) – sole kwasu siarkowego (IV) H 2 SO 3 ◦ Siarczany (VI) – sole kwasu siarkowego (VI) ◦ Azotany (V) – sole kwasu azotowego (V) ◦ Fosforany (V) – sole kwasu fosforowego (V) ◦ Węglany – sole kwasu węglowego H 2 CO 3 �Sole kwasów beztlenowych to: ◦ Chlorki – sole kwasu chlorowodorowego HCl ◦ Siarczki – sole kwasu siarkowodorowego H 2 S

2. Wymienia sole, które mają zastosowanie w gospodarstwie domowym, rolnictwie i lecznictwie.

3. Umie opisać budowę soli. �Sole to związki chemiczne składające się z metalu i reszty kwasowej

4. Podaje nazwy soli zapisane wzorem sumarycznym i zapisuje wzory sumaryczne znając wartościowość metalu i reszty kwasowej. �Na. Cl – związek ten składa się z atomu sodu Na i reszty kwasowej kwasu chlorowodorowego czyli nazwa brzmi chlorek sodu �Mg. SO 4 związek ten składa się z atomu magnezu i reszty kwasowej kwasu siarkowego(VI), czyli nazwa brzmi siarczan (VI) magnezu �Al 3 PO 4 związek ten składa się z atomu glinu i reszty kwasowej kwasu fosforowego (V), czyli nazwa brzmi fosforan (V) glinu (III)

� Siarczek potasu – jeśli siarczek to musi być sól kwasu siarkowodorowego H 2 S, którego reszta kwasowa S ma wartościowość II, potas ma wartościowość I. piszemy najpierw symbole KISII, a następnie „spuszczamy” wartościowości na dół na krzyż czyli poprawny wzór to: K 2 S � Azotan(V) magnezu – jeśli azotan(V) to musi być to sól kwasu azotowego(V) HNO 3, którego reszta kwasowa NO 3 ma wartościowość I, magnez ma wartościowość II, czyli tak jak w poprzednim przykładzie piszemy najpierw symbole Mg. IINO 3 I, „spuszczamy” wartościowości na krzyż na dół i otrzymujemy wzór Mg(NO 3)2 � Fosforan(V) sodu – jeśli fosforan(V) to musi być to sól kwasu fosforowego(V) H 3 PO 4, którego reszta kwasowa PO 4 ma wartościowość III, sód ma wartościowość I, czyli Na. IPO 4 III, „spuszczając” wartościowości na krzyż na dół otrzymujemy wzór Na 3 PO 4

5. Podaje definicję soli według Arrheniusa i pisze proste równania dysocjacji na podstawie tabeli rozpuszczalności soli. �Sole to substancje, które w roztworze wodnym dysocjują na dodatnie jony (kationy) metali i ujemne jony (aniony) reszt kwasowych

6. Wyjaśnia pojęcie reakcji zobojętniania i pisze cząsteczkowo proste równania zobojętniania. �Reakcja zobojętniania to reakcja zachodząca pomiędzy kwasem i zasadą w wyniku której powstaje sól i woda, która jest głównym produktem tej reakcji ◦ Na. OH + HCl →Na. Cl + H 2 O ◦ Mg(OH)2 + 2 HNO 3 → Mg(NO 3)2 + 2 H 2 O

7. Wymienia przykłady metali aktywnych i szlachetnych. �Metale aktywne to np. lit Li, potas K, sód Na �metale szlachetne to np. srebro Ag, platyna Pt, złoto Au

8. Korzysta z szeregu aktywności metali. � Li K Na Ca Mg Al Zn Cr Fe Cd Co Ni Sn Pb H Sb Bi Cu Ag Hg Pt Au Szereg aktywności metali określa nam ich aktywność. Pierwiastki stojące po lewej stronie wodoru są bardziej aktywne niż stojące po prawej stronie wodoru. I tak najbardziej aktywnym wg podanego wyżej szeregu aktywności jest lit Li, a najmniej aktywnym jest złoto Au. Pierwiastki stojące po lewej stronie wodoru wypierają wodór z kwasów

9. Pisze słownie i cząsteczkowo proste równania metalu z kwasami. �Zn + 2 HCl → Zn. Cl 2 + H 2 ◦ Atom cynku reaguje z 2 cząsteczkami kwasu solnego dając cząsteczkę chlorku cynku i dwuatomową cząsteczkę wodoru �Ca + 2 HCl → Ca. Cl 2 + H 2 ◦ Atom wapnia reaguje z 2 cząsteczkami kwasu solnego dając cząsteczkę chlorku wapnia i dwuatomową cząsteczkę wodoru

� 2 K + 2 HNO 3 → 2 KNO 3 + H 2 ◦ 2 atomy potasu reagują z 2 cząsteczkami kwasu azotowego (V) dając 2 cząsteczki azotanu (V) potasu i dwuatomową cząsteczkę wodoru � 2 Al + 6 HCl → 2 Al. Cl 3 + 3 H 2 ◦ 2 atomy glinu reagują z 6 cząsteczkami kwasu solnego dając 2 cząsteczki chlorku glinu i 3 cząsteczki dwuatomowego wodoru

10. Wymienia poznane sposoby otrzymywania soli w reakcjach wodorotlenków z tlenkami kwasowymi, metali z niemetalami, oraz kwasów z tlenkami metali.
 Uczeń wlał do cylindra miarowego
Uczeń wlał do cylindra miarowego Zbir kateta nad hipotenuzom
Zbir kateta nad hipotenuzom če dedek ne zna pripovedovati pravljic
če dedek ne zna pripovedovati pravljic Pitagorina teorema
Pitagorina teorema Pitagorina teorema na kvadrat
Pitagorina teorema na kvadrat Tlenki o charakterze kwasowym
Tlenki o charakterze kwasowym Kwasy są elektrolitami
Kwasy są elektrolitami Tlenki chloru
Tlenki chloru Tlenki kwasowe
Tlenki kwasowe Otrzymywanie wodorkow
Otrzymywanie wodorkow Wzory i nazwy wodorotlenków
Wzory i nazwy wodorotlenków Wodorotlenki to związki chemiczne zbudowane z
Wodorotlenki to związki chemiczne zbudowane z Rboh charakter chemiczny
Rboh charakter chemiczny Wodorotlenek wapnia wzór strukturalny
Wodorotlenek wapnia wzór strukturalny Otrzymywanie kwasów beztlenowych
Otrzymywanie kwasów beztlenowych Nienasycone kwasy karboksylowe
Nienasycone kwasy karboksylowe Lipidy proste i złożone
Lipidy proste i złożone 3-hydroksybutanal
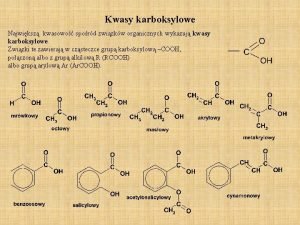
3-hydroksybutanal Kwasy karboksylowe nazwy
Kwasy karboksylowe nazwy Kwas lewisa
Kwas lewisa Dekarboksylacja octanu sodu
Dekarboksylacja octanu sodu Długołańcuchowe kwasy karboksylowe nasycone
Długołańcuchowe kwasy karboksylowe nasycone Kwasy karboksylowe
Kwasy karboksylowe Kwasy według arrheniusa
Kwasy według arrheniusa Na jaki kolor zabarwi się papierek wskaźnikowy w kwasach
Na jaki kolor zabarwi się papierek wskaźnikowy w kwasach Kwasy tłuszczowe
Kwasy tłuszczowe Rcoor'
Rcoor' Kwasy w gospodarstwie domowym
Kwasy w gospodarstwie domowym Kwasy tłuszczowe
Kwasy tłuszczowe