Zestawienie wiadomoci wodorotlenkach charakterystyka wodorotlenkw otrzymywanie wodorotlenkw wodorotlenki












- Slides: 13

Zestawienie wiadomości wodorotlenkach -charakterystyka wodorotlenków -otrzymywanie wodorotlenków -wodorotlenki amfoteryczne

Charakterystyka wodorotlenków metali • Wodorotlenki metali są ciałami stałymi, które różnią się rozpuszczalnością w wodzie np: Dobrze rozpuszczalne Słabo rozpuszczalne Trudno rozpuszczalne Na. OH; KOH; Ba(OH)2 Mg(OH)2; Ca(OH)2 Be(OH)2; Al(OH)3 Wodorotlenki o właściwościach zasadowych, w reakcji z kwasami dają sole i powstaje woda, rozpuszczalne w wodzie są zasadami, dysocjując: Me(OH)m ↔Mem+ + m. OH-

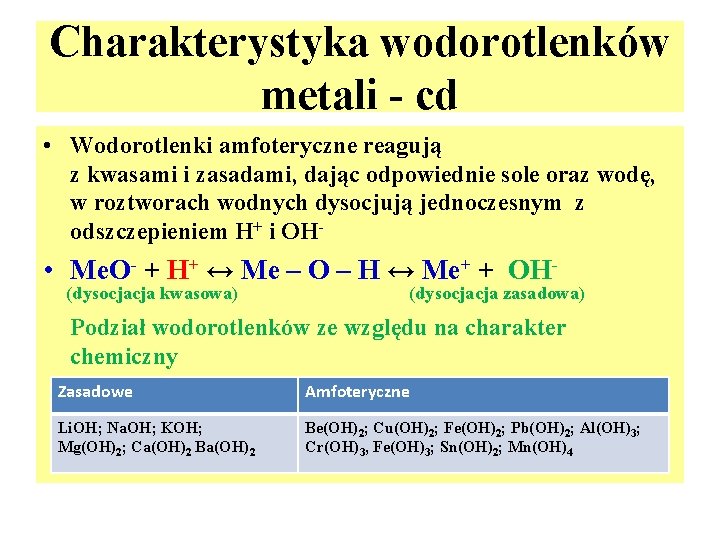
Charakterystyka wodorotlenków metali - cd • Wodorotlenki amfoteryczne reagują z kwasami i zasadami, dając odpowiednie sole oraz wodę, w roztworach wodnych dysocjują jednoczesnym z odszczepieniem H+ i OH- • Me. O- + H+ ↔ Me – O – H ↔ Me+ + OH(dysocjacja kwasowa) (dysocjacja zasadowa) Podział wodorotlenków ze względu na charakter chemiczny Zasadowe Amfoteryczne Li. OH; Na. OH; KOH; Mg(OH)2; Ca(OH)2 Be(OH)2; Cu(OH)2; Fe(OH)2; Pb(OH)2; Al(OH)3; Cr(OH)3, Fe(OH)3; Sn(OH)2; Mn(OH)4

Charakterystyka wodorotlenków metali - cd • Podział wodorotlenków ze względu na stopień dysocjacji Elektrolity mocne Elektrolity o średniej mocy Elektrolity słabe Na. OH; KOH; Ca(OH)2; Ba(OH)2 Li. OH; Mg(OH)2 Be(OH)2; Al(OH)3 • Im większa różnica elektroujemności między atomem metalu a tlenem, tym silniejsza polaryzacja wiązania, a tym samym mniejsza trwałość wiązania Me – OH, moc zasad wzrasta w grupie a maleje w okresie wraz ze wzrostem liczby atomowej

Otrzymywanie wodorotlenków • Reakcja litowców i berylowców z wodą w temp. pokojowej (wyjątek beryl, magnez): 2 Na + 2 H 2 O 2 Na. OH + H 2 Ba + 2 H 2 O Ba(OH)2 + H 2 • Reakcja metali z gorącą wodą lub parą wodną: Mg + 2 H 2 O Mg(OH)2 + H 2 2 Al + 6 H 2 O 2 Al(OH)3 + 3 H 2

Otrzymywanie wodorotlenków cd • Reakcja tlenków, nadtlenków, podtlenków litowców oraz berylowców (wyjątek tlenek berylu) z wodą: Li 2 O + H 2 O 2 Li. OH Na 2 O 2 + 2 H 2 O 2 Na. OH + H 2 O 2 2 KO 2 + 2 H 2 O 2 KOH + H 2 O 2 + O 2 Ba. O + H 2 O Ba(OH)2

Otrzymywanie wodorotlenków cd • Sól + wodny roztwór zasady (wodorotlenki metali głównie bloku d i p, dla wodorotlenków amfoterycznych w stosunkach stechiometrycznych): Cu. SO 4 + 2 Na. OH Cu(OH)2 + Na 2 SO 4 Al. Cl 3 + 3 Na. OH Al(OH)3 + 3 Na. Cl Zn. Cl 2 + 2 KOH Zn(OH)2 + 2 KCl • Hydroliza niektórych soli: Pb(NO 3)2 + 2 H 2 O Pb(OH)2 + 2 HNO 3 Ag. NO 3 + H 2 O Ag. OH + HNO 3

Otrzymywanie wodorotlenków cd Specyficzne reakcje prowadzące do otrzymywania wodorotlenków • Hydroliza węglików lub acetylenków: Ca. C 2 + 2 H 2 O C 2 H 2 + Ca(OH)2 Al 4 C 3 + 12 H 2 O 3 CH 4 + 4 Al(OH)3 • Reakcja wodorków metali z wodą; Na. H + H 2 O Na. OH + H 2 Ca. H 2 + 2 H 2 O Ca(OH)2 + 2 H 2 • Utlenianie wodorotlenków 4 Fe(OH)2 + O 2 + 2 H 2 O 4 Fe(OH)3

Termiczny rozkład wodorotlenków • Wodorotlenki w wyniku ogrzewania (prażenia) ulegają rozkładowi na odpowiednie tlenki metali i wodę – proces usuwania wody konstytucyjnej: 2 Li. OH Li 2 O + H 2 O Ca(OH)2 Ca. O + H 2 O Cu(OH)2 Cu. O + H 2 O 2 Al(OH)3 Al 2 O 3 + 3 H 2 O

Amfoteryczność wodorotlenków -Polarność wiązań a amfoteryczność -Ważniejsze wodorotlenki amfoteryczne

Polaryzacja wiązań w cząsteczkach wodorotlenków • W cząsteczkach wodorotlenków, czyli związków zawierających układ Me-O-H, amfoteryczność wynika z możliwości dwukierunkowej dysocjacji elektrolitycznej: Me – O- + H+ ↔ Me – O – H ↔ Me+ + O – H • Kierunek dysocjacji elektrolitycznej zależy od polarności wiązań Me – O i O – H, przy czym stopień utlenienia atomu centralnego (metalu) nie ulega zmianie, bez względu czy przechodzi on do kationu, czy anionu. • Jeżeli metal na określonym stopniu utlenienia tworzy tylko kationy, to ma charakter zasadowy, jeżeli tworzy tylko aniony, to ma charakter kwasowy • Właściwość tworzenia przez metal na określonym stopniu utlenienia zarówno kationów i anionów określa się jako amfoteryczność

Polaryzacja wiązań w cząsteczkach wodorotlenków - cd • Wodorotlenki amfoteryczne są słabymi elektrolitami, w środowisku obojętnym ustala się stan równowagi pomiędzy formami zdysocjowanymi (Me+/OH- i Me. O-/H+ ) • Zakłócenie stanu równowagi przez dodanie kationów H+(kwasu) powoduje przesunięcie jej w kierunku Me+ i tworzenia się anionów OH-, które tworzą z H+ cząsteczki H 2 O i usuwanie ich z roztworu • Wprowadzenie anionów OH- (dodanie zasady) przesuwa stan równowagi w kierunku powstawania Me. Oi tworzenia się kationów H+ , które z anionami OHtworzą cząsteczki H 2 O i usunięcie ich z roztworu

Schemat stanów równowagowych dla Al(OH)3 Al(OH)2+ + OH- ↔ Al(OH)2+ + 2 OH- ↔Al 3+ + 3 OH- ↕ OH- 2 OH- Al. O 2 - + H+ ↔ Al(OH)3(aq) ↔ Al(OH)4 - ↔ Al(OH)63↕ H 2 Al. O 3 - + H+ ↔ HAl. O 32 - + 2 H+ ↔ Al. O 33 - + 3 H+ Powyższe stany równowagowe obserwuję się dla następujących wodorotlenków amfoterycznych: Sn(OH)2; Pb(OH)2; Cr(OH)3; Mn(OH)4; Fe(OH)2; Fe(OH)3; Cu(OH)2; Zn(OH)2
 Wodorotlenki amfoteryczne otrzymywanie
Wodorotlenki amfoteryczne otrzymywanie Tlenek metalu + woda = wodorotlenek
Tlenek metalu + woda = wodorotlenek Ekonomiczne zestawienie
Ekonomiczne zestawienie Zestawienie obrotow i sald
Zestawienie obrotow i sald Zestawienie zbiorcze nadań
Zestawienie zbiorcze nadań Rboh charakter chemiczny
Rboh charakter chemiczny Wzór strukturalny ca(oh)2
Wzór strukturalny ca(oh)2 P
P Wodorotlenki to związki chemiczne zbudowane z
Wodorotlenki to związki chemiczne zbudowane z Agata charakterystyka
Agata charakterystyka Znaczenie transportu lotniczego
Znaczenie transportu lotniczego Charakterystyka fazowo częstotliwościowa
Charakterystyka fazowo częstotliwościowa Opis krajobrazu
Opis krajobrazu Charakterystyki częstotliwościowe automatyka
Charakterystyki częstotliwościowe automatyka