KWASY I WODOROTLENKI TESTY ZADANIE 1 Wska poprawny



















- Slides: 21

KWASY I WODOROTLENKI TESTY

ZADANIE 1 Wskaż poprawny zapis równania reakcji dysocjacji zasady wchodzącej w skład środka do udrażniania rur (zamaluj odpowiednią kratkę w pierwszej kolumnie tabeli), a następnie zaznacz w drugiej kolumnie nazwy jonów powstających w wyniku tej reakcji. 1. Równanie reakcji dysocjacji 2. Nazwy powstałych jonów A. KOH → K+ + OH− 1. kation sodu, anion wodorotlenkowy B. Ca(OH)2 → Ca 2− + 2 OH+ 2. anion wapnia, kationy wodorotlenkowe C. Ba(OH)2 → Ba+ + 2 OH− 3. kation baru, anion wodorotlenkowy D. Na. OH → Na+ + OH− 4. kation potasu, anion wodorotlenkowy

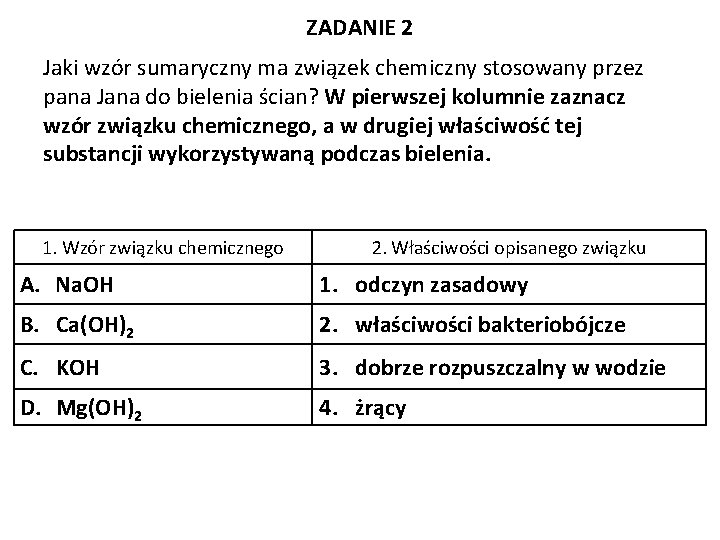
ZADANIE 2 Jaki wzór sumaryczny ma związek chemiczny stosowany przez pana Jana do bielenia ścian? W pierwszej kolumnie zaznacz wzór związku chemicznego, a w drugiej właściwość tej substancji wykorzystywaną podczas bielenia. 1. Wzór związku chemicznego 2. Właściwości opisanego związku A. Na. OH 1. odczyn zasadowy B. Ca(OH)2 2. właściwości bakteriobójcze C. KOH 3. dobrze rozpuszczalny w wodzie D. Mg(OH)2 4. żrący

ZADANIE 3 Niektóre metalowe narzędzia w gospodarstwie pana Jana zostały pokryte warstwą innego metalu, w celu zabezpieczenia ich przed korozją. Który z wymienionych metali może służyć jako powłoka antykorozyjna do zabezpieczenia narzędzi, mających częsty kontakt z wilgocią? A. wapń B. sód C. cyna D. potas

ZADANIE 4 Gleba w gospodarstwie pana Jana, jak większość ziem w Polsce, ma odczyn kwasowy. Uniwersalny papierek wskaźnikowy zanurzony w wodzie destylowanej, w której znajduje się próbka tej gleby, zabarwi się na • • A. zielono, ze względu na nadmiar jonów OH–. B. czerwono, ze względu na nadmiar jonów H+. C. malinowo, ze względu na nadmiar jonów OH–. D. żółto, ze względu na jednakowe stężenie jonów H+ i OH–.

ZADANIE 5 Wysokie plony ziemniaków uzyskuje się na glebach o p. H = 5– 6. Natomiast fasola najlepiej rośnie na podłożu o p. H = 7– 8. Odpowiedz, w jaki sposób pan Jan powinien przygotować pole pod uprawę fasoli. Gleba występująca na polu ma odczyn kwasowy. 1. Powinien zastosować nawóz zakwaszający glebę. TAK / NIE 2. Powinien tylko obficie podlać obszar przeznaczony pod uprawę. TAK / NIE 3. Powinien zastosować nawóz zmieniający odczyn gleby na obojętny lub zasadowy. TAK / NIE 4. Nie powinien nic robić, ponieważ gleba jest odpowiednia do uprawy fasoli. TAK / NIE

ZADANIE 6 Do zwiększenia kwasowości gleby przyczyniają się kwaśne opady, spowodowane obecnością w powietrzu m. in. tlenków siarki. Które równanie reakcji chemicznej przedstawia powstawanie kwaśnych opadów? A. B. C. D. H 2 + S → H 2 S↑ H 2 SO 3 → H 2 O + SO 2↑ SO 2 + H 2 O → H 2 SO 3 P 4 O 10 + 6 H 2 O → 4 H 3 PO 4

ZADANIE 7 Pan Jan zakupił nawóz (wapno gaszone), aby zmienić właściwości gleby przeznaczonej pod niektóre uprawy. Które równanie przedstawia proces dysocjacji jonowej tego nawozu? A. B. C. D. Ca(OH)2 →Ca 2+ + 2 OH– Ca. O + H 2 O → Ca(OH)2 Na. OH →Na+ + OH– K 2 O + H 2 O → 2 KOH

ZADANIE 8 Uzupełnij zdania zaznaczając odpowiedzi wybrane spośród A – H, tak aby zdania były prawdziwe. 1. 2. 3. 4. Po rozpuszczeniu w wodzie tlenku fosforu (V) powstanie A / B. Roztwór tej substancji zabarwi oranż metylowy na kolor C / D. Tlenek fosforu (V) jest tlenkiem E / F. W reakcji tlenku niemetalu z wodą nie można otrzymać G / H. A. kwas C. czerwony E. zasadowym G. kwasu siarkowego (VI) B. zasada D. żółty F. kwasowym H. kwasu solnego

Zadanie 9 Ułóż schemat otrzymywania kwasu siarkowego (VI), wpisując w miejsce cyfr 1 -4 symbole i wzory substancji wybrane spośród podanych poniżej. SO 2 H 2 SO 4 S SO 3 H 2 SO 3 1. → 2. → 3. → 4.

ZADANIE 10 Wybierz poprawną nazwę kwasu stosowanego w akumulatorach samochodowych, a następnie oceń poprawność informacji na temat tego kwasu 1 – 4, zaznaczając odpowiedź TAK lub NIE. A. kwas siarkowodorowy B. kwas siarkowy (IV) C. kwas siarkowy (VI) 1. Kwas ten jest gęstą oleistą cieczą. TAK / NIE 2. Jego stężony roztwór ma gęstość mniejszą od gęstości wody. TAK / NIE 3. Jego stężony roztwór zwęgla papier, tkaninę, drewno. TAK / NIE 4. Jego stężony roztwór można rozcieńczyć, wlewając do niego wodę TAK / NIE

ZADANIE 11 Uzupełnij poniższy tekst, zaznaczając odpowiedzi wybrane spośród A – H, tak aby informacje o tlenku siarki (IV) i kwasie siarkowym (IV) były prawdziwe. Tlenek siarki (IV) i kwas siarkowy (IV) mają właściwości bakteriobójcze, grzybobójcze i owadobójcze. Wykorzystuje się je między innymi do dezynfekcji. Aby stężenie tlenku siarki (IV) w pomieszczeniu o wymiarach 5 m x 4 m x 3 m wynosiło 4 g/m 3, należy rozpylić A / B tego związku. Tlenek siarki (IV) dobrze rozpuszcza się w wodzie i tworzy kwas siarkowy (IV) o wzorze sumarycznym C / D. Kwas siarkowy (IV) jest kwasem E / F, dlatego G / H, odparowując wodę, otrzymać roztwór bardziej stężony. A. 240 g C. H 2 SO 4 E. trwałym G. można B. 15 g D. H 2 SO 3 F. nietrwałym H. nie można

ZADANIE 12 Uczeń wlał do cylindra miarowego 5 cm 3 stężonego H 2 SO 4 i pozostawił w pracowni chemicznej na kilka dni. Co zaobserwował uczeń po tym czasie? 1. Objętość i masa substancji w cylindrze zmalała. 2. Objętość i masa substancji w cylindrze wzrosła. A. H 2 SO 4 to kwas lotny i wyparował. ponieważ B. H 2 SO 4 jest higroskopijny i wchłonął parę wodną z powietrza.

ZADANIE 13 Oceń, czy poprawnie podano odczyn roztworów w punktach 1 – 3. 1. Wartość p. H soku żołądkowego wynosi od 1 do 3. Sok żołądkowy ma odczyn kwasowy. TAK / NIE 2. Wartość p. H mydła wynosi od 9 do 10. Mydło ma odczyn obojętny TAK / NIE 3. Wartość p. H proszku do pieczenia wynosi od 9 do 10. Proszek do pieczenia ma odczyn zasadowy. TAK / NIE

ZADANIE 14 Przyporządkuj nazwom kwasów (1 – 4) charakterystyczne właściwości tych kwasów ( A – D) oraz ich wzory sumaryczne (E – H). A. Ciecz gęsta, oleista, bez zapachu, zwęgla substancje organiczne. B. Ciało stałe, krystaliczne, dobrze rozpuszcza się w wodzie. C. Ciecz bezbarwna o charakterystycznym zapachu, powoduje żółknięcie substancji zawierającej białko. D. Ciecz bezbarwna, stężony roztwór dymi po otwarciu butelki, występuje w soku żołądkowym człowieka. E. HCl F. H 2 SO 4 G. HNO 3 H. H 2 SO 4 Nazwa Właściwości Wzór sumaryczny 1. Kwas azotowy (V) A B C D E F G H 2. Kwas siarkowy (VI) A B C D E F G H 3. Kwas fosforowy (V) A B C D E F G H 4. Kwas solny A B C D E F G H

ZADANIE 15 Uzupełnij zdania, zaznaczając odpowiedzi wybrane spośród A – H, tak aby informacje były prawdziwe. 1. Po rozpuszczeniu w wodzie tlenku wapnia powstaje A / B. 2. Roztwór tej substancji zabarwi papierek uniwersalny na kolor C / D. 3. Tlenek wapnia to tlenek E / F. 4. Wodorotlenek miedzi (II) G / H w reakcji tlenku miedzi (II) z wodą. A. C. E. G. kwas czerwony zasadowy powstanie B. zasada D. zielony F. kwasowy H. nie powstanie

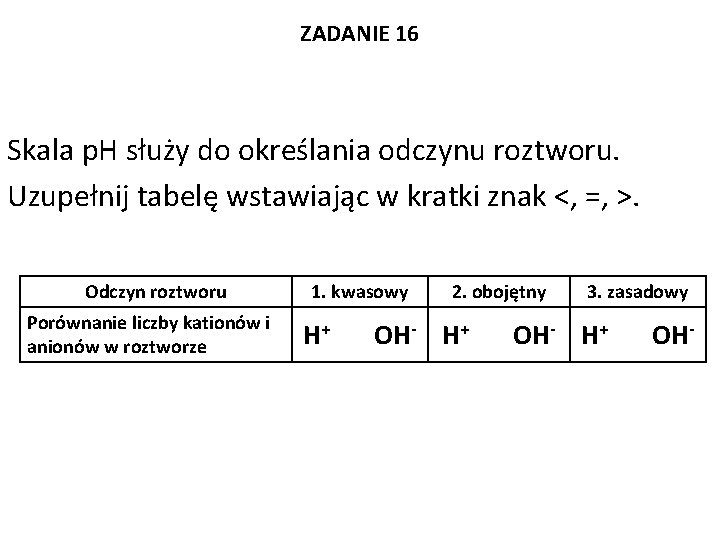
ZADANIE 16 Skala p. H służy do określania odczynu roztworu. Uzupełnij tabelę wstawiając w kratki znak <, =, >. Odczyn roztworu Porównanie liczby kationów i anionów w roztworze 1. kwasowy H+ 2. obojętny OH- H+ 3. zasadowy OH- H+ OH-

ZADANIE 17 Uczeń spalił kawałek drewna, a otrzymany popiół zalał wodą i dobrze wymieszał. Następnie roztwór przesączył. Woda po przesączeniu w dotyku była śliska i zabarwiła papierek uniwersalny na kolor niebieski. Zaznacz poprawne odpowiedzi na pytania 1 – 3 dotyczące opisu powyżej. 1. Czy wszystkie składniki popiołu są nierozpuszczalne w wodzie? TAK / NIE 2. O czym świadczy zmiana barwy papierka uniwersalnego? POWSTAŁ KWAS / POWSTAŁA ZASADA. 3. Jaka jest wartość p. H przesączu? WIĘKSZA NIŻ 7 / MNIEJSZA NIŻ 7.

Zadanie 18 W roztworach znajdujących się w trzech zlewkach zanurzono uniwersalne papierki wskaźnikowe. W pierwszym roztworze papierek zabarwił się na czerwono, w drugim nie zmienił barwy, a w trzecim zabarwił się na niebiesko. Oceń prawdziwość każdego zdania. 1. Roztwór II może być roztworem chlorku sodu. P / F 2. Wartość p. H roztworów I i III jest różna od 7 P/F 3. Roztwór III może być roztworem kwasu solnego P / F 4. Wartość p. H wszystkich roztworów jest większa od 7. P / F 5. Roztwór I może być roztworem wodorotlenku sodu. P / F 6. Roztwór I ma odczyn obojętny, a roztwór II – kwasowy. P / F 7. W roztworze III fenoloftaleina zabarwiłaby się na kolor malinowy. P/F

Zadanie 19 Uczeń wrzucił do wody kawałek metalicznego sodu, po czym do roztworu dodał fenoloftaleinę. Wskaż wszystkie poprawne dokończenia zdania. W wyniku przeprowadzonego doświadczenia A. W zlewce wytrącił się osad. B. Roztwór zabarwił się na malinowo. C. Nie zaobserwowano żadnych zmian. D. Nastąpiło zmętnienie roztworu. E. Otrzymano roztwór o odczynie kwasowym. F. Otrzymano roztwór o odczynie zasadowym.

Zadanie 20 Oceń prawdziwość każdego zdania. Zaznacz P, jeśli zdanie jest prawdziwe, lub F, jeśli jest fałszywe. 1. Zasadami nazywamy wodorotlenki rozpuszczalne w wodzie. P/F 2. Zasadami nazywamy wodorotlenki nierozpuszczalne w wodzie. P / F 3. Substancje zbudowane z kationów metalu i anionów reszt kwasowych to kwasy. P / F 4. Kwasy to substancje, które w wodzie dysocjują na kationy wodoru i aniony reszt kwasowych. P / F
 Kwasy i wodorotlenki test
Kwasy i wodorotlenki test Wodorotlenki a zasady
Wodorotlenki a zasady Koh wzór strukturalny
Koh wzór strukturalny Podział wodorotlenków
Podział wodorotlenków Tlenek metalu + woda = wodorotlenek
Tlenek metalu + woda = wodorotlenek Wodorotlenki to związki chemiczne zbudowane z
Wodorotlenki to związki chemiczne zbudowane z Na żądanie pisownia
Na żądanie pisownia Przybliżenie z niedomiarem
Przybliżenie z niedomiarem Optymalizacja liniowa
Optymalizacja liniowa Zawór wydechowy w ubraniu gazoszczelnym ma za zadanie
Zawór wydechowy w ubraniu gazoszczelnym ma za zadanie Siły wzajemnego oddziaływania ciał naelektryzowanych
Siły wzajemnego oddziaływania ciał naelektryzowanych Roztwory wodne dzieli się na
Roztwory wodne dzieli się na Symbole sieciowe
Symbole sieciowe Zadanie domowe
Zadanie domowe Jak obliczyc paletowa jednostke ladunkowa
Jak obliczyc paletowa jednostke ladunkowa Zadanie
Zadanie Zadanie
Zadanie Dobór zabezpieczeń do silnika
Dobór zabezpieczeń do silnika Zadanie egzaminacyjne
Zadanie egzaminacyjne Pozew o ekwiwalent za urlop wzór
Pozew o ekwiwalent za urlop wzór Zawór wydechowy w ubraniu gazoszczelnym ma za zadanie
Zawór wydechowy w ubraniu gazoszczelnym ma za zadanie Minikoparka przemieszcza się ruchem jednostajnym
Minikoparka przemieszcza się ruchem jednostajnym