Zestawienie wiadomoci o solach podzia soli otrzymywanie soli











- Slides: 15

Zestawienie wiadomości o solach - podział soli - otrzymywanie soli - wybrane właściwości soli

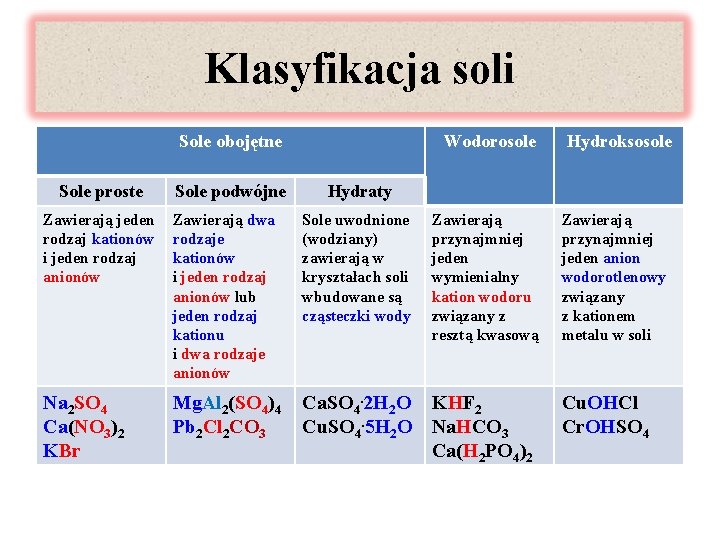
Klasyfikacja soli Sole obojętne Sole proste Sole podwójne Wodorosole Hydroksosole Hydraty Zawierają jeden rodzaj kationów i jeden rodzaj anionów Zawierają dwa rodzaje kationów i jeden rodzaj anionów lub jeden rodzaj kationu i dwa rodzaje anionów Sole uwodnione (wodziany) zawierają w kryształach soli wbudowane są cząsteczki wody Zawierają przynajmniej jeden wymienialny kation wodoru związany z resztą kwasową Na 2 SO 4 Ca(NO 3)2 KBr Mg. Al 2(SO 4)4 Pb 2 Cl 2 CO 3 Ca. SO 4. 2 H 2 O KHF 2 Cu. SO 4. 5 H 2 O Na. HCO 3 Ca(H 2 PO 4)2 Zawierają przynajmniej jeden anion wodorotlenowy związany z kationem metalu w soli Cu. OHCl Cr. OHSO 4

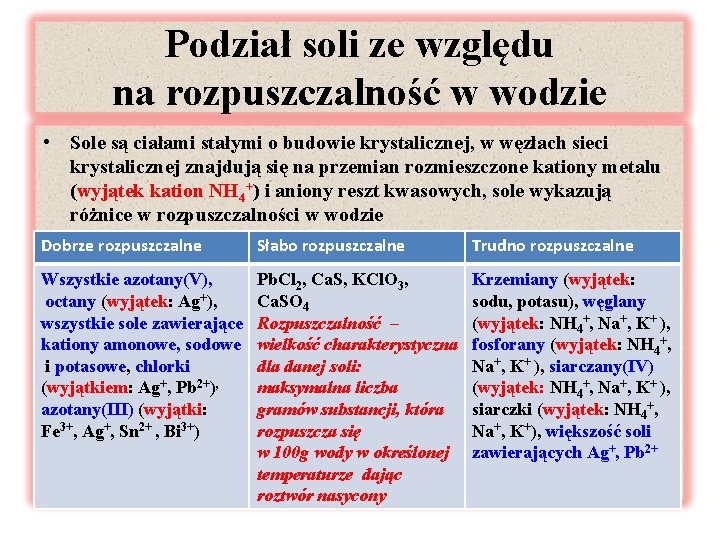
Podział soli ze względu na rozpuszczalność w wodzie • Sole są ciałami stałymi o budowie krystalicznej, w węzłach sieci krystalicznej znajdują się na przemian rozmieszczone kationy metalu (wyjątek kation NH 4+) i aniony reszt kwasowych, sole wykazują różnice w rozpuszczalności w wodzie Dobrze rozpuszczalne Słabo rozpuszczalne Trudno rozpuszczalne Wszystkie azotany(V), octany (wyjątek: Ag+), wszystkie sole zawierające kationy amonowe, sodowe i potasowe, chlorki (wyjątkiem: Ag+, Pb 2+), azotany(III) (wyjątki: Fe 3+, Ag+, Sn 2+ , Bi 3+) Pb. Cl 2, Ca. S, KCl. O 3, Ca. SO 4 Rozpuszczalność – wielkość charakterystyczna dla danej soli: maksymalna liczba gramów substancji, która rozpuszcza się w 100 g wody w określonej temperaturze dając roztwór nasycony Krzemiany (wyjątek: sodu, potasu), węglany (wyjątek: NH 4+, Na+, K+ ), fosforany (wyjątek: NH 4+, Na+, K+ ), siarczany(IV) (wyjątek: NH 4+, Na+, K+ ), siarczki (wyjątek: NH 4+, Na+, K+), większość soli zawierających Ag+, Pb 2+

Podział soli ze względu na reakcję jonów soli z wodą • Sole pochodzące od mocnych kwasów i mocnych zasad nie ulegają hydrolizie, odczyn ich wodnego roztworu jest zbliżony do obojętnego • Rozpuszczalne sole pochodzące od mocnych kwasów i słabych zasad w roztworach wodnych wykazują odczyn kwasowy, ponieważ ulegają hydrolizie kationowej: Mem+ + m. H 2 O Me(OH)m + m. H+ • Rozpuszczalne sole pochodzące od słabych kwasów i mocnych zasad w roztworach wodnych wykazują odczyn zasadowy, ponieważ ulegają hydrolizie anionowej: Rn- + n. H 2 O Hn. R + n. OH- • Rozpuszczalne sole pochodzące od słabych kwasów i słabych zasad w roztworach wodnych wykazują odczyn zbliżony do obojętnego, ponieważ ulegają hydrolizie anionowo -kationowej: (n ≠ m): n. Mem+ + m. Rn- + n. m. H 2 O n. Me(OH)m + m. Hn. R (n = m): Mem+ + Rn- + n. H 2 O Me(OH)m + Hn. R

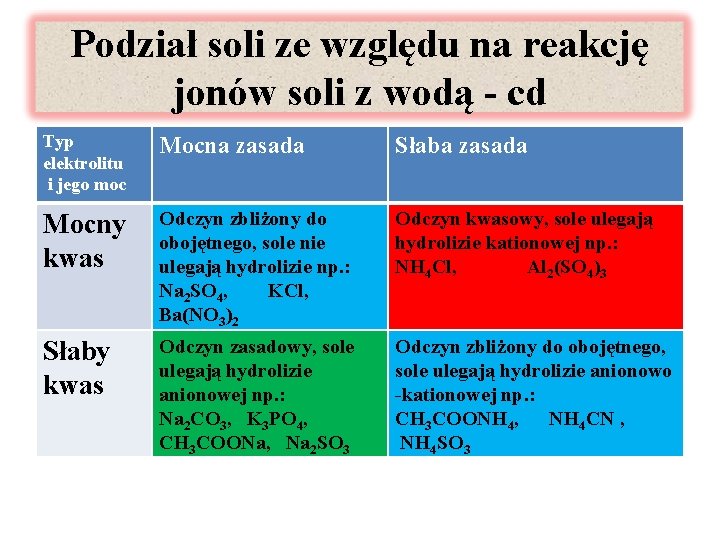
Podział soli ze względu na reakcję jonów soli z wodą - cd Typ elektrolitu i jego moc Mocna zasada Słaba zasada Mocny kwas Odczyn zbliżony do obojętnego, sole nie ulegają hydrolizie np. : Na 2 SO 4, KCl, Ba(NO 3)2 Odczyn kwasowy, sole ulegają hydrolizie kationowej np. : NH 4 Cl, Al 2(SO 4)3 Słaby kwas Odczyn zasadowy, sole ulegają hydrolizie anionowej np. : Na 2 CO 3, K 3 PO 4, CH 3 COONa, Na 2 SO 3 Odczyn zbliżony do obojętnego, sole ulegają hydrolizie anionowo -kationowej np. : CH 3 COONH 4, NH 4 CN , NH 4 SO 3

Odczyny wodnych roztworów hydroksosoli i wodorosoli • Odczyny wodnych roztworów hydroksosoli i wodorosoli jest odmienny niż soli obojętnych, ponieważ do roztworu przechodzą obok kationów metalu i anionów reszt kwasowych w hydroksosolach aniony: OHw wodorosolach: kationy H+ Typ soli Odczyn wodnego roztworu K 2 SO 4 KHSO 4 Obojętny Kwasowy Na 2 SO 3 Na. HSO 3 Zasadowy Kwasowy (p. H ≈ 10) (p. H ≈ 5) Na 3 PO 4 Na. H 2 PO 4 Zasadowy Kwasowy (p. H ≈ 12) (p. H ≈ 5) Na 2 CO 3 *Na. HCO 3 Zasadowy (p. H ≈ 11) (p. H ≈8) • mmmm * W tym przypadku proces hydrolizy jest dominujący, nad procesem dysocjacji jonu HCO 3 -

Metody otrzymywania soli • Reakcja zobojętniania: wodorotlenek + kwas sól + woda 1. n = m; Me(OH)m + Hn. R Me. R + n. H 2 O KOH + HNO 3 KNO 3 + H 2 O Ba(OH)2 + H 2 SO 4 Ba. SO 4 + 2 H 2 O 2. n ≠ m; n. Me(OH)m + m. Hn. R Men. Rm + n. m. H 2 O Ca(OH)2 + 2 HBr Ca. Br 2 + 2 H 2 O 3 Mg(OH)2 +2 H 3 PO 4 Mg 3(PO 4)2 + 6 H 2 O 2 Al(OH)3 + 3 H 2 SO 4 Al 2(SO 4)3 + 6 H 2 O

Metody otrzymywania soli – cd • Tlenek zasadowy + kwas sól + woda: m = n = 2; Me. O + Hn. R Me. R + ½ n. H 2 O Ca. O + H 2 SO 4 Ca. SO 4 + H 2 O m = n = 1; Me 2 O + 2 HR 2 Me. R + n. H 2 O K 2 O + 2 HI 2 KI + H 2 O m ≠ n; n. Me 2 Om + m. Hn. R n. Men. Rm + ½m. n. H 2 O Al 2 O 3 + 3 H 2 SO 4 Al 2(SO 4)3 + 3 H 2 O 3 Na 2 O + 2 H 3 PO 4 2 Na 3 PO 4 + 3 H 2 O Ba. O + 2 HNO 3 Na(NO 3)2 + H 2 O • Uwaga: współczynniki stechiometryczne n i m należy każdorazowo dobrać w każdym równaniu reakcji

Metody otrzymywania soli – cd • Metal + kwas sól + wodór: (reakcja kwasów z metalami znajdującymi się w szeregu aktywności metali przed wodorem (wyjątki: metale półszlachetne: Cu, Hg, Ag, które reagują z kwasami utleniającymi: H 2 SO 4 stężony, HNO 3 stężony lub rozcieńczony, reakcje przebiegają z częściową redukcją kwasu do SO 2 lub NO, NO 2, produktem ubocznym obok soli jest woda, kolejne wyjątki to pasywacja niektórych metali w reakcji ze stężonymi kwasami utleniającymi, np. Fe z H 2 SO 4, Al z HNO 3) • 1. m = n; Me + Hn. R Me. R + ½ H 2 2 Na + 2 HCl 2 Na. Cl + H 2 Ca + H 2 SO 4 Ca. SO 4 + H 2 • 2. m ≠ n; n. Me + m. Hn. R + ½m. n. H 2 Mg + 2 HBr Zn. Br 2 + H 2 2 Al + 3 H 2 SO 4 Al 2(SO 4)3 + 3 H 2

Metody otrzymywania soli – cd • Zasada + tlenek kwasowy sól + woda: Ca(OH)2 + CO 2 Ca. CO 3 + H 2 O Ba(OH)2 + SO 3 Ba. SO 4 + H 2 O 12 Li. OH + P 4 O 10 4 Li 3 PO 4 + 6 H 2 O • Tlenek zasadowy + tlenek kwasowy sól Na 2 O + SO 2 Na 2 SO 3 6 Ca. O + P 4 O 10 2 Ca 3(PO 4)2

Metody otrzymywania soli – cd • Synteza z pierwiastków – metal + niemetal sól kwasu beztlenowego Hg + S Hg. S 2 Na + Cl 2 2 Na. Cl 2 Al + 3 F 2 2 Al. F 3 • Sól kwasu słabego + kwas mocny sól kwasu mocnego + kwas słaby Na 2 CO 3 + 2 HCl 2 Na. Cl + CO 2 + H 2 O K 2 SO 3 + 2 HBr 2 KBr + SO 2 + H 2 O

Metody otrzymywania soli – cd • Sól(I) + sól(II) sól(III) + sól(IV) (sole jako substraty muszą być rozpuszczalne w wodzie, jedna z soli jako produkt musi być słabo rozpuszczalna - z reguły sól słabej zasady i słabszego kwasu): Ag. NO 3 + Na. Cl ↓Ag. Cl + Na. NO 3 K 2 CO 3 + Ca(NO 3)2 ↓Ca. CO 3 + 2 KNO 3 • Sól(I) + zasada(I) sól(II) + zasada(II) (jeden z produktów musi być nierozpuszczalny w wodzie): Cr 2(SO 4)3 + 6 Na. OH 3 Na 2 SO 4 + ↓ 2 Cr(OH)3 • Sól metalu(I) + metal(II) sól metalu(II) + metal(I) - metal znajdujący się w szeregu aktywności metali przed pozostałymi metalami wypiera je z soli: 2 Ag. NO 3 + Cu Cu(NO 3)2 + 2 Ag 3 Cu. SO 4 + 2 Fe Fe 2(SO 4)3 + 3 Cu

Metody otrzymywania soli – cd • Sól kwasu beztlenowego(I) + niemetal(II) aktywniejszy sól kwasu beztlenowego(II) + niemetal(II): 2 Na. I + F 2 2 Na. F + I 2 2 KBr + Cl 2 2 KCl + Br 2 • Niektóre niemetale + zasada sól(I) + sól(II) + woda: 3 S + 6 Na. OH Na 2 SO 3 + 2 Na 2 S + 3 H 2 O Cl 2 + 2 KOH KCl + KCl. O + H 2 O • Wodorek kwasowy + wodorek zasadowy sól HCl(g) + NH 3(g) NH 4 Cl(s) (reakcja specyficzna)

Metody otrzymywania soli – cd • Pozostałe metody: • Termiczny rozkład niektórych soli 4 KCl. O 3 3 KCl. O 4 + KCl lub 2 KCl. O 3 2 KCl + 3 O 2 • Reakcje soli z udziałem utleniaczy lub reduktorów 2 KMn. O 4 + 5 Na 2 SO 3 + 3 H 2 SO 4 K 2 SO 4 + 5 Na 2 SO 4 + 2 Mn. SO 4 + 3 H 2 O 2 KMn. O 4 + 3 Na 2 SO 3 + H 2 O 3 Na 2 SO 4 + 2 Mn. O 2 + 2 KOH 2 KMn. O 4 + Na 2 SO 3 + 2 KOH 2 K 2 Mn. O 4 + Na 2 SO 4 + H 2 O 4 Cr. Cl 2 + 4 HCl + O 2 4 Cr. Cl 3 + 2 H 2 O

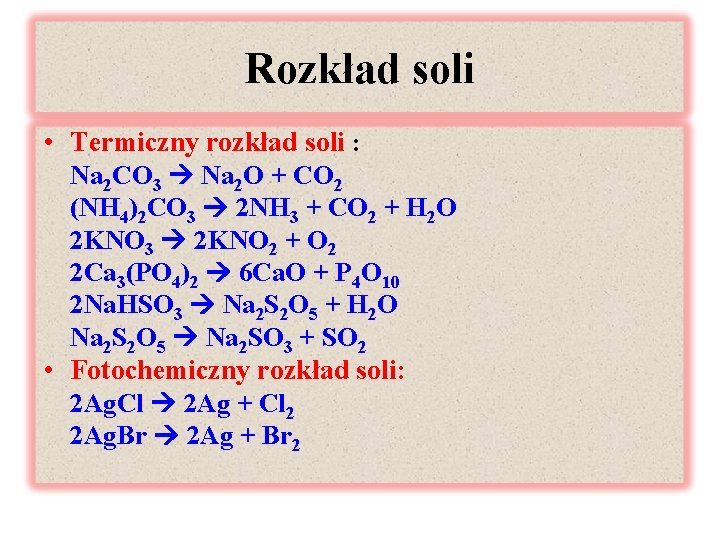
Rozkład soli • Termiczny rozkład soli : Na 2 CO 3 Na 2 O + CO 2 (NH 4)2 CO 3 2 NH 3 + CO 2 + H 2 O 2 KNO 3 2 KNO 2 + O 2 2 Ca 3(PO 4)2 6 Ca. O + P 4 O 10 2 Na. HSO 3 Na 2 S 2 O 5 + H 2 O Na 2 S 2 O 5 Na 2 SO 3 + SO 2 • Fotochemiczny rozkład soli: 2 Ag. Cl 2 Ag + Cl 2 2 Ag. Br 2 Ag + Br 2
 Reakcja zobojętniania soli
Reakcja zobojętniania soli Otrzymywanie soli zadania
Otrzymywanie soli zadania Soli
Soli Ekonomiczne zestawienie
Ekonomiczne zestawienie Zestawienie obrotow i sald
Zestawienie obrotow i sald Zestawienie zbiorcze nadań
Zestawienie zbiorcze nadań Kristalizacija kuhinjske soli
Kristalizacija kuhinjske soli Stopnie utlenienia manganu
Stopnie utlenienia manganu Nitrowanie fenolu
Nitrowanie fenolu Hydroliza nitryli
Hydroliza nitryli Otrzymywanie wodorotlenków
Otrzymywanie wodorotlenków Dysocjacja hcl
Dysocjacja hcl Estry zapachy
Estry zapachy Rozkład alkanów o długich łańcuchach węglowych
Rozkład alkanów o długich łańcuchach węglowych Metale
Metale Szereg homologiczny alkenów
Szereg homologiczny alkenów