chemia stosowana I temat woda i roztwory WODA

2 Fe. tworzenie hydratów soli Mg. Cl 2· 6 H 2 O [Mg(H 2 O)62+](Cl–)2 Fe.](https://slidetodoc.com/presentation_image_h/a5ac5a2250720befd21a3de0cc31926c/image-7.jpg)









- Slides: 22

chemia stosowana I temat: woda i roztwory

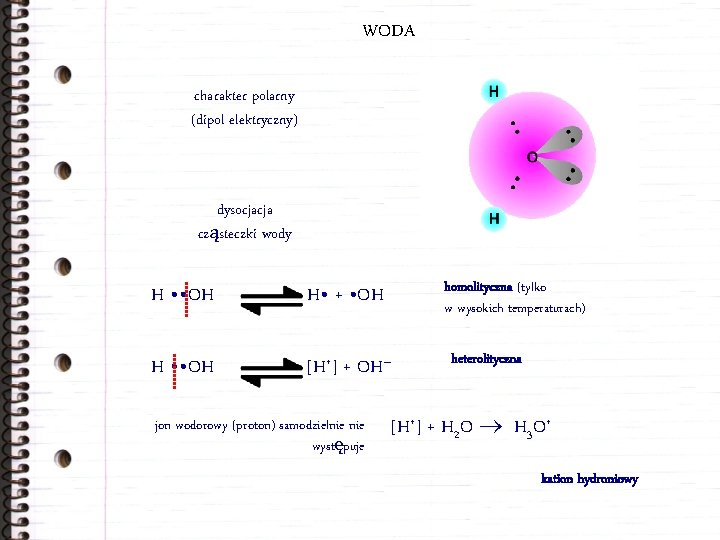
WODA charakter polarny (dipol elektryczny) dysocjacja cząsteczki wody H • • OH H • + • OH H • • OH [H+] + OH– jon wodorowy (proton) samodzielnie występuje homolityczna (tylko w wysokich temperaturach) heterolityczna [H+] + H 2 O H 3 O+ kation hydroniowy

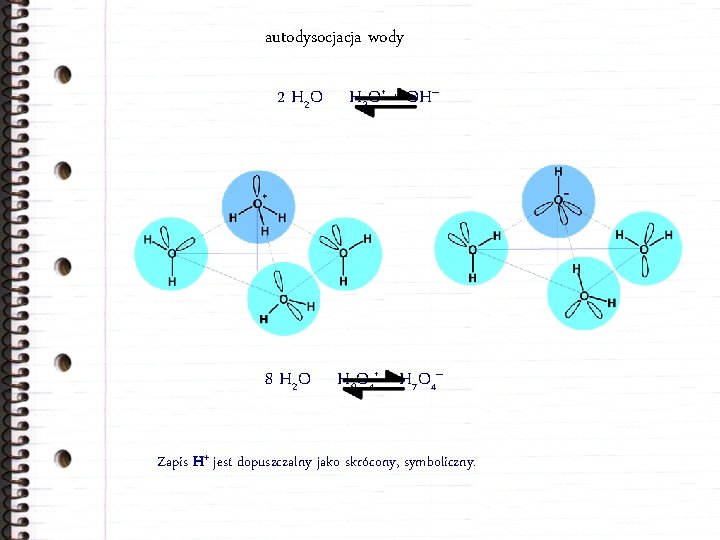
autodysocjacja wody 2 H 2 O 8 H 2 O H 3 O+ + OH– H 9 O 4+ + H 7 O 4– Zapis H+ jest dopuszczalny jako skrócony, symboliczny.

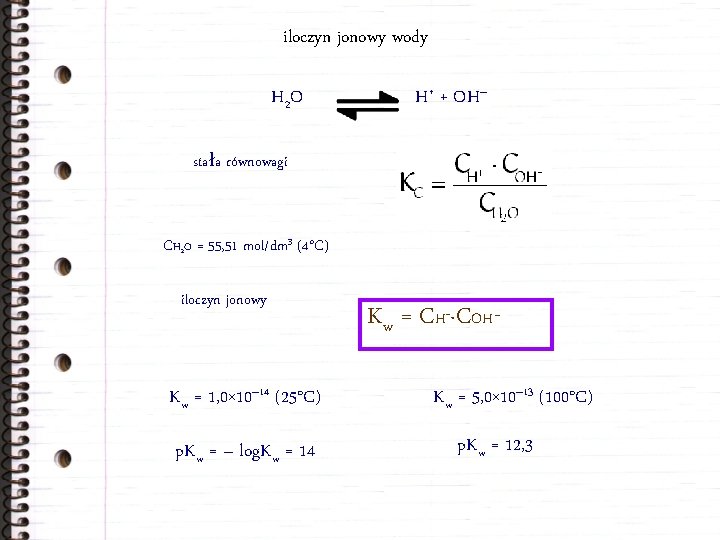
iloczyn jonowy wody H 2 O H+ + OH– stała równowagi CH 2 O = 55, 51 mol/dm 3 (4°C) iloczyn jonowy Kw = 1, 0× 10– 14 (25°C) p. Kw = – log. Kw = 14 Kw = CH+·COH– Kw = 5, 0× 10– 13 (100°C) p. Kw = 12, 3

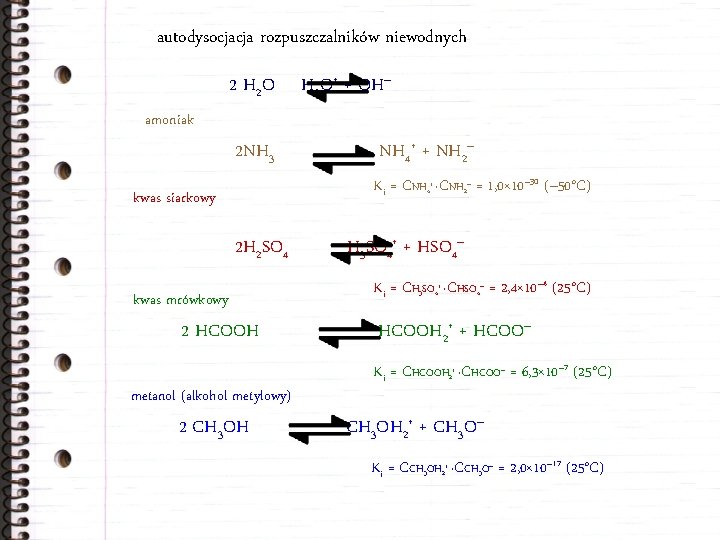
autodysocjacja rozpuszczalników niewodnych 2 H 2 O H 3 O+ + OH– amoniak 2 NH 3 NH 4+ + NH 2– Ki = CNH 4+ ·CNH 2– = 1, 0× 10– 30 (– 50°C) kwas siarkowy 2 H 2 SO 4 kwas mrówkowy 2 HCOOH metanol (alkohol metylowy) 2 CH 3 OH H 3 SO 4+ + HSO 4– Ki = CH 3 SO 4+ ·CHSO 4– = 2, 4× 10– 4 (25°C) HCOOH 2+ + HCOO– Ki = CHCOOH 2+ ·CHCOO– = 6, 3× 10– 7 (25°C) CH 3 OH 2+ + CH 3 O– Ki = CCH 3 OH 2+ ·CCH 3 O– = 2, 0× 10– 17 (25°C)

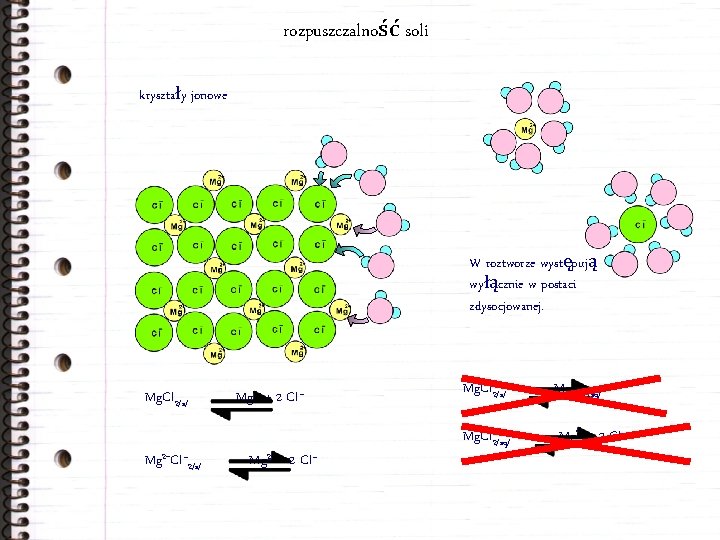
rozpuszczalność soli kryształy jonowe W roztworze występują wyłącznie w postaci zdysocjowanej. Mg. Cl 2/s/ Mg 2+Cl– 2/s/ Mg 2+ + 2 Cl– Mg. Cl 2/s/ Mg. Cl 2/aq/ Mg 2+ + 2 Cl–
2 Fe.](https://slidetodoc.com/presentation_image_h/a5ac5a2250720befd21a3de0cc31926c/image-7.jpg)
tworzenie hydratów soli Mg. Cl 2· 6 H 2 O [Mg(H 2 O)62+](Cl–)2 Fe. Cl 3· 6 H 2 O [Fe(H 2 O)63+](Cl–)3 Mg(Cl. O 4)2· 6 H 2 O [Mg(H 2 O)62+](Cl. O 4–)2 Fe(NH 4)2(SO 4)2· 6 H 2 O [Fe(H 2 O)62+](NH 4+)2(SO 42–)2 KAl(SO 4)2· 12 H 2 O [K(H 2 O)6+][Al(H 2 O)63+](SO 42–)2 KCr(SO 4)2· 12 H 2 O [K(H 2 O)6+][Cr(H 2 O)63+](SO 42–)2 Fe. SO 4· 7 H 2 O [Fe(H 2 O)62+](SO 42–)(H 2 O) Ni. SO 4· 7 H 2 O [Ni(H 2 O)62+](SO 42–)(H 2 O) Co. SO 4· 7 H 2 O [Co(H 2 O)62+](SO 42–)(H 2 O) Cu. SO 4· 5 H 2 O [Cu(H 2 O)42+](SO 42–)(H 2 O)

rozpuszczalność soli Wartość energii sieci krystalicznej Es i energii hydratacji Eh niektórych soli Sól Es k. J/mol Eh k. J/mol M = Es - Eh k. J/mol Li. Cl Na. Cl KCl Na. Br Ag. Cl Ag. Br Ag. I 831, 8 764, 9 690, 0 731, 5 886, 2 873, 6 852, 7 836, 0 739, 8 664, 6 710, 6 785, 8 756, 6 760, 8 -4, 2 25, 1 25, 4 20, 9 100, 4 117, 0 91, 9

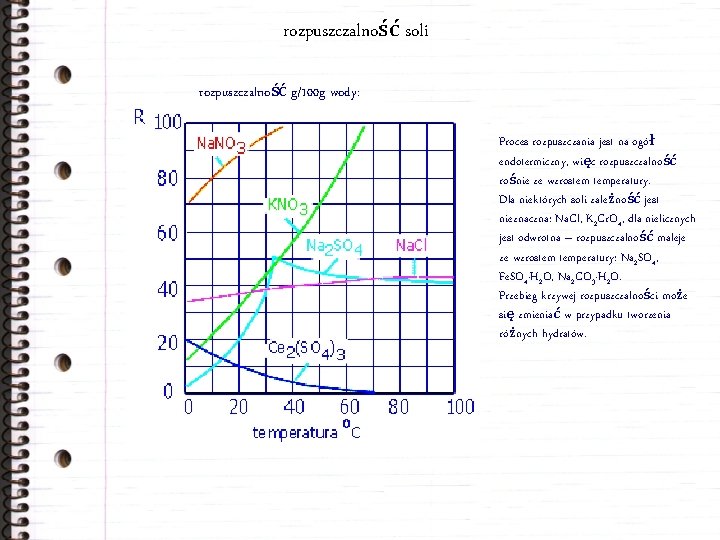
rozpuszczalność soli rozpuszczalność g/100 g wody: Proces rozpuszczania jest na ogół endotermiczny, więc rozpuszczalność rośnie ze wzrostem temperatury. Dla niektórych soli zależność jest nieznaczna: Na. Cl, K 2 Cr. O 4, dla nielicznych jest odwrotna – rozpuszczalność maleje ze wzrostem temperatury: Na 2 SO 4, Fe. SO 4·H 2 O, Na 2 CO 3·H 2 O. Przebieg krzywej rozpuszczalności może się zmieniać w przypadku tworzenia różnych hydratów.

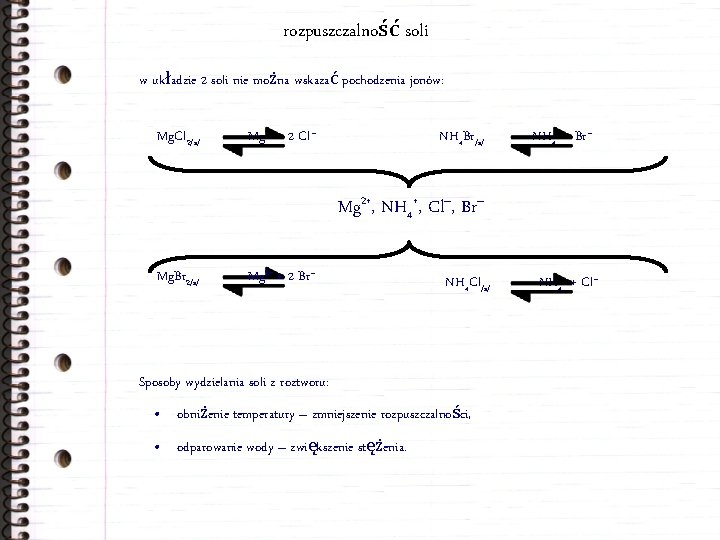
rozpuszczalność soli w układzie 2 soli nie można wskazać pochodzenia jonów: Mg. Cl 2/s/ Mg 2+ + 2 Cl– NH 4 Br/s/ NH 4+ + Br– Mg 2+, NH 4+, Cl–, Br– Mg. Br 2/s/ Mg 2+ + 2 Br– NH 4 Cl/s/ Sposoby wydzielania soli z roztworu: • obniżenie temperatury – zmniejszenie rozpuszczalności, • odparowanie wody – zwiększenie stężenia. NH 4+ + Cl–

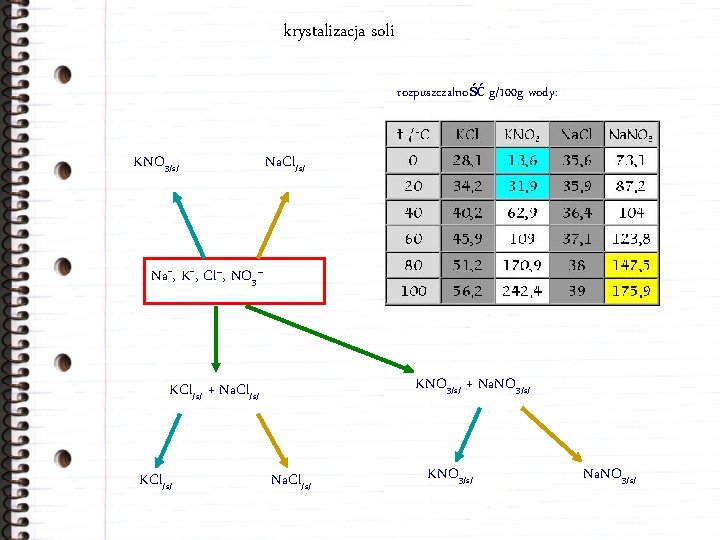
krystalizacja soli rozpuszczalność g/100 g wody: KNO 3/s/ Na. Cl/s/ Na+, K+, Cl–, NO 3– KNO 3/s/ + Na. NO 3/s/ KCl/s/ + Na. Cl/s/ KCl/s/ Na. Cl/s/ KNO 3/s/ Na. NO 3/s/

sole trudno rozpuszczalne • azotany, octany, chlorany są rozpuszczalne, • chlorki, bromki, jodki są rozpuszczalne z wyjątkiem soli Ag(I), Hg(I), Pb(II), Cu(I), Hg. I 2, Bi. I 3 i Sb. I 3, • siarczany są rozpuszczalne z wyjątkiem soli Ca, Sr, Ba i Pb(II), • siarczki są trudno rozpuszczalne z wyjątkiem soli litowców i berylowców, • fosforany, węglany i wodorotlenki są nierozpuszczalne z wyjątkiem soli litowców, • sole litowców (i amonu) są rozpuszczalne

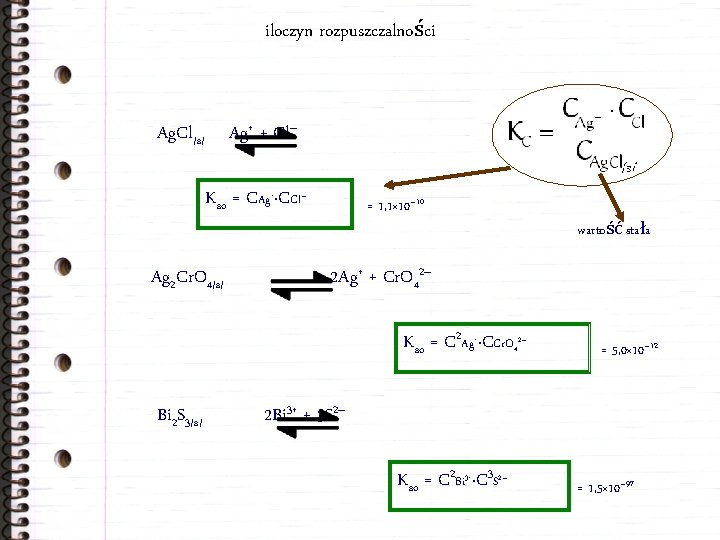
iloczyn rozpuszczalności Ag+ + Cl– Ag. Cl/s/ Kso = CAg+·CCl– Ag 2 Cr. O 4/s/ = 1, 1× 10– 10 2 Ag+ + Cr. O 42– Kso = C 2 Ag+·CCr. O 42– Bi 2 S 3/s/ wartość stała = 5, 0× 10– 12 2 Bi 3+ + 3 S 2– Kso = C 2 Bi 3+·C 3 S 2– = 1, 5× 10– 97

iloczyn rozpuszczalności a rozpuszczalność Mg(NH 4)PO 4 Mg 2+ + NH 4+ + PO 43– Kso = 2, 5× 10– 13 stężenie CMg(NH 4)PO 4 = x Kso = CMg 2+ · CNH 4+ · CPO 43– = x 3 = 2, 5× 10– 13 Ca 3(PO 4)2 3 Ca 2+ + 2 PO 43– x = 6, 3× 10– 5 mol/dm 3 Kso = 1, 0× 10– 25 stężenie CCa 3(PO 4)2 = x Kso = C 3 Ca 2+ · C 2 PO 43– = (3 x)3·(2 x)2 = 1, 0× 10– 25 Ogólnie dla związku o wzorze Aa. Bb rozpuszczalność: x = 3, 9× 10– 6 mol/dm 3

efekt wspólnego jonu Ba 2+ + SO 42– Ba. SO 4 Kso = CBa 2+ · CSO 42– dla ilości stechiometrycznej siarczanów: CBa 2+ = 1, 0× 10– 5 mol/dm 3 (1, 4× 10– 3 g/dm 3) można zastosować nadmiar siarczanów: CBa 2+ = 1, 0× 10– 10/CSO 42– dla stężenia siarczanów 0, 001 M: CBa 2+ = 1, 0× 10– 7 mol/dm 3 (1, 4× 10– 5 g/dm 3) dla stężenia siarczanów 0, 01 M: CBa 2+ = 1, 0× 10– 8 mol/dm 3 (1, 4× 10– 6 g/dm 3) Nadmiar jonu strącającego sprzyja reakcji tworzenia osadu. Kso = 1, 0× 10– 10

iloczyn rozpuszczalności Kso = 10–p. Kso = – log Kso sól Ag. Cl p. Kso 9, 96 sól p. Kso Al(OH)3 32, 7 Ag. Br 12, 4 Cr(OH)3 30, 2 Ag. I 16, 0 Fe(OH)2 13, 5 Ag 2 Cr. O 4 11, 7 Fe(OH)3 37, 4 Ag 2 S 49, 5 Mg(OH)2 10, 9 Bi 2 S 3 96, 8 Sb(OH)3 41, 4 Cd. S 27, 8 Sn(OH)2 25, 3 Cu 2 S 46, 7 Zn(OH)2 16, 8 Hg. S 52, 4 Ba. CO 3 8, 2 Sn. S 26, 0 Ba. Cr. O 4 9, 7 Zn. S 25, 3 Ba. SO 4 10, 0

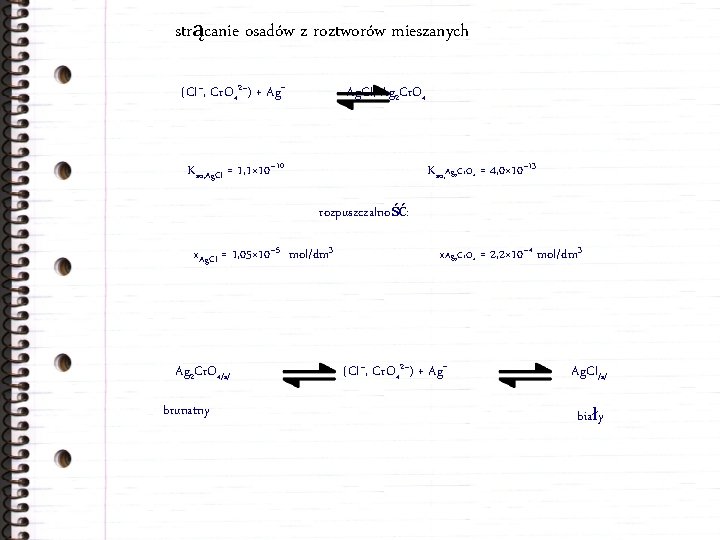
strącanie osadów z roztworów mieszanych (Cl–, Cr. O 42–) + Ag. Cl, Ag 2 Cr. O 4 Kso, Ag. Cl = 1, 1× 10– 10 Kso, Ag 2 Cr. O 4 = 4, 0× 10– 13 rozpuszczalność: x. Ag. Cl = 1, 05× 10– 5 mol/dm 3 Ag 2 Cr. O 4/s/ brunatny x. Ag 2 Cr. O 4 = 2, 2× 10– 4 mol/dm 3 (Cl–, Cr. O 42–) + Ag. Cl/s/ biały

strącanie osadów z roztworów mieszanych (Cl–, Br–, I–) + Ag+ Kso, Ag. Cl = 1, 1× 10– 10 Ag. Cl, Ag. Br, Ag. I Kso, Ag. Br = 4, 0× 10– 13 Kso, Ag. I = 1, 0× 10– 16 CAg+ = Kso, Ag. Cl / CCl– = Kso, Ag. Br / CBr– = Kso, Ag. I / CI– CBr– ______ Kso, Ag. Br ___ = CCl– Kso, Ag. Cl 0, 36% stężenia wyjściowego CI – Kso, Ag. I ______ = CCl– Kso, Ag. Cl 0, 00009% stężenia wyjściowego

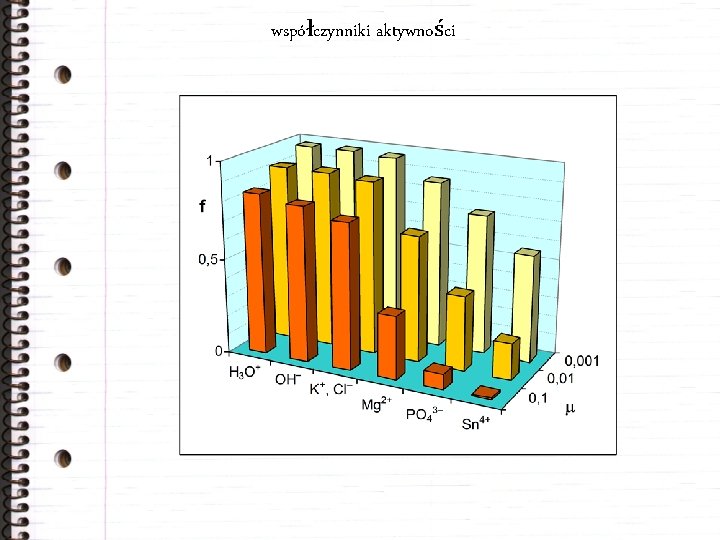
aktywność elektrolitów Dla dużych stężeń elektrolitu jony znajdują się w odległości umożliwiającej wzajemne oddziaływania maleje rzeczywista zdolność jonów do reagowania - aktywność. ai = fi·Ci/C° Dla roztworów rozcieńczonych fi = 1. a. A+b. B = c. C+d. D Termodynamiczna stała równowagi:

siła jonowa Określa efektywne oddziaływanie jonów obecnych w roztworze. = ½ zi 2·Ci Wg teorii Debye’a i Hückla, dla roztworów o < 0, 1: Dla wody jest: Dla roztworów o < 0, 01:

współczynniki aktywności

wpływ siły jonowej na rozpuszczalność (efekt „solny”) Ba. SO 4 współczynniki aktywności rozpuszczalność czysta woda 0, 97 2, 3× 10– 3 g/dm 3 0, 01 M Na. Cl 0, 63 3, 7× 10– 3 g/dm 3 0, 1 M Na. Cl 0, 33 7, 0× 10– 3 g/dm 3
 Podział roztworów
Podział roztworów Zmieszano dwa rodzaje soli kuchennej
Zmieszano dwa rodzaje soli kuchennej Ekonomia stosowana
Ekonomia stosowana Psychologia teoretyczna
Psychologia teoretyczna Model sita i kapitału ludzkiego
Model sita i kapitału ludzkiego Maszyna stosowana przy produkcji kaszy
Maszyna stosowana przy produkcji kaszy Klasyczne czynniki produkcji
Klasyczne czynniki produkcji Prezentacja o pilce noznej
Prezentacja o pilce noznej Esej na temat
Esej na temat Ego psychologia
Ego psychologia Ciekawostki o kardynale wyszyńskim
Ciekawostki o kardynale wyszyńskim Esej na temat
Esej na temat Temat prezentacji
Temat prezentacji Rodzina wyrazow dom
Rodzina wyrazow dom Typy rymów
Typy rymów Budowa i funkcje łodygi
Budowa i funkcje łodygi Dneperska skola
Dneperska skola Kso chemia
Kso chemia Wydział psychologii uw
Wydział psychologii uw 15g magnezu poddano reakcji chemicznej z kwasem etanowym
15g magnezu poddano reakcji chemicznej z kwasem etanowym Moc kwasów tlenowych
Moc kwasów tlenowych Benzoamina
Benzoamina Zasady pobierania próbek do badań laboratoryjnych
Zasady pobierania próbek do badań laboratoryjnych









































