CHEMIA OGLNA STANY SKUPIENIA MATERII Wojciech Solarski STANY























- Slides: 48

CHEMIA OGÓLNA STANY SKUPIENIA MATERII Wojciech Solarski

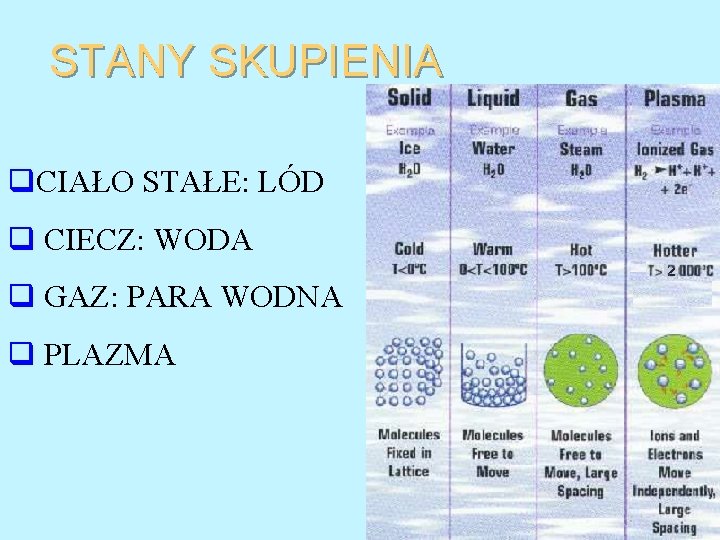
STANY SKUPIENIA • CIAŁO STAŁE • CIECZ

STANY SKUPIENIA • CIAŁO STAŁE • CIECZ l GAZ l PLAZMA

STANY SKUPIENIA q. CIAŁO STAŁE: LÓD q CIECZ: WODA q GAZ: PARA WODNA q PLAZMA

PLAZMA

ZASTOSOWANIA TECHNIKA Plazmowe narzędzia do cięcia metali i stopów (stal, aluminium, miedź) o grubości 0, 6 – 150 mm ANALITYKA CHEMICZNA spektrometria emisyjna ze wzbudzeniem plazmowym

UKŁAD FAZA GAZOWA l FAZA CIEKŁA l FAZA STAŁA l FAZA – CZĘŚĆ UKŁADU, ODDZIELONA OD INNYCH CZĘŚCI GRANICAMI FAZOWYMI, W KTÓREJ SUBSTANCJA POSIADA JEDNAKOWE WŁAŚCIWOŚCI FIZYCZNE I CHEMICZNE

Faza To w jakiej fazie występuje substancja zależy od: Siły oddziaływań międzycząsteczkowych. l Temperatura l Ciśnienie l

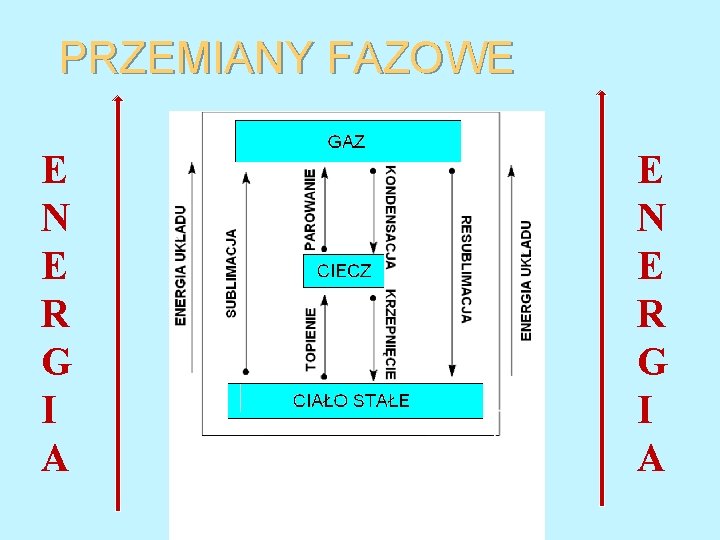
PRZEMIANY FAZOWE E N E R G I A

PRZEMIANY FAZOWE

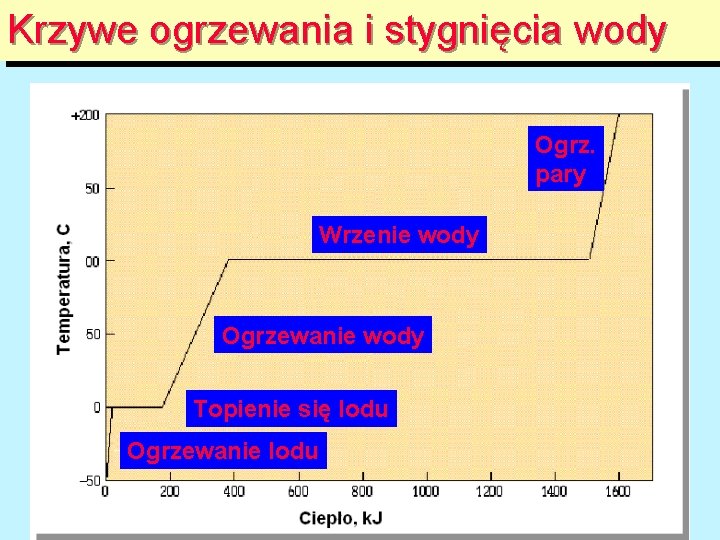
Krzywe ogrzewania i stygnięcia wody Ogrz. pary Wrzenie wody Ogrzewanie wody Topienie się lodu Ogrzewanie lodu

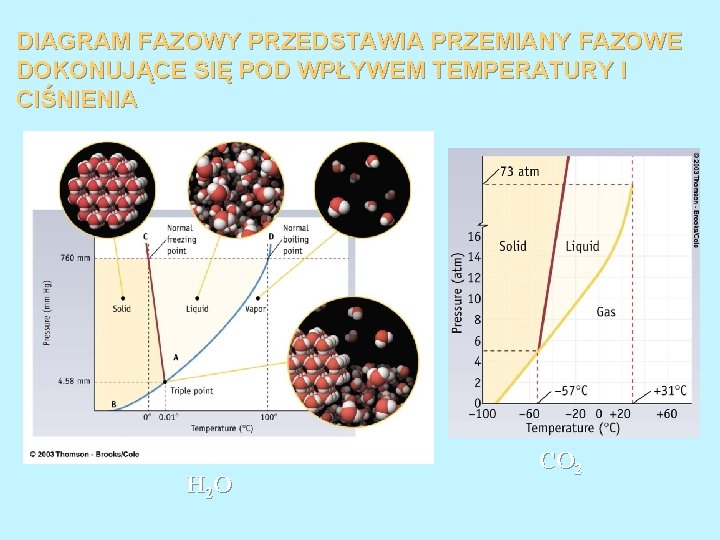
DIAGRAM FAZOWY PRZEDSTAWIA PRZEMIANY FAZOWE DOKONUJĄCE SIĘ POD WPŁYWEM TEMPERATURY I CIŚNIENIA H 2 O CO 2

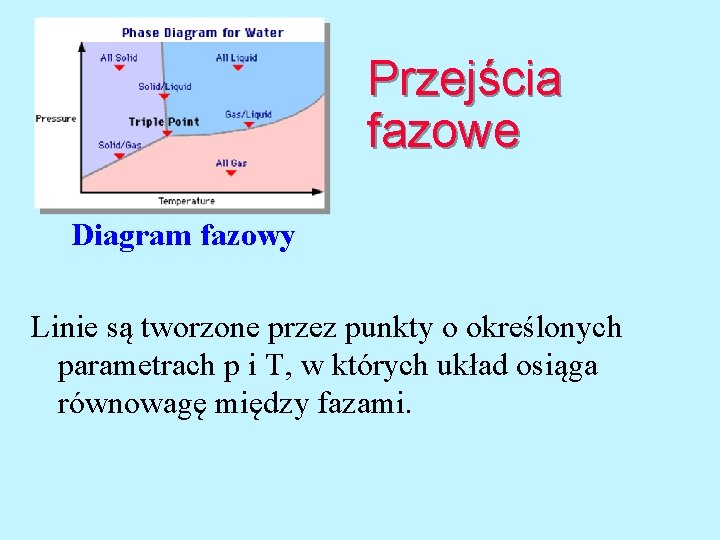
Przejścia fazowe Diagram fazowy Linie są tworzone przez punkty o określonych parametrach p i T, w których układ osiąga równowagę między fazami.

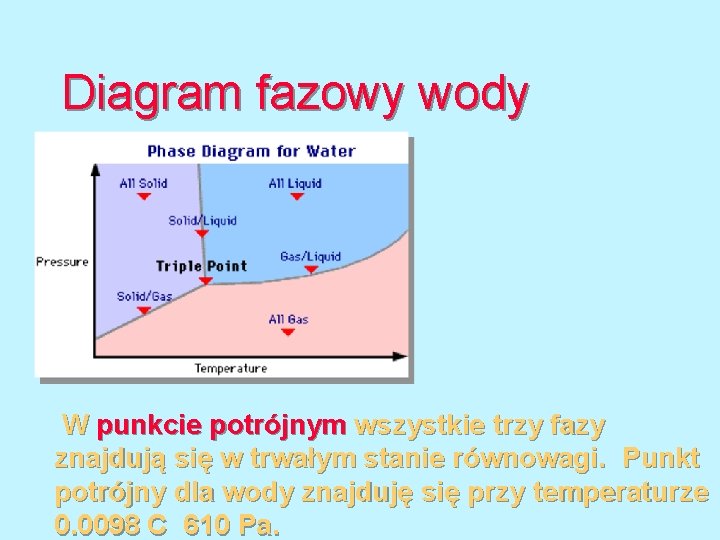
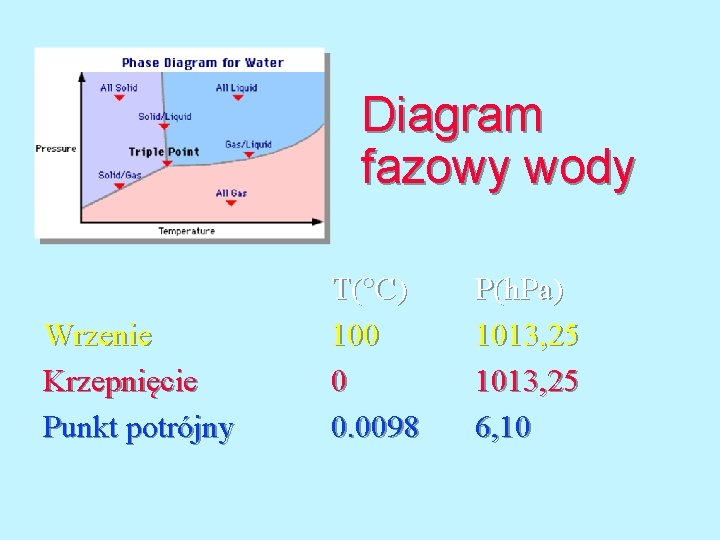
Diagram fazowy wody W punkcie potrójnym wszystkie trzy fazy znajdują się w trwałym stanie równowagi. Punkt potrójny dla wody znajduję się przy temperaturze 0. 0098 C 610 Pa.

Diagram fazowy wody Wrzenie Krzepnięcie Punkt potrójny T( C) 100 0 0. 0098 P(h. Pa) 1013, 25 6, 10

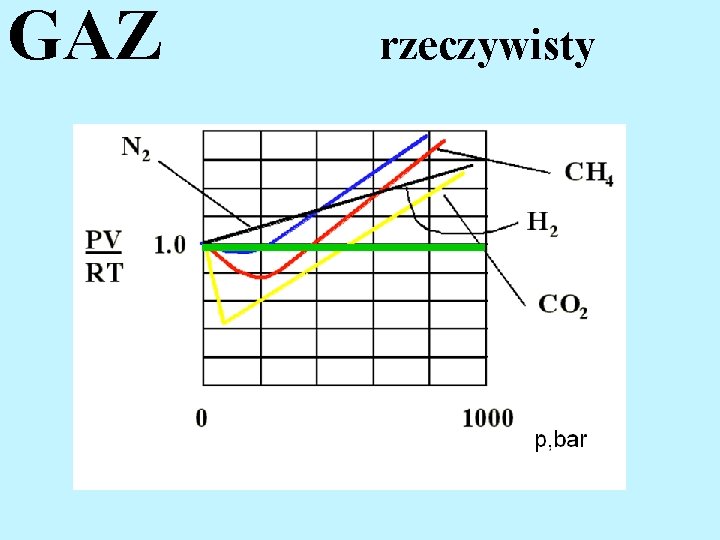
GAZ

GAZ Model gazu doskonałego można scharakteryzować następującymi założeniami: 1. Gaz składa się z cząsteczek (atomów) będących w nieustającym, przypadkowym ruchu. 2. Cząsteczki (atomy) można traktować jako punkty bezwymiarowe. Można zaniedbać wymiary cząsteczek. Średnica cząsteczek (atomów) jest znacznie mniejsza od średniej drogi między zderzeniami. 3. Zderzenia cząsteczek i atomów są „zderzeniami sprężystymi”.

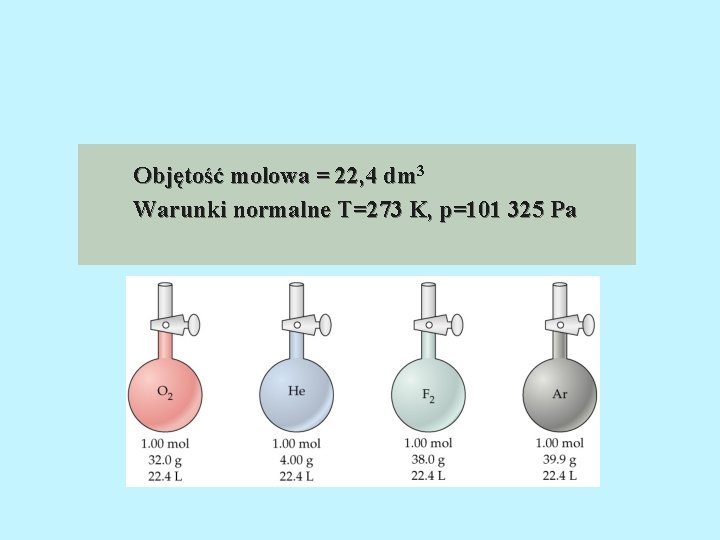
GAZ T =273 K, p = 101325 Pa Prawa gazu doskonałego Prawo Avogadra Jednakowe objętości różnych gazów znajdujących się pod tym samym ciśnieniem i w tej samej temperaturze zawierają jednakową liczbę cząsteczek. Z prawa tego wynika, że jednakowa liczba moli różnych gazów w tych samych warunkach ciśnienia i temperatury zajmuje tą samą objętość. Objętość jednego mola gazu doskonałego tzw. objętość molowa, w warunkach normalnych wynosi: V 0 =22, 415 dm 3 /mol Liczba cząsteczek (atomów) w jednym molu nosi nazwę liczby Avogadra i wynosi: 23 N = 6, 023 * 10 A

Objętość molowa = 22, 4 dm 3 Warunki normalne T=273 K, p=101 325 Pa

GAZ doskonały Równanie stanu gazu doskonałego Równania opisujące zachowanie się gazów wczasie przemian: izotermicznej, izobarycznej i izochorycznej można sprowadzić do ogólnego równania stanu gazu doskonałego.

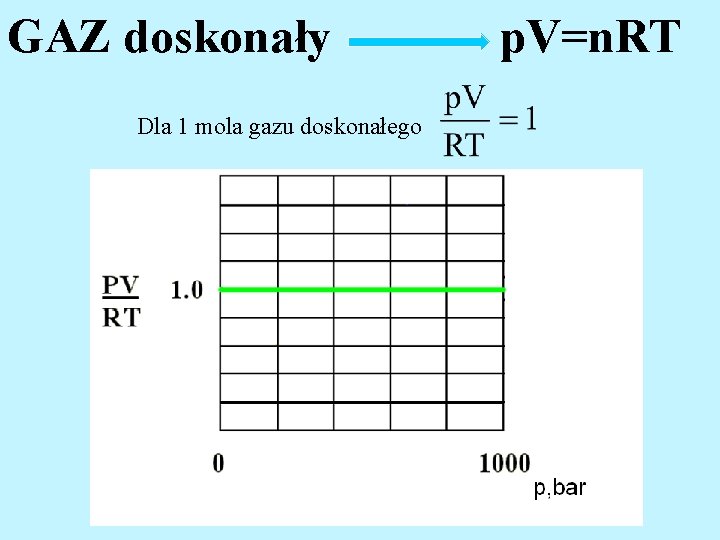
GAZ doskonały Równanie stanu gazu doskonałego R= 8, 314 J/mol*K Równanie Clapeyrona

GAZ doskonały p. V=n. RT Dla 1 mola gazu doskonałego

GAZ rzeczywisty W niskich temperaturach (mała energia kinetyczna cząsteczek) i przy wysokich ciśnieniach (duże zagęszczenie cząsteczek) nie można zaniedbać ani wymiarów cząsteczek ani ich wzajemnego oddziaływania.

GAZ rzeczywisty

GAZ rzeczywisty RÓWNANIE CLAPEYRONA gaz idealny (doskonały) RÓWNANIE VAN DER WAALSA gaz rzeczywisty

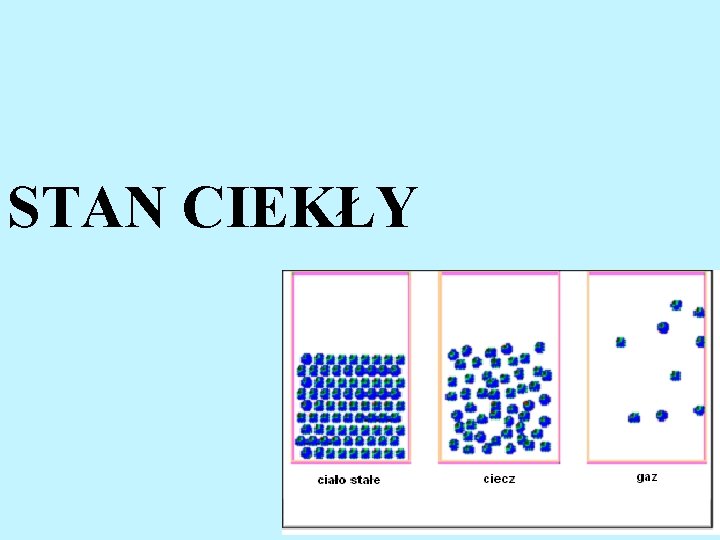
STAN CIEKŁY

Ciecze l l l Cząsteczki są w stałym ruchu Oddziaływują na siebie siłami międzycząsteczkowymi Odległości międzycząsteczkowe są znacznie mniesze niż w gazach Ciecze są praktycznie nieściśliwe Ciecze, w odróżnieniu do gazów, nie wypełniają całej objętości zbiornika

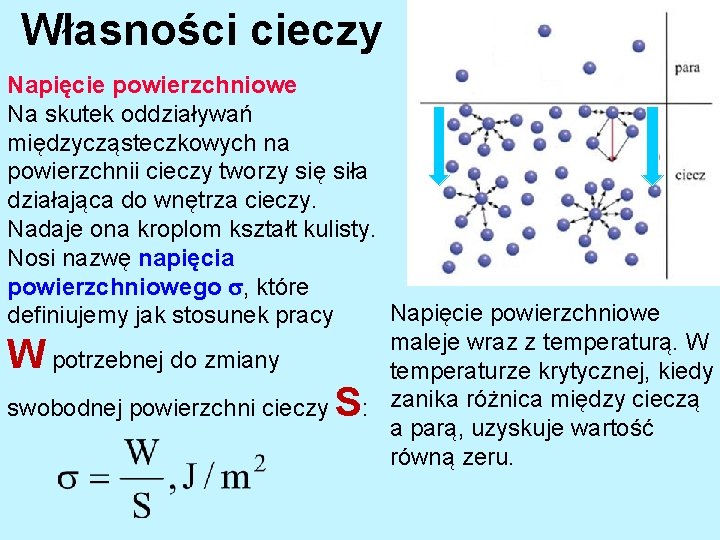
l Własności cieczy Napięcie powierzchniowe

Własności cieczy Napięcie powierzchniowe Na skutek oddziaływań międzycząsteczkowych na powierzchnii cieczy tworzy się siła działająca do wnętrza cieczy. Nadaje ona kroplom kształt kulisty. Nosi nazwę napięcia powierzchniowego , które Napięcie powierzchniowe definiujemy jak stosunek pracy maleje wraz z temperaturą. W potrzebnej do zmiany temperaturze krytycznej, kiedy swobodnej powierzchni cieczy : zanika różnica między cieczą a parą, uzyskuje wartość równą zeru. W S

Własności cieczy Lepkość cieczy Istnienie sił spójności miedzy cząsteczkami cieczy powoduje, że przesuwanie się jednych warstw cieczy względem drugich natrafia w ruchu jednostajnym na pewien opór zwany tarciem wewnętrznym lub lepkością. Mało ruchliwe płyny o dużej lepkości jak gliceryna czy olej to ciecze o dużym tarciu wewnętrznym.

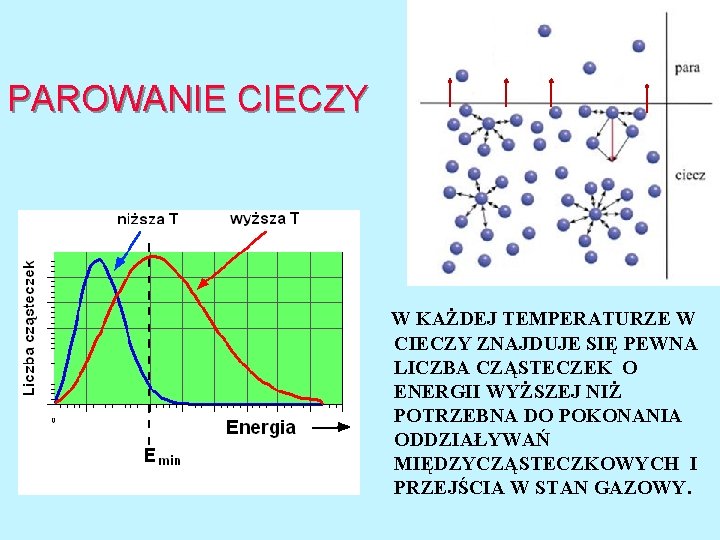
PAROWANIE CIECZY W KAŻDEJ TEMPERATURZE W CIECZY ZNAJDUJE SIĘ PEWNA LICZBA CZĄSTECZEK O ENERGII WYŻSZEJ NIŻ POTRZEBNA DO POKONANIA ODDZIAŁYWAŃ MIĘDZYCZĄSTECZKOWYCH I PRZEJŚCIA W STAN GAZOWY.

PAROWANIE CIECZY W wyniku ustalenia się równowagi dynamicznej Parowanie = Kondensacja w fazie gazowej znajdzie się pewna ilość cząsteczek cieczy. Ilość ta zależy od rodzaju cieczy i temperatury. Ciśnienie fazy gazowej w warunkach równowagi nosi nazwę prężności pary nasyconej

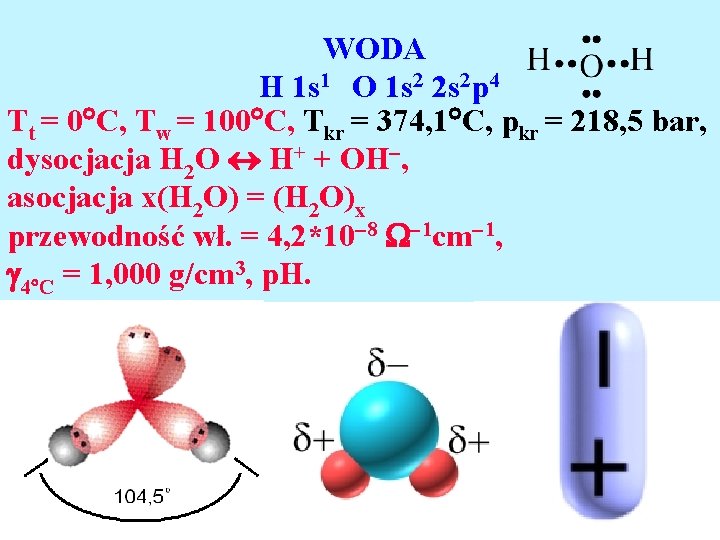
WODA H 1 s 1 O 1 s 2 2 s 2 p 4 Tt = 0 C, Tw = 100 C, Tkr = 374, 1 C, pkr = 218, 5 bar, dysocjacja H 2 O H+ + OH , asocjacja x(H 2 O) = (H 2 O)x przewodność wł. = 4, 2*10 8 1 cm 1, 4 C = 1, 000 g/cm 3, p. H.

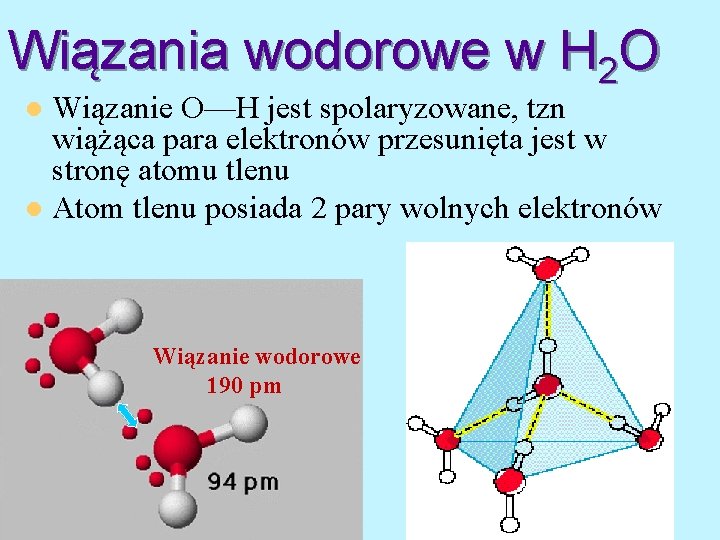
Wiązania wodorowe w H 2 O Wiązanie O—H jest spolaryzowane, tzn wiążąca para elektronów przesunięta jest w stronę atomu tlenu l Atom tlenu posiada 2 pary wolnych elektronów l Wiązanie wodorowe 190 pm

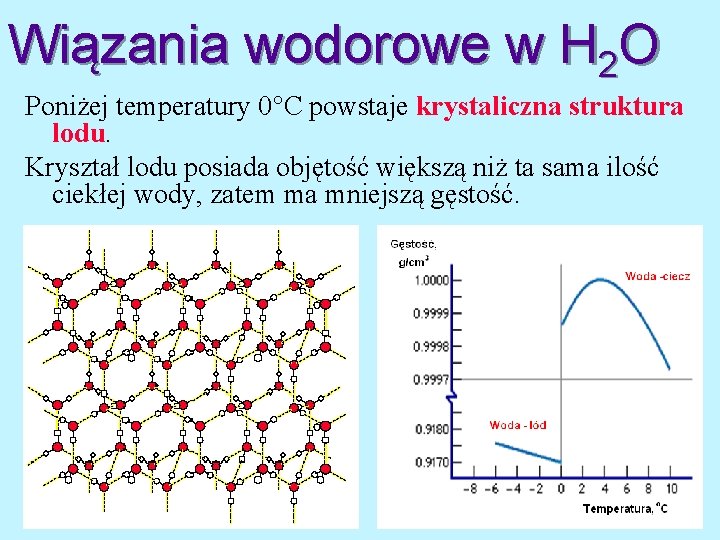
Wiązania wodorowe w H 2 O Poniżej temperatury 0 C powstaje krystaliczna struktura lodu. Kryształ lodu posiada objętość większą niż ta sama ilość ciekłej wody, zatem ma mniejszą gęstość.

CIAŁO STAŁE

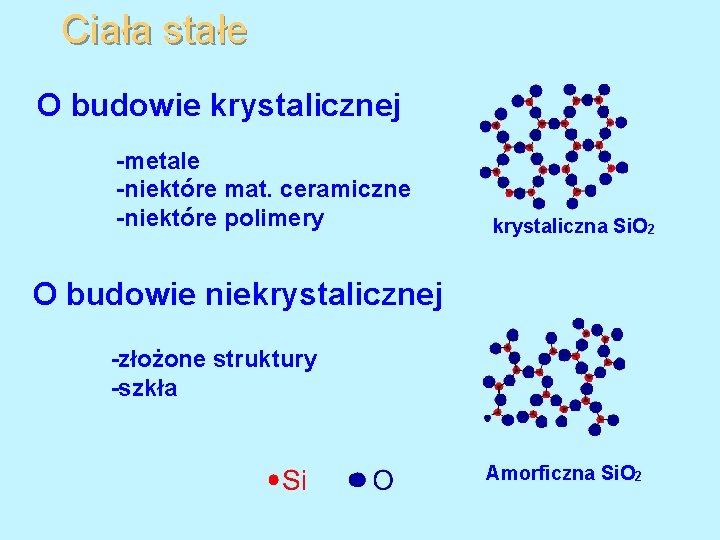
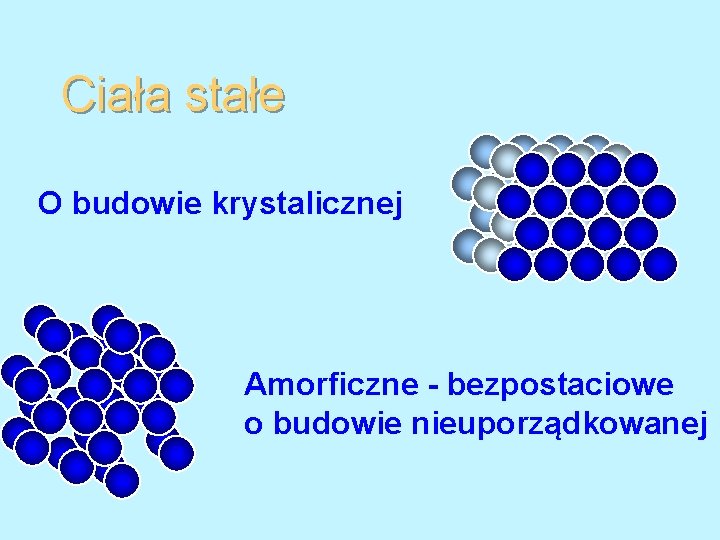
Ciała stałe O budowie krystalicznej -metale -niektóre mat. ceramiczne -niektóre polimery krystaliczna Si. O 2 O budowie niekrystalicznej -złożone struktury -szkła Amorficzna Si. O 2

Ciała stałe O budowie krystalicznej Amorficzne - bezpostaciowe o budowie nieuporządkowanej

Ciała amorficzne Szkła Polimery

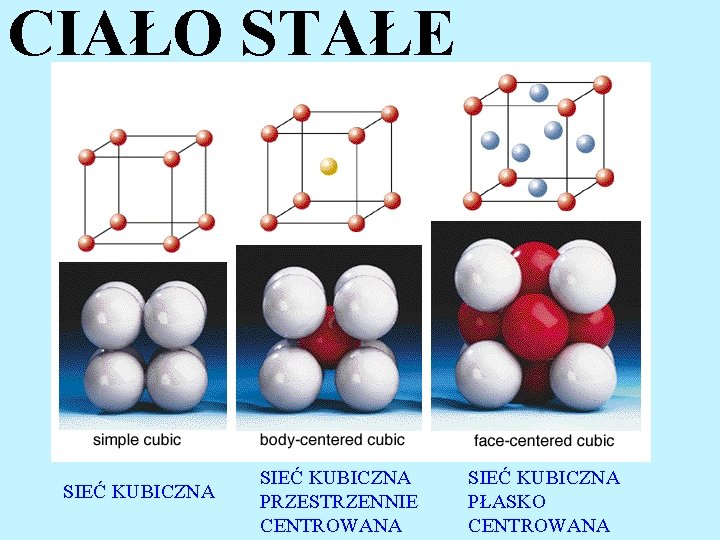
CIAŁO STAŁE Ciałem stałym nazywamy zbiór cząsteczek lub atomów oddziaływujących ze sobą tak silnie, że wszelkie ruchy translacyjne względnie rotacyjne cząsteczek (atomów) są niemożliwe. Cząsteczki (atomy) ciała stałego mają tendencję do zajmowania ściśle określonych miejsc w przestrzeni co różni stan stały od stanu gazowego i ciekłego. KRYSZTAŁ

CIAŁO STAŁE SIEĆ KUBICZNA PRZESTRZENNIE CENTROWANA SIEĆ KUBICZNA PŁASKO CENTROWANA

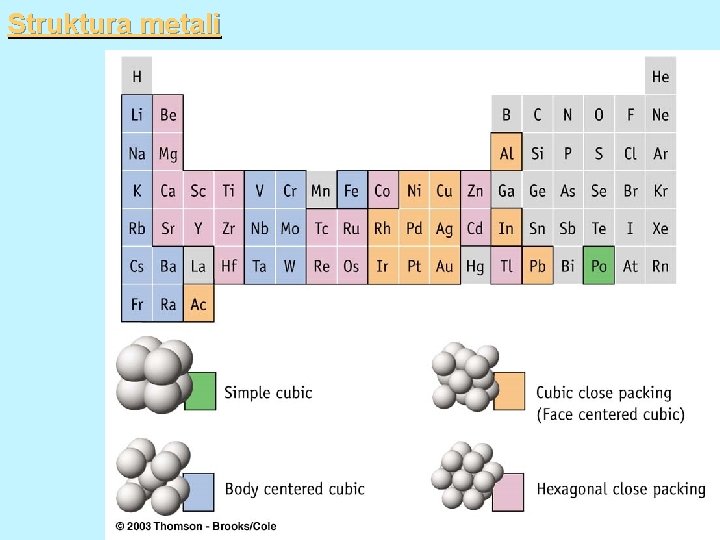
Struktura metali

CIAŁO STAŁE Ruch cząsteczek i atomów w stanie stałym sprowadza się wyłącznie do ruchów oscylacyjnych wokół ich położenia równowagi. Zbiór cząstek o regularnym ułożeniu w przestrzeni nosi nazwę KRYSZTAŁU

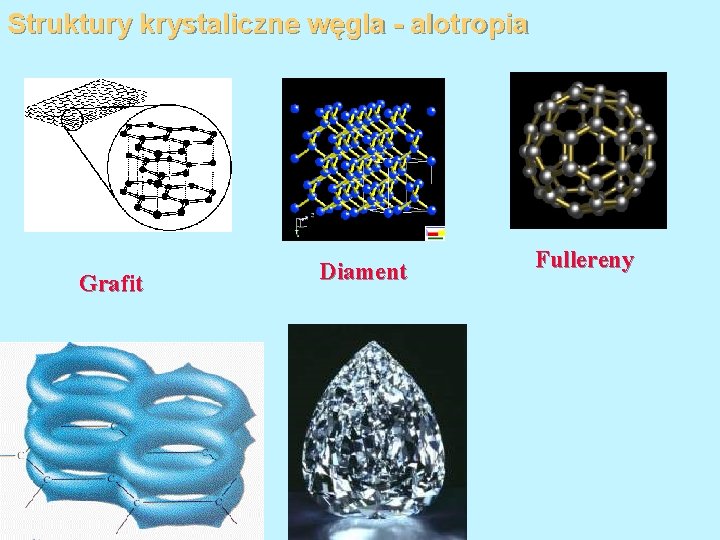
Struktury krystaliczne węgla - alotropia Grafit Diament Fullereny

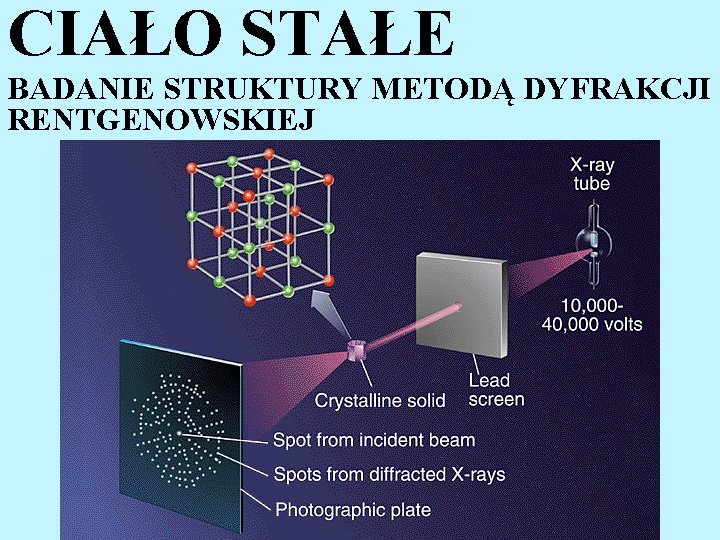
CIAŁO STAŁE BADANIE STRUKTURY METODĄ DYFRAKCJI RENTGENOWSKIEJ

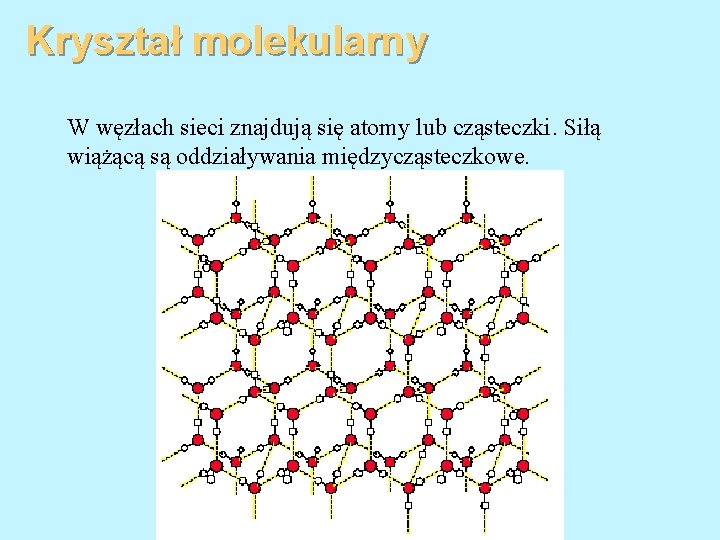
Kryształ molekularny W węzłach sieci znajdują się atomy lub cząsteczki. Siłą wiążącą są oddziaływania międzycząsteczkowe.

Kryształ metalu Elektrony walencyjne atomów metalu mogą swobodnie poruszać się między dodatnimi rdzeniami atomowymi stanowiąc tzw. zdelokalizowany gaz elektronowy. Uporządkowany ruch elektronów to przepływ prądu elektrycznego.

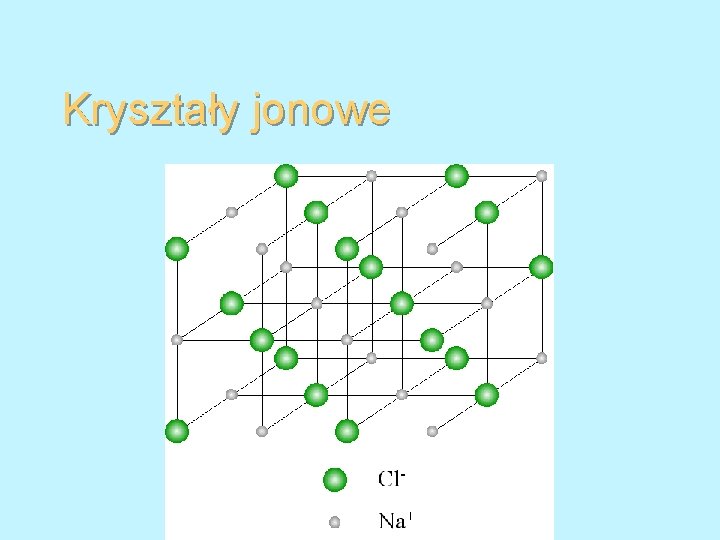
Kryształy jonowe
 Stan skupienia etan
Stan skupienia etan Catalog scolar online
Catalog scolar online Zadanie domowe
Zadanie domowe Podział materii
Podział materii Fala materii
Fala materii Materii in franceza
Materii in franceza Fala materii
Fala materii Fala de broglie
Fala de broglie Klin odłamu jak obliczyć
Klin odłamu jak obliczyć Stabilizator trójkońcówkowy
Stabilizator trójkońcówkowy Konfiguracja elektronowa v
Konfiguracja elektronowa v Bramki logiczne symbole
Bramki logiczne symbole Ucesat
Ucesat Wojciech lubas
Wojciech lubas Ahtapol
Ahtapol Lemańska joanna
Lemańska joanna Bitwa pod racławicami krótka notatka
Bitwa pod racławicami krótka notatka Wojciech wencel
Wojciech wencel Wojciech jablonski
Wojciech jablonski Wojciech duliński
Wojciech duliński Wojciech szpankowski
Wojciech szpankowski Wojciech rodek
Wojciech rodek Ewald gawlik
Ewald gawlik Wstrząs janina
Wstrząs janina Wojciech dadak uj
Wojciech dadak uj Andrzej wróblewski obrazy
Andrzej wróblewski obrazy Wojciech kossak grunwald
Wojciech kossak grunwald Wojciech dworakowski
Wojciech dworakowski Wojciech szpankowski
Wojciech szpankowski Wojciech krawczyk
Wojciech krawczyk Wojciech kic
Wojciech kic Niezawodność definicja
Niezawodność definicja Silverlight 5 download
Silverlight 5 download Wojciech complak
Wojciech complak Wojciech korfanty
Wojciech korfanty Wojciech dworakowski
Wojciech dworakowski Wojciech wyrzykowski pg
Wojciech wyrzykowski pg Wojciech sliwinski
Wojciech sliwinski Prof wojciech krajewski
Prof wojciech krajewski Mechanizm usuwania brudu chemia
Mechanizm usuwania brudu chemia Roztoky chemia 7 rocnik
Roztoky chemia 7 rocnik Forenzna chemia
Forenzna chemia Elektrolity chemia
Elektrolity chemia Wzor na mole
Wzor na mole Chemia odlew agh
Chemia odlew agh Odzysk chemia
Odzysk chemia Metoda krzyzowa chemia
Metoda krzyzowa chemia Wzory grupowe
Wzory grupowe Stavebné látky rastlinných tiel tvoria
Stavebné látky rastlinných tiel tvoria