Reakcje chemiczne Krystyna Sitko Reakcje chemiczne l l




- Slides: 16

Reakcje chemiczne Krystyna Sitko

Reakcje chemiczne l l l Reakcje chemiczne są to takie przemiany, w wyniku których z jednych substancji powstają inne substancje, o zupełnie odmiennych właściwościach fizycznych i chemicznych. Substancje wchodzące w reakcje chemiczne noszą nazwę substratów. Substancje, które powstają w czasie reakcji chemicznych noszą nazwę produktów. Równanie reakcji chemicznej - zapis przebiegu procesu chemicznego za pomocą symboli pierwiastków chemicznych i wzorów związków chemicznych. Równanie reakcji chemicznej jest bardzo podobne do zwykłego równania matematycznego.

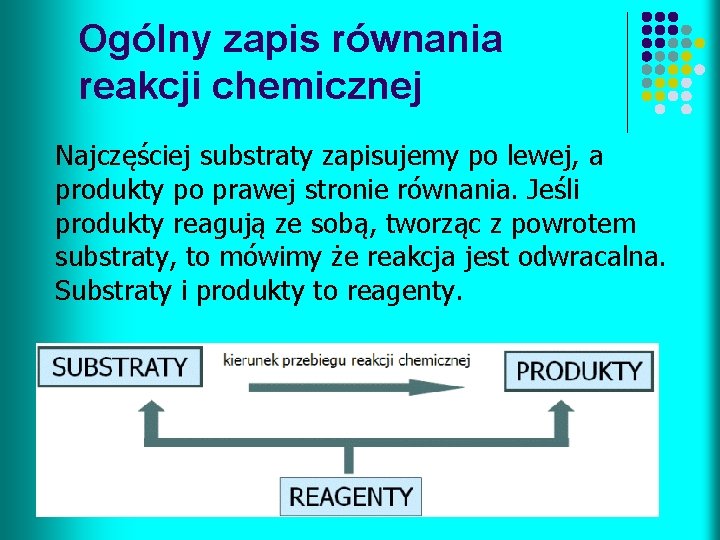
Ogólny zapis równania reakcji chemicznej Najczęściej substraty zapisujemy po lewej, a produkty po prawej stronie równania. Jeśli produkty reagują ze sobą, tworząc z powrotem substraty, to mówimy że reakcja jest odwracalna. Substraty i produkty to reagenty.

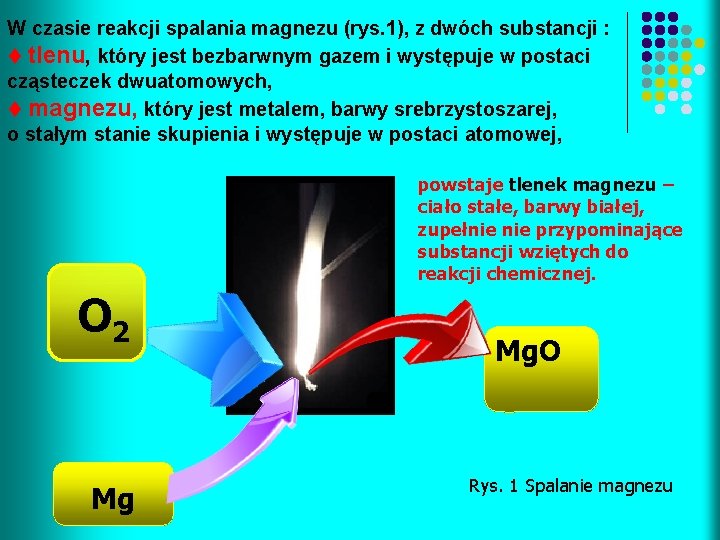
W czasie reakcji spalania magnezu (rys. 1), z dwóch substancji : t tlenu, który jest bezbarwnym gazem i występuje w postaci cząsteczek dwuatomowych, t magnezu, który jest metalem, barwy srebrzystoszarej, o stałym stanie skupienia i występuje w postaci atomowej, powstaje tlenek magnezu – ciało stałe, barwy białej, zupełnie przypominające substancji wziętych do reakcji chemicznej. O 2 Mg Mg. O Rys. 1 Spalanie magnezu

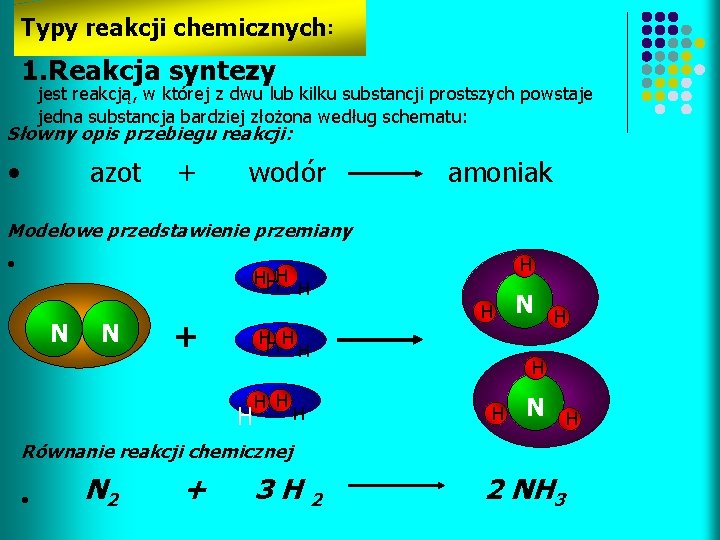
Typy reakcji chemicznych: 1. Reakcja syntezy jest reakcją, w której z dwu lub kilku substancji prostszych powstaje jedna substancja bardziej złożona według schematu: Słowny opis przebiegu reakcji: • azot + wodór amoniak Modelowe przedstawienie przemiany • H HHH N N H H + HH H H H N Równanie reakcji chemicznej • N 2 + 3 H 2 2 NH 3 H

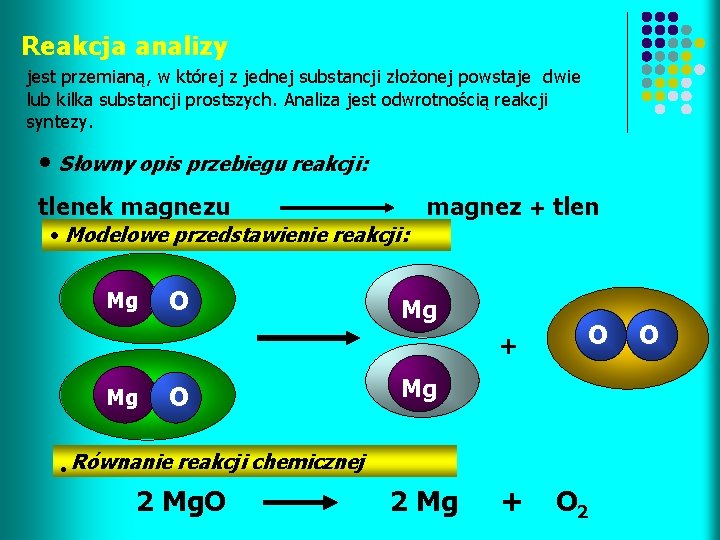
Reakcja analizy jest przemianą, w której z jednej substancji złożonej powstaje dwie lub kilka substancji prostszych. Analiza jest odwrotnością reakcji syntezy. • Słowny opis przebiegu reakcji: tlenek magnezu magnez + tlen • Modelowe przedstawienie reakcji: Mg O Mg + Mg • O O Mg Równanie reakcji chemicznej 2 Mg. O 2 Mg + O 2 O

Reakcja wymiany jest najczęściej spotykanym typem reakcji. W procesie tym następuje wymiana składników pomiędzy substancjami reagującymi. Wyróżnia się reakcje wymiany: • pojedynczej, Wymiana pojedyncza • podwójnej. Wymiana podwójna A + BC Kierunek reakcji AC + B Zn + 2 HCl ---> Zn. Cl 2 + H 2 2 K + 2 H 2 O ---> 2 KOH + H 2 AB + CD Kierunek reakcji AC + BD Mg. SO 4 + Na 2 CO 3 ---> Mg. CO 3 + Na 2 SO 4 H 2 SO 4 + Ca(OH)2 ---> Ca. SO 4 + 2 H 2 O

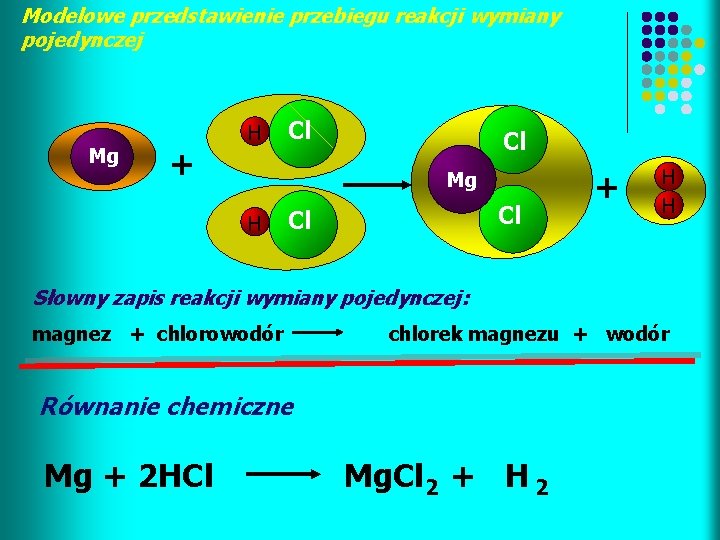
Modelowe przedstawienie przebiegu reakcji wymiany pojedynczej Mg + H Cl Cl Mg H Cl Cl + H H Słowny zapis reakcji wymiany pojedynczej: magnez + chlorowodór chlorek magnezu + wodór Równanie chemiczne Mg + 2 HCl Mg. Cl 2 + H 2

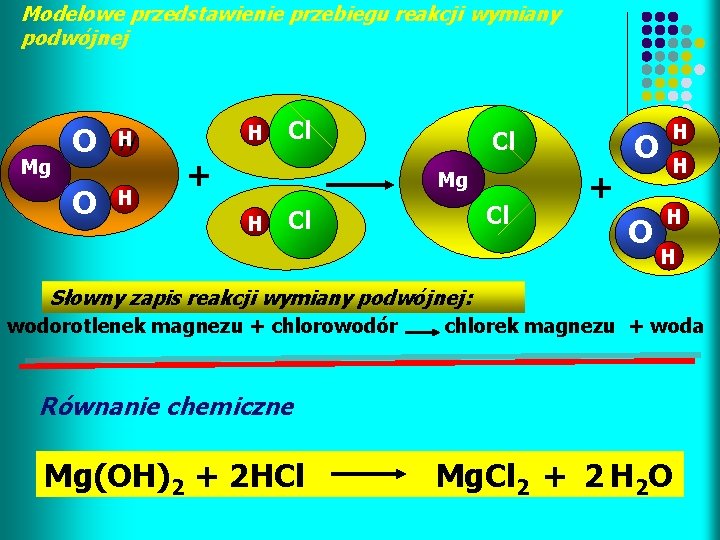
Modelowe przedstawienie przebiegu reakcji wymiany podwójnej Mg O O H H Cl + Cl Mg H Cl Cl O H + H H Słowny zapis reakcji wymiany podwójnej: wodorotlenek magnezu + chlorowodór chlorek magnezu + woda Równanie chemiczne Mg(OH)2 + 2 HCl Mg. Cl 2 + 2 H 2 O

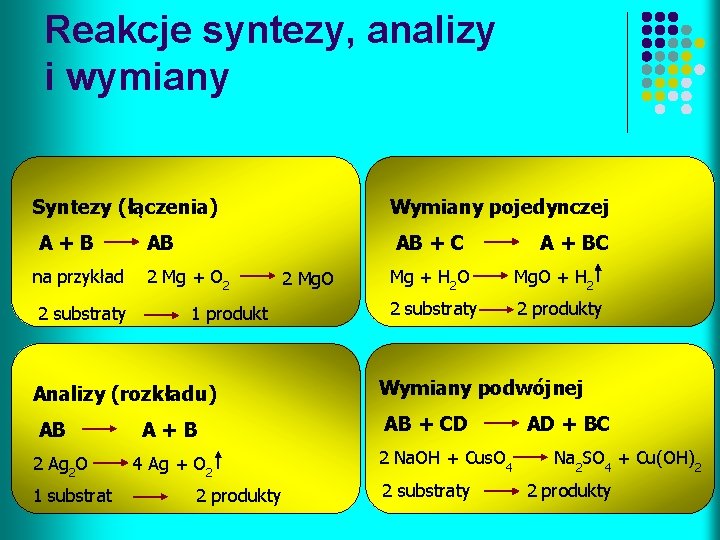
Reakcje syntezy, analizy i wymiany Syntezy (łączenia) Wymiany pojedynczej A+B AB + C na przykład 2 substraty AB 2 Mg + O 2 1 produkt 2 Mg. O A + BC Mg + H 2 O Mg. O + H 2 2 substraty 2 produkty Analizy (rozkładu) Wymiany podwójnej AB AB + CD 2 Ag 2 O 1 substrat A+B 4 Ag + O 2 2 produkty 2 Na. OH + Cus. O 4 2 substraty AD + BC Na 2 SO 4 + Cu(OH)2 2 produkty

na z - tr zo ną eg ew z Energia w reakcjach chemicznych Spalanie na przykład magnezu czy siarki w tlenie wymaga dostarczenia energii do zapoczątkowania reakcji. Potem proces spalania zachodzi gwałtownie z wydzieleniem energii cieplnej i świetlnej. Niektórym reakcjom mogą towarzyszyć również efekty akustyczne (wybuch). Takie reakcje przebiegające z wydzieleniem energii do otoczenia noszą nazwę reakcji egzoenergetycznych. Otrzymywanie tlenu z manganianu (VII) potasu zachodzi tylko wtedy, gdy dostarczamy przez cały czas energii. Reakcja chemiczna do której przebiegu konieczne jest ciągłe dostarczanie energii nosi nazwę reakcji endoenergetycznej end o wnę - do trza W życiu codziennym przykładem reakcji egzoenergetycznych jest spalanie drewna lub węgla kamiennego.

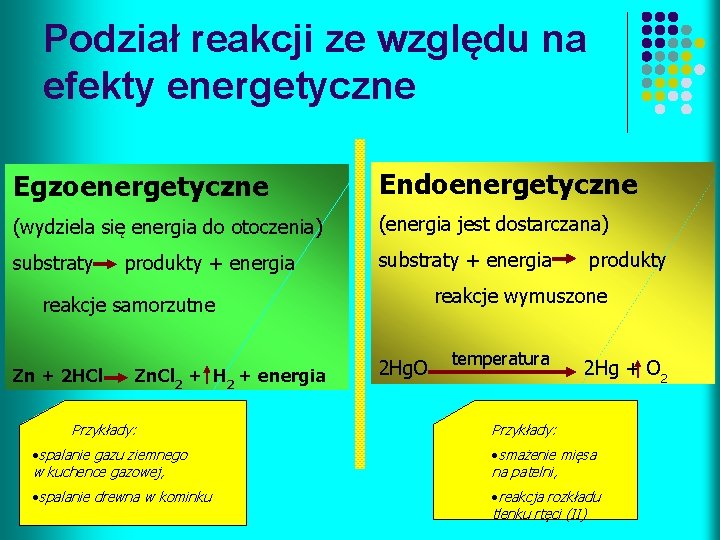
Podział reakcji ze względu na efekty energetyczne Egzoenergetyczne Endoenergetyczne (wydziela się energia do otoczenia) (energia jest dostarczana) substraty + energia produkty + energia reakcje wymuszone reakcje samorzutne Zn + 2 HCl Zn. Cl 2 + H 2 + energia Przykłady: produkty 2 Hg. O temperatura 2 Hg + O 2 Przykłady: • spalanie gazu ziemnego w kuchence gazowej, • smażenie mięsa na patelni, • spalanie drewna w kominku • reakcja rozkładu tlenku rtęci (II)

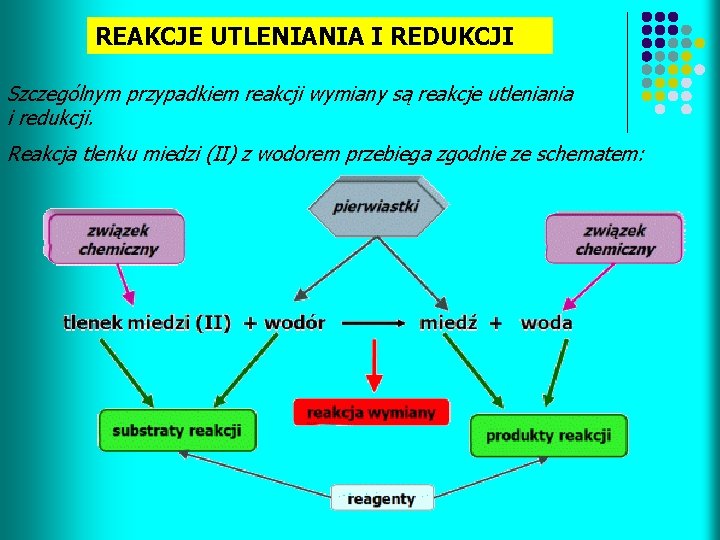
REAKCJE UTLENIANIA I REDUKCJI Szczególnym przypadkiem reakcji wymiany są reakcje utleniania i redukcji. Reakcja tlenku miedzi (II) z wodorem przebiega zgodnie ze schematem:

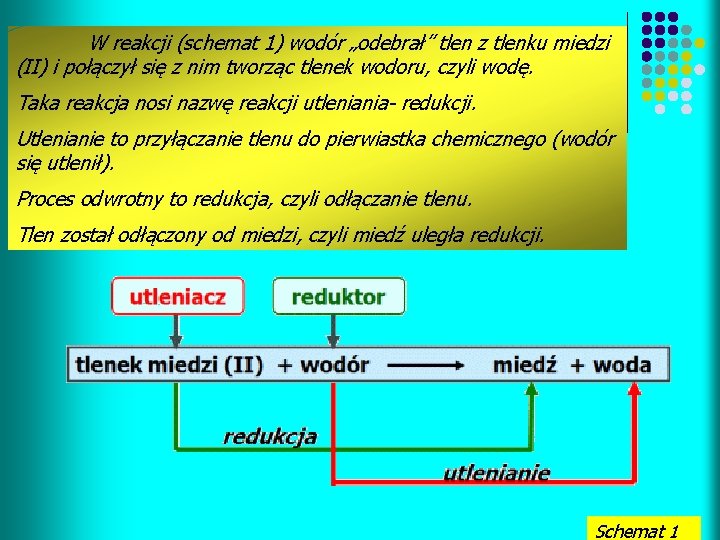
W reakcji (schemat 1) wodór „odebrał” tlen z tlenku miedzi (II) i połączył się z nim tworząc tlenek wodoru, czyli wodę. Taka reakcja nosi nazwę reakcji utleniania- redukcji. Utlenianie to przyłączanie tlenu do pierwiastka chemicznego (wodór się utlenił). Proces odwrotny to redukcja, czyli odłączanie tlenu. Tlen został odłączony od miedzi, czyli miedź uległa redukcji. Schemat 1

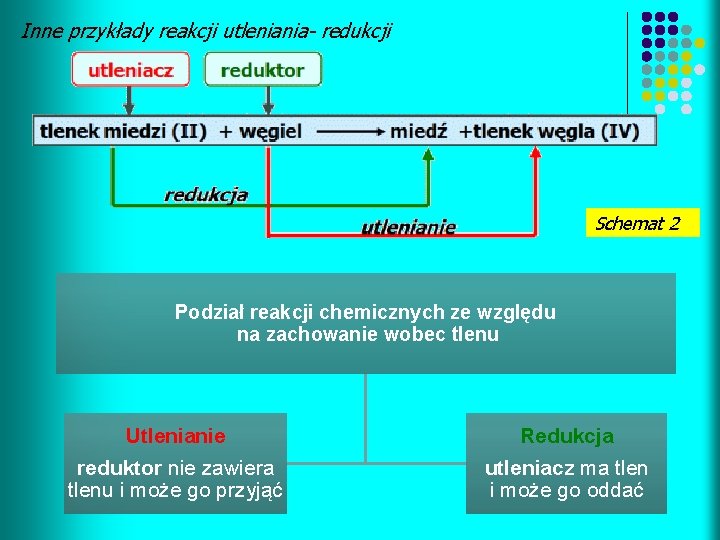
Inne przykłady reakcji utleniania- redukcji Schemat 2 Podział reakcji chemicznych ze względu na zachowanie wobec tlenu Utlenianie reduktor nie zawiera tlenu i może go przyjąć Redukcja utleniacz ma tlen i może go oddać

W czasie reakcji chemicznych obserwujemy; powstawanie nowych cząstek (atomów, jonów lub cząsteczek) o innej strukturze niż cząstki wyjściowe, przemianę jednych substancji w inne, o nowych właściwościach, przebudowę wiązań chemicznych, efekty cieplne związane ze zmianą stanu energetycznego
 Halina sitko
Halina sitko Arkadiusz sitko
Arkadiusz sitko Krystyna koelner
Krystyna koelner Famous polish mathematicians
Famous polish mathematicians Krystyna ciesielska pp
Krystyna ciesielska pp Krystyna piotrowska
Krystyna piotrowska Krystyna swiderska
Krystyna swiderska Friedman krystyna
Friedman krystyna Oskar szindler
Oskar szindler Krystyna de obaldia
Krystyna de obaldia Przesunięcie chemiczne nmr
Przesunięcie chemiczne nmr Tablice chemiczne logarytmy
Tablice chemiczne logarytmy Właściwości chemiczne miedzi
Właściwości chemiczne miedzi Stopnie oparzeń
Stopnie oparzeń Wodorotlenki to związki chemiczne zbudowane z
Wodorotlenki to związki chemiczne zbudowane z Reaktory chemiczne
Reaktory chemiczne Prostowanie chemiczne
Prostowanie chemiczne