Wodorotlenki waciwoci chemiczne Klasa 1 CP 1 DP










![Wodorotlenki amfoteryczne Na 3[Al(OH)6] czyli heksahydroksoglinian sodu to sól kompleksowa Jak się tworzy nazwy Wodorotlenki amfoteryczne Na 3[Al(OH)6] czyli heksahydroksoglinian sodu to sól kompleksowa Jak się tworzy nazwy](https://slidetodoc.com/presentation_image_h2/604ec111e8099f33cfde21891f50ae0d/image-12.jpg)
![Wodorotlenki amfoteryczne – sole kompleksowe Na 3[Al(OH)6] czyli heksahydroksoglinian sodu to sól kompleksowa Jak Wodorotlenki amfoteryczne – sole kompleksowe Na 3[Al(OH)6] czyli heksahydroksoglinian sodu to sól kompleksowa Jak](https://slidetodoc.com/presentation_image_h2/604ec111e8099f33cfde21891f50ae0d/image-13.jpg)





- Slides: 20

Wodorotlenki właściwości chemiczne Klasa 1 CP, 1 DP, 1 FP 30 marca – 1 kwietnia 2020 r. Marta Sawicka


Z poprzednich lekcji wiemy : � co to są wodorotlenki n Me(OH)n liczba grup wodorotlenkowych = wartościowość metalu � jak tworzyć nazwy wodorotlenków na podstawie ich wzoru i jak napisać wzór wodorotlenku na podstawie jego nazwy; np. Na. OH – wodorotlenek sodu Al(OH)3 – wodorotlenek glinu Cr(OH)3 – wodorotlenek chromu(III) tu: mamy jedną grupę wodorotlenkową, bo potas leży w grupie 1 układu okresowego i jego wartościowość zawsze wynosi I tu: podajemy wartościowość bo chrom w związkach może przyjmować różne wartościowości wodorotlenek potasu – KOH wodorotlenek żelaza(II) – Fe(OH)2 tu: mamy dwie grupy wodorotlenkowe, bo wartościowość żelaza w tym związku, zgodnie z jego nazwą, wynosi II

Z poprzednich lekcji wiemy : � co to są zasady Wodorotlenki rozpuszczalne w wodzie i ich wodne roztwory nazywamy zasadami � jakie są metody otrzymywania wodorotlenków metal aktywny + woda wodorek metalu + woda tlenek metalu aktywnego + woda wodorotlenek+ wodór wodorotlenek oraz (dla wodorotlenków praktycznie nierozpuszczalnych w wodzie) sól metalu 1 + zasada metalu 2 wodorotlenek metalu 1 + sól metalu 2

Z tej lekcji dowiesz się: � jaki charakter chemiczny mają wodorotlenki, � jak określić charakter chemiczny wodorotlenków na podstawie wyników doświadczenia, � jak przebiegają reakcje chemiczne potwierdzające charakter chemiczny wodorotlenków

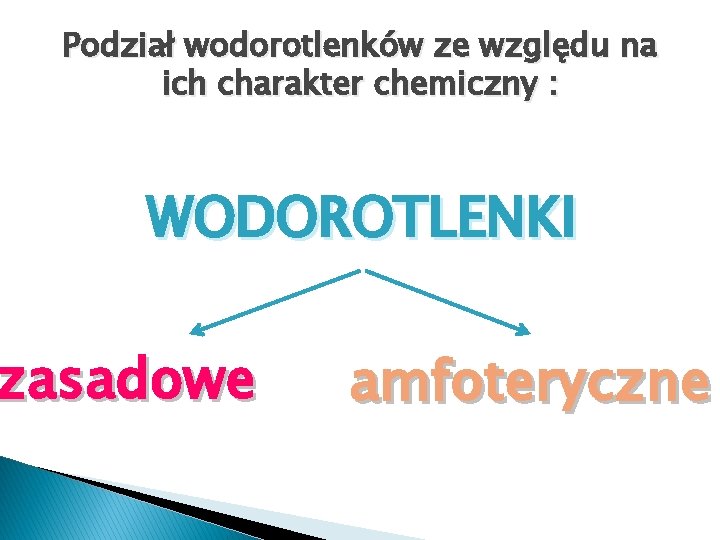
Podział wodorotlenków ze względu na ich charakter chemiczny : WODOROTLENKI zasadowe amfoteryczne

Wodorotlenki zasadowe � to wodorotlenki litowców i niektórych berylowców, np. Na. OH, KOH, Sr(OH)2, Ba(OH)2 � ich wodne roztwory mają odczyn zasadowy więc barwią fenoloftaleinę na malinowo fenoloftaleina woda + Na. OH

Wodorotlenki zasadowe � reagują z kwasami dając odpowiednie sole wodorotlenek + kwas → sól + woda np. Na. OH + HCl wodorotlenek sodu → kwas chlorowodorowy Na. Cl + H 2 O chlorek sodu woda Zapoznaj się z przebiegiem takiej reakcji oglądając film: https: //www. youtube. com/watch? v=8 n. BSL 90 z. YUw źródło: youtube. com

A co to są wodorotlenki amfoteryczne?

Wodorotlenki amfoteryczne � � to np. Al(OH)3 , Be(OH)2 , Pb(OH)2 , Cr(OH)3 , Sn(OH)2 , Sn(OH)4 i inne; zauważ, że wszystkie te związki nie rozpuszczają się w wodzie (sprawdź w tabeli rozpuszczalności) czyli w wodzie występują w postaci osadu; reagują zarówno z kwasami, kwasami jak i zasadami dając odpowiednie sole wodorotlenek + kwas → sól + woda wodorotlenek + zasada → sól + woda amfoteryczny kompleksowa

� np. Wodorotlenki amfoteryczne reakcja z kwasem Al(OH)3 + 3 HCl wodorotlenek glinu � np. → Al. Cl 3 + 3 H 2 O kwas chlorowodorowy chlorek glinu woda reakcja z zasadą Al(OH)3 + 3 Na. OH wodorotlenek glinu wodorotlenek sodu → Na 3[Al(OH)6] heksahydroksoglinian sodu
![Wodorotlenki amfoteryczne Na 3AlOH6 czyli heksahydroksoglinian sodu to sól kompleksowa Jak się tworzy nazwy Wodorotlenki amfoteryczne Na 3[Al(OH)6] czyli heksahydroksoglinian sodu to sól kompleksowa Jak się tworzy nazwy](https://slidetodoc.com/presentation_image_h2/604ec111e8099f33cfde21891f50ae0d/image-12.jpg)
Wodorotlenki amfoteryczne Na 3[Al(OH)6] czyli heksahydroksoglinian sodu to sól kompleksowa Jak się tworzy nazwy takich soli: • heksa - bo we zorze jest obecnych 6 grup wodorotlenkowych • hydrokso - bo obecne są grupy wodorotlenkowe, które nazywane są też grupami hydroksylowymi • glinian - bo to sól glinu • sodu – bo kationem metalu w tej soli jest właśnie sód
![Wodorotlenki amfoteryczne sole kompleksowe Na 3AlOH6 czyli heksahydroksoglinian sodu to sól kompleksowa Jak Wodorotlenki amfoteryczne – sole kompleksowe Na 3[Al(OH)6] czyli heksahydroksoglinian sodu to sól kompleksowa Jak](https://slidetodoc.com/presentation_image_h2/604ec111e8099f33cfde21891f50ae0d/image-13.jpg)
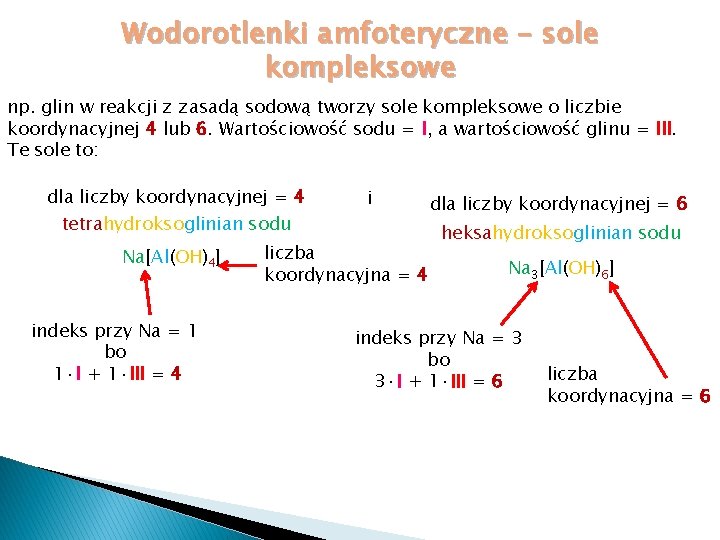
Wodorotlenki amfoteryczne – sole kompleksowe Na 3[Al(OH)6] czyli heksahydroksoglinian sodu to sól kompleksowa Jak się tworzy wzory takich soli: • musisz znać tzw. liczbę koordynacyjną - czyli liczbę np. grup OH, które mogą występować w soli kompleksowej • musisz pamiętać, że : suma iloczynów wartościowości metali i ich indeksów stechiometrycznych = liczba koordynacyjna

Wodorotlenki amfoteryczne – sole kompleksowe np. glin w reakcji z zasadą sodową tworzy sole kompleksowe o liczbie koordynacyjnej 4 lub 6. Wartościowość sodu = I, a wartościowość glinu = III. Te sole to: dla liczby koordynacyjnej = 4 tetrahydroksoglinian sodu Na[Al(OH)4] indeks przy Na = 1 bo 1·I + 1·III = 4 i liczba koordynacyjna = 4 dla liczby koordynacyjnej = 6 heksahydroksoglinian sodu Na 3[Al(OH)6] indeks przy Na = 3 bo 3·I + 1·III = 6 liczba koordynacyjna = 6

Wodorotlenki amfoteryczne Zapoznaj się z przebiegiem reakcji wodorotlenku amfoterycznego z kwasem i zasadą oglądając film: https: //www. youtube. com/watch? v=r 5 fn. GBq-EJM (źródło: youtube. com) UWAGA: przerwij oglądanie filmu w 1. 42 min oglądania ! *Zwróć uwagę, że tym razem, o zajściu reakcji wodorotlenku amfoterycznego z kwasem i zasadą świadczy zanik (czyli roztworzenie się) osadu wodorotlenku. Nie ma więc potrzeby dodawania żadnego wskaźnika.

A teraz wykonaj zadania znajdujące się na kolejnych slajdach. Odpowiedzi przepisz do zeszytu. Zadania pochodzą z Kart pracy ucznia z kartami laboratoryjnymi dla liceum ogólnokształcącego i technikum 1 To jest chemia, wydawnictwa Nowa Era.

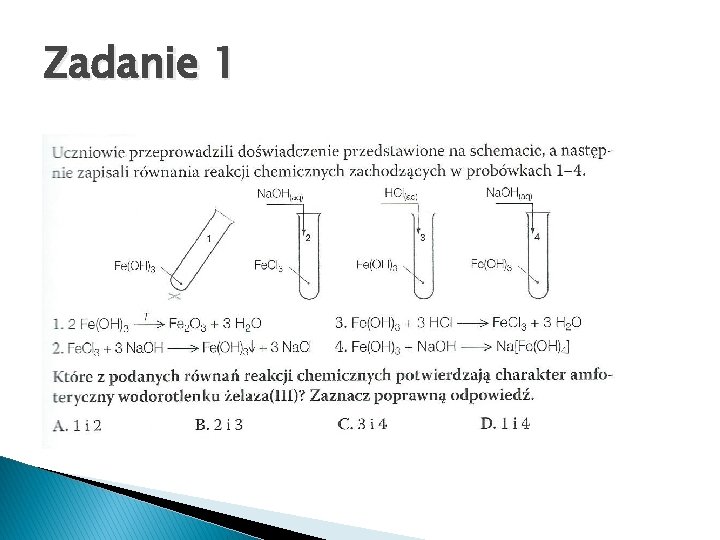
Zadanie 1

Zadanie 2 Uczniowie przeprowadzili doświadczenie chemiczne, którego celem było zbadanie właściwości wodorotlenku potasu. Polegało ono na tym, że na początku, w dwóch zlewkach umieścili wodny roztwór tego wodorotlenku. Wykonane w dalszych krokach czynności oraz towarzyszące im obserwacje umieścili w poniższej tabeli.

To wszystko na dziś Dzwonek Przepraszam, jeszcze tylko jeden slajd……

 Wodorotlenki to związki chemiczne zbudowane z
Wodorotlenki to związki chemiczne zbudowane z Wodorotlenki testy
Wodorotlenki testy Wodorotlenki amfoteryczne to
Wodorotlenki amfoteryczne to Tlenek metalu + woda = wodorotlenek
Tlenek metalu + woda = wodorotlenek Rboh charakter chemiczny
Rboh charakter chemiczny Wzór strukturalny ca(oh)2
Wzór strukturalny ca(oh)2 Właściwości chemiczne miedzi
Właściwości chemiczne miedzi Liczba damkohlera
Liczba damkohlera Przebieg technologiczny prostowania włosów
Przebieg technologiczny prostowania włosów Przesunięcia chemiczne nmr tablice
Przesunięcia chemiczne nmr tablice Logarytmy tomasz gwiazda
Logarytmy tomasz gwiazda Stopnie oparzeń
Stopnie oparzeń Budowa komputera ppt
Budowa komputera ppt Budowa roweru układy
Budowa roweru układy Doswiadczenie z fasolka
Doswiadczenie z fasolka Typy lityki
Typy lityki Dwa worki wstydu
Dwa worki wstydu Projekt klasa e dyte
Projekt klasa e dyte Ptaki ssaki owady klasa 3
Ptaki ssaki owady klasa 3 Biznis klasa u avionu
Biznis klasa u avionu Scenariusz zajęć klasa 3 edukacja polonistyczna
Scenariusz zajęć klasa 3 edukacja polonistyczna