Westflische WilhelmsUniversitt Fehlvorstellungen in der Chemie Diagnose und









































- Slides: 44

Westfälische Wilhelms-Universität Fehlvorstellungen in der Chemie Diagnose und Korrektur Sommersemester 2006 Prof. Dr. H. -D. Barke und T. Dörfler Referat zum Thema: Säure und Basen Carsten Knoop & Christoph Wacker

Gliederung 1. Einleitung 2. Säure/Base Begriff 3. Reine Säuren und Säure Lösungen 4. ph-Wert 5. Neutralisation 6. Starke und schwache Säuren 7. Zusammenfassung

Einleitung - Säure-Base Reaktion eines der Hauptthemen im Chemieunterricht - Fehlvorstellungen der Schüler aufzeigen - Vorschläge zur Korrektur machen bzw. darstellen

2. Säure/Base Begriff Was versteht man unter einer Säure bzw. unter einer Base? Brönstedsäure: Protonendonator Brönstedbase: Protonenakzeptor Lewissäure: Elektronenakzeptor Lewisbase: Elektronendonator

Vorstellungen der Schüler zum Säure/Base Begriff

Fehlvorstellungen der Schüler - Argumentation mit p. H-Wert - Säuren sind ätzend, gefährlich, gelb, rot oder sauer - Säuren wird eine aggressive Wirkung zugeschrieben - Säuren zerfressen „Dinge“ - beim Arrhenius Konzept (Säuren enthalten H+-Ionen) - beim Brönsted-Konzept (Säuren geben Protonen ab) - Basen werden oftmals vernachlässigt

Fazit: Schüler können mit der Säure-Base Theorie oftmals nicht viel anfangen.

Unterrichtsvorschläge zum Säure-Base Begriff - Reaktion von Säuren und Laugen als Substanz und ihre aggressive Wirkung Reaktion von Zucker mit konz. H 2 SO 4 Zucker + konz. Schwefelsäure schwarzer Kohlenstoff + Wasserdampf

- Alltagsbezug durch Untersuchung von Haushaltsreinigern Kalkentferner Abflussfrei

Säure-Base-Konzepte Man unterscheidet zwei wesentliche Konzepte: 1. Arrhenius: Substanz-bezogen (~1884) 2. Brönsted: Teilchen-bezogen (~1923) Was ist davon sinnvoll für den Unterricht?

Was ist davon sinnvoll für den Unterricht? Arrhenius-Konzept Brönsted-Konzept -betrachtet nur Ionen in -Säure-Base-Reaktion: wässrigen Lösungen (OH-/H+-Ionen) Übergabe von Protonen der Säure an die Base erlaubt keine Anwendung allgemeineres Konzept zur Deutung verschiedenster im allgemeinen Sinne Phänomene Feststellung: Das Konzept nach Arrhenius kann angesprochen werden, Brönsted-Konzept sollte allerdings im Vordergrund stehen!

Einstieg in das Konzept nach Brönsted-Säuren: Die Protonenspender 1. Teilversuch: Reaktion von Kochsalz und Schwefelsäure unter Bildung von gasförmigem Chlorwasserstoff H 2 SO 4 -Molekül+Cl--Ion HCl-Molekül + HSO 4 --Ion Säure 1 Base 1 Säure 2 Base 2 2. Teilversuch: Einleiten des entstandenen Chlorwasserstoff-Gases in Wasser HCl-Molekül +H 2 O-Molekül Cl-(aq)-Ion + H 3 O+(aq)-Ion Säure 1 Base 1 Base 2 Säure 2

Einstieg in das Konzept nach Brönsted-Basen: Die Protonenempfänger Versuch: Calciumoxid und Wasser reagieren stark exotherm Ca 2+-Ion + O 2 --Ion + 2 H 2 O-Molekül Ca 2+-Ion + (OH-)2 -Ion + H 2 O-Molekül Wesentliche Reaktion: O 2 --Ion + H 2 O-Molekül OH--Ion + OH--Ion Es kann festgestellt werden, dass Wasser sowohl als Säure als auch als Base reagieren kann. Solche Substanzen werden als Ampholyt-Teilchen bezeichnet!

3. Reine Säuren und Säure. Lösungen Gemeinsamkeiten und Unterschiede zwischen reiner Säure und Säurelösung am Beispiel einer Schwefelsäure

Fehlvorstellungen der Schüler - Verdünnungseffekt - Dichten unterscheiden sich - Reine Säure ätzender, reaktionsfreudiger

Beispiele für falsche Modellvorstellungen

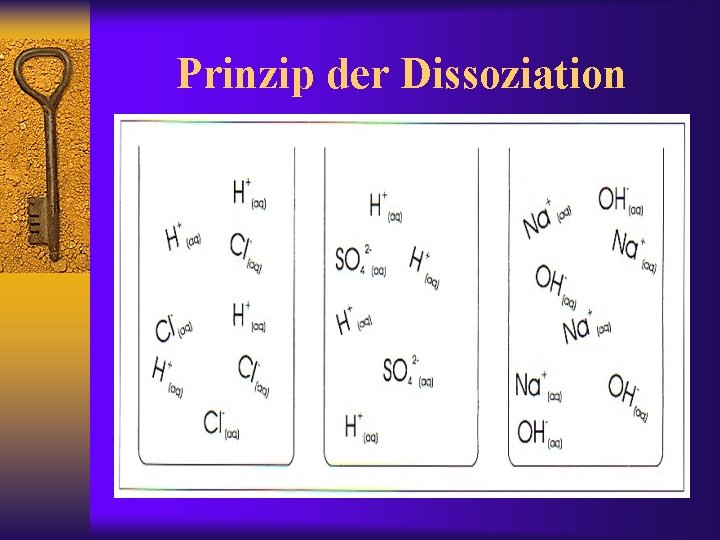
Fazit - Prinzip der Dissoziation wurde nicht verstanden - Wichtige Inhalte der Säure-Base Reaktion bleiben unverstanden

Unterrichtsvorschläge zu reinen Säuren und Säure. Lösungen Aggressivität von Säuren und ihren verdünnten Lösungen: Alltagsbezug: Magensäure, Phosphorsäure (in Cola), Zitronen- und Essigsäure (als Würzmittel), etc. Vergleich zum Verhalten reiner, konzentrierter Säuren Folgerung: Durch Verdunsten des Wassers können auch verdünnte Lösungen eine aggressive Wirkung erzielen!

Prinzip der Dissoziation

4. p. H-Wert Was ist der p. H-Wert bzw. wie definiert er sich? - negative dekadische Logarithmus der H+-Konzentration

Vorstellungen der Schüler zum Begriff des p. H-Werts

Fehlvorstellungen der Schüler - phänomenologische Antworten - viele verändern die Definition - richtige Antwort nur vereinzelt von Schülern - Argumentation mit Säuregrad/Säuregehalt

Fazit - reines Merkwissen und überwiegend Unverständnis von Schülern bezüglich des p. H-Werte - enorme Schwierigkeiten mit dem p. H-Wert umzugehen

Unterrichtsvorschläge zum p. H-Wert Einführung: Versuche zum Bestimmen des p. H-Wertes von Lösungen aus dem Alltag mit Hilfe von Universalindikator-Papier

Vertiefung: Der p. H-Wert Begriff des Mol muss den Schülern bekannt sein -Kurzübersicht geben: Beispiel: -Wasser: 18 g Wasser enthalten 1 mol H 2 O-Moleküle (nicht „ 1 mol Wasser“) -Salzsäure (1 mol/L): 1 mol H 30+(aq)-Ionen und 1 mol Cl-(aq)-Ionen Verdünnung: a)1: 10 0, 1 mol H 30+(aq)-Ionen b)1: 100 0, 01 mol H 30+(aq)-Ionen *Verweis: H+-(aq)-Ion als Kurzschreibweise für H 30+(aq)Ionen *Untersuchung des p. H-Wertes der Salzsäuren und Feststellung, dass ph-Wert = x , wenn c(H+) = 10 -x

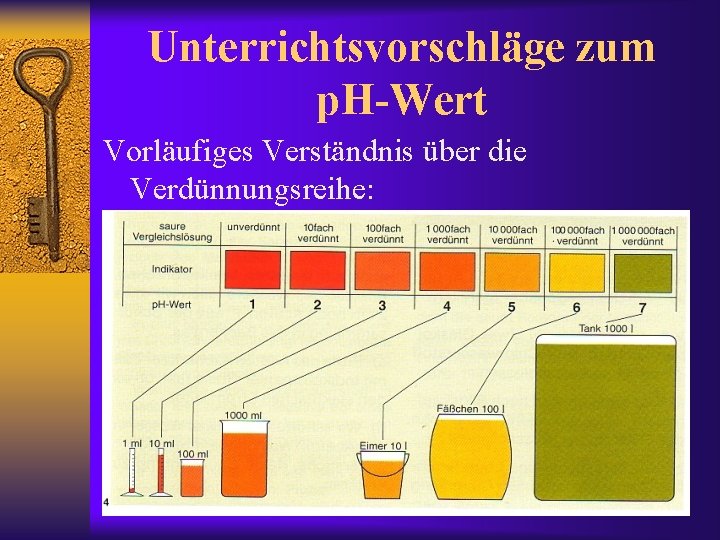
Unterrichtsvorschläge zum p. H-Wert Vorläufiges Verständnis über die Verdünnungsreihe:

Vertiefung: Der p. H-Wert Begriff des Mol muss den Schülern bekannt sein -Kurzübersicht geben: Beispiel: -Wasser: 18 g Wasser enthalten 1 mol H 2 O-Moleküle (nicht „ 1 mol Wasser“) -Salzsäure (1 mol/L): 1 mol H 30+(aq)-Ionen und 1 mol Cl-(aq)-Ionen Verdünnung: a)1: 10 0, 1 mol H 30+(aq)-Ionen b)1: 100 0, 01 mol H 30+(aq)-Ionen *Verweis: H+-(aq)-Ion als Kurzschreibweise für H 30+(aq)Ionen *Untersuchung des p. H-Wertes der Salzsäuren und Feststellung, dass ph-Wert = x , wenn c(H+) = 10 -x

Vertiefung: Der p. H-Wert Da bisher nur Säuren untersucht wurden, können anhand von Schaubildern auch Rückschlüsse auf alkalische Lösungen gezogen werden:

5. Neutralisation - Schülerbefragung zur Neutralisation

Vorstellungen von Schülern von einer Neutralisation

Fehlvorstellungen der Schüler - Reaktionsgleichung HCl + Na. OH Na. Cl + H 2 O

Fehlvorstellungen der Schüler - Ionensymbole H+-Ionen und OH--Ionen reagieren zu H 20 - Name der Reaktion

Fazit - Salzbildung wird in den Vordergrund gestellt - Ionen werden zu „Salz-Molekülen“

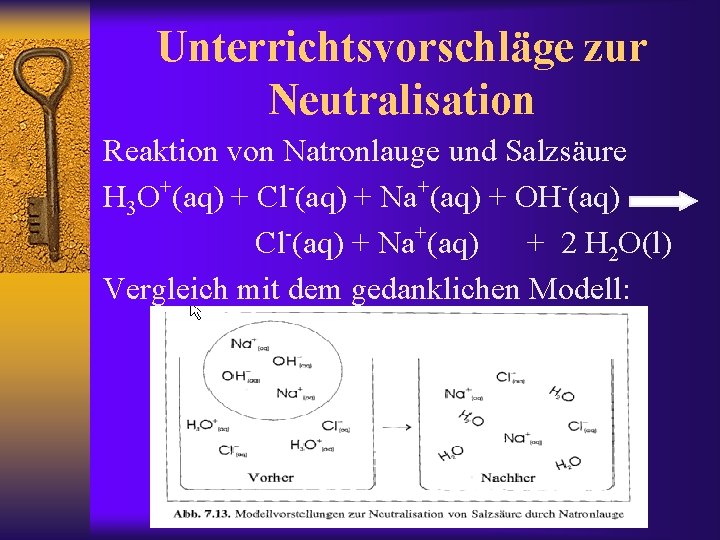
Unterrichtsvorschläge zur Neutralisation Reaktion von Natronlauge und Salzsäure H 3 O+(aq) + Cl-(aq) + Na+(aq) + OH-(aq) + Cl (aq) + Na (aq) + 2 H 2 O(l) Vergleich mit dem gedanklichen Modell:

Unterrichtsvorschläge zur Neutralisation Folgende Versuchsmethoden erlauben eine Überprüfung der Neutralisation: -p. H-Wert Bestimmung -Leitfähigkeitstitration -Überprüfung der Neutralisationswärme als Beweis, dass bei der Reaktion von starken Säuren und Basen nur die Hydronium-Ionen mit den Hydroxid -Ionen zu Wasser reagieren ( RH 0 m= -56 k. J/mol)

6. Starke und schwache Säuren Worin unterscheidet sich eine starke Säure von einer schwachen Säure?

Fehlvorstellungen der Schüler - Argumentation mit dem ph-Wert - Schwierigkeiten beim Überführen von Modellvorstellungen in konkrete Zeichnungen

Modellvorstellungen

Fazit Dissoziations- oder Protolysegard sind nicht verstanden worden

Unterrichtsvorschläge zu starken und schwachen Säuren Stärke der Säure entspricht nicht der Konzentration, sondern: - starke Säuren sind Teilchen, die leicht Protonen abgeben können. - schwache Säuren sind Teilchen, die nur schwer Protonen abgeben können. es gilt: Säurestärke wächst mit der Tendenz Protonen abzugeben [Umkehrschluss: Basenstärke wächst mit der Tendenz Protonen aufzunehmen]

Unterrichtsvorschläge zu starken und schwachen Säuren Einführung des Protoloyse-Begriffs und Vorstellung der Modelle

Unterrichtsvorschläge zu starken und schwachen Säuren

Zusammenfassung Schüler können mit einem Hauptthema der Chemie, der Säure-Base Theorien wenig anfangen Zusammenhänge müssen besser herausgearbeitet werden Verknüpfungen zwischen den Begriffen nicht nur auf Definitionen beschränken

Danke für eure Aufmerksamkeit!
 Fehlvorstellungen chemie
Fehlvorstellungen chemie Ressourcendiagnostik soziale arbeit
Ressourcendiagnostik soziale arbeit Vulnus reg mentalis
Vulnus reg mentalis Using karyotypes to diagnose genetic disorders
Using karyotypes to diagnose genetic disorders Diagnose ascites
Diagnose ascites Klimaanlage diagnose drücke
Klimaanlage diagnose drücke Diagnose recept model
Diagnose recept model Diagnose it
Diagnose it Pancreatitis stool pictures
Pancreatitis stool pictures Het verpleegkundig proces
Het verpleegkundig proces Akn diagnose
Akn diagnose Basc 3 classification ranges
Basc 3 classification ranges Loopback
Loopback Eupf diagnose
Eupf diagnose Gesprekstechnieken adviesgesprek
Gesprekstechnieken adviesgesprek Test to diagnose pulmonary embolism
Test to diagnose pulmonary embolism Cyber awareness diagnose
Cyber awareness diagnose Portal hypertension symptoms
Portal hypertension symptoms Cont cubiti sin diagnose
Cont cubiti sin diagnose Pancreatitis film
Pancreatitis film Naive pathfinder
Naive pathfinder Pes voorbeeld
Pes voorbeeld Low iron deficiency symptoms
Low iron deficiency symptoms Der gott der stadt bild
Der gott der stadt bild Gegenstand der psychologie beispiel
Gegenstand der psychologie beispiel Beschriftung einer burg
Beschriftung einer burg Der seele heimat ist der sinn
Der seele heimat ist der sinn Das ist der daumen der pflückt die pflaumen
Das ist der daumen der pflückt die pflaumen Erster tag der woche
Erster tag der woche Steuerung der atmung
Steuerung der atmung Ezekiel 25 17 der pfad der gerechten
Ezekiel 25 17 der pfad der gerechten At eternity's gate painting
At eternity's gate painting Skorpion und der frosch
Skorpion und der frosch Grnder
Grnder Chemie
Chemie Mechanismus
Mechanismus Massenwirkungsgesetz
Massenwirkungsgesetz Pulsar college
Pulsar college Katedra fyziky chemie a odborného vzdělávání
Katedra fyziky chemie a odborného vzdělávání Impuls chemie 4 lösungen pdf
Impuls chemie 4 lösungen pdf Soli chemie 9. ročník
Soli chemie 9. ročník Vis vitalis chemie
Vis vitalis chemie Podobory chemie
Podobory chemie Boeken over kwantumchemie en theoretische chemie
Boeken over kwantumchemie en theoretische chemie Chemie porn
Chemie porn