Prinzip von Le Chatelier Reaktionsbedingungen Das Prinzip von
Prinzip von Le Chatelier Reaktionsbedingungen Das Prinzip von Henry Le Chatelier und Ferdinand Braun wurde zwischen 1884 und 1888 formuliert… . . . und wird auch als Prinzip vom kleinsten Zwang bezeichnet.
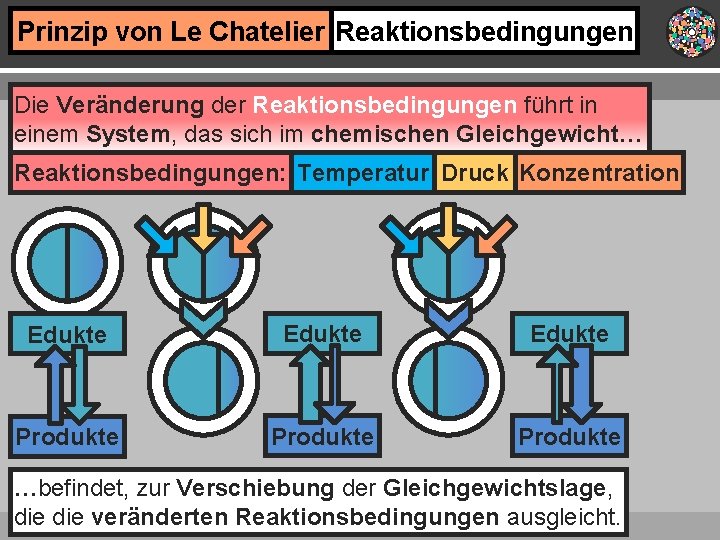
Prinzip von Le Chatelier Reaktionsbedingungen Die Veränderung der Reaktionsbedingungen führt in einem System, das sich im chemischen Gleichgewicht… Reaktionsbedingungen: Temperatur Druck Konzentration Edukte Produkte …befindet, zur Verschiebung der Gleichgewichtslage, die veränderten Reaktionsbedingungen ausgleicht.

Prinzip von Le Chatelier Reaktionsbedingungen Wenn man auf ein chemisches System im Gleichgewicht einen äußeren Zwang ausübt, … Ausweichung Zwang Ausweichung Gleichgewicht Edukte A + B Hinreaktion C + D Produkte Rückreaktion Reaktionsbedingungen: Temperatur Druck Konzentration …so weicht es diesem äußeren Zwang aus. Das Prinzip ermöglicht keine quantitativen Aussagen.
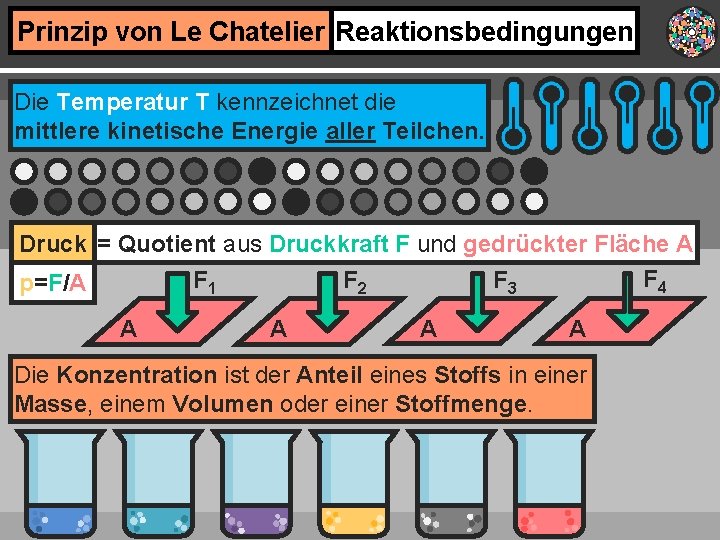
Prinzip von Le Chatelier Reaktionsbedingungen Die Temperatur T kennzeichnet die mittlere kinetische Energie aller Teilchen. Druck = Quotient aus Druckkraft F und gedrückter Fläche A F 4 F 3 F 1 F 2 p=F/A A A Die Konzentration ist der Anteil eines Stoffs in einer Masse, einem Volumen oder einer Stoffmenge.
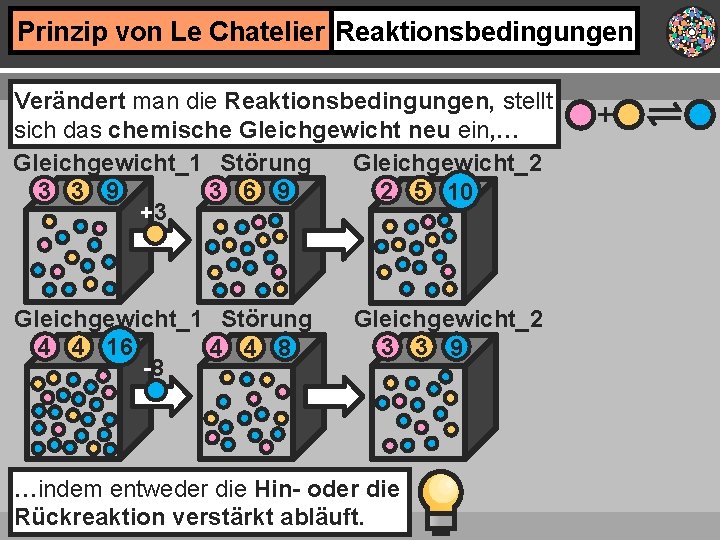
Prinzip von Le Chatelier Reaktionsbedingungen Verändert man die Reaktionsbedingungen, stellt sich das chemische Gleichgewicht neu ein, … Gleichgewicht_1 Störung Gleichgewicht_2 2 5 10 3 3 9 3 6 9 +3 Gleichgewicht_1 Störung 4 4 16 4 4 8 -8 Gleichgewicht_2 3 3 9 …indem entweder die Hin- oder die Rückreaktion verstärkt abläuft. +
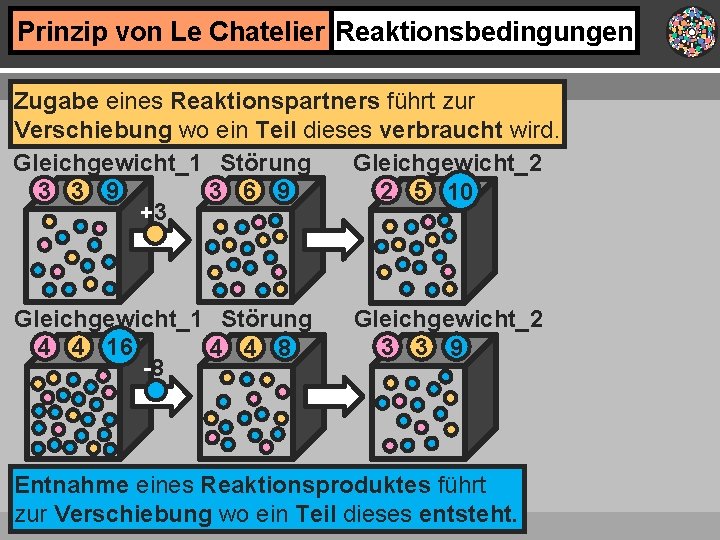
Prinzip von Le Chatelier Reaktionsbedingungen Zugabe eines Reaktionspartners führt zur Verschiebung wo ein Teil dieses verbraucht wird. Gleichgewicht_1 Störung Gleichgewicht_2 2 5 10 3 3 9 3 6 9 +3 Gleichgewicht_1 Störung 4 4 16 4 4 8 -8 Gleichgewicht_2 3 3 9 Entnahme eines Reaktionsproduktes führt zur Verschiebung wo ein Teil dieses entsteht.
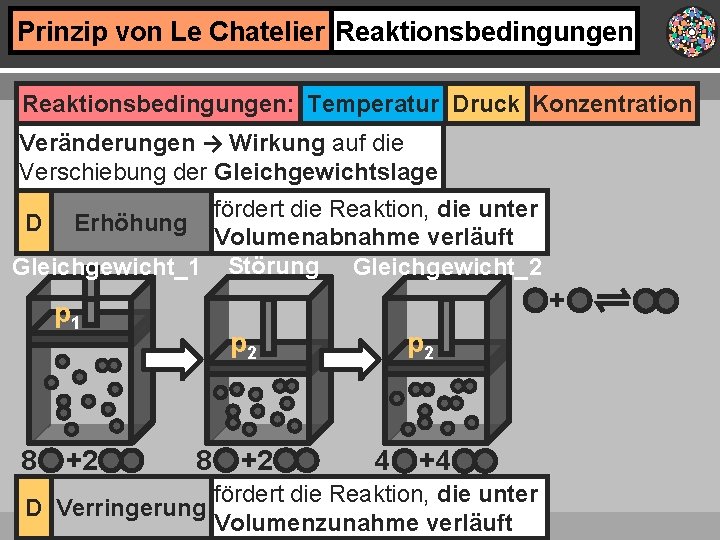
Prinzip von Le Chatelier Reaktionsbedingungen: Temperatur Druck Konzentration Veränderungen → Wirkung auf die Verschiebung der Gleichgewichtslage fördert die Reaktion, die unter Volumenabnahme verläuft Gleichgewicht_1 Störung Gleichgewicht_2 D Erhöhung + p 1 8 +2 p 2 4 +4 fördert die Reaktion, die unter D Verringerung Volumenzunahme verläuft
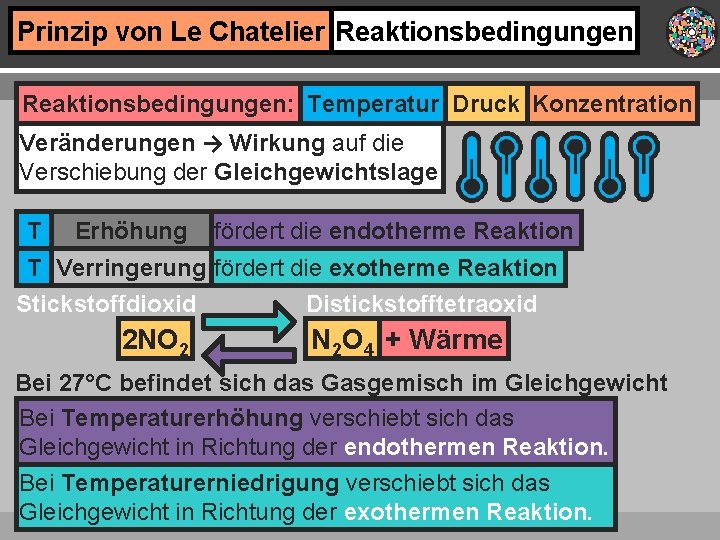
Prinzip von Le Chatelier Reaktionsbedingungen: Temperatur Druck Konzentration Veränderungen → Wirkung auf die Verschiebung der Gleichgewichtslage T Erhöhung fördert die endotherme Reaktion T Verringerung fördert die exotherme Reaktion Stickstoffdioxid 2 NO 2 Distickstofftetraoxid N 2 O 4 + Wärme Bei 27°C befindet sich das Gasgemisch im Gleichgewicht Bei Temperaturerhöhung verschiebt sich das Gleichgewicht in Richtung der endothermen Reaktion. Bei Temperaturerniedrigung verschiebt sich das Gleichgewicht in Richtung der exothermen Reaktion.

Prinzip von Le Chatelier Reaktionsbedingungen: Temperatur Druck Konzentration Veränderungen → Wirkung auf die Verschiebung der Gleichgewichtslage fördert die Reaktion unter K Erhöhung Verbrauch des zugeführten Stoffs fördert die Reaktion unter Bildung K Verringerung des abgeführten Stoffs

Prinzip von Le Chatelier Reaktionsbedingungen Zusammenfassung: Das Prinzip von Le Chatelier, das als Prinzip vom kleinsten Zwang bezeichnet wird, besagt folgendes: Die Veränderung der Reaktionsbedingungen (Temperatur, Druck, Konzentration) führt in einem System, das sich im chemischen Gleichgewicht befindet, zur Verschiebung der Gleichgewichtslage, die veränderten Reaktionsbedingungen ausgleicht.
- Slides: 10


















