GRAVIMETRIE prof Viktor Kanick Analytick chemie I 1




















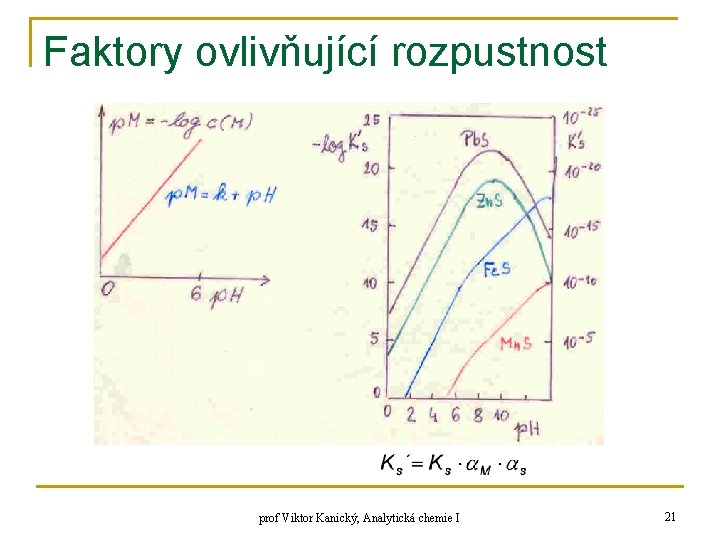

![Faktory ovlivňující rozpustnost n příklad: Ag. Cl, rozp. komplexy [Ag. Cl 2]-, [Ag. Cl Faktory ovlivňující rozpustnost n příklad: Ag. Cl, rozp. komplexy [Ag. Cl 2]-, [Ag. Cl](https://slidetodoc.com/presentation_image_h/c963713f1227aebffe1b70decc15e734/image-23.jpg)







































- Slides: 69

GRAVIMETRIE prof Viktor Kanický, Analytická chemie I 1

Gravimetrie n n n základní metoda, klasická určovaná složka se převádí z daného množství vzorku v definované chemické individuum, jehož navážka je mírou obsahu složky analytické váhy (rovnoram. dvoj. páka + kyvadlo) q q citlivost správnost prof Viktor Kanický, Analytická chemie I 2

Gravimetrie q 1) správnost – stejná délka vahadel (Gaussova metoda dvojího vážení) vztlaková síla (redukce vážení na vzduchoprázdno) mx – skutečná hmotnost z – hmotnost závaží sx, sz – hustoty mx a z σ – hustota vzduchu σ = 0, 0012 g. cm-3, sz = 8, 4 g. cm-3 (mosaz) → pro z = 1 n 0, 5 g látky ≈ vztlak 0, 08 mg prof Viktor Kanický, Analytická chemie I 3

Gravimetrie n další vlivy: q q q vzdušná vlhkost: adsorpce H 2 O, časový faktor otisk prstů: pinzeta, kleště hygroskopické látky: zabroušené váženky elektrický náboj: práškovité nevodivé látky suché sklo závaží (relativní kalibrace – standardy) postup při vážení: aretace, otevírání vah… nepřetížit !!! prof Viktor Kanický, Analytická chemie I 4

Gravimetrie q 2) citlivost l - délka vahadla G – tíha vahadla d - vzdálenost Analytické váhy: netlumené – poloautomatické Výrobci: SARTORIUS, METTLER, PRECISA elektronické váhy digitální prof Viktor Kanický, Analytická chemie I 5

Srážení n n klasická separační gravimetrická metoda preparace čistých sloučenin q q q nerozpustnost sraženiny x ztráta (< 0, 1 mg) rozpustnost sraženiny ≈ koncentrace nasyc. roztok nad sraženinou málo rozpust. soli ≈ silné elektrolyty ≈ dokonalá disociace ← jednosytná aktivita tuhé fáze zahrnuta do konstanty = součin rozpustnosti (termodynamická hodnota) prof Viktor Kanický, Analytická chemie I 6

Výpočet rozpustnosti čistých látek uni-univalentní elektrolyt q platí v dest. vodě za nepřítomnosti dalších iontů obecně prof Viktor Kanický, Analytická chemie I 7

Výpočet rozpustnosti čistých látek n příklad: Kolik gramů Ag. Cl obsahuje 1 l nasyc. roztoku Ag. Cl, M (Ag. Cl) = 143, 32 g. mol-1 n příklad: Jaká je rozpustnost Ag 2 Cr. O 4 v H 2 O? prof Viktor Kanický, Analytická chemie I 8

Výpočet rozpustnosti čistých látek n faktory ovlivňující rozpustnost q q q q vliv vlastních iontů vliv p. H vliv tvorby komplexů vliv teploty vliv rozpouštědla vliv velikosti částic vliv iontové síly } tzv. vedlejší reakce prof Viktor Kanický, Analytická chemie I 9

Faktory ovlivňující rozpustnost n 1) vliv vlastních iontů – přebytek srážedla q M+ B - a) nadbytek srážedla: b) nadbytek srážedla: q n obecně příklad: při srážení Ag+ nadbytkem → i promývání sraženin ne vodou, ale zřeď. roztokem srážedla x velký nadbytek → tvorba komplexů → rozpouštění prof Viktor Kanický, Analytická chemie I 10

Faktory ovlivňující rozpustnost n příklad: Vypočtěte koncentraci SO 42 - nutnou k dokonalému vysrážení Ba. SO 4 (Ba. SO 4) = 233, 43 g. mol-1; Ks = 1, 08. 10 -10) n (M Podmínka: m (Ba. SO 4) v roztoku < 10 -4 g; V = 300 cm 3 prof Viktor Kanický, Analytická chemie I 11

Faktory ovlivňující rozpustnost n 2) vliv p. H a tvorby komplexů q q vedlejší rovnováhy → rozpustné komplexy (hydroxokomplexy kationů, protonizace aniontů) kyseliny a zásady zvyšují rozpustnost sraženiny prof Viktor Kanický, Analytická chemie I 12

Faktory ovlivňující rozpustnost q q podmíněný součin rozpustnosti c (M) c (B) α – koeficient vedlejších reakcí prof Viktor Kanický, Analytická chemie I 13

Faktory ovlivňující rozpustnost n příklad: dvojsytná kyselina: prof Viktor Kanický, Analytická chemie I 14

Faktory ovlivňující rozpustnost n příklad: Jaká je rozpustnost Ca. F 2 v 0, 01 M – HCl? prof Viktor Kanický, Analytická chemie I 15

Faktory ovlivňující rozpustnost n příklad: Vypočtěte rozpustnost Ag. I v 0, 01 M NH 3 Rozpustnost se zvýší 40 x. prof Viktor Kanický, Analytická chemie I 16

Faktory ovlivňující rozpustnost n příklad: Vypočítejte molární rozpustnost Ba. CO 3 při = 6 a I = 0, 1 (p. Ks = 8, 09; p. K 1 = 6, 15; p. K 2 = 9, 99) prof Viktor Kanický, Analytická chemie I p. H 17

Faktory ovlivňující rozpustnost q rozpouštění Ba. CO 3 v H 2 O, p. H se ovlivní, postup iterační 1) zanedbání hydrolýzy → 2) zjistíme hodnotu p. H při hydrolýze CO 32 a) hydrolytická konstanta b) zanedbáme pro výpočet p. H, protože prof Viktor Kanický, Analytická chemie I 18

Faktory ovlivňující rozpustnost c) p. H slabé kyseliny: 3) zjistíme hodnotu podm. souč. rozp. Ks´ a c (Ba. CO 3) 4) opakujeme výpočet p. H podle 2 c) s c (CO 32 -) = 1, 48. 10 -4 dostaneme p. H = 9, 90, Ks´ = 10 -7, 74, c (Ba. CO 3) = 1, 35. 10 -4 M další aproximace dává c (Ba. CO 3) = 1, 32. 10 -4 M prof Viktor Kanický, Analytická chemie I 19

Faktory ovlivňující rozpustnost q q q závislost rozpustnosti sulfidů na p. H – podstata klasického „sirovodíkového“ dělení kationtů sulfid MS: podmínka okrajová: p. H ≤ 6 – zjednodušení → x (S) zahrnuje jen 1 člen: K 1, K 2 – disoc. konst. H 2 S a HS-, hydrolýza M se zanedbává prof Viktor Kanický, Analytická chemie I 20

Faktory ovlivňující rozpustnost prof Viktor Kanický, Analytická chemie I 21

Faktory ovlivňující rozpustnost q vliv tvorby komplexů s vlastními ionty na rozpustnost M – kation; B – anion, ligand; MB – málo rozpustná slouč. rozpustné komplexy (MB)r – rozpustný, nedisociovaný podíl slouč. MB βMB – konstanta stability vztah pro výpočet rozpustnosti MB za přítomnosti nadbytku srážedla prof Viktor Kanický, Analytická chemie I 22
![Faktory ovlivňující rozpustnost n příklad Ag Cl rozp komplexy Ag Cl 2 Ag Cl Faktory ovlivňující rozpustnost n příklad: Ag. Cl, rozp. komplexy [Ag. Cl 2]-, [Ag. Cl](https://slidetodoc.com/presentation_image_h/c963713f1227aebffe1b70decc15e734/image-23.jpg)
Faktory ovlivňující rozpustnost n příklad: Ag. Cl, rozp. komplexy [Ag. Cl 2]-, [Ag. Cl 3]2 -, [Ag. Cl 4]3 K s, β 1 β 2 β 3 β 4 prof Viktor Kanický, Analytická chemie I 23

Faktory ovlivňující rozpustnost q závislost rozpustnosti hydroxidů na p. H prof Viktor Kanický, Analytická chemie I 24

Faktory ovlivňující rozpustnost Hydroxidy trojmocných kovů jsou méně rozpustné než hydroxidy dvojmocných. Při p. H 4, 5 až 6: Fe(OH)3 ↓, Al(OH)3 ↓ kvantitativně oddělí se od Zn 2+, Mn 2+, Co 3+, Ni 2+, Ca 2+ a Mg 2+ prof Viktor Kanický, Analytická chemie I 25

Faktory ovlivňující rozpustnost n 3) vliv iontové síly (vliv cizích iontů) q indiferentní elektrolyt 1) 2) 3) q rozpustnost látek se zvětšuje se stoupající koncentrací „cizích“ iontů v roztoku prof Viktor Kanický, Analytická chemie I 26

Faktory ovlivňující rozpustnost n 4) vliv velikosti částic sraženiny vliv povrchu krystalů q q q pro r > 10 -3 mm platí rozpustnost roste – hrany krystalů – menší přitažlivé síly malé krystaly se rozpouštějí – větší rostou zrání sraženiny koloidní disperze – náboj adsorbovaných iontů snižuje rozpustnost OSTWALD - FREUNDLICH prof Viktor Kanický, Analytická chemie I 27

Faktory ovlivňující rozpustnost n 5) vliv rozpouštědla q q q organická rozpouštědla snižují rozpustnost anorganických látek příklad: Ca. SO 4 v 50% Et. OH kvantitativně Li. Cl rozpustný v amylalkoholu, KCl a Na. Cl nikoliv vliv roste s nábojem iontů prof Viktor Kanický, Analytická chemie I 28

Vlastnosti sraženin n závisejí na: - chemickém složení - prostředí - způsobu srážení n druhy sraženin: - koloidní (síra) - želatinová (Fe(OH)3) - hrudkovitá (Ag. Cl) - krystalická: q q q n jemně (Ba. SO 4) hrubě (Pb. Cl 2) krystalická s. vhodnější: lépe se filtruje, čistší než amorfní požadavky na sraženinu: filtrovatelnost, snadné sušení a žíhání na definovaný stav prof Viktor Kanický, Analytická chemie I 29

Vlastnosti sraženin n mechanismus: 1) vznik přesyceného roztoku (metastabilní n stav) 2) tvorba krystalizačních center (jádra, prim. část. ) 3) narůstání částic (stárnutí) velké částice rostou na úkor malých a) rychlost vylučování sraženiny (Weimarn) c´ - okamžitá koncentrace přesyceného roztoku c - rozpustnost prof Viktor Kanický, Analytická chemie I 30

Vlastnosti sraženin b) střední velikost částic závisí na původní koncentraci roztoku (Weimarn) n n rozpustnější látky – větší částice t – čas – doba zrání c) střední velikost částic roste s dobou, po kterou byla ponechána sraženina v matečném roztoku prof Viktor Kanický, Analytická chemie I 31

Vlastnosti sraženin n stárnutí (zrání) sedlin: n n nedokonalé → dokonalejší krystaly metastabilní modifikace → stabilní (aragonit → kalcit) změna počtu molekul krystalické vody dehydratace sraženin (hydrat. oxidy Fe, Ti, Sn, Al, Zr, Th) polymerace (Co. S, Ni. S) prof Viktor Kanický, Analytická chemie I 32

Koloidní vlastnosti sraženin q koloidní disperze (10 -5 – 10 -7 cm): Brownův pohyb Tyndallův efekt q RTG → krystalický charakter n n q q velký specifický povrch (S/V) schopnost adsorpce existence koloidní disperze: odpudivé elastické síly elektrická dvojvrstva → micely příklad: změna náboje micely v tzv. izoelektrickém bodě x bod ekvivalence prof Viktor Kanický, Analytická chemie I 33

Koloidní vlastnosti sraženin n koagulace q q q souhlasné náboje micel x shlukování nadbytkem elektrolytu se rozruší dvojvrstva → micely koagulují koagul. účinek roste s nábojem (Ag. Cl >> NH 4 Cl, 1000 x) x přednost amonných solí – lze odkouřit stabilita disperze – poutání molekul vody → n n n lyofobní koloidy – nestálé (As 2 S 3, S, Au, Ag. X) lyofilní koloidy – stálé (škrob, želatina, proteiny, Al 2 O 3. x. H 2 O, Si. O 2. x. H 2 O) peptizace – opak koagulace q při filtraci a promývání vodou – odstranění elektrolytu nežádoucí jev! – promýváme proto elektrolytem prof Viktor Kanický, Analytická chemie I 34

Znečištění sraženin q q n spolusrážení (koprecipitace) dodatečné srážení (indukované) spolusrážení adsorpce okluze inkluze směsné krystaly a) adsorpce: závisí na n - koncentraci adsorbovaných látek - vlastnostech sraženiny Paneth-Fajans: nejvíce se adsorbují ionty vlastní a tvořící málo rozpustné látky prof Viktor Kanický, Analytická chemie I 35

Spolusrážení (koprecipitace) q q q příklad: Ba. SO 4 v nadbytku Ba 2+: Br- < Cl. O 3 - < NO 3 Ba. SO 4 v nadbytku SO 42 -: Na+ < K+ < Ca 2+ < Pb 2+ snadněji ionty s větším nábojem, polariz. i. org. barviv Freundlichova adsorpční izoterma (T=konst. ); k, n – konst. ; x – množ. /1 g sraž. q q relativně největší znečišťování je při nejmenších konc. nečistot (poslední zbytky nečistot se odstraňují nejobtížněji) znečištění sraženiny je úměrné povrchu → koagulované koloidní disperze x hrubě kryst. sraženiny prof Viktor Kanický, Analytická chemie I 36

Spolusrážení (koprecipitace) b) okluze: mechanické strhávání cizích součástí roztoku při srážení a narůstání krystalů sraž. kolem nečistoty ≈ koncentrace roztoku a ≈ rychlosti srážení c) inkluze: mechanické uzavření matečného roztoku při růstu krystalů prof Viktor Kanický, Analytická chemie I 37

Spolusrážení (koprecipitace) d) směsné krystaly: izomorfní zastupování iontů při ∆riontu < 10 -15 % a stejné kryst. soustavě tzv. tuhé roztoky přednost ionty se stejnými velikostmi nábojů D – rozděl. koef. ; c 1, c 2 – koncentrace izomorfních složek; t – sraženina; r-roztok nelze čistit opak. sraž. týmž činidlem!!! D málo závisí na T(K), v srážení, na koncentraci prof Viktor Kanický, Analytická chemie I 38

Spolusrážení (koprecipitace) q typy znečištění prof Viktor Kanický, Analytická chemie I 39

Dodatečné srážení n 1) 2) n postprecipitace – indukované původně čistá sraženina: po čase z přesyc. roztoku Mg. Ox sráží Mg. Ox je proto nutné dodržovat konc. poměry a Ca. Ox brzy odfiltrovat, dtto sulfidy klathráty unvitř benzen prof Viktor Kanický, Analytická chemie I 40

Amorfní sraženiny n amorfní sraženiny – koagulací koloidů → gely q q n velký specifický povrch → velká sorpce koagulace přebytkem elektrolytu – již tento znečišťuje filtrace – ihned promývat elektrolytem (peptizace!!!) snížení koprecipitace – vhodným postupem prof Viktor Kanický, Analytická chemie I 41

Zásady srážení 1) srážení z horkých roztoků – lepší tvorba dokonalé kryst. mřížky bez cizích iontů; před filtrací ochladit v případě rozpustnějších sraženin (např. Mg. NH 4 PO 4) 2) srážení z dostatečně zředěných roztoků; opakovaná srážení (2 x) (hydroxidy); snížení koprecipitace kationtů na sraž. A+B- srážením aniontem B- a naopak 3) srážecí činidlo se přidává zvolna za míchání x lokální zvýšení koncentrace; tvorba hrubých sedlin s malým povrchem 4) nechat stát před filtrací – menší okluze x dodatečné srážení! 5) důkladné promytí (horká voda, elektrolyt), koloidy!! příliš r rozp. látky - alkoholem prof Viktor Kanický, Analytická chemie I 42

Postup srážení 1) roztok látky určené k analýze upravíme dle návodu (p. H, teplota) a srážíme čirým roztokem srážedla 2) srážení v kádinkách 250 -400 ml, vzorek upraven na cca 100 -200 ml 3) srážedlo přidáváme pomalu z byrety nebo pipety + míchání skleněnou tyčinkou bez gumové stěrky 4) po usazení sraženiny zkouška na úplnost srážení prof Viktor Kanický, Analytická chemie I 43

Postup srážení n srážení z homogenního prostředí: q q q srážecí činidlo vzniká pozvolna a plynule chemickou reakcí rozklad, hydrolýza příklad: srážení sulfidů thioacetamidem (za horka hyd. ) sraž. sulfidů lépe koagulují a méně adsorbují prof Viktor Kanický, Analytická chemie I 44

Postup srážení q příklad: srážení hydroxidů (M 3+, M 4+) odděl od M 2+ vázání H+ prof Viktor Kanický, Analytická chemie I 45

Filtrace n rychlost filtrace P – filtrační plocha r – poloměr pórů p 1 -p 2 rozdíl hydrostatických tlaků na obou stranách l – efektivní délka kapilár η – dynamická viskosita V – objem kapiláry t - čas q urychlení filtrace: n n zvětšení P (skládaný filtr, frita) p 1 -p 2 (odsávání, delší stopka) zmenšení η (zahřátí) prof Viktor Kanický, Analytická chemie I 46

Filtrace n kromě mechanických vlivů: n n n q q hydratační efekt adhezní efekt adsorpční efekt elektrokinetický efekt povaha filtrované látky hydratace – bobtnání lyofilní filtrační hmoty → zpomalené filtrace (zachytí i menší částice) adhese – kapalina v kapilárách proudí pomaleji při stěnách prof Viktor Kanický, Analytická chemie I 47

Filtrace q q adsorpce – částice sraženiny na stěnách kapilár ulpívají elektrokinetický efekt – potenciálový rozdíl mezi stěnou kapiláry a kapalinou → n n q záporný náboj filtr. papíru zadržuje kationty a kladně nabité částice sraženiny po promytí HCl papír zadržuje záporné částice povaha filtrované látky – tvoří další filtrační vrstvu – jiná kapilarita n gely – ucpávání filtru, proto větší pórovitost a filtrace s odsáváním (p 1 -p 2) prof Viktor Kanický, Analytická chemie I 48

Filtrace n papírové filtry kvantitativní (bezpopel. ) čistá celulosa, 0, 01 mg popela n barevné odlišení n n červená páska (amorfní Fe 2 O 3) žlutá páska (koloidní, sulfidy) modrá páska ( jemná kryst. sraženina, Ba. SO 4) také černá páska prof Viktor Kanický, Analytická chemie I 49

Filtrace n > 10% kys. nebo louhů rozrušuje filtry papírové a nelze filtrovat látky, které se redukují při spalování n filtrační kelímky q q q krystalické sraženiny skleněné – jen sušení (do 200°C) porcelánové – žíhání (do 1200°C) prof Viktor Kanický, Analytická chemie I 50

Promývání sraženiny n odstranění zbytku matečných louhů – účinná je dekantace – promývání v kádince po srážení n menší objemy vícekrát V 1 – objem filtrátu zadržovaného sraženinou V 2 – promývací objem cn – konc. cizích iontů po n promytí prof Viktor Kanický, Analytická chemie I 51

Promývání sraženiny n sraženina – ionex – vytěsnit cizí ionty adsorpcí elektrolytu promývacího roztoku n krystalické sraženiny – promývání roztokem soli o společném iontu se sraženinou n koloidní sraženiny – roztok elektrolytu zabraňující peptizaci n amonné soli – snadné odstranění žíháním n vodou nakonec, alkohol u rozpustnějších sraženin prof Viktor Kanický, Analytická chemie I 52

Sušení n a) na vzduchu q q zbavení přebytečné vlhkosti až do rovnovážného stavu s tenzí vodních par ve vzduchu při dané teplotě Freundlichova adsorpční izoterma y = a. xb – monomolekulární vrstva vody a) nehygroskopické látky b) hygroskopické látky (více vrstev H 2 O) ad b) nelze sušit na vzduchu → snížení tenze par a zvýšení teploty; vakuové sušení q tenze par povrchově vázané vody nižší, proto 105 -110°C prof Viktor Kanický, Analytická chemie I 53

Sušení n b) v exikátoru – vysoušedla n n chemicky (P 2 O 5) adsorpcí (silik. ) P 2 O 5 mg/l H 2 O ve vzduchu 2. 10 -5 Mg(Cl. O 4)2 Ba. O KOH silikagel 5. 10 -4 (anhydron) – pro element. analýzu 7. 10 -4 2. 10 -3 3. 10 -2 – zachycení až 40 % své hmotnosti vodních par modifikace Co. Cl 2 – bezvodý modrý → vlhký růžový, regenerace 180 -200°C prof Viktor Kanický, Analytická chemie I 54

Sušení q molekulová síta – silikáty Al, Ca, K, Na q adsorpce plynů n n kyselých (CO 2, SO 2) ≈ Ca. O, KOH, Na. OH zásaditých (NH 3) ≈ P 2 O 5, H 2 SO 4 q páry alkoholu ≈ Ca. Cl 2 q benzin, chloroform, éter ≈ parafin prof Viktor Kanický, Analytická chemie I 55

Sušení n c) při zvýšené teplotě q q q sušárny do 180°C, ± 5°C regulace, 105 -110°C, také ztráta krystalové vody: prchání: NH 3, CO 2, SO 2, amonné soli při 150°C, těkavé chloridy filtrační papír vydrží 150°C sušení do tzv. konstantní váhy – pokud je vysušená sraženina přímo formou k vážení – opakujeme sušení a vážení až se hmotnost nemění (0, 2 mg) prof Viktor Kanický, Analytická chemie I 56

Žíhání n n převedení sraženiny do definovaného stavu porcelánový kelímek + triangl s keramickými válečky (Pt - kelímek) teploty: Bunsen. kahan -porcel. 700 -800°C - Pt 850 -1000°C Tecluho + 100°C x Buns. Mecker + 200°C x Buns. prof Viktor Kanický, Analytická chemie I 57

Zásady a postup žíhání 1) 2) vysušení a vyžíhání prázdného kelímku do konstantní hmotnosti (pozvolna, nesvítivý plamen), kleště sbalený filtr do kelímku: a) b) 3) vysušit při 70°C v sušárně nebo nad kahanem spálit (uhelnatí, přístup vzduchu, nesmí hořet!!!) žíhat (500 -1000°C) – kahan, muflová pec; po ochlazení na 100 -200°C → do exikátoru; do konstantní hmotnosti (± 0, 2 mg) prof Viktor Kanický, Analytická chemie I 58

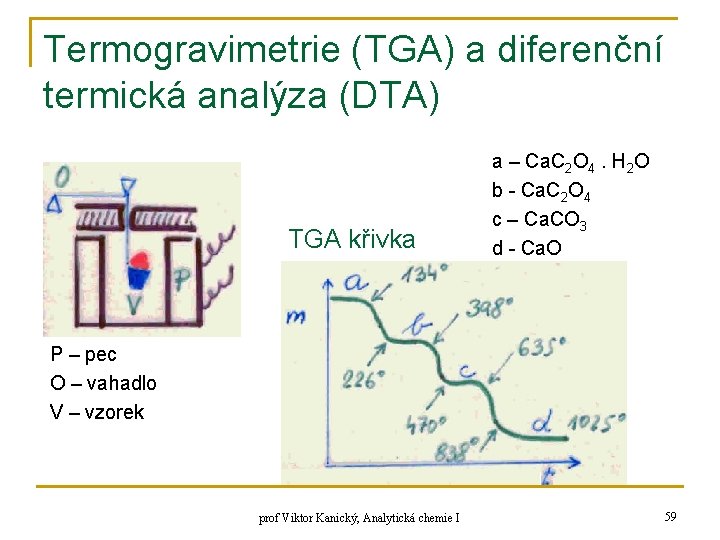
Termogravimetrie (TGA) a diferenční termická analýza (DTA) TGA křivka a – Ca. C 2 O 4. H 2 O b - Ca. C 2 O 4 c – Ca. CO 3 d - Ca. O P – pec O – vahadlo V – vzorek prof Viktor Kanický, Analytická chemie I 59

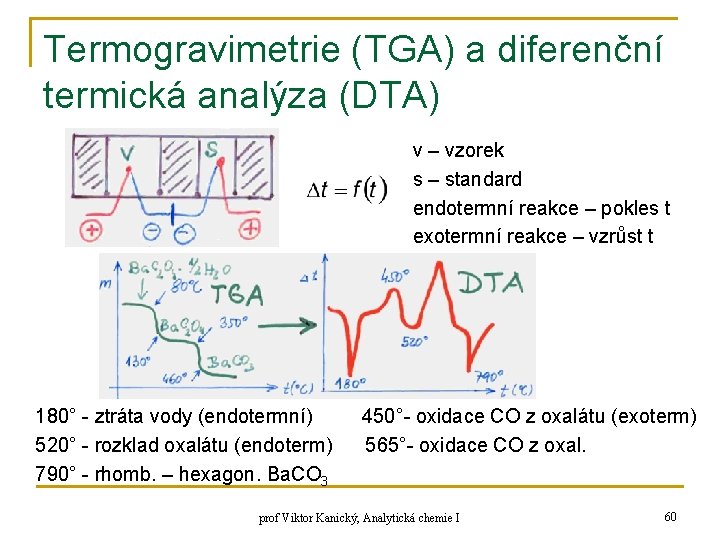
Termogravimetrie (TGA) a diferenční termická analýza (DTA) v – vzorek s – standard endotermní reakce – pokles t exotermní reakce – vzrůst t 180° - ztráta vody (endotermní) 520° - rozklad oxalátu (endoterm) 790° - rhomb. – hexagon. Ba. CO 3 450°- oxidace CO z oxalátu (exoterm) 565°- oxidace CO z oxal. prof Viktor Kanický, Analytická chemie I 60

Typy vážkových stanovení a) bez použití srážecího činidla – žíhání solí, soli těžkých kovů s aniontem těkavé kyseliny (NO 3 -, CO 32 -, SO 42 -) → Cu. O, Zn. O, Fe 2 O 3, Al 2 O 3, Cr 2 O 3, Bi 2 O 3, Sb 2 O 3, Sn. O 2, Ti. O 2, Zr. O 2) b) přidáním srážecího činidla – srážedla: H 2 S, HCl, H 2 SO 4, NH 4 OH, Na 2 HPO 4, Ag. NO 3, Ba. Cl 2 organická srážedla: 8 -hydroxychinolin, anthranilová kyselina, šťavelová kyselina prof Viktor Kanický, Analytická chemie I 61

Typy vážkových stanovení c) srážením z homogenního prostředí pro vylučování hydroxidů: pro vylučování oxalátů, fosfátů a sulfátů hydrolýza esterů: pro vylučování sulfidů thioacetamid prof Viktor Kanický, Analytická chemie I acetamid 62

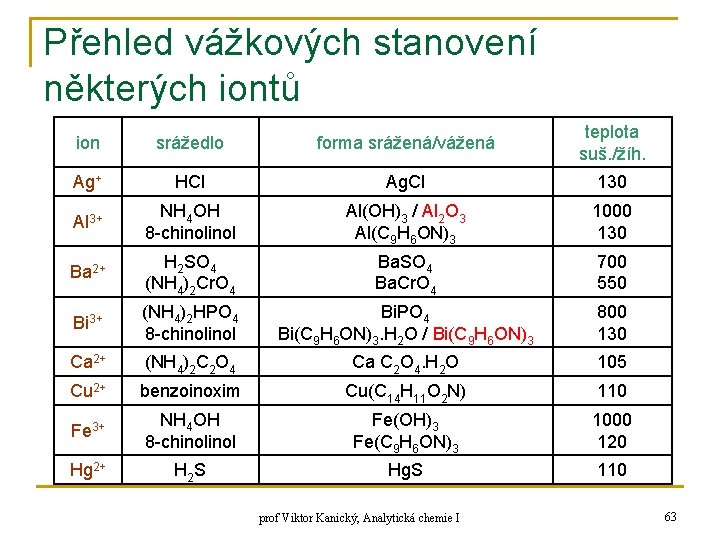
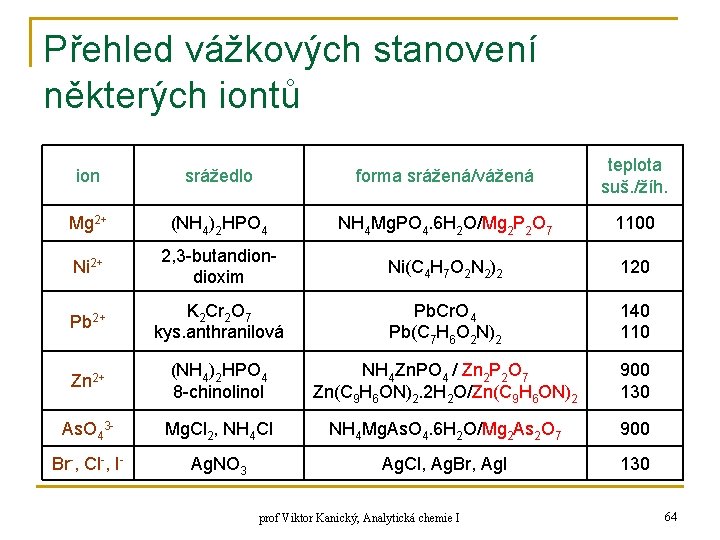
Přehled vážkových stanovení některých iontů ion srážedlo forma srážená/vážená teplota suš. /žíh. Ag+ HCl Ag. Cl 130 Al 3+ NH 4 OH 8 -chinol Al(OH)3 / Al 2 O 3 Al(C 9 H 6 ON)3 1000 130 Ba 2+ H 2 SO 4 (NH 4)2 Cr. O 4 Ba. SO 4 Ba. Cr. O 4 700 550 Bi 3+ (NH 4)2 HPO 4 8 -chinol Bi. PO 4 Bi(C 9 H 6 ON)3. H 2 O / Bi(C 9 H 6 ON)3 800 130 Ca 2+ (NH 4)2 C 2 O 4 Ca C 2 O 4. H 2 O 105 Cu 2+ benzoinoxim Cu(C 14 H 11 O 2 N) 110 Fe 3+ NH 4 OH 8 -chinol Fe(OH)3 Fe(C 9 H 6 ON)3 1000 120 Hg 2+ H 2 S Hg. S 110 prof Viktor Kanický, Analytická chemie I 63

Přehled vážkových stanovení některých iontů ion srážedlo forma srážená/vážená teplota suš. /žíh. Mg 2+ (NH 4)2 HPO 4 NH 4 Mg. PO 4. 6 H 2 O/Mg 2 P 2 O 7 1100 Ni 2+ 2, 3 -butandioxim Ni(C 4 H 7 O 2 N 2)2 120 Pb 2+ K 2 Cr 2 O 7 kys. anthranilová Pb. Cr. O 4 Pb(C 7 H 6 O 2 N)2 140 110 Zn 2+ (NH 4)2 HPO 4 8 -chinol NH 4 Zn. PO 4 / Zn 2 P 2 O 7 Zn(C 9 H 6 ON)2. 2 H 2 O/Zn(C 9 H 6 ON)2 900 130 As. O 43 - Mg. Cl 2, NH 4 Cl NH 4 Mg. As. O 4. 6 H 2 O/Mg 2 As 2 O 7 900 Br-, Cl-, I- Ag. NO 3 Ag. Cl, Ag. Br, Ag. I 130 prof Viktor Kanický, Analytická chemie I 64

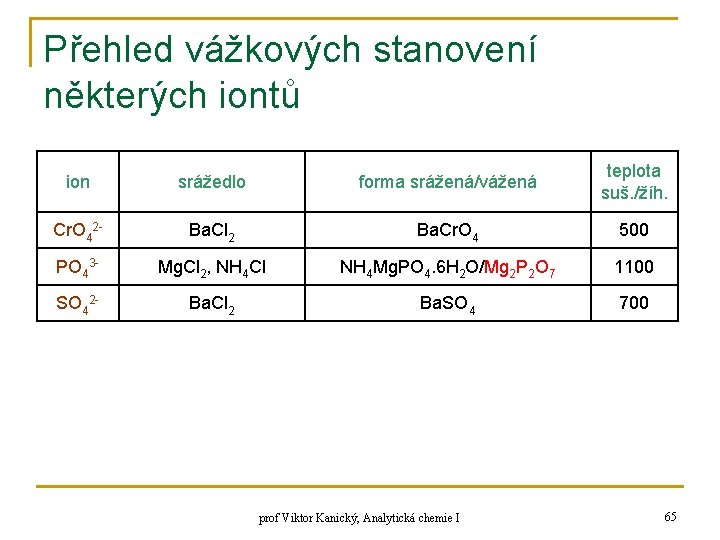
Přehled vážkových stanovení některých iontů ion srážedlo forma srážená/vážená teplota suš. /žíh. Cr. O 42 - Ba. Cl 2 Ba. Cr. O 4 500 PO 43 - Mg. Cl 2, NH 4 Cl NH 4 Mg. PO 4. 6 H 2 O/Mg 2 P 2 O 7 1100 SO 42 - Ba. Cl 2 Ba. SO 4 700 prof Viktor Kanický, Analytická chemie I 65

Výpočet vážkové analýzy n gravimetrický faktor – čím je < 1, tím je analytická chyba menší q př. a (g) vzorku → b (g) Ag. Cl, obsah chloridů je prof Viktor Kanický, Analytická chemie I 66

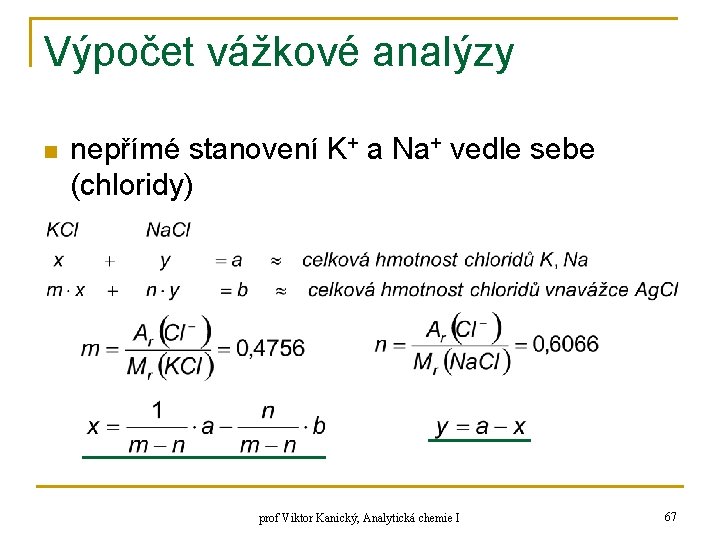
Výpočet vážkové analýzy n nepřímé stanovení K+ a Na+ vedle sebe (chloridy) prof Viktor Kanický, Analytická chemie I 67

Odpařování a odkuřování roztoků n 1) odpařování roztoků q zmenšení objemu roztoku před srážením n n n q q q v kádinkách, miskách (porcelán, Pt, PTFE) na vzdušné, vodní, pískové lázni, infralampou teplota pod b. v. rozpouštědla – bez prskání (ztráty) alkalické roztoky – v porcelánových miskách použitých, vyleptaných – převládá na povrchu alkalická složka kyselé roztoky – v křemenných miskách nebo v použitých skleněných - převládá na povrchu kyselá složka úplné odpaření – stanovení odparku (např. ve vodách) prof Viktor Kanický, Analytická chemie I 68

Odpařování a odkuřování roztoků n 2) odkuřování roztoků q q těkavé kyseliny na vodní lázni H 2 SO 4, HCl. O 4, amonné soli, MF + Si. O 2 – vyšší teplota, písková lázeň, infralampa, přežíhnutí prof Viktor Kanický, Analytická chemie I 69
 Gravimetrický faktor
Gravimetrický faktor Viktor dyk literární směr
Viktor dyk literární směr Elektro
Elektro Geng viktor
Geng viktor Vitalij pecharsky
Vitalij pecharsky Viktor polić
Viktor polić Rajzfejlődés gyermekkorban
Rajzfejlődés gyermekkorban Viktor maier
Viktor maier Viktor frankl gestalt
Viktor frankl gestalt Careea
Careea Viktor binzberger
Viktor binzberger Victor pestov
Victor pestov Viktor haase
Viktor haase Arany viktor
Arany viktor Dr viktor christiansen
Dr viktor christiansen Viktor marko
Viktor marko Viktor staroverov
Viktor staroverov Jozef jurko karikaturista
Jozef jurko karikaturista Vladimir vasnetsov
Vladimir vasnetsov Krysař hlavní myšlenka
Krysař hlavní myšlenka L
L Teori viktor frankl
Teori viktor frankl Arany viktor
Arany viktor Viktor arhipov
Viktor arhipov Acs functions
Acs functions Opel viktor
Opel viktor Viktor pocajt
Viktor pocajt Viktor dyk současníci
Viktor dyk současníci Teoria de viktor frankl
Teoria de viktor frankl Viktor fedun
Viktor fedun Viktor mizo wikipedia
Viktor mizo wikipedia Viktor bergen
Viktor bergen Dr viktor christiansen
Dr viktor christiansen Viktor hartmann baba yaga
Viktor hartmann baba yaga Kresba postavy podle věku
Kresba postavy podle věku Zsiday viktor
Zsiday viktor Viktor emil frankl
Viktor emil frankl Viktor binzberger
Viktor binzberger Impuls chemie 4 lösungen
Impuls chemie 4 lösungen Hochofen beschriftung
Hochofen beschriftung Soli chemie 9. ročník
Soli chemie 9. ročník Lnky
Lnky Boeken over kwantumchemie en theoretische chemie
Boeken over kwantumchemie en theoretische chemie Concept cartoon chemie
Concept cartoon chemie Le chatelier
Le chatelier Chemie 4 klasse
Chemie 4 klasse Isosteria
Isosteria Chemie
Chemie Podobory chemie
Podobory chemie Donauchem pischelsdorf
Donauchem pischelsdorf Dobrý sluha ale zlý pán chemie
Dobrý sluha ale zlý pán chemie Plyn hexan
Plyn hexan Schilling chemie
Schilling chemie Magnesiumhydrogencarbonat formel
Magnesiumhydrogencarbonat formel Ddt chemie
Ddt chemie Gefahrensymbole physik
Gefahrensymbole physik Chemie
Chemie Substrat chemie
Substrat chemie Nico rutten
Nico rutten Scheikunde chemie overal vwo 4
Scheikunde chemie overal vwo 4 Molecuulorbitaal
Molecuulorbitaal Alkane
Alkane Impuls chemie 4 lösungen
Impuls chemie 4 lösungen Danke für eure aufmerksamkeit chemie
Danke für eure aufmerksamkeit chemie Chemie porn
Chemie porn Methan ethan
Methan ethan Chemie
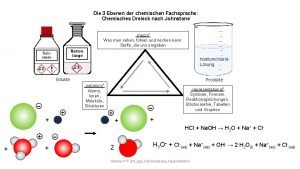
Chemie Johnstone dreieck
Johnstone dreieck Chemie
Chemie Impuls chemie 4
Impuls chemie 4