DKAZY ANIONT prof Viktor Kanick Analytick chemie I






























- Slides: 35

DŮKAZY ANIONTŮ prof. Viktor Kanický, Analytická chemie I 1

Důkazy aniontů n není zde systém postupného dělení důkazy jsou dostatečně selektivní provedení reakcí: q q neutrální roztok × kyselé prostředí únik plynů: CO 32 -, S 2 -, HS-, NO 3 -, NO 2 odstranění těžkých kovů: n varem s 1 M Na 2 CO 3 nerozpustné uhličitany, vznikají však nežádoucí změny a ztráty: q q q n n oxidace SO 32 -, S 2 -, NO 2 adsorpce na sraženiny karbonátů: SO 42 -, PO 42únik těkavých kyselin po neutralizaci HNO 3 pomocí iontoměničů – výměna za Na+ povařením s Mg. O: nelze požít pro důkazy PO 42 -, As. O 42 -, CO 32 prof. Viktor Kanický, Analytická chemie I 2

Skupinové reakce aniontů A. n srážecí: Ba 2+, Ag+ ; rozpustnost = f(podmínek) I. srážecí reakce Ba 2+ n Ba soli nerozpustné v silně kyselém prostředí 2 M HCl, 2 M HNO 3 : SO 42 - n Ba soli nerozpustné ve slabě kyselém prostředí 2 M HAc : F-, Cr. O 42 -, SO 32 -, S 2 O 32 - n Ba soli nerozpustné v neutrálním prostředí (voda) PO 43 - , As. O 43 -, CO 32 -, BO 2 prof. Viktor Kanický, Analytická chemie I 3

Skupinové reakce aniontů n II. srážecí reakce Ag+ (z neutrálního prostředí) n Ag soli nerozpustné ve 2 M HNO 3 Cl-, Br-, I-, SCN-, [Fe(CN)6]4 -, [Fe(CN)6]3 -, S 2 - n Ag soli stálé jen v neutrálním prostředí, rozpustné v HNO 3 Cr. O 42 -, SO 32 -, S 2 O 32 -, PO 43 -, As. O 33 -, As. O 43 -, CO 32, BO 2 - n Ag soli nerozpustné ve 2 M NH 3 Br-, SCN-, [Fe(CN)6]4 -, I-, S 2 prof. Viktor Kanický, Analytická chemie I 4

Skupinové reakce aniontů B. n oxidačně-redukční: Mn. O 4 -, I 2 ; barevné přechody I. oxidační reakce manganistanu q odbarvení Mn. O 4 - v kys. prostředí (1 M H 2 SO 4) působením iontů s redukčními vlastnostmi SO 32 -, S 2 O 32 -, As. O 33 -, S 2 -, [Fe(CN)6]4 -, Br-, I-, CN-, SCN-, NO 2 - prof. Viktor Kanický, Analytická chemie I 5

Skupinové reakce aniontů n II. oxidační reakce jodu q odbarvení I 2 v neutrálním nebo slabě alkalickém (p. H < 9) prostředí, vratná reakce (Na. HCO 3 pevný) SO 32 -, S 2 O 32 -, As. O 33 -, S 2 -, [Fe(CN)6]4 -, CN-, SCN- prof. Viktor Kanický, Analytická chemie I 6

Skupinové reakce aniontů n III. redukční reakce jodidu q anionty s oxidačními vlastnostmi oxidují v kyselém prostředí jodid na jod → žluté, červenohnědé zbarvení roztoku, modré zbarvení škrobového roztoku Cr. O 42 -, Cr 2 O 72 -, As. O 43 -, S 2 -, [Fe(CN)6]3 -, NO 2 - prof. Viktor Kanický, Analytická chemie I 7

Selektivní reakce aniontů n I. skupina málo rozpustných Ba solí Ba. SO 4 nerozpust. X Ba. S 2 O 3 (rozklad → SO 2, S – zákal) dělění: Sr. Cl 2 Ba. SO 4, Sr. SO 4 – důkaz SO 42 - heparovou reakcí prof. Viktor Kanický, Analytická chemie I 8

Skupina málo rozpustných Ba solí n SO 42 n n sraženina za žáru s Mg → redukce S 2 - - důkaz: Pb. Ac (octan olovnatý) Na 2 Fe(CN)5 NO (nitroprussid sodný) prof. Viktor Kanický, Analytická chemie I 9

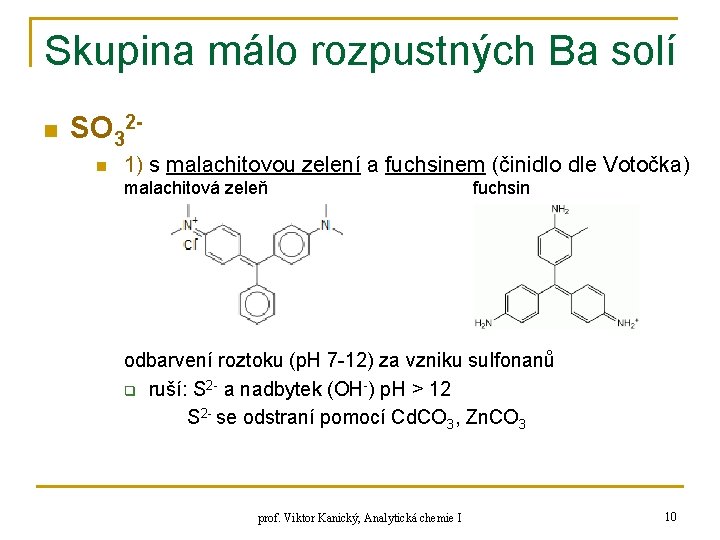
Skupina málo rozpustných Ba solí n SO 32 n 1) s malachitovou zelení a fuchsinem (činidlo dle Votočka) malachitová zeleň fuchsin odbarvení roztoku (p. H 7 -12) za vzniku sulfonanů q ruší: S 2 - a nadbytek (OH-) p. H > 12 S 2 - se odstraní pomocí Cd. CO 3, Zn. CO 3 prof. Viktor Kanický, Analytická chemie I 10

Skupina málo rozpustných Ba solí n 2) s nitroprussidem zinečnatým – důkaz v plynné fázi sulfitonitroprussid zinečnatý (červený, málo rozpustný) q q q ruší: maskování: Hg. Cl 2 provedení: na filtračním papíře napojeném činidlem – nad kelímkem v parách. Nezreagovaný nitroprussid se odbarví v parách amoniaku → barva jen u produktu prof. Viktor Kanický, Analytická chemie I 11

Skupina málo rozpustných Ba solí n S 2 O 32 n 1) v kyselém prostředí rozklad: n 2) s chloridem zinečnatým přechodné zbarvení neboť redukce Fe. III → Fe. II q n ruší: SCN-, SO 32 - 3) jodozidová reakce – katalýza; v přítomnosti S 2(obsažena v S 2 O 32 -) rychle probíhá: q ruší: SCN-, S 2 - (oddělení jako Cd. S, Zn. S) prof. Viktor Kanický, Analytická chemie I 12

Skupina málo rozpustných Ba solí n Fn se Zr. IV-chelátem s xylenovou oranží q q stabilnější komplex Zr s ligandy F- → chelát se rozkládá → červeno fialový chelát → žluté uvolněné činidlo obecně: využití F- jako silně komplex. ligandu prof. Viktor Kanický, Analytická chemie I 13

Skupina málo rozpustných Ba solí n Si. O 32 n s molybdenanem amonným → molybdáto-křemičitá kyselina H 4[Si(Mo 3 O 10)4] q q vznik v kyselém prostředí – žlutý roztok vzorek však nejdříve zalkalizovat, aby byl dostatek monomerní kys. Si(OH)4 redukcí Sn. Cl 2, S 2 O 32 - → molybdenová modř – lze ji zoxidovat HNO 3 na žlutou H 4[Si(Mo 3 O 10)4] ruší: As. O 43 -, PO 43 - → molybdátofosforečná molybdátoarseničná prof. Viktor Kanický, Analytická chemie I 14

Skupina málo rozpustných Ag solí Rozpustných v 2 M HNO 3 n zbarvení solí: charakteristické n n n Ag 2 Cr. O 4 – červenohnědý Ag 3 As. O 4 – čokoládově hnědý Ag 3 PO 4, Ag. As. O 2 – žluté Ag. BO 2 – bílý Ag 2 CO 3 – nažloutlý neutrální, alkal. , žlutý roz. kyselý, oranž. roz. interference (rušení): As. O 43 - x PO 43 - molybdenanem NH 4+ As. O 2 - (HNO 3 konc. ) → As. O 43 - rovněž prof. Viktor Kanický, Analytická chemie I 15

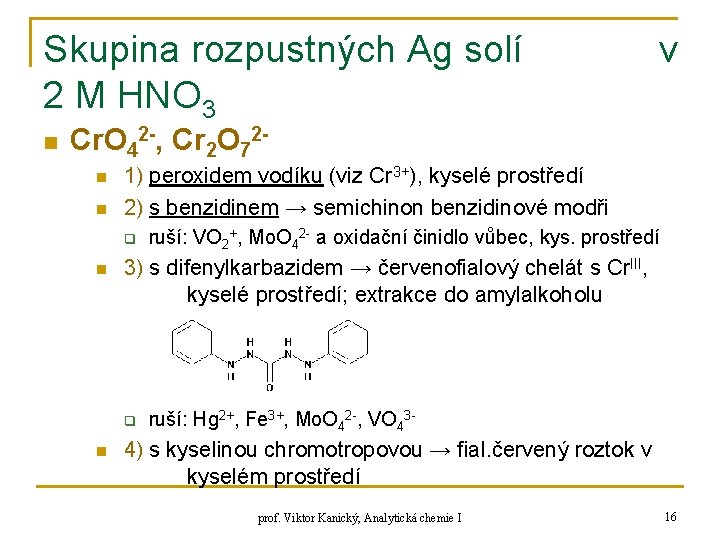
Skupina rozpustných Ag solí 2 M HNO 3 n v Cr. O 42 -, Cr 2 O 72 n n 1) peroxidem vodíku (viz Cr 3+), kyselé prostředí 2) s benzidinem → semichinon benzidinové modři q n 3) s difenylkarbazidem → červenofialový chelát s Cr. III, kyselé prostředí; extrakce do amylalkoholu q n ruší: VO 2+, Mo. O 42 - a oxidační činidlo vůbec, kys. prostředí ruší: Hg 2+, Fe 3+, Mo. O 42 -, VO 43 - 4) s kyselinou chromotropovou → fial. červený roztok v kyselém prostředí prof. Viktor Kanický, Analytická chemie I 16

Skupina rozpustných Ag solí 2 M HNO 3 n v PO 43 n 1) s molybdenanem amonným → žlutá sraženina § q q q x Si. O 32 - (žlutý roztok) tetrakis-trimolybdátofosforečnan amonný srážení za horka, kys. prostředí ruší: As. O 43 odstranění As. O 43 - redukcí Zn prachem na As. O 33 - a vysrážení H 2 S na As 2 S 3 prof. Viktor Kanický, Analytická chemie I 17

Skupina rozpustných Ag solí 2 M HNO 3 n n v As. IIIO 2 - (As. IIIO 33 -) n 1) redukcí Sn. Cl 2 – společná reakce s As. O 43 - n (Bettendorfova zkouška) 2) se sulfanem → As 2 S 3 žlutý, As. V nereaguje! As. VO 43 n 1) redukcí Sn. Cl 2 – jako As. III →hnědočerný elementární As n 2) s molybdenanem amonným → žlutá sraženina v kys. prostředí HNO 3 q ruší: PO 43 prof. Viktor Kanický, Analytická chemie I 18

Skupina rozpustných Ag solí 2 M HNO 3 v Rozlišení As. IIIO 2 - x As. VO 43 - Ag. NO 3 As. IIIO 2 - : žlutá sraženina Ag 3 As. O 3 rozpuštěné v HNO 3 a NH 3 As. VO 43 - : čokoládově hnědá sraženina Ag 3 As. O 4 rozpuštěné v HNO 3 a NH 3 prof. Viktor Kanický, Analytická chemie I 19

As – toxicita, jedy, kriminalistika Společné reakce sloučenin arsenu – redukce na arsenovodík (arsin, arsan) As. H 3 n 1) Marshova – Liebigova zkouška – oficiální důkaz prof. Viktor Kanický, Analytická chemie I 20

As – toxicita, jedy, kriminalistika n 2) Gutzeitova zkouška – As. H 3 q As. H 3 barví papírek s Ag. NO 3 žlutě (arsenid Ag 3 As) a posléze černá rozkladem prof. Viktor Kanický, Analytická chemie I 21

Skupina rozpustných Ag solí 2 M HNO 3 n v B(OH)4 boritanový anion: jednosytná kyselina p. K = 10 n 1) plamenová zkouška–zelený plamen(λ=548, 1 a 519, 3 nm) q ruší: Cu 2+ n 2) plamenová zk. těkavých esterů – zelený plamen n 3) s kurkuminem (kurkumový papírek) q červený rozpustný komplex 1: 1 ve slabě kys. prostředí (červenohnědé zbarvení papírku, slepý pokus – žlutá), kapka alkal. hydroxidu → temně zelená prof. Viktor Kanický, Analytická chemie I 22

Skupina rozpustných Ag solí 2 M HNO 3 n v CO 32 n 1) s minerálními kyselinami q q ruší: SO 32 -, S 2 O 32 -, HS-, CN- → plyny odstranění: rozklad kys. chromsírovou (K 2 Cr. O 4 v H 2 SO 4) → oxidace rušících aniontů na netěkavé soli (také KMn. O 4) prof. Viktor Kanický, Analytická chemie I 23

Skupina nerozpustných Ag solí v 2 M HNO 3 n v prostředí 2 M HNO 3 se srážejí: n n Ag. Cl, Ag. SCN – bílá sraženina Ag. Br – nažloutlá sraženina Ag. I – žlutá sraženina Ag 2 S – černá sraženina q q Cl-, Br-, SCN- - stálé v H+, OH- prostředí I- v H+oxidace → I 2 (žlutá) HS-, S 2 - - hydrolýza → H 2 S, polysulfidy E 0 – standardní potenciály redox. reakcí prof. Viktor Kanický, Analytická chemie I 24

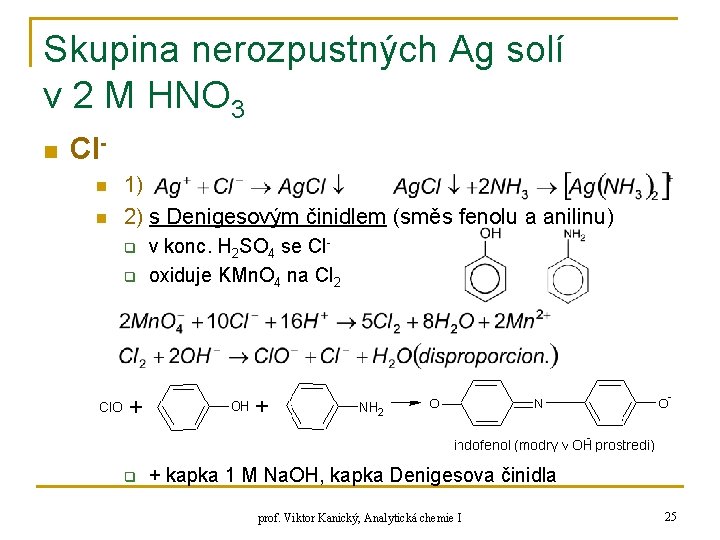
Skupina nerozpustných Ag solí v 2 M HNO 3 n Cln n 1) 2) s Denigesovým činidlem (směs fenolu a anilinu) q v konc. H 2 SO 4 se Cloxiduje KMn. O 4 na Cl 2 q + kapka 1 M Na. OH, kapka Denigesova činidla q prof. Viktor Kanický, Analytická chemie I 25

Skupina nerozpustných Ag solí v 2 M HNO 3 q q také provedení s pipetkou: nad kelímkem pipetka s kapkou Na. OH – absorbce Cl 2 → Cl. Ovyfouknout na kap. desku s Denigesovým činidlem barví suchou část papíru hnědě, fialově nepřecházejí na Br. O-, IO- ! prof. Viktor Kanický, Analytická chemie I 26

Skupina nerozpustných Ag solí v 2 M HNO 3 n 3) tvorba chromylchloridu q v bezvodém prostředí (konc. H 2 SO 4) (červenohnědý, těkavý) q na papíře reakce s OH- papír se zbarví žlutě q ruší: NO 2 -, NO 3 - → NOCl prof. Viktor Kanický, Analytická chemie I 27

Skupina nerozpustných Ag solí v 2 M HNO 3 n Brn 1) oxidací na Br 2 chloraminem T q q q Br 2 – žluté, hnědé zbarvení roztoků – extrakce do chloroformu CHCl 3 ruší: SCN-, I- (nadbytek) v přítomnosti I- nejdříve oxidace na I 2 (hnědé zbarvení vodné fáze – fialové v CCl 3 H), pak I 2 → IO 3 - (bezbarv. ) a nakonec Br 2 SCN- → (CN)2 – dikyan - jedovatý prof. Viktor Kanický, Analytická chemie I 28

Skupina nerozpustných Ag solí v 2 - M HNO 3 n I n n 1) oxidací na I 2 dusitanem sodným q důkaz I 2: q ruší: S 2 O 32 - SCNn 1) s chloridem železitým – v kyselém prostředí q n a) extrakce do CCl 4 nebo CHCl 3 – fial. roztok b) škrobovým roztokem – modrá c) jodido-škrob. papírek - modrá ruší: F-, H 2 PO 4 - (nadbytek) [Fe. NCS]2+ [Fe(NCS)2]+ čerev. komp. HS-, S 2 n n 1) s Pb 2+ →Pb. S 2) s nitroprussidem → [Fe. II(CN)5 NOS]4 - fialový kopmplex prof. Viktor Kanický, Analytická chemie I 29

Skupina aniontů NO 3 -, NO 2 -, Cl. O 4 n NO 3 -, Cl. O 4 n n v roztocích stálé oxidační vlastnosti, pouze soli v pevném stavu nebo koncentrované kyseliny netvoří: komplexy, sraženiny q q n NO 3 - analogie Na+ - rozpustné soli Cl. O 4 - velký objem, malý náboj, tvorba iontových asociátů s bazickými barvivy NO 2 n n oxidační vlastnosti ( 2 I- → I 2) vzdušným O 2 se oxiduje na NO 3 - prof. Viktor Kanický, Analytická chemie I 30

Skupina aniontů NO 3 -, NO 2 -, Cl. O 4 n NO 3 n 1) s difenylaminem q q n modrý oxidační produkt (v konc. H 2 SO 4) ruší: NO 2 -, Cr. O 42 -, Mn. O 4 - (oxidační činidla), Fe 3+, I-, IO 3 I 2 ) (vyluč. 2) tvorba azobarviva po redukci Zn na NO 2 v prostředí HAc se NO 3 - redukují prášk. Zn na NO 2 q důkaz diazotační a kopulační reakcí za vzniku azobarviva q ruší: NO 2 - → odstraní se: a) močovinou v prostředí 1 M H 2 SO 4 q b) jodidem draselným v prostředí kys. octové (80%ní) prof. Viktor Kanický, Analytická chemie I 31

Skupina aniontů NO 3 -, NO 2 -, Cl. O 4 c) azidem sodným (slabě kys. prostředí) d) amonnými solemi (kys. prostředí) vedlejší reakce!!! : 3 HNO 2 → n 3) nitračními reakcemi – v kyselém protředí (v konc. H 2 SO 4) q žluté až oranžové slouč. charakter. zápachu (nutné slepé zk. ) q NO 2 - NERUŠÍ – barví pouze H 2 SO 4 oranžově ruší: I- → odstranit srážením Pb. Ac 2 q q nitrace dalších sloučenin: kyselina fenolsulfonová, fenol 2, 4 disulfonová, α-naftolsulfonová, α-naftylamin (červenofialový) pyrokatechin (zelený), m-fenylendiamin (žl. , červený), kys. chromotropová prof. Viktor Kanický, Analytická chemie I 32

Skupina aniontů NO 3 -, NO 2 -, Cl. O 4 n 4) redukční reakce – zinkem nebo Devardovou slitinou (Cu – Zn - Al) v alkalickém prostředí → NH 3 q q q a) b) c) d) ruší: NO 2 -, CNpřímý důkaz: nitrační reakce po odstranění halogenidů síranem stříbrným postup při redoxních reakcích: pozitivní reakce s difenylaminem (důkaz oxididačních vlast. ) redukcí Zn v OH- prostředí vzniká NH 3 (důkaz dusíku) pomocí KI prověřit případnou přítomnost NO 2 - a při pozitivní reakci je odstranit redukcí Zn v HAc převést NO 3 - na HNO 2 a NO 2 - dokázat tvorbou azobarviva prof. Viktor Kanický, Analytická chemie I 33

Skupina aniontů NO 3 -, NO 2 -, Cl. O 4 n NO 2 n 1) s KI – oxidace I- na jód q q n 2) s difenylaminem q n je to důkaz NO 2 - vedle NO 3 probíhá okamžitě na rozdíl od Cr 2 O 72 - nebo Cl. O 3 - oxidace na d. modř ruší: NO 3 -, Cr 2 O 72 - aj. 3) s KMn. O 4 – redukce na Mn 2+ prof. Viktor Kanický, Analytická chemie I 34

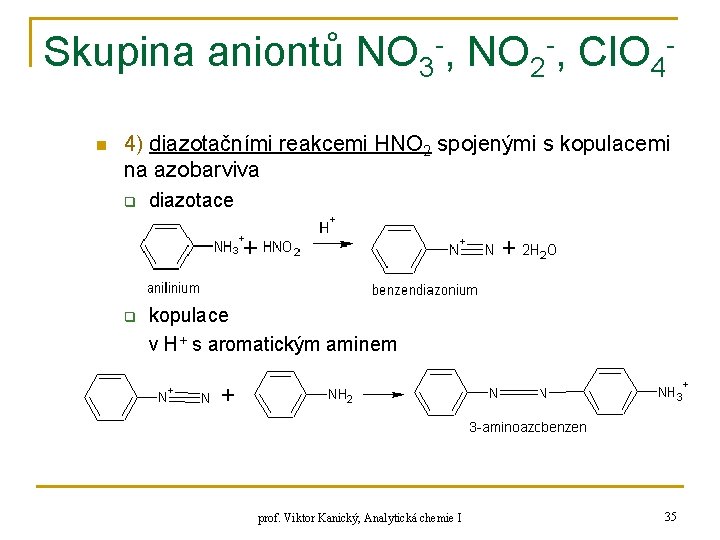
Skupina aniontů NO 3 -, NO 2 -, Cl. O 4 n 4) diazotačními reakcemi HNO 2 spojenými s kopulacemi na azobarviva q diazotace q kopulace v H+ s aromatickým aminem prof. Viktor Kanický, Analytická chemie I 35