ANALYTICK CHEMIE KVALITATIVN prof Viktor Kanick Analytick chemie






























- Slides: 39

ANALYTICKÁ CHEMIE KVALITATIVNÍ prof. Viktor Kanický, Analytická chemie I 1

Analýza kvalitativní n důkaz q q n poznatky q q q n chemické metody instrumentální metody (spektrální, elektrochemické) senzorické posouzení vzhledu (krystal. stav, homogenita, zápach, barva) změny v závislosti na fyzikálních podmínkách (zahřívání, barvení plamene) analytické reakce mezi zkoumanou látkou a analytickým činidlem (acidobazické, srážecí, komplexotvorné, oxidačně redukční, katalytické) anorganická kvalitativní analýza – iontové reakce prof. Viktor Kanický, Analytická chemie I 2

Postup kvalitativní analýzy 1. 2. 3. 4. 5. 6. 7. odběr vzorku a jeho popis předběžné zkoušky převedení vzorku do roztoku důkaz kationtů v 1/3 roztoku důkaz aniontů v 1/3 roztoku ověření výsledků ve zbývajícím roztoku závěr rozboru obecné zásady A) B) C) D) E) množství vzorku pracovní technika část vzorku uschovat předběžné zkoušky dokazovat jen ty prvky, které mohou být přítomny na základě předběžných zkoušek výsledek rozboru musí souhlasit s pozorováním prof. Viktor Kanický, Analytická chemie I 3

Předběžné zkoušky n povaha vzorku q zahřívání v plameni za přístupu vzduchu n n n q hoření (organické látky) těkání, sublimace (amonné soli) tání (soli alkalických kovů) zbytek po žíhání (sloučeniny těžkých kovů oxidy) barvení plamene (Na, Ca, K, Ba, Cu, B) zkouška s H 2 SO 4 n n zředěná: vývin plynů za chladu (CO 2 uhličitany, NO 2 dusitany) za tepla (SO 2 ze siřičitanů a thiosíranů, H 2 S ze sulfidů, HX z halogenidů) koncentrovaná: uhelnatění organických látek, oxidace Br- a Ivývin Br 2 a I 2 prof. Viktor Kanický, Analytická chemie I a 4

Selektivita a provedení analytických reakcí n podle stupně selektivity rozlišujeme analytické reakce: q q q n skupinové skupinová činidla - vhodná pro dělení skupin iontů selektivní činidla - za určitých podmínek důkaz omezené skupiny iontů - důkaz jednoho iontu vyžaduje více selektivních reakcí specifické za předepsaných podmínek se dokazuje jediný ion provedení reakcí q q q zkumavkové (5 ml, 1 ml), mikrozkumavka (0, 1 ml) kapkové (0, 3 ml) mikroskopové 0. 01 ml D = P/(V. 106), P = mez postřehu (μg), V (ml), D = mezní zředění, p. D = - log D prof. Viktor Kanický, Analytická chemie I 5

Důkazy kationtů n n historie: Boettger, Fresenius – rozdílné vlastnosti sulfidů činidla: HCl, H 2 S, (NH 4)HS, (NH 4)2 CO 3 1. 2. 3. 4. 5. nerozpustné chloridy sulfidy srážející se z kyselého prostředí sulfidy a hydroxidy srážející se z amoniakálního prostředí nerozpustné uhličitany kationty, které se nesrážejí žádným z uvedených činidel dělení se již nepoužívá (plynný sulfan!) místo toho: skupinové reakce paralelně v alikvotních podílech prof. Viktor Kanický, Analytická chemie I 6

DŮKAZY KATIONŮ SKUPINOVÉ REAKCE SELEKTIVNÍ REAKCE prof. Viktor Kanický, Analytická chemie I 7

Důkazy kationtů – Skupinové reakce HCl: Ag+, Hg 22+, Pb 2+ 1. • • • Ag+: Ag. Cl + hν Ag (redukce, šednutí) rozpouští se: CN-, S 2 O 32 -, NH 3; Ag. Cl + 2 NH 3 [Ag(NH 3)2]+ + Cl- [Ag(NH 3)2]+ + 2 H+ Ag. Cl + Cl. Hg 22+: Hg 2 Cl 2 + 2 NH 3 Hg + Hg(NH 2)Cl + NH 4+ + Cl. Pb 2+: Pb. Cl 2 se rozpouští v horké vodě 2. H 2 SO 4: Pb 2+, Ba 2+, Sr 2+, Ca 2+ bílé sraženiny 3. H 2 S (H+): Ag+, Hg 22+, Pb 2+, Hg 2+, Cu 2+, Cd 2+, Bi 3+, Sb 3+, Sn 2+, Sn 4+ • • sulfidy barevné: Cd. S, Sb 2 S 3, Sn. S 2, ostatní černé polymerní sulfidy v kyselém prostředí je H 2 S málo disociovaný, srážejí se proto jen ty nejméně rozpustné sulfidy také disproporcionace: 3 Cu. S Cu 2 S + Cu. S + S prof. Viktor Kanický, Analytická chemie I 8

Důkazy kationtů – Skupinové reakce NH 4 HS: Fe 2+, Fe 3+, Cr 3+, Al 3+, Co 2+, Ni 2+, Mn 2+, Zn 2+ 4. • • vyšší stupeň disociace NH 4 HS na S 2 - než H 2 S v kyselém prostředí, proto se srážejí i rozpustnější sulfidy NH 4 HS sráží současně kationty skupiny 3. (jejich sulfidy jsou méně rozpustné) Fe. S, Fe 2 S 3, Co. S, Ni. S – černé Zn. S – bílý, Mn. S – světlý, oxidace tmavnutí Cr 3+, Al 3+ - alkalické prostředí Al(OH)3 bílý, průsvitný, Cr(OH)3 zelený, netvoří sulfidy Co. S, Ni. S – stárnutí, polymerace, na rozdíl od ostatních sulfidů této skupiny se nerozpouštějí v HCl v nadbytku se rozpouštějí: Sb 2 S 3 + 3 S 2 - 2 Sb. S 33 Sn. S 2 + S 2 - Sn. S 3 a po okyselení zpět srážení prof. Viktor Kanický, Analytická chemie I 9

Důkazy kationtů – Skupinové reakce Na. OH: Ag+, Hg 22+, Pb 2+, Hg 2+, Cu 2+, Cd 2+, Bi 3+, Sb 3+, Sn 2+/4+, Fe 2+/3+, Cr 3+, Al 3+, Co 2+, Ni 2+, Mn 2+, Zn 2+ 5. • • • nesrážejí se: Ba 2+, Sr 2+, Ca 2+ část. , Mg se sráží p. H > 9; alkal. kovy; NH 4+ amorfní slizovité sraženiny: zásadité soli hydroxidy v nadbytku Na. OH se rozpouštějí amfoterní hydroxidy: Pb(OH)2, Sb(OH)3, Sn(OH)2, Sn(OH)4, Cr(OH)3, Al(OH)3, Zn(OH)2 využití pro dělení kationtů ušlechtilé kovy: Ag+ Ag 2 O hnědý Hg 2+ Hg. O žlutý dismutace: Hg 22+ + 2 OH- Hg. O + Hg + H 2 O (černání) oxidace hydroxidů Mn 2+/3+, Co 2+/3+ Fe 2+/3+ změna zbarvení Mn: světlý hnědočerný Co: světlý hnědočerný Fe: světle zelený rezavě hnědý prof. Viktor Kanický, Analytická chemie I 10

Důkazy kationtů – Skupinové reakce NH 4 OH: Ag+, Hg 2+, Pb 2+, Hg 2+, Cu 2+, Cd 2+, Co 2+, Ni 2+, Zn 2+, Mn 2+, Bi 3+, Sb 3+, Sn 2+/4+, Fe 2+/3+, Al 3+, Cr 3+ 6. • • nesrážejí se: alkalické kovy; Ba 2+, Sr 2+, Ca 2+, Mg 2+ v nadbytku NH 4 OH se nerozpouštějí amfoterní hydroxidy: Pb(OH)2, Sb(OH)3, Sn(OH)2, Sn(OH)4, Cr(OH)3, Al(OH)3, Zn(OH)2 v nadbytku se tvoří rozpustné amminkomplexy, proto se rozpouštějí hydroxidy Ag+, Cd 2+, Zn 2+, Cu 2+, Co 2+ na barevné (Cu 2+ modrý, Co 2+/3+ vzdušná oxidace – červený kobaltitý komplex) nebo bezbarvé (Ag, Cd, Zn) komplexy Hg 22+ + X- + 2 NH 3 Hg. NH 2 X + NH 4+ + Hg Hg 2+ + X- + 2 NH 3 Hg. NH 2 X + NH 4+ 2 Hg 2+ + 4 NH 3 (Hg 2 N)+ + 3 NH 4+ Millonova báze prof. Viktor Kanický, Analytická chemie I 11

Důkazy kationtů – Skupinové reakce KI: Ag+, Hg 2+, Pb 2+, Hg 2+, Cu 2+, Bi 3+ 7. • • Ag. I – světle žlutý, Pb. I 2 – žlutý rozpustný v horké vodě na bezbarvý roztok, Hg. I 2 – červený, Hg 2 I 2 – žlutozelený, Bi. I 3 - hnědočerný přebytek jodidu – komplexotvorné vlastnosti: Pb. I 2 + I- [Pb. I 3]Hg 2 I 2 + 2 I- [Hg. I 4 ]2 - + Hg Bi. I 3 + I- [Bi. I 4]hydrolýza: Bi. I 3 + H 2 O Bi. OI (oranž. ) + 2 H+ + 2 Iredoxní reakce: Cu 2+ + 4 I- 2 Cu. I (bílý) + I 2 Hg 2 I 2 Hg. I 2 + Hg (šedne) 2 Fe 3+ + 2 I- 2 Fe 2+ + I 2 hnědé zbarvení roztoků vyloučeným jódem prof. Viktor Kanický, Analytická chemie I 12

Důkazy kationtů – Skupinové reakce hydrolytické reakce: Bi 3+, Sn 2+/4+, Sb 3+ 8. • • • hydroxokomplexy, zásadité soli a hydroxidy vznikají zvyšováním p. H – odštěpování H+ z H 2 O v hydratačních obalech kationtů hydrolýza: a) zředěním vodou b) přídavkem octanového tlumiče HAc/Ac-, p. H 5 výrazná hydrolýza – ve formě chloridů: Bi 3+ + H 2 O + Cl- Bi. OCl + 2 H+ prof. Viktor Kanický, Analytická chemie I 13

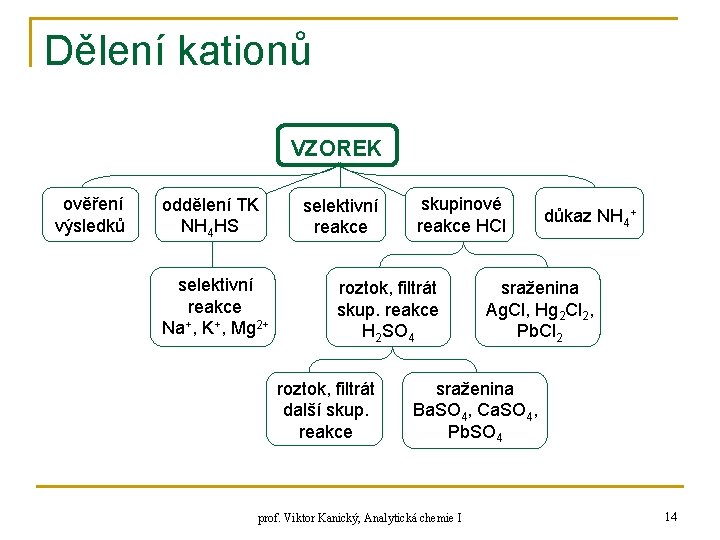
Dělení kationů VZOREK ověření výsledků oddělení TK NH 4 HS selektivní reakce Na+, K+, Mg 2+ selektivní reakce skupinové reakce HCl roztok, filtrát skup. reakce H 2 SO 4 roztok, filtrát další skup. reakce důkaz NH 4+ sraženina Ag. Cl, Hg 2 Cl 2, Pb. Cl 2 sraženina Ba. SO 4, Ca. SO 4, Pb. SO 4 prof. Viktor Kanický, Analytická chemie I 14

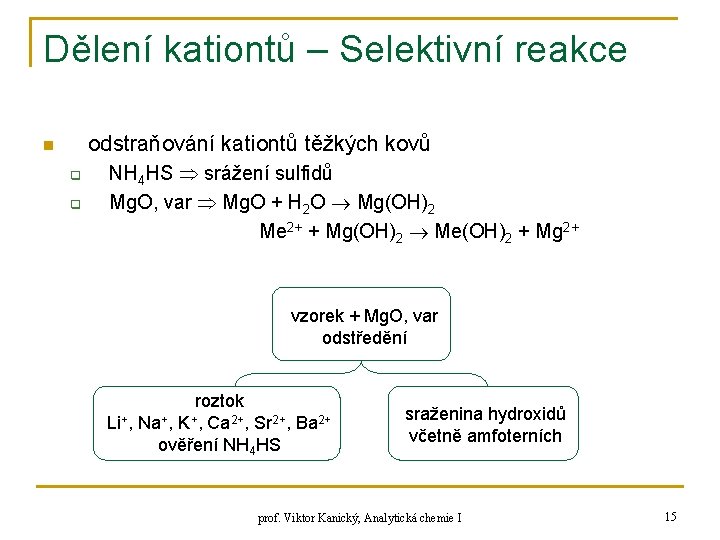
Dělení kationtů – Selektivní reakce odstraňování kationtů těžkých kovů n q q NH 4 HS srážení sulfidů Mg. O, var Mg. O + H 2 O Mg(OH)2 Me 2+ + Mg(OH)2 Me(OH)2 + Mg 2+ vzorek + Mg. O, var odstředění roztok Li+, Na+, K+, Ca 2+, Sr 2+, Ba 2+ ověření NH 4 HS sraženina hydroxidů včetně amfoterních prof. Viktor Kanický, Analytická chemie I 15

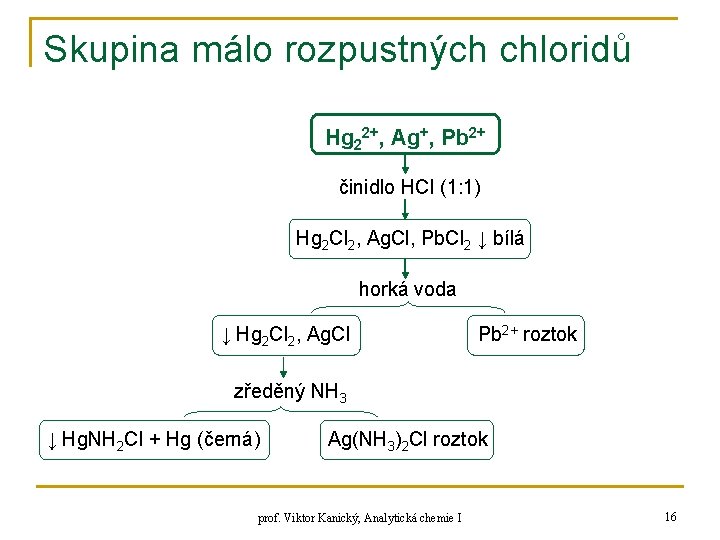
Skupina málo rozpustných chloridů Hg 22+, Ag+, Pb 2+ činidlo HCl (1: 1) Hg 2 Cl 2, Ag. Cl, Pb. Cl 2 ↓ bílá horká voda ↓ Hg 2 Cl 2, Ag. Cl Pb 2+ roztok zředěný NH 3 ↓ Hg. NH 2 Cl + Hg (černá) Ag(NH 3)2 Cl roztok prof. Viktor Kanický, Analytická chemie I 16

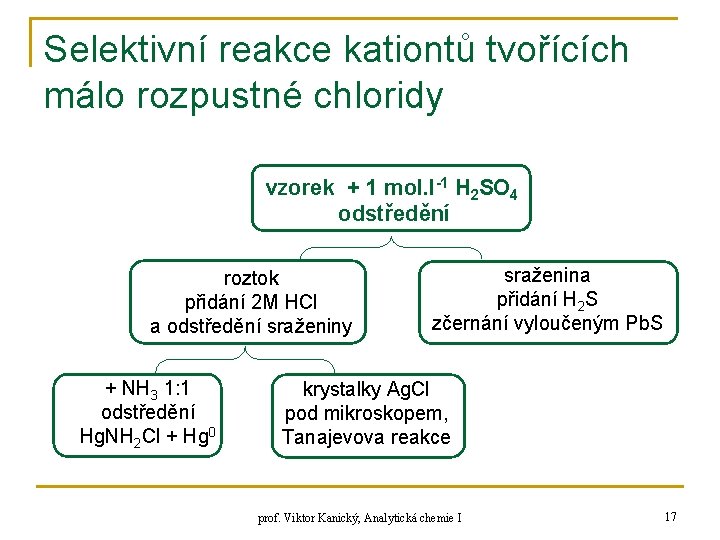
Selektivní reakce kationtů tvořících málo rozpustné chloridy vzorek + 1 mol. l-1 H 2 SO 4 odstředění roztok přidání 2 M HCl a odstředění sraženiny + NH 3 1: 1 odstředění Hg. NH 2 Cl + Hg 0 sraženina přidání H 2 S zčernání vyloučeným Pb. S krystalky Ag. Cl pod mikroskopem, Tanajevova reakce prof. Viktor Kanický, Analytická chemie I 17

Selektivní reakce kationtů tvořících málo rozpustné chloridy Hg 22+: n 1. 2. 3. 4. Hg 2 Cl 2 + 2 NH 3 NH 4 Cl + Hg. NH 2 Cl ↓ bílá + Hg 0 ↓ černá (šedě zbarvená sraženina) Hg 22+ + 2 I- Hg 2 I 2 ↓ žlutozelená (černá vyloučenou Hg) Hg 22+ + Cr. O 4 - Hg 2 Cr. O 4 ↓ červenohnědá katalytická oxidace Al 0 (Hg 22+, Hg 0), ruší Cu 2+, Bi 3+, As. III prof. Viktor Kanický, Analytická chemie I 18

Selektivní reakce kationtů tvořících málo rozpustné chloridy Ag+: n 1. Ag. Cl + 2 NH 4 OH Ag(NH 3)2+ + 2 H 2 O + Cl- , unikání NH 3 vylučování Ag. Cl – mikroskop 2. Ag+ + Br- Ag. Br ↓ nažloutlá (v NH 3 pouze zbělá) 3. Ag+ + I- Ag. I ↓ žlutá (s NH 3 nereaguje) 4. 2 Ag+ + Cr. O 4 - Ag 2 Cr. O 4 ↓ červenohnědá 5. 6. redoxní Tananajevova reakce Mn(OH)2 + 2 Ag+ + 2 OH- 2 H 2 O + Mn. O 2 ↓ hnědá + 2 Ag ↓ černá Ag+ + rhodamin + H+ žlutooranžová ↓ prof. Viktor Kanický, Analytická chemie I 19

Selektivní reakce kationtů tvořících málo rozpustné chloridy Pb 2+: n 1. 2. 3. 4. 5. Pb 2+ + H 2 SO 4 Pb. SO 4 ↓ bílá + 2 H+; Pb. SO 4 + 3 Na. OH Pb(OH)3 - + SO 42 - + 3 Na+; rozdíl proti Ba. SO 4 Pb. SO 4 + S 2 - Pb. S + SO 42 - ↓ černá; oddělení Ba 2+ od Pb 2+: NH 4 OH Pb(OH)2; Ba 2+, 2 OHPb. SO 4 + K 2 Cr. O 4 Pb. Cr. O 4 ↓ žlutá + 2 K+ + SO 42 Pb 2+ + 2 I- Pb. I 2 ↓ žlutá (zlatý déšť), v nadbytku I- přechází na [Pb. I 4]2 - bezbarvý roztok Pb 2+ + difenylthiokarbazon červená ↓ prof. Viktor Kanický, Analytická chemie I 20

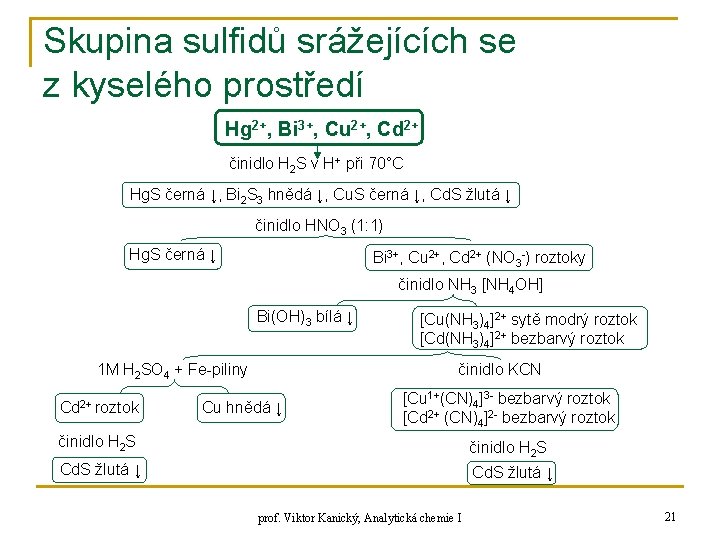
Skupina sulfidů srážejících se z kyselého prostředí Hg 2+, Bi 3+, Cu 2+, Cd 2+ činidlo H 2 S v H+ při 70°C Hg. S černá ↓, Bi 2 S 3 hnědá ↓, Cu. S černá ↓, Cd. S žlutá ↓ činidlo HNO 3 (1: 1) Hg. S černá ↓ Bi 3+, Cu 2+, Cd 2+ (NO 3 -) roztoky činidlo NH 3 [NH 4 OH] Bi(OH)3 bílá ↓ 1 M H 2 SO 4 + Fe-piliny Cd 2+ roztok [Cu(NH 3)4]2+ sytě modrý roztok [Cd(NH 3)4]2+ bezbarvý roztok činidlo KCN Cu hnědá ↓ [Cu 1+(CN)4]3 - bezbarvý roztok [Cd 2+ (CN)4]2 - bezbarvý roztok činidlo H 2 S Cd. S žlutá ↓ prof. Viktor Kanický, Analytická chemie I 21

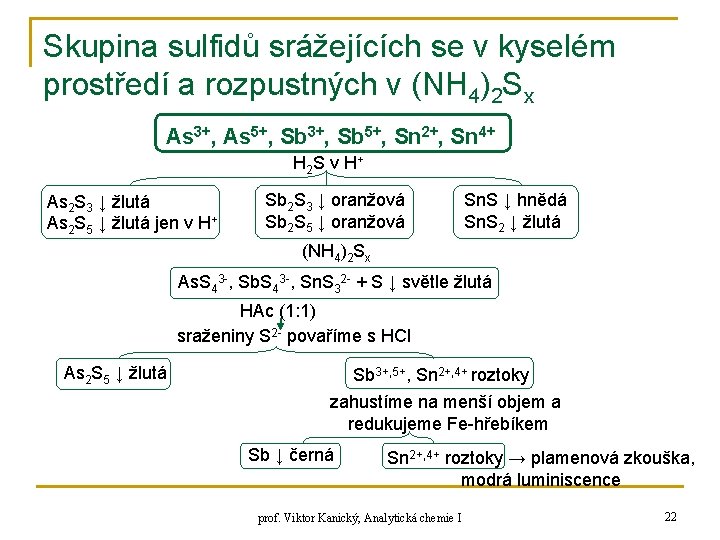
Skupina sulfidů srážejících se v kyselém prostředí a rozpustných v (NH 4)2 Sx As 3+, As 5+, Sb 3+, Sb 5+, Sn 2+, Sn 4+ H 2 S v H + As 2 S 3 ↓ žlutá As 2 S 5 ↓ žlutá jen v H+ Sb 2 S 3 ↓ oranžová Sb 2 S 5 ↓ oranžová Sn. S ↓ hnědá Sn. S 2 ↓ žlutá (NH 4)2 Sx As. S 43 -, Sb. S 43 -, Sn. S 32 - + S ↓ světle žlutá HAc (1: 1) sraženiny S 2 - povaříme s HCl As 2 S 5 ↓ žlutá Sb 3+, 5+, Sn 2+, 4+ roztoky zahustíme na menší objem a redukujeme Fe-hřebíkem Sb ↓ černá Sn 2+, 4+ roztoky → plamenová zkouška, modrá luminiscence prof. Viktor Kanický, Analytická chemie I 22

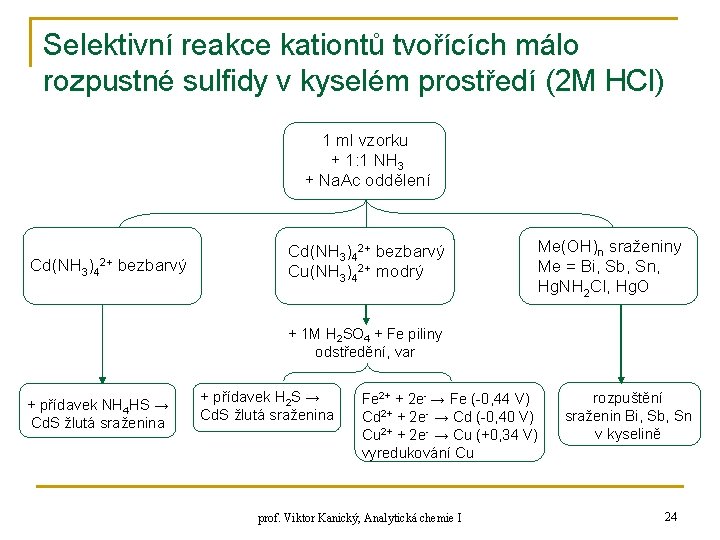
Selektivní reakce kationtů tvořících málo rozpustné sulfidy v kyselém prostředí (2 M HCl) H 2 S + H 2 O HS- + H 3 O+ HS- + H 2 O S 2 - + H 3 O+ q q q q Hg. S černý Cu. S černý Bi 2 S 3 hnědý Cd. S žlutý Sb 2 S 3 oranžově červený Sn. S hnědý Sn. S 2 špinavě žlutý n q n Sn. S 2 rozpustný v nadbytku NH 4 HS na Sn. S 32 - As 2 S 3 žlutý, As 2 S 5 žlutý jen v H+ použití amoniakálního dělení Hg 2+, Cu 2+, Cd 2+, Sn. IV, Sb 3+, Bi 3+ prof. Viktor Kanický, Analytická chemie I 23

Selektivní reakce kationtů tvořících málo rozpustné sulfidy v kyselém prostředí (2 M HCl) 1 ml vzorku + 1: 1 NH 3 + Na. Ac oddělení Cd(NH 3)42+ bezbarvý Cu(NH 3)42+ modrý Me(OH)n sraženiny Me = Bi, Sb, Sn, Hg. NH 2 Cl, Hg. O + 1 M H 2 SO 4 + Fe piliny odstředění, var + přídavek NH 4 HS → Cd. S žlutá sraženina + přídavek H 2 S → Cd. S žlutá sraženina Fe 2+ + 2 e- → Fe (-0, 44 V) Cd 2+ + 2 e- → Cd (-0, 40 V) Cu 2+ + 2 e- → Cu (+0, 34 V) vyredukování Cu prof. Viktor Kanický, Analytická chemie I rozpuštění sraženin Bi, Sb, Sn v kyselině 24

Selektivní reakce kationtů tvořících málo rozpustné sulfidy v kyselém prostředí (2 M HCl) rozpuštění sraženin Bi, Sb, Sn v minerální kyselině hydrolýza v Na. Ac Bi 3+ se vysráží Sb(OH)4 -, Sn(OH)62 -, Sn(OH)3 - v roztoku Hg 2+ n 1. 2. 3. 4. reakce s Sn. Cl 2: Sn 2+ + 2 Hg 2+ + 2 Cl- → Hg 2 Cl 2 ↓ bílá (šedne až černá) + Sn. IV odstranění rušících Pb 2+, Ag+, Hg 22+ přídavkem 2 M HCl katalytická oxidace hliníku reakce s KI : Hg 2+ + 2 I- → Hg. I 2 červená sraženina Hg. I 2 + 2 I- → [Hg. I 4]2 - rozpustný komplex ruší Bi 3+ tvorbou Bi. I 3 + I- → [Bi. I 4]- žlutý roztok, řeší se přídavkem Cu 2+, disprop. Cu. I (bílý), sorpce Hg. I 2 na Cu. I Bi. I 3 se rozpustí Hg 2+ + difenylthiokarbazon + OH- → červenooranžový roztok prof. Viktor Kanický, Analytická chemie I 25

Selektivní reakce kationtů tvořících málo rozpustné sulfidy v kyselém prostředí (2 M HCl) Cu 2+ n 1. 2. 3. reakce s K 4[Fe(CN)6]: Cu 2+ + [Fe(CN)6]4 - → Cu 2[Fe(CN)6] ↓ červenohnědá = Hatschettova hněď sraženina proměnlivého složení Cu. K 2[Fe(CN)6], Cu 2 K[Fe(CN)6] v neutrálním nebo slabě kyselém prostředíí; sraženina je rozpustná v NH 3 a ve zředěných minerálních kyselinách; ruší Fe 3+ (Bberlínská modř) odstraní se NH 3 reakce s Kupralem (diethyldithiokarbaminan) vzniká hnědá sraženina chelátu 1: 2, extrakce do chloroformu; ruší málo rozpustné cheláty, reakce je selektivní v NH 3 výluhu a při maskování EDTA Cu 2+ + salicylaldoxim + H+ → světle žlutá ↓ prof. Viktor Kanický, Analytická chemie I 26

Selektivní reakce kationtů tvořících málo rozpustné sulfidy v kyselém prostředí (2 M HCl) Cd 2+ n 1. 2. reakce s plynným H 2 S nebo přídavkem sulfanové vody vzniká žlutá sraženina Cd. S po oddělení TK: ruší Hg, Ag, Pb, Cu, Bi, Sb, Sn, amoniakální dělení, v roztoku zůstává Ag+, Cu 2+, Cd 2+, redukce Ag+, Cu 2+ pomocí Fe Cd 2+ + 2 OH- → Cd(OH)2 ↓ bílá Bi 3+ n 1. 2. reakce s s thiomočovinou žlutý rozpustný komplex (p. H < 1) {Bi[S=C(NH 2)2] 3}3+; ruší Sb 3+ eliminuje se oxidací na Sb. V KMn. O 4 a Sb. V se maskuje Fredukce cínatanem 3 Sn. II + 2 Bi 3+ → 2 Bi 0 + 3 Sn. IV, bismut = černý kov; ruší Ag+, Hg 22+ - odstranění 2 M HCl, ruší Hg 2+, pak důkaz Bi 3+ hydrolýzou na Bi. OCl prof. Viktor Kanický, Analytická chemie I 27

Selektivní reakce kationtů tvořících málo rozpustné sulfidy v kyselém prostředí (2 M HCl) Sb 3+ n 1. 2. 3. 4. Sb 3+ se hydrolyticky oddělí pomocí Na. Ac, redukce Fe v kys. prostředí → černý práškovitý antimon a H 2; ruší Cu 2+, odstraní se oddělením hydrolyzátů po oxidaci KMn. O 4 na Sb. V se přídavkem krystalové violeti tvoří iontový barevný asociát {Sb. Cl 6 -; B+} extrakce do benzenu Sb 3+ + Na 2 S 2 O 3 → ↓ červená antimonové rumělky Marsh-Liebigova zkouška, antimonové zrcátko se teplem neposunuje Sn 2+, Sn 4+ n 1. luminiscenční reakce v plameni – modré zbarvení emise Sn. Cl, ruší Cu 2+ - barví plamen zeleně, proto se redukuje práškovým Fe prof. Viktor Kanický, Analytická chemie I 28

Skupina zbývajících sulfidů a hydroxidů srážejících se hydrogensulfidem amonným Co 2+, Ni 2+, Fe 3+, Mn 2+, Al 3+, Zn 2+, Cr 3+ činidlo (NH 4)2 S v NH 4 Cl a NH 4 OH prostředí (amoniakální) Co. S černá ↓, Ni. S černá ↓, Fe 2 S 3 hnědočerná ↓, Mn. S pleťově růžová ↓, Al(OH)3 bílá ↓, Zn. S bílá ↓, Cr(OH)3 šedomodrozelená ↓ činidlo HCl (1: 4) Co. S ↓ černá, Ni. S ↓ černá H 2 O 2 (5%) + H+ Co. SO 4, Ni. SO 4 roztoky Fe 2+, Fe 3+, Mn 2+, Al 3+, Zn 2+, Cr 3+ (Cl-) roztoky Na. OH (20%) + H 2 O 2 (5%) Fe(OH)3 ↓ rezavě hnědá Mn(OH)2 ↓ rezavě hnědá Cr. O 42 - žlutý roztok Al. O 33 - [Al(OH)4]- bb roztok Zn. O 22 - [Zn(OH)4]2 - bb roztok + 1 kapka H 2 O 2 + 1 M H 2 SO 4 + extr. izoamylalkohol + 1 kapka alizarinu + 2 M CH 3 COOH + 20% HCl + [Fe(CN)6]3 - modrý extrakt Cr 3+ červený roztok Al 3+ žluto zelená ↓ Zn 2+ prof. Viktor Kanický, Analytická chemie I 29

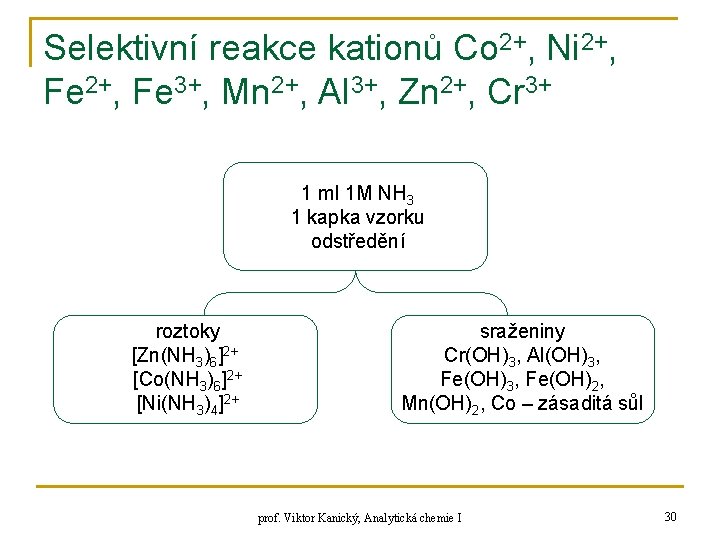
Selektivní reakce kationů Co 2+, Ni 2+, Fe 3+, Mn 2+, Al 3+, Zn 2+, Cr 3+ 1 ml 1 M NH 3 1 kapka vzorku odstředění roztoky [Zn(NH 3)6]2+ [Co(NH 3)6]2+ [Ni(NH 3)4]2+ sraženiny Cr(OH)3, Al(OH)3, Fe(OH)2, Mn(OH)2, Co – zásaditá sůl prof. Viktor Kanický, Analytická chemie I 30

Selektivní reakce kationů Co 2+, Ni 2+, Fe 3+, Mn 2+, Al 3+, Zn 2+, Cr 3+ Fe 3+ n 1. 2. 3. 4. s thiokyanatanem (SCN)- v kyselém prostředí Fe 3+ + SCN- → červené komplexy [Fe(SCN)]2+, [Fe(SCN)2]+… Fe[Fe(SCN)6] typický krvavě červený roztok; ruší fluoridy s K 4[Fe(CN)6] v kys. prostředí vzniká sraženina nebo koloidní roztok Berlínské modři K{Fe. III[Fe. II(CN)6]} respektive Fe. III 4[Fe. II(CN)6]3; ruší Cu 2+ ve velkém nadbytku s kyselinou sulfosalicylovou v kys. prostř. vzniká fialový roztok rozpustného chelátu; ruší fluoridy a dihydrogenfosforečnany Fe 3+ + 3 NH 3 + 3 H 2 O → 3 NH 4+ + Fe(OH)3 ↓ rezavě hnědá, v nadbytku NH 3 nerozpustná Fe 2+ n 1. 2. 3. s 1, 10 -fenanthrolinem při p. H 2 -9 vzniká stabilní červený chelát s kynoželezitanem K 3[Fe(CN)6] vzniká Berlínská modř bezvodé soli Fe 2+ jsou bílé, hydratované světle zelené: Fe. SO 4. 7 H 2 O, (NH 4)Fe(SO 4)2. 6 H 2 O (Mohrova sůl) a Fe. Cl 2. 4 H 2 O prof. Viktor Kanický, Analytická chemie I 31

Selektivní reakce kationů Co 2+, Ni 2+, Fe 3+, Mn 2+, Al 3+, Zn 2+, Cr 3+ Al 3+ n 1. 2. s alizarinem S (1, 2 -dihydroxyantrachinon-3 -sulfonan) vzniká červený lak – chelát Al. L, povrchově adsorbován na Al(OH)3 v NH 3 prostředí, ruší: Fe 3+, Cu 2+ - oddělení pomocí Na. OH s kvercetinem – vzniká zeleně fluoreskující, ve vodě málo rozpustný Al - chelát při p. H 1 -4, ruší: Zn 2+ a Sb 3+ – nepatrná fluorescence, maskování: F- Cr 3+ n 1. 2. s peroxidem H 2 O 2 v alkalickém prostředí za varu → Cr. O 42 - žlutý roztok, po okyselení přechází s přebytečným peroxidem na nestálý modrý peroxid Cr. VIO 5, ruší: Mn 2+ - alkalické dělení Cr 3+ + 3 NH 3 + 3 H 2 O → 3 NH 4+ + Cr(OH)3 ↓ šedozelená prof. Viktor Kanický, Analytická chemie I 32

Selektivní reakce kationů Co 2+, Ni 2+, Fe 3+, Mn 2+, Al 3+, Zn 2+, Cr 3+ Zn 2+ n 1. 2. s kyanoželeznatanem K 4[Fe(CN)6] v prostředí 1 M HCl vzniká bílá sraženina K 2 Zn[Fe(CN)6]; ruší Fe 3+, Cu 2+, Mn 2+, Ni 2+ a Co 2+ - dělení v 10% Na. OH s difenylthiokarbazonem v alkalickém prostředí vzniká zelený roztok, vytřepáním v roztoku CCl 4 přechází na purpurovou červeň Co 2+ n 1. 2. 3. 4. s thiokyanatanem vzniká modrý rozpustný komplex [Co(SCN)4]2 -, extrakce např. do izoamylalkoholu, ruší Fe 3+, Bi 3+ - maskování s F-, Cu 2+ tvoří hnědou sraženinu bezvodé soli jsou modré, hydratované růžové např. : Co. Cl 2. 6 H 2 O, Co(NO 3)2. 6 H 2 O, Co. SO 4. 7 H 2 O Co 2+ + 2 NH 3 + 2 H 2 O → ↓ světle modrá zásaditých solí, rozpouští se v nadbytku NH 3 na [Co(NH 3)4]2+, který oxiduje na [Co(NH 3)6]3+ (hnědý roztok) s 1 -nitroso-2 -naftolem vzniká červenohnědá sraženina chelátu Co. L 3, ruší Cu 2+, Fe 3+, Hg 2+, Ni 2+ - jejich cheláty se v 10% HCl rozloží prof. Viktor Kanický, Analytická chemie I 33

Selektivní reakce kationů Co 2+, Ni 2+, Fe 3+, Mn 2+, Al 3+, Zn 2+, Cr 3+ Mn 2+ n 1. 2. 3. oxidací v kyselých roztocích jodistanem za horka vzniká fialový Mn. O 4 Mn 2+ + 2 NH 3 + 3 H 2 O → bílá ↓ zásaditých solí, v důsledku oxidace hnědne bezvodé soli jsou bezbarvé hydratované růžové: Mn. SO 4. 7 H 2 O, Mn(NO 3)2. 6 H 2 O, Mn. Cl 2. 4 H 2 O Ni 2+ n 1. 2. 3. s diacetylaldioximem (Čugajevovo činidlo) v amoniakálním prostředí vzniká růžově červená sraženina chelátu Ni(DH)2 Ni 2+ + 2 NH 3 + 2 H 2 O → ↓ zásadité soli, v nadbytku NH 3 vznik [Ni(NH 3)4]2+ modrý roztok hydratované soli Ni 2+ jsou zelené, bezvodé jsou bezbarvé prof. Viktor Kanický, Analytická chemie I 34

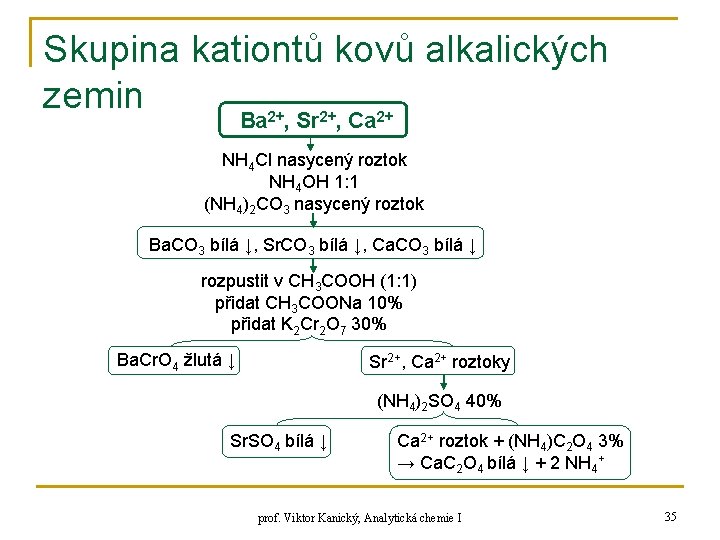
Skupina kationtů kovů alkalických zemin Ba 2+, Sr 2+, Ca 2+ NH 4 Cl nasycený roztok NH 4 OH 1: 1 (NH 4)2 CO 3 nasycený roztok Ba. CO 3 bílá ↓, Sr. CO 3 bílá ↓, Ca. CO 3 bílá ↓ rozpustit v CH 3 COOH (1: 1) přidat CH 3 COONa 10% přidat K 2 Cr 2 O 7 30% Ba. Cr. O 4 žlutá ↓ Sr 2+, Ca 2+ roztoky (NH 4)2 SO 4 40% Sr. SO 4 bílá ↓ Ca 2+ roztok + (NH 4)C 2 O 4 3% → Ca. C 2 O 4 bílá ↓ + 2 NH 4+ prof. Viktor Kanický, Analytická chemie I 35

Selektivní reakce alkalických kovů alkalických zemin n Li+, Na+, K+, NH 4+ q bezbarvé, dobře rozpustné soli; netvoří stabilní komplexy plamenové zkoušky (ne NH 4+) - zbarvení emisí alkal. kovů q reakce s organickými činidly q n Ca 2+, Sr 2+, Ba 2+ q sraženiny: SO 42 -, Cr. O 42 -, OH-, F-, C 2 O 42 -, CO 32 - rozpustnost: n n n SO 42 -, Cr. O 42 - : OH-, F-, C 2 O 42 - : CO 32 - : Ca 2+ > Sr 2+ > Ba 2+ Ca 2+ < Sr 2+ < Ba 2+ Ca 2+ ≈ Ba 2+ < Sr 2+ prof. Viktor Kanický, Analytická chemie I 36

Selektivní reakce alkalických kovů alkalických zemin n plamenové zkoušky – těkavé chloridy, Pt drát q q q Li 2+ karmínově červená Na+ žlutá K+ fialová + červená Ca 2+ cihlově červená Sr 2+ červená + oranž. Ba 2+ zelená 670, 0 nm 589, 6 a 589, 0 nm 404, 7 a 768, 0 nm 620, 0 nm 674, 7; 662, 8 a 606, 0 nm (oranž. ) 531; 524 a 514 nm prof. Viktor Kanický, Analytická chemie I 37

Selektivní reakce alkalických kovů alkalických zemin n Li+ 1. n Na+ 1. n s octanem uranylo-zinečnatým v kyselině octové vzniká světle žlutá krystalická sraženina Na. Mg(UO 2)3(CH 3 COO)9. 9 H 2 O, ruší TK K+ 1. 2. n Li. Cl je rozpustný v organických rozpouštědlech chloridy Na, K, Ca a Ba, vhodné pro oddělení pro plamenovou zkoušku s dipikrylaminem vzniká oranžovo-červená sraženina draselné soli hexanitrodifenylaminátu, ruší TK, NH 4+ s kyselinou pikrovou vzniká pikran draselný žlutá sraženina NH 4+ 1. s Nesslerovým činidlem v alkalickém prostředí vzniká hnědá až žlutá sraženina; příprava Ness. činidla: Hg. Cl 2 + 2 KI Hg. I 2 … + 2 KI [Hg. I 4]2 -; v Na. OH reakce [Hg. I 4]2 - + NH 4+ Hg 2 I 3 NH 2 ruší všechny kationty, které se srážejí v alkalickém prostředí prof. Viktor Kanický, Analytická chemie I 38

Selektivní reakce alkalických kovů alkalických zemin n Mg 2+ 1. 2. 3. n Ca 2+ 1. n s kyselinou šťavelovou ve slabě kyselém prostředí vzniká bílá krystalická sraženina šťavelanu vápenatého; Neruší Sr 2+, Ba 2+, alkalické kovy, ruší TK odstranění s Mg. O Sr 2+ 1. n s Magnezonem (4 -nitrobenzen azorezorcin nebo 4 -nitrobenzenazo-1 naftol) v Na. OH tvoří modrou sraženinu chelátu; slepý pokus: žlutá fialová v roztoku (acidobazický indikátor); modrý chelát – zbarvení při adsorpci na Mg(OH)2 s thiazolovou (titanovou) žlutí vzniká červená sraženina; slepý pokus dává žlutý až oranžový roztok s 8 -hydroxichinolinem v alkalickém prostředí vzniká žlutá sraženina (jehličky) žlutá sraženina s K 2 Cr. O 4 po oddělení TK, ruší Ca 2+, na rozdíl od Ba 2+ se nesráží Sr 2+ ve 2 mol. l-1 kys. octové Ba 2+ 1. sráží se s K 2 Cr. O 4 ve 2 mol. l-1 HAc, v neutr. / alkal. prostředí, sráží se 1 mol. l-1 H 2 SO 4 prof. Viktor Kanický, Analytická chemie I 39
 Acs functions
Acs functions Dr victor christiansen
Dr victor christiansen Viktor pocajt
Viktor pocajt Gnomus bild hartmann
Gnomus bild hartmann Viktor mizo wikipedia
Viktor mizo wikipedia Opel viktor
Opel viktor Viktor bergen
Viktor bergen Viktor binzberger
Viktor binzberger Viktor dyk literární směr
Viktor dyk literární směr Matlab matrix notation
Matlab matrix notation Zsiday viktor
Zsiday viktor Advanced persistent threat assessment
Advanced persistent threat assessment Viktor emil frankl
Viktor emil frankl Rajzfejlődés gyermekkorban
Rajzfejlődés gyermekkorban Careea
Careea Geng krisztina
Geng krisztina Kresba postavy podle věku
Kresba postavy podle věku Viktor balema
Viktor balema Viktor pestov
Viktor pestov Viktor haase
Viktor haase Elektro konstruktion
Elektro konstruktion Viktor frankl gestalt
Viktor frankl gestalt Viktor binzberger
Viktor binzberger Viktor kubal vtipy
Viktor kubal vtipy Viktor mikhaylovich
Viktor mikhaylovich Viktor marko
Viktor marko Viktor maier
Viktor maier Dr viktor christiansen
Dr viktor christiansen Arany viktor
Arany viktor Viktor staroverov
Viktor staroverov Viktor arhipov
Viktor arhipov Arany viktor
Arany viktor Dachaou
Dachaou Teori viktor frankl
Teori viktor frankl Viktor dyk současníci
Viktor dyk současníci Humores de hipócrates
Humores de hipócrates Krysař hlavní myšlenka
Krysař hlavní myšlenka Areny chemie
Areny chemie Oxalsäurediethylester
Oxalsäurediethylester Naturfasern übersicht
Naturfasern übersicht































































