Modlisation pharmacocintique pharmacodynamique Approche traditionnelle approche population Dr



























![Principe pharmacocinétique de population NONMEM [t, C(t)] pour ch. sujet, ID +covariables(t) Hulot J. Principe pharmacocinétique de population NONMEM [t, C(t)] pour ch. sujet, ID +covariables(t) Hulot J.](https://slidetodoc.com/presentation_image/41070472c564f90bb8e5eb8beb417d05/image-49.jpg)

![Quelles Données ? • Estimer les p. pk : données [t, posologie(t), C(t)] • Quelles Données ? • Estimer les p. pk : données [t, posologie(t), C(t)] •](https://slidetodoc.com/presentation_image/41070472c564f90bb8e5eb8beb417d05/image-51.jpg)




























































- Slides: 136

Modélisation pharmacocinétique / pharmacodynamique Approche traditionnelle / approche population Dr Jean-Sébastien Hulot Service de Pharmacologie C. H. U. Pitié-Salpêtrière Hulot J. S.

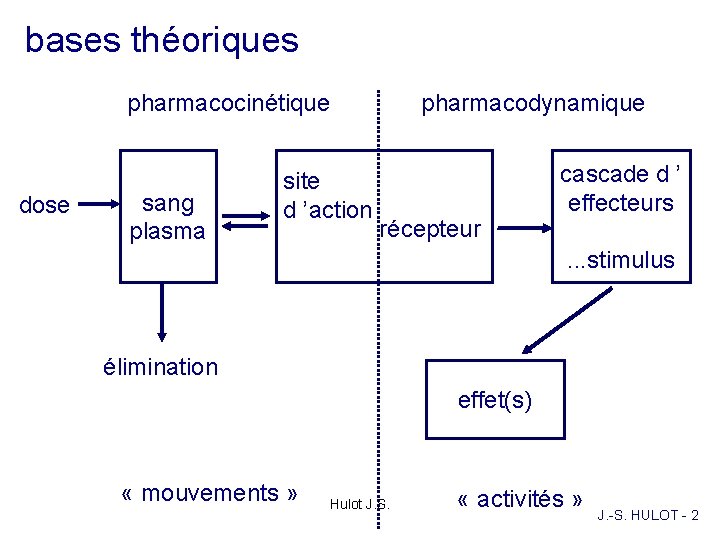
bases théoriques pharmacocinétique dose sang plasma pharmacodynamique site d ’action récepteur cascade d ’ effecteurs. . . stimulus élimination effet(s) « mouvements » Hulot J. S. « activités » J. -S. HULOT - 2

Dose Effet • Une cascade d’événements: – Pharmacocinétiques – Pharmacodynamiques • Une succession de sources de variabilité: – Selon les étapes – De nature diverses (gène, physique, environnement…) • Une dose Plusieurs concentrations effets variables Hulot J. S.

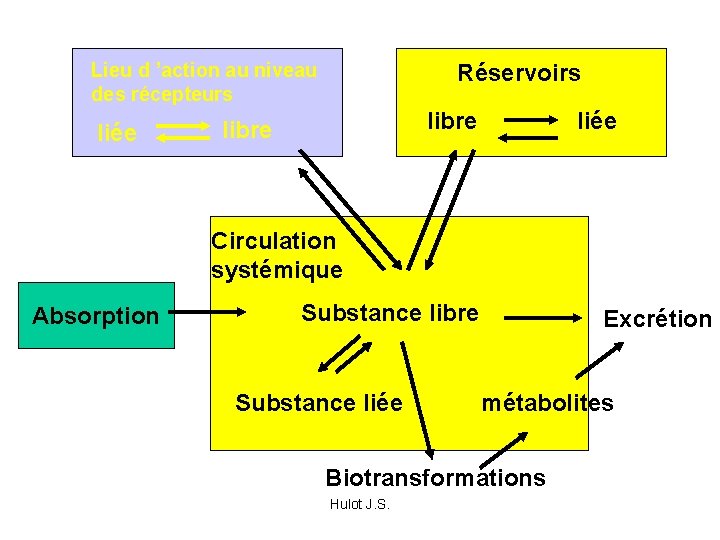
Lieu d ’action au niveau des récepteurs liée Réservoirs libre liée Circulation systémique Absorption Substance libre Substance liée Excrétion métabolites Biotransformations Hulot J. S.

Comment évaluer une PK? • Quelles données PK ? – Concentrations plasmatiques / urinaires – Molécule mère / métabolites • Profil pharmacocinétique ? – Naît de la cascade et de l’importance des différentes phases PK – Caractérisation de ces phases mathématiquement Hulot J. S.

Imaginons un protocole PK • Responsable du départment de pharmacocinétique • Produit nouveau = nouvel immunosuppresseur Hulot J. S.

Le Mycophénolate Mofétil Mécanisme d’action Inhibiteur réversible et non-compétitif de l’inosine monophosphate deshydrogénase (IMPDH), préférentiellement l’isoforme-2: Inhibition de la prolifération des lymphocytes. Inhibition de la production d’anticorps. Inhibition de la glycosylation et de l’expression des molécules d’adhésion. Hulot J. S.

Le Mycophénolate Mofétil Caractéristiques pharmaco MMF = prodrogue, inactif Absorption ~ complète Métabolisme pré-systémique en acide mycophénolique (AMP) par des estérases intestinales, hépatiques et plasmatiques. Taux de fixation protéique moyen 97. 5% L’AMP est principalement métabolisé par des mécanismes de phase II impliquant 2 types d’enzyme : les UDP-glucuronosyltransférases AMPG (inactif) AMPa. G (actif) les UDP-glucosyltransférases AMP- -phenyl-glucoside (inactif) Élimination biliaire des glucuroconjugués cycle entéro-hépatique rebond de l’AMP plasmatique. Hulot J. S.

Protocole clinique PK => C = f(t) • Sujets sélectionnés : volontaires sains puis populations particulières • Nombre limité de sujets (3 à 20) • Beaucoup de mesures par sujets (6 à 20) • Etude courte • Gamme de doses • Protocole de recueil très encadré • Typiquement Phase I • Analyse des infos sujet par sujet puis synthèse Hulot J. S.

Protocoles PK • Approche individuelle: analyse sujet par sujet Nombre minimal de mesures (10) pour pouvoir proposer donner des estimations individuelles Hulot J. S.

Matériels et Méthodes Suite: Plan expérimental: Patients à jeun. Prélèvements à : H 0, 20 min, 40 min, 1, 1. 5, 2, 3, 4, 6, 8, 12 h après l’administration. Repas à H 1, H 5 et H 10. Méthode analytique: H. P. L. C, à partir de 100µl de plasma Détection UV, LOQ = 0. 1µg/ml de l’AMP et 0. 5µg/ml de l’AMPG, CV=5 et 12% Détection par fluorescence , LOQ = 5 ng/ml de l’AMP, CV =4% Hulot J. S.

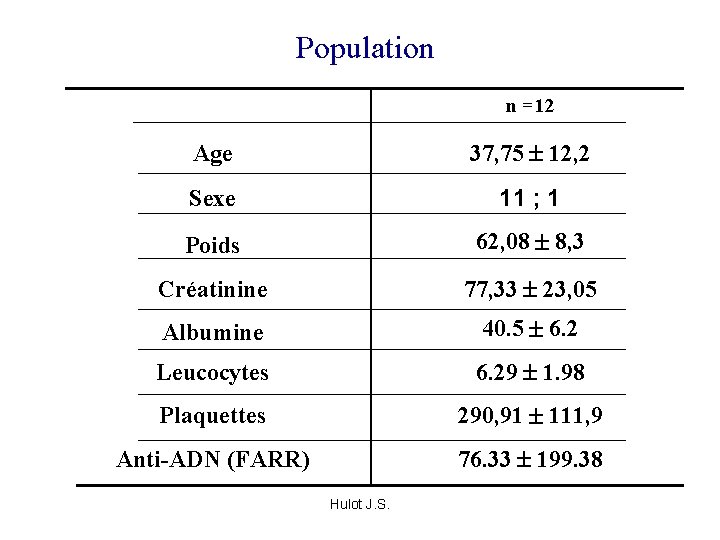
Population n =12 Age 37, 75 12, 2 Sexe 11 ; 1 Poids 62, 08 8, 3 Créatinine 77, 33 23, 05 Albumine 40. 5 6. 2 Leucocytes 6. 29 1. 98 Plaquettes 290, 91 111, 9 Anti-ADN (FARR) 76. 33 199. 38 Hulot J. S.

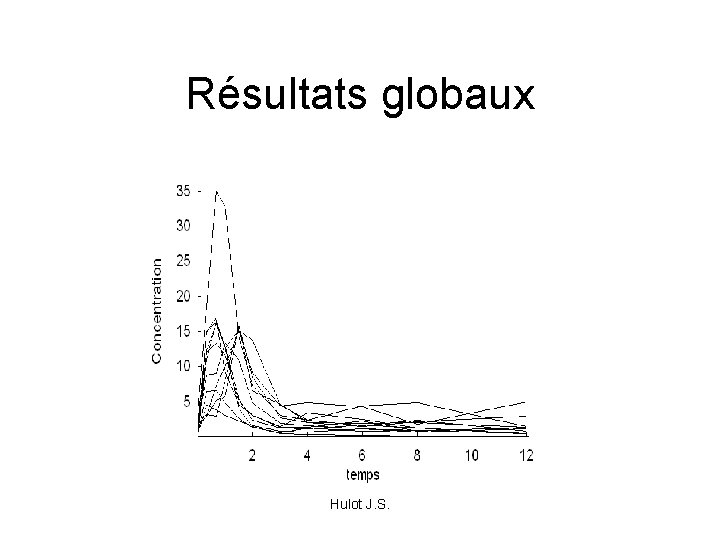
Résultats globaux Hulot J. S.

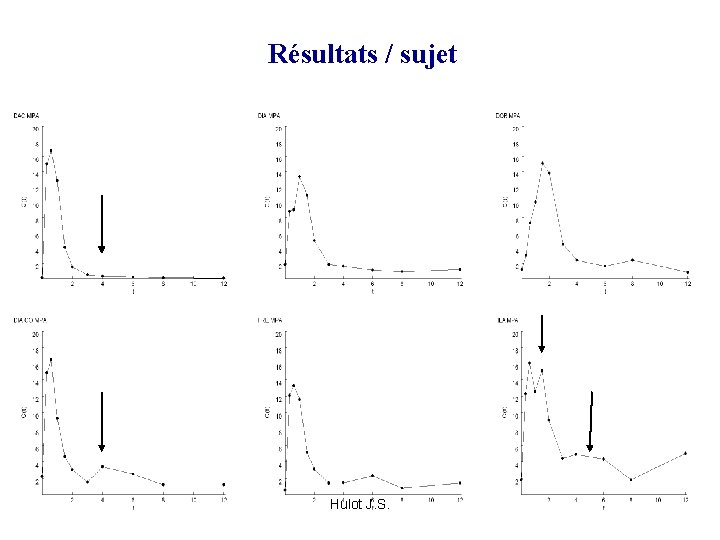
Résultats / sujet Hulot J. S.

Analyse ? • Individu par individu • Approche non compartimentale • Paramètres descriptifs simples d’exposition: – – Tmax C 0 (résiduelle) Aire sous Courbe • Présentation moyenne +- SD Hulot J. S.

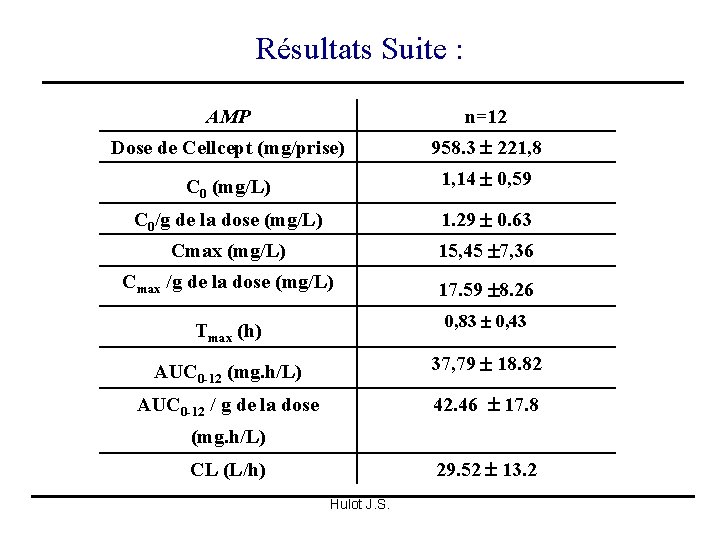
Résultats Suite : AMP n=12 Dose de Cellcept (mg/prise) 958. 3 221, 8 C 0 (mg/L) 1, 14 0, 59 C 0/g de la dose (mg/L) 1. 29 0. 63 Cmax (mg/L) 15, 45 7, 36 Cmax /g de la dose (mg/L) 17. 59 8. 26 Tmax (h) 0, 83 0, 43 AUC 0 -12 (mg. h/L) 37, 79 18. 82 AUC 0 -12 / g de la dose 42. 46 17. 8 CL (L/h) 29. 52 13. 2 (mg. h/L) Hulot J. S.

Etudes descriptives pharmacocinétiques • Nombreuses • Essentielles pour la connaissance initiale de la pharmacocinétique d’un produit • Souvent menées chez des sujets sains • Exemple de protocole d’interaction Hulot J. S.

Interaction Glucocorticoïdes – Itraconazole B. Lebrun-Vignes et al. BJCP 2001; 51(5): 443 -50 • Traitements par glucocorticoïdes oraux favorisent les infections notamment fungiques • Association corticoïdes oraux – antifungiques fréquentes • Antifungiques (Itraconazole) Inhibiteur enzymatique (3 A 4) puissant • Methylprednisolone Substrats de 3 A 4 Hulot J. S.

• Quelle question pharmacologique vous posez-vous ? • Quel protocole proposeriez-vous pour y répondre ? Hulot J. S.

Protocole d’interactions PK + effets PD • 14 sujets sains • PK corticoïdes seul puis PK corticoïdes + itraconazole (5 jours de ttt) • Mesure de l’effet sur la sécrétion de cortisol • 14 prélèvements en 24 heures Hulot J. S.

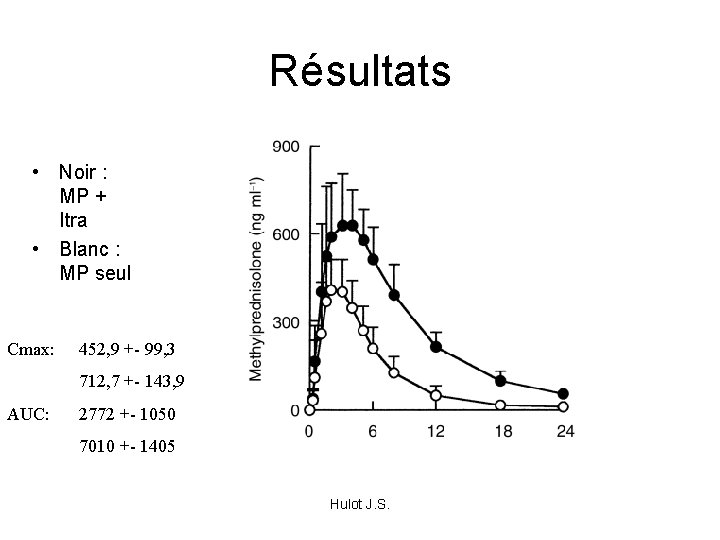
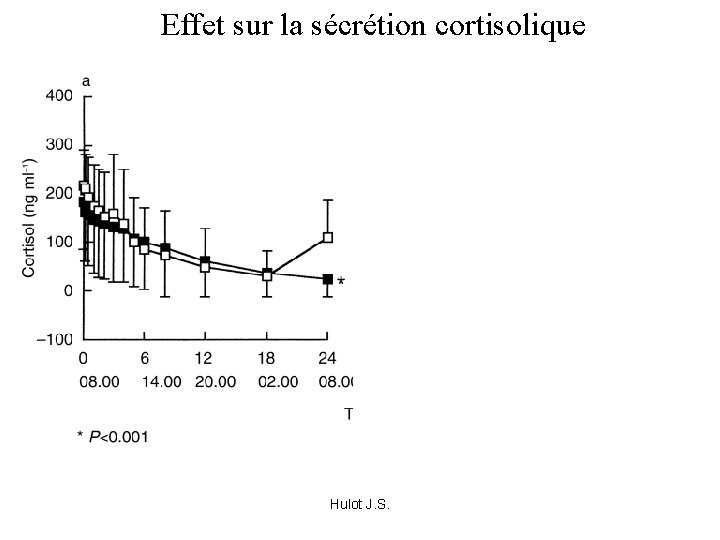
Résultats • Noir : MP + Itra • Blanc : MP seul Cmax: 452, 9 +- 99, 3 712, 7 +- 143, 9 AUC: 2772 +- 1050 7010 +- 1405 Hulot J. S.

Effet sur la sécrétion cortisolique Hulot J. S.

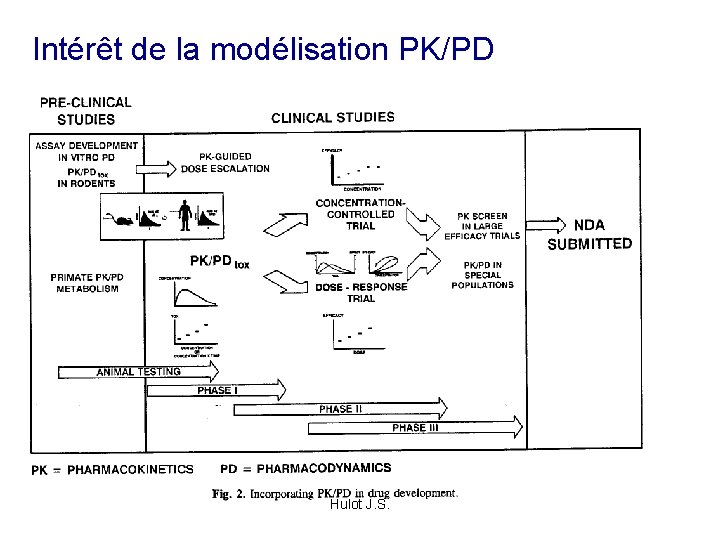
Pourquoi procéder à une modélisation pharmacocinétique ? Hulot J. S.

Paramètres pharmacocinétiques • Paramètres principaux : 1/ Biodisponibilité = La fraction de substance absorbée qui atteint la circulation systémique 2/ Volume de distribution = une mesure du volume dans lequel se répartit la substance dans l ’organisme 3/ Clairance = une mesure de la vitesse avec laquelle l ’organisme élimine le produit 4/ Demi-vie d ’élimination = temps nécessaire à la décroissance de moitié des concentrations plasmatiques du Hulot J. S. médicament

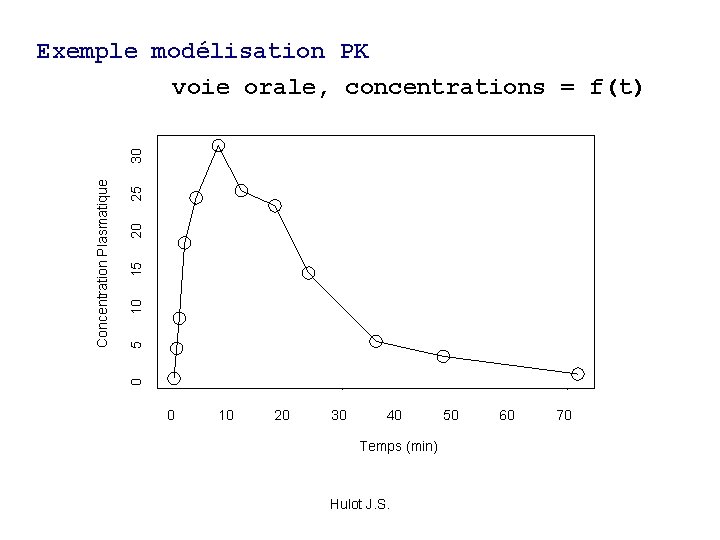
Modélisation PK • Ces paramètres essayent de refléter le comportement du médicament • Modèle= structure hypothétique mathématique qui va ‘agencer’ ces paramètres pour permettre de décrire de la façon la plus exacte le comportement d’un médicament dans l’organisme – C = f(t) Hulot J. S.

25 20 15 10 5 0 Concentration Plasmatique 30 Exemple modélisation PK voie orale, concentrations = f(t) 0 10 20 30 40 Temps (min) Hulot J. S. 50 60 70

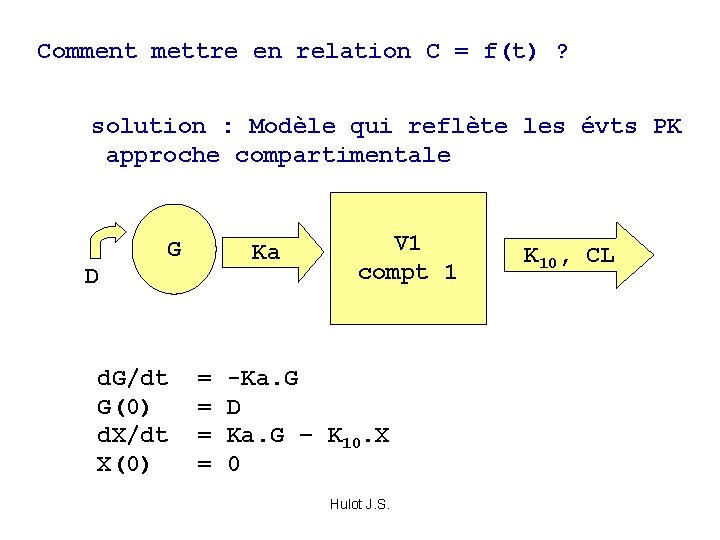
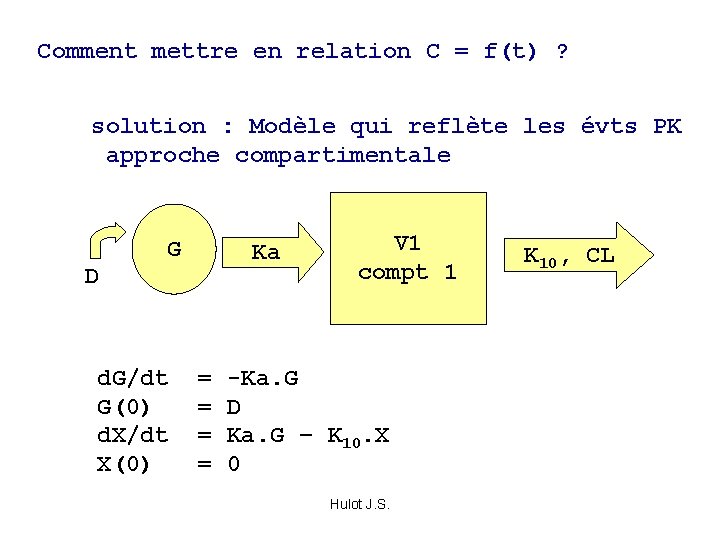
Comment mettre en relation C = f(t) ? solution : Modèle qui reflète les évts PK approche compartimentale D G Ka V 1 compt 1 d. G/dt = -Ka. G G(0) = D d. X/dt = Ka. G – K 10. X X(0) = 0 Hulot J. S. K 10, CL

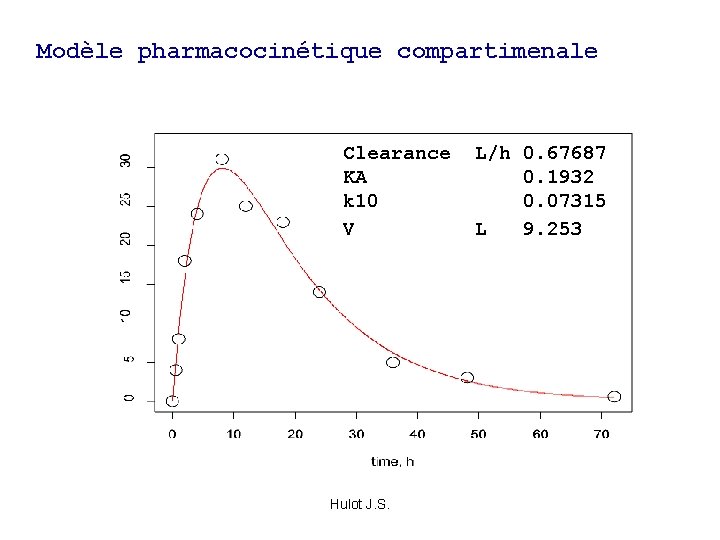
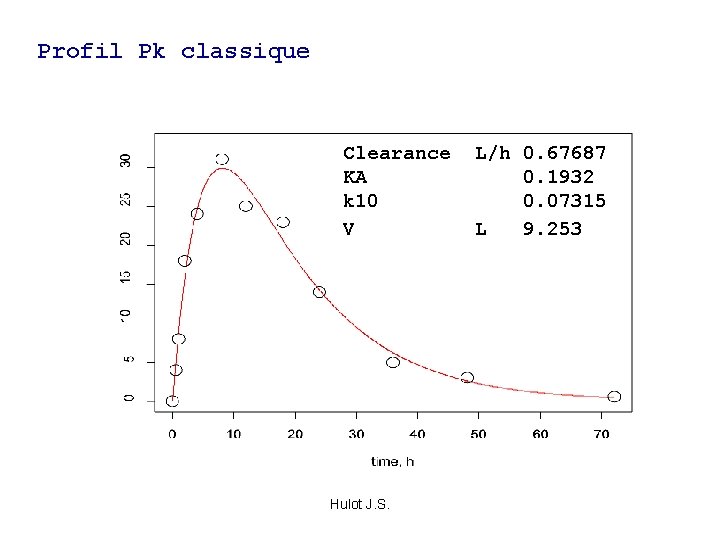
Modèle pharmacocinétique compartimenale Clearance L/h 0. 67687 KA 0. 1932 k 10 0. 07315 V L 9. 253 Hulot J. S.

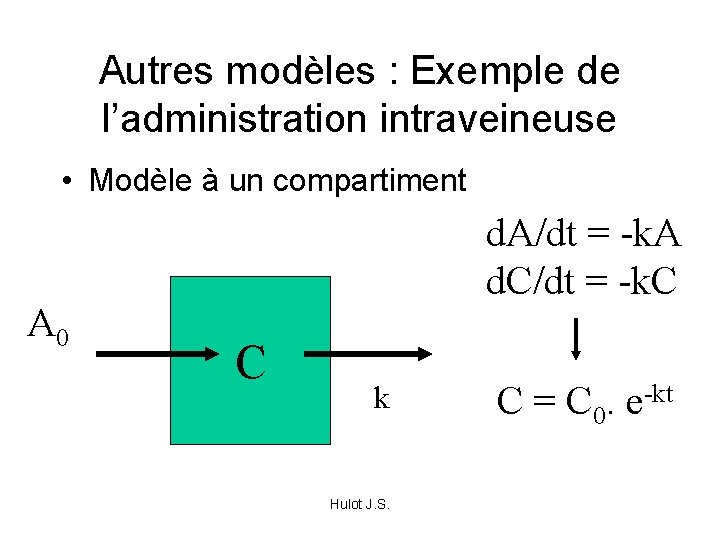
Autres modèles : Exemple de l’administration intraveineuse • Modèle à un compartiment A 0 d. A/dt = -k. A d. C/dt = -k. C C k Hulot J. S. C = C 0. e-kt

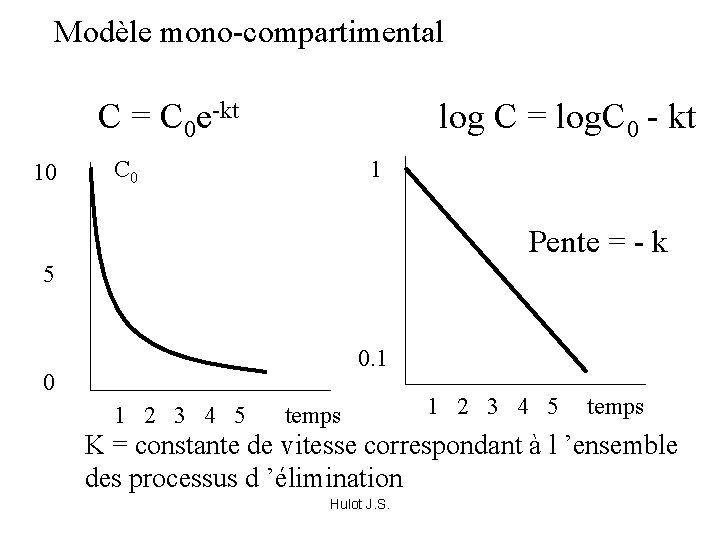
Modèle mono-compartimental C = C 0 e-kt 10 log C = log. C 0 - kt C 0 1 Pente = - k 5 0. 1 0 1 2 3 4 5 temps K = constante de vitesse correspondant à l ’ensemble des processus d ’élimination Hulot J. S.

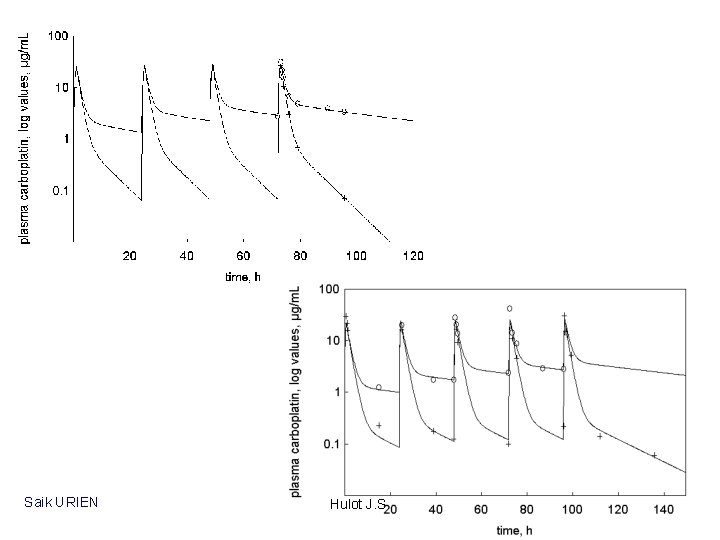
carboplatine Dose K 0 (2) (B) bound species CLB 0 (1) CL 1 B plasma binding process unbound species Q CL 10 Hulot J. S. unbound species

Saik URIEN Hulot J. S.

Un bon modèle • Explique les faits / observations • Permet d’étendre la connaissance du profil • À partir d’un nombre réduit de données • Appréhende l’importance de chaque phase PK / PD Hulot J. S.

‘Résultats’ de la modélisation • 1. Quantifier les paramètres – PK et/ou PD moyens – Leur variabilité • 2. Tester des hypothèses – Influence variables : sous-groupes – Linéarité PK – Type de relation PK / PD • 3. Prédire : Simuler – Autres schémas posologiques – Essais thérapeutiques • 4. Optimiser : individualiser – Prédiction bayesienne Hulot J. S.

Intérêt de la modélisation PK/PD • Explique les faits observés Hulot J. S.

• Comment procéder pour faire une modélisation PK, PD, PK / PD ? Hulot J. S.

Protocole clinique PK => C = f(t) • Sujets sélectionnés : volontaires sains puis populations particulières • Nombre limité de sujets (3 à 20) • Beaucoup de mesures par sujets (6 à 20) • Etude courte • Gamme de doses • Protocole de recueil très encadré • Typiquement Phase I • Analyse des infos sujet par sujet puis synthèse Hulot J. S.

25 20 15 10 5 0 Concentration Plasmatique 30 Exemple modélisation PK voie orale, concentrations = f(t) 0 10 20 30 40 Temps (min) Hulot J. S. 50 60 70

Comment mettre en relation C = f(t) ? solution : Modèle qui reflète les évts PK approche compartimentale D G Ka V 1 compt 1 d. G/dt = -Ka. G G(0) = D d. X/dt = Ka. G – K 10. X X(0) = 0 Hulot J. S. K 10, CL

Profil Pk classique Clearance L/h 0. 67687 KA 0. 1932 k 10 0. 07315 V L 9. 253 Hulot J. S.

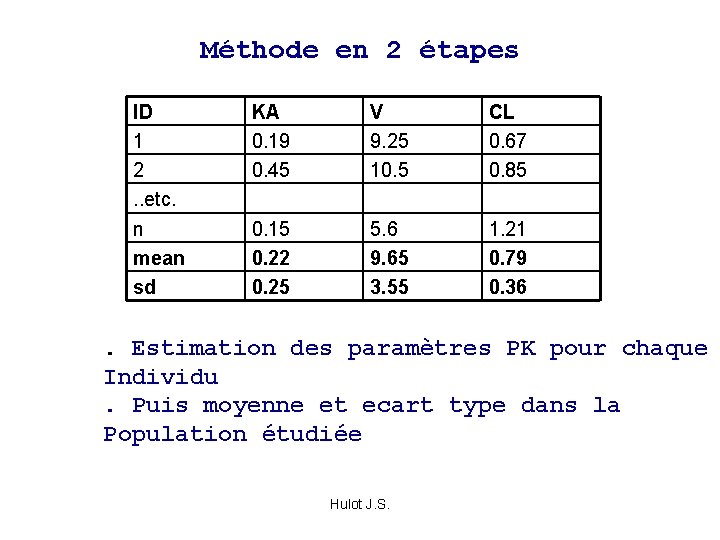
Méthode en 2 étapes ID 1 2. . etc. n mean sd KA 0. 19 0. 45 V 9. 25 10. 5 CL 0. 67 0. 85 0. 15 0. 22 0. 25 5. 6 9. 65 3. 55 1. 21 0. 79 0. 36 . Estimation des paramètres PK pour chaque Individu. Puis moyenne et ecart type dans la Population étudiée Hulot J. S.

Problématique (1) • Données riches chez tous les patients Nombre de prélévement ++ • Représentativité par rapport à la population cible – Faisabilité dans certaines populations ? – Patients les plus compliqués • N modélisations individuelles = N modèles (1 cpt ; non compartimental) Hulot J. S.

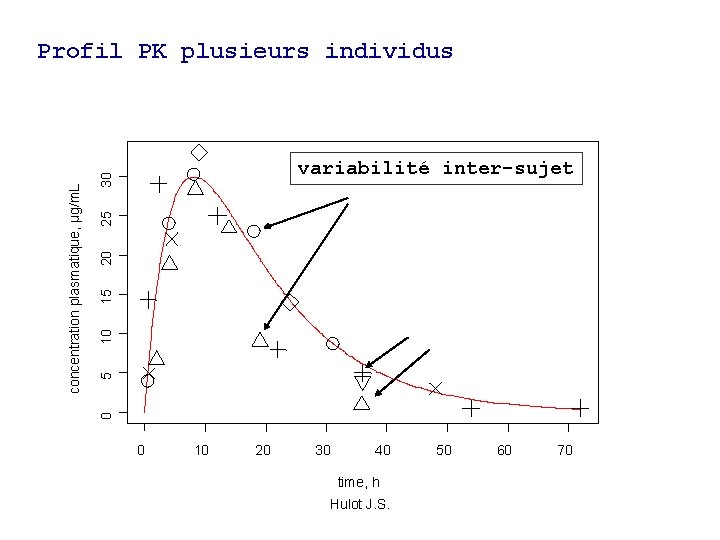
Problématique (2) • Analyse de la variabilité: • Moyenne et variance des paramètres PK: – Analyse de la variabilité ? – Catégorisation d’individus ? • Composantes de la variabilité: – Inter-individuelle – Intra-individuelle – Résiduelle Hulot J. S.

5 10 15 20 25 30 variabilité inter-sujet 0 concentration plasmatique, µg/m. L Profil PK plusieurs individus 0 10 20 30 40 time, h Hulot J. S. 50 60 70

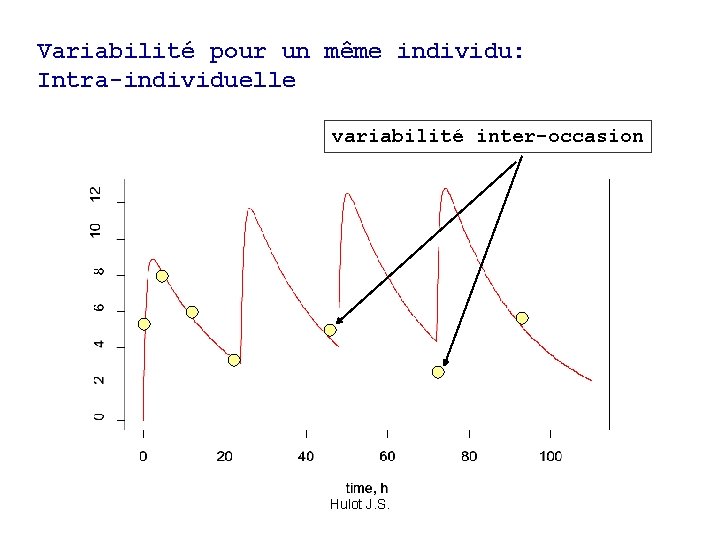
Variabilité pour un même individu: Intra-individuelle variabilité inter-occasion Hulot J. S.

Variabilité résiduelle • Inexpliquée • Erreur liée à la mesure de concentration • Erreur de timing • Méthodes en 2 étapes: variabilité globale Autres approches de modélisation PK ? Hulot J. S.

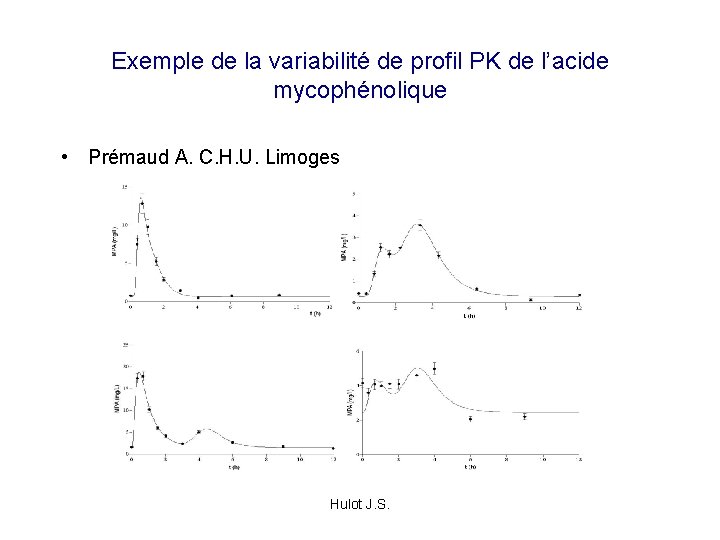
Exemple de la variabilité de profil PK de l’acide mycophénolique • Prémaud A. C. H. U. Limoges Hulot J. S.

Objectifs de l’approche population • Proposée par L. Scheiner & coll • Caractériser et estimer des caractéristiques PK typiques d’une population • et leur variabilité: – Identifier les facteurs pertinents de variabilité entre les sujets / variabilité résiduelle (mesures, temps…) • Etudier la PK/PD dans des sous-groupes de patients • Prédire la posologie à utiliser pour obtenir un effet défini Hulot J. S.
![Principe pharmacocinétique de population NONMEM t Ct pour ch sujet ID covariablest Hulot J Principe pharmacocinétique de population NONMEM [t, C(t)] pour ch. sujet, ID +covariables(t) Hulot J.](https://slidetodoc.com/presentation_image/41070472c564f90bb8e5eb8beb417d05/image-49.jpg)
Principe pharmacocinétique de population NONMEM [t, C(t)] pour ch. sujet, ID +covariables(t) Hulot J. S.

• Plus de raisonnement pour l’individu • Raisonnement pour la population dont on peut tirer l’information pour retourner à l’individu • En conséquence: pas besoin de beaucoup d’info sur 1 individu mais beaucoup d’info sur 1 population = population représentative des sujets à traiter en limitant les exclusions • Typiquement adapté à des données de routine Hulot J. S.
![Quelles Données Estimer les p pk données t posologiet Ct Quelles Données ? • Estimer les p. pk : données [t, posologie(t), C(t)] •](https://slidetodoc.com/presentation_image/41070472c564f90bb8e5eb8beb417d05/image-51.jpg)
Quelles Données ? • Estimer les p. pk : données [t, posologie(t), C(t)] • Sources de variabilité : N d'IDs "raisonnablement" grand • admis N>=30 ( ) Caractéristiques ID : recueil de covariables X, Poids, Taille, Age… Bio. SCr, Alb. , Hb… Medic. associés Phénotypes (metab. , CYP 450…) Hulot J. S.

Analyse des informations sur l’ensemble des sujets = analyse pour une population • Beaucoup de sujets • Peu de mesures • N de prélts/ID petit, • 1 -3 • compensé par • N IDs grand • Richesse d’info sur les données+++ • Phase II, III, post AMM Hulot J. S.

Quels patients ? • Ensemble de sujets avec les caractéristiques les plus diverses possibles / très proches des sujets à traiter Acceptation dans le protocole d’une variabilité forte == Approche classique • Nombre de sujets ? • Pas de calcul simple disponible • Raisonnement en nombre de points ? • N > 30 de base + 10 à 20 patients / covariables Hulot J. S.

Déroulement pratique • 1ère étape: Construire le modèle structural • PK et / ou PD: – Utilisation de modèles prédéfinis • Ex: modèle monocompartimental … • Modèle Emax… – Modèles libres : création d’un modèle structural Choix selon les connaissances préalables Le meilleur modèle structural est celui qui décrit le mieux les données Modèle appliqué à la population Hulot J. S.

Données ‘PK pop’ et modèle typique Hulot J. S.

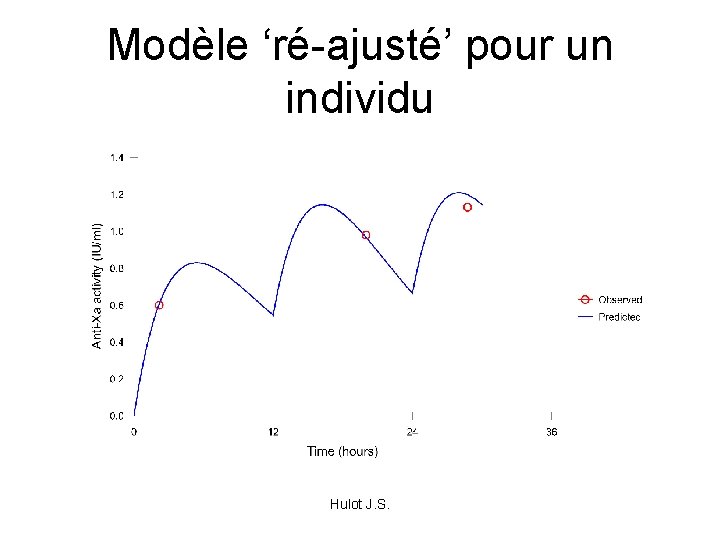
Modèle ‘ré-ajusté’ pour un individu Hulot J. S.

Même modèle pour tous ! • 2 notions importantes: – L’analyse des variabilités inter-individuelle n’est pas encore effectuée – Grâce à une estimation bayesienne des paramètres, on peut revenir à l’individu • 1 conséquence: – A cette étape la prédiction typique du modèle est ‘médiocre’ Hulot J. S.

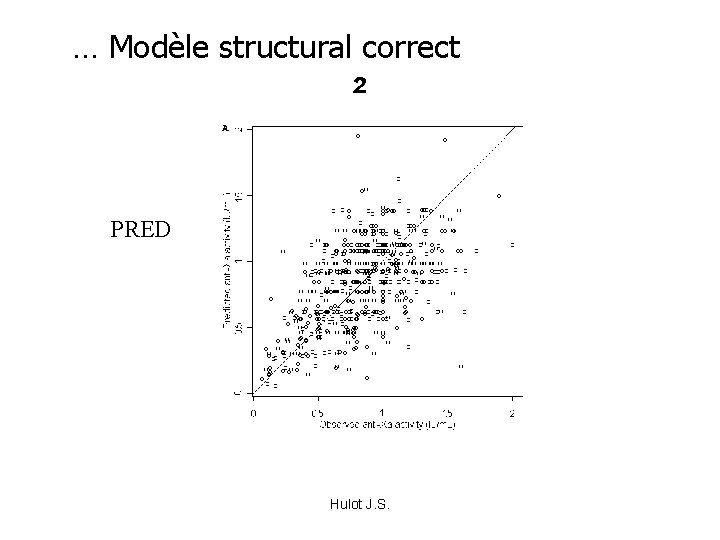
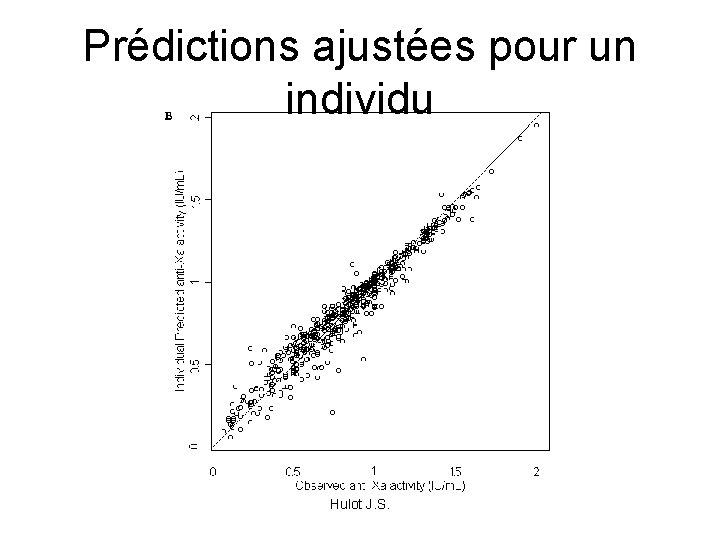
Comment juger ? • Comparaison des prédites typiques et des observées – Symétrie / dispersion – Sur- ou Sous-estimation systématique • Comparaison des prédites individuelles et des observées – Estimation bayesienne d’un paramètre individuel selon les paramètres Popu et le/les points du sujet = vision probabiliste • Valeurs des paramètres PK/PD • Graphiques des résidus Hulot J. S.

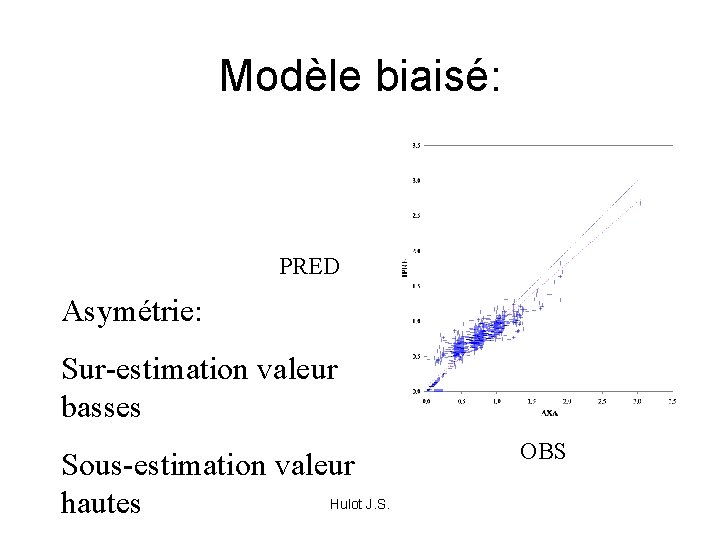
Modèle biaisé: PRED Asymétrie: Sur-estimation valeur basses Sous-estimation valeur Hulot J. S. hautes OBS

… Modèle structural correct ² PRED OBS Hulot J. S.

Evaluation d'une modélisation PKPOP . analyses graphiques individuelles Hulot J. S.

Prédictions ajustées pour un individu Hulot J. S.

2ème étape Principe de l ’analyse des données = modélisation pharmaco-statistique modélisation statistique des variabilités. erreur intra-sujet. erreur inter-occasion Hulot J. S.

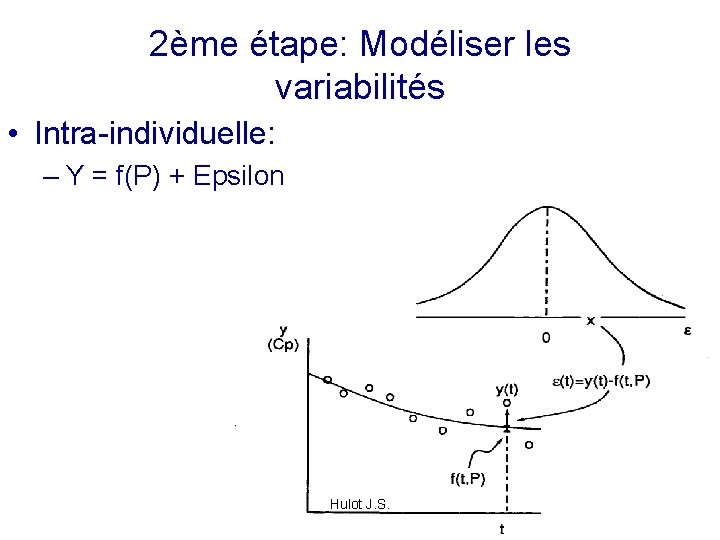
2ème étape: Modéliser les variabilités • Intra-individuelle: – Y = f(P) + Epsilon Hulot J. S.

Epsilon ? • Modèle pour l’observation j au temps tj Yj = f (P, tj) + epsilon • Ecart entre les prédits et observés pour un sujet • Erreur: • Ecart lié au modèle de structure • Erreur due à l’essai (collecte temps de prélévements…) • Variabilité inter occasion Hulot J. S.

Hypothèses sur Epsilon ? • Moyenne nulle – Sinon problème de structure • Différents modèles: Obs = Pred ± Obs = Pred + Obs = Pred*(1 + ) Obs = Pred*e • Distribution ? • normale Hulot J. S.

Types d’erreur additive O = P + Erreur est la même quelque soit la grandeur de P. erreur proportionnelle O = P*(1 + ) Plus P est grand, Plus l’erreur grandit. Erreur mixte : Proportionnel + part additif Hulot J. S.

Caractéristiques des variabilités • Epsilon est un paramètre de population • Sa variance (sigma) est dite, en PK pop, – Variabilité résiduelle – Variabilité intra-individuelle • Additive: écart type des erreurs • Multiplicative: CV (%) Hulot J. S.

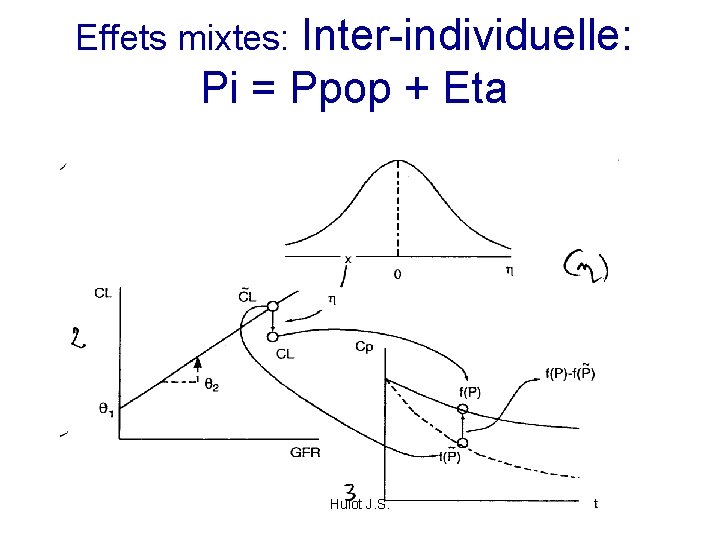
Effets mixtes: Inter-individuelle: Pi = Ppop + Eta Hulot J. S.

Hypothèses Tous les individus peuvent être décrits par le même modèle structural Variabilité entre les sujets peut être modélisée en observant les différences des paramètres entre les individus Cette variabilité est un paramètre popu : ETA - distribution - moyenne - variance omega Hulot J. S.

Codage de l’erreur inter. individuelle ? erreur inter-sujet « eta » CLi = CLm ± Additif: PKi = PKm + Multiplicatif: PKi = PKm*(1 + ) PKi = PKm*e Hulot J. S.

Modèle pop • Modèle de structure: – Reflête un processus biologique • Modèle de l’erreur résiduelle (Epsilon) – Le même pour tous – Inclus intra-individuelle • Modèle variabilité entre les individus (Eta) – Caractérise la population observée – Peut incorporer des covariables • Modèle inter-occasion (Kappa) Hulot J. S.

Hypothèses sur les ISV • Méthode paramétrique – Hypothèses sur la distribution – Loi normale (µ, omega²) – NONMEM • Méthode non paramétrique – Pas d’hypothèse sur la distribution – Mathématique plus lourde mais potentiellement plus précise – NPML / NPEM Hulot J. S.

2. pharmacocinétique de population NONMEM Résultats: Paramètres pop: V=14 l Cl=2. 7 l/h et Ka=1. 1/h Hulot J. S.

De la population à l’individu • Couplage à la formule Bayes – Loi probabiliste – Compte-tenu des informations sur les paramètres dans la population et leur variabilité, quels sont les paramètres les plus probables pour un individu ? • Estimation individuelle des paramètres • Option Post Hoc NONMEM Hulot J. S.

2. Conséquences ++ Résultats: Paramètres pop: V=14 l Cl=2. 7 l/h et Ka=1. 1/h V 1 10 L CL 2 L/h KA 1. 5/h V 1 15 L CL 2. 5 L/h KA 1/h Hulot J. S.

Quelle utilité ? . erreur intra-sujet/ résiduelle « sigma » . . quantification. . recueil t. . Erreur bio. erreur inter-sujet « eta » ISV. . explicables par des différences de caractéristiques entre les patients fct renale, hep. par. pondéraux intérêt des covariables. . non explicables. erreur IOV. . v. orale, période obs. longue Hulot J. S. . . patients, PKPD

Tester l’influence des covariables sur les paramètres PK • Clpopu=Théta(1) *age + Theta(2) Hulot J. S.

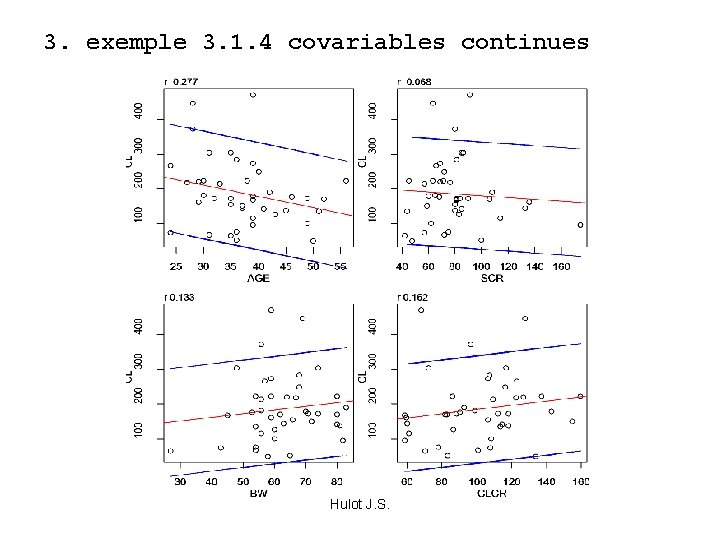
3. exemple 3. 1. 4 covariables continues Hulot J. S.

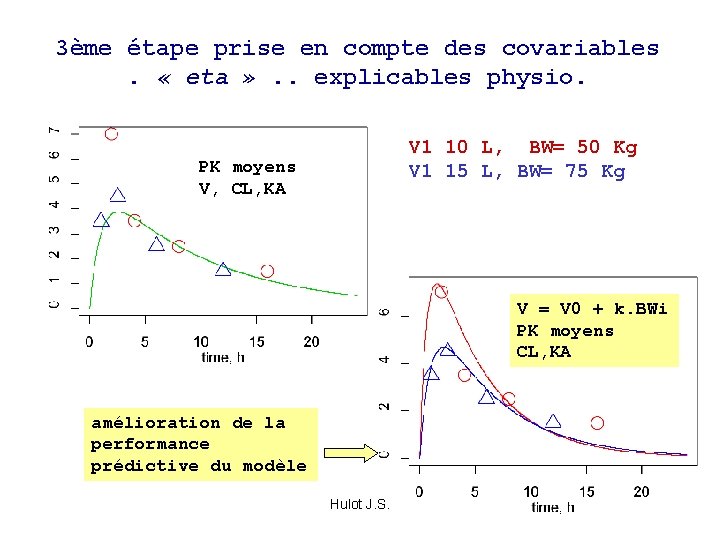
3ème étape prise en compte des covariables. « eta » . . explicables physio. V 1 10 L, BW= 50 Kg V 1 15 L, BW= 75 Kg PK moyens V, CL, KA V = V 0 + k. BWi PK moyens CL, KA amélioration de la performance prédictive du modèle Hulot J. S.

Comment juger ? si une covariable a un effet significatif sur le modèle, a) amélioration de la prédiction du modèle (graphiques + critère statistique), b) diminution de la variabilité intersujet associée à ce paramètre, c) acceptable si bases physiologiques d) autres critères, TV, précision, Cov(min-max), N IDs etc… Hulot J. S.

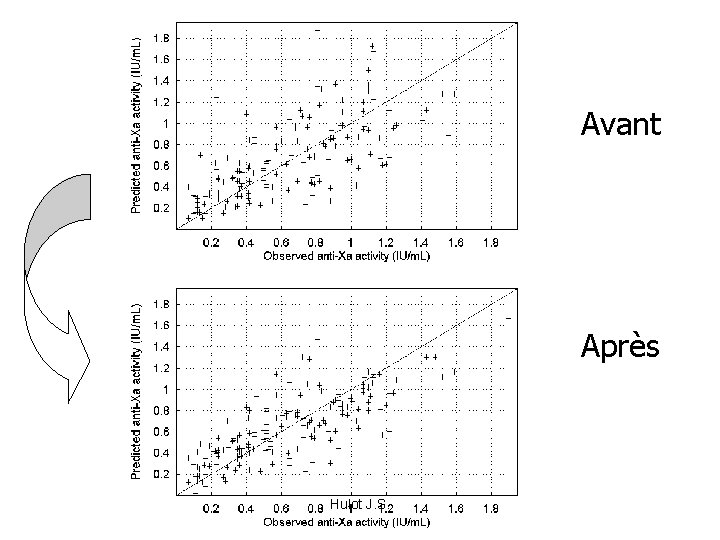
Avant Après Hulot J. S.

Critère statistique : Objective Function Avec une régression linéaire: - jugement de la valeur de la prédiction Par l’estimation de la somme du carré des écarts Même principe lors d’une régression non linéaire Mais pas même formule: Maximum de vraisemblance OBJ function = 2 ln vraisemblance • Plus elle diminue meilleure est la prédiction • Elle suit une loi du Chi 2 • Si diminution > 3. 84, • Le modèle est Statistiquement meilleur p<0. 05 Hulot J. S.

Construction du modèle final • Rentrée progressive des covariables sur les paramètres PK – Univarié puis Multivarié • Test final par retrait un à un des covariables sur les paramètres PK – Backward elimination Hulot J. S.

Validation d’un modèle Externe Méthode de référence Une autre étude -> analyse vérifie les prédictions Interne Data spliting Bootstraping Jackknife Hulot J. S.

4ème étape validation interne d'une modélisation . Data splitting 2/3 – 1/3 2/3, apprentissage, "learning" 1/3, validation. techniques de simulation statistique bootstrap ré-échantillonage de la population 400 (au -) retirages avec remise estimation des paramètres/ch. tirage m ± SD, médiane, percentiles… Hulot J. S.

Bootstraping Principe 1/2: Unité statistique = l’individu Si n individus: On tire au hasard n fois dans la base de données MAIS en remettant à chaque fois l’individu dans la base (=> Un même individu peut être tiré plusieurs fois) On refait l’analyse PK en utilisant le modèle final -> donne de nouvelles estimations des paramètres de population. Le processus est répété au moins 200 fois. Hulot J. S.

Principe 2/2: Les paramètres sont synthétisés sous forme de moyenne, sd, intervalle de confiance… Les paramètres estimés avec la base de données originale doivent être équivalent à ceux donnés par le bootstraping. Si un paramètre est ‘différent’ du bootstrap, il faut remettre en cause la stabilité et la performance du modèle. Hulot J. S.

Modèle final • 1 modèle structural • Estimation des paramètres PK de population (dits typiques) • Estimation des variabilités • Influence des covariables permettant de prédire les paramètres du modèle Hulot J. S.

‘Résultats’ de la modélisation • 1. Quantifier les paramètres – PK et/ou PD moyens – Leur variabilité • 2. Tester des hypothèses – Influence variables : sous-groupes – Linéarité PK – Type de relation PK / PD • 3. Prédire : Simuler – Autres schémas posologiques – Essais thérapeutiques • 4. Optimiser : individualiser – Prédiction bayesienne Hulot J. S.

Population pharmacokinetics of tacrolimus in full liver transplant patients : Modelling of the post operative clearance • Marie ANTIGNAC 1, Jean Sebastien HULOT 2, Emmanuel BOLESLAWSKI 4, Laurent HANNOUN 4, Yvan TOUITOU 4, Robert FARINOTTI 1, Philippe LECHAT 2, Saïk URIEN 2 • Eur J Clin Pharmacol 2005; 61: 409 -416 Hulot J. S.

Problématique • Tacrolimus : immunosuppresseur indiqué dans post-greffe d’organe • PK: – Forte variabilité inter-individuelle – Marge thérapeutique étroite Pour maintenir des concentrations résiduelles entre 5 et 20 ng/ml chez des transplantés stables doses vont de 1 à 44 mg/j. • Fort métabolisme hépatique • Quid post-greffe hépatique immédiat (<15 j) ? – Comment se fait l’évolution de clairance Tacro ? Hulot J. S.

Patients • • Données démographiques : 37 patients (26 M/ 11 F) • • greffés hépatiques (foie entier) sur cirrhose post hépatite virale B ou C ou alcoolique. Durée d’hospitalisation moyenne : 28. 9 ± 11. 7 jours [11 -66] Dose initiale de tacrolimus (Prograff®) : 0. 0137 mg/kg (± 0. 0043) [0. 0053 -0. 0238] Hulot J. S.

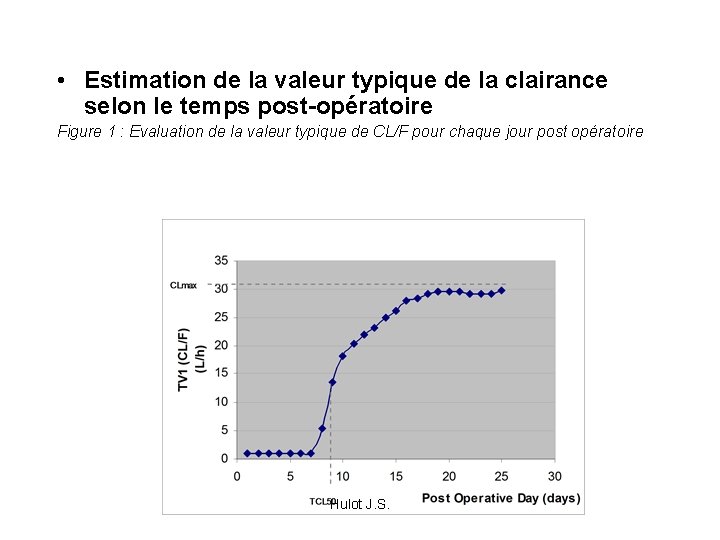
Tacrolimus • Modèle : • Modèle à 1 compartiment • 728 concentrations Résiduelles • Ka fixé à 4. 48 h-1, • aucun effet sur V/F Tacrolimus residual whole blood concentration (ng/ml)° • Covariable : POD : nombre de jour post opératoire Diminution de 87 unités de FO sur le modèle de base Hulot J. S. TIME (hours)°

• Estimation de la valeur typique de la clairance selon le temps post-opératoire Figure 1 : Evaluation de la valeur typique de CL/F pour chaque jour post opératoire Hulot J. S.

Description par un modèle sigmoïde de l’évolution de la clairance • Modèle sigmoïde : CL/F = TV (CLm) h 1 x 1+ TV (TCL 50) (1 + POD) h 3 avec TV(CLm), TV(TCL 50), TV(GAM) valeur typique de CLm : clairance apparente max, TCL 50 : temps pour obtenir 50% de la clairance max GAM : coefficient de sigmoidicité Chute de FO / base : 266 unités Hulot J. S. TV (GAM)

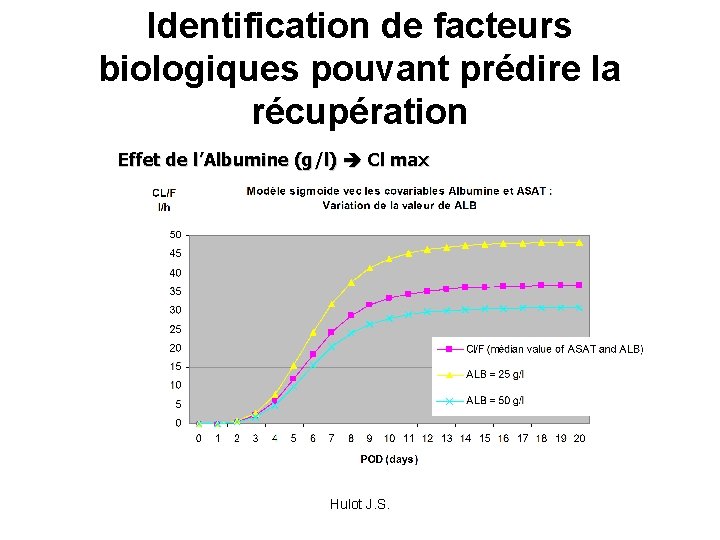
Identification de facteurs biologiques pouvant prédire la récupération Effet de l’Albumine (g/l) Cl max Hulot J. S.

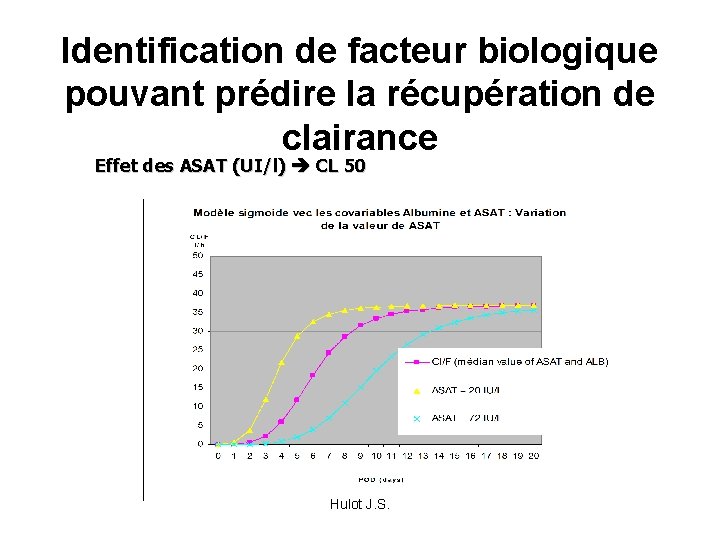
Identification de facteur biologique pouvant prédire la récupération de clairance Effet des ASAT (UI/l) CL 50 Hulot J. S.

‘Résultats’ de la modélisation • 1. Quantifier les paramètres – PK et/ou PD moyens – Leur variabilité • 2. Tester des hypothèses – Influence variables : sous-groupes – Linéarité PK – Type de relation PK / PD • 3. Prédire : Simuler – Autres schémas posologiques – Essais thérapeutiques • 4. Optimiser : individualiser – Prédiction bayesienne Hulot J. S.

Syndrome Coronaire Aigu (SCA) sans sus -décalage du segment ST • Une pathologie fréquente : – 180 000 cas /an en France – 60% des accidents coronariens • Liée à la formation d’un thrombus intra-coronaire, développé sur une plaque athéromateuse déstabilisée • Nécessitant un traitement anti-thrombotique : – Anti-agrégants plaquettaires + Anti-coagulant Héparine de bas-poids moléculaire : Enoxaparine Hulot J. S.

Utilisation de l’enoxaparine chez l’insuffisant rénal ? • Chaines saccharidiques de bas poids moléculaire: – PM : 5000 D (2000 D – 10000 D) • Elimination mixte : par voie rénale et participation d’un système extra-rénal (Bruno R. 2003, Sanderink 2003, Hulot JS 2004) • Augmentation significative du risque hémorragique sous Enoxaparine 1 mg/kg/12 h – Données ESSENCE / TIMI 11 b (ESC Munich 2004) Hémorragies Majeures Enoxaparine HNF P value CLCR < 30 ml/min 7. 5 % 5. 8 % * 30 -50 ml/min 3 % 1. 1 % * 50 – 80 ml/min 1. 3 % Hulot J. S. NS >80 ml/min 0. 7% 0. 6% NS

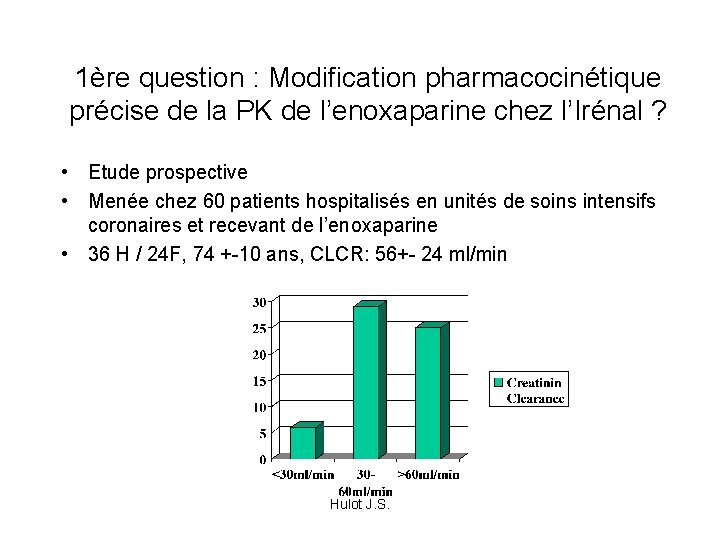
1ère question : Modification pharmacocinétique précise de la PK de l’enoxaparine chez l’Irénal ? • Etude prospective • Menée chez 60 patients hospitalisés en unités de soins intensifs coronaires et recevant de l’enoxaparine • 36 H / 24 F, 74 +-10 ans, CLCR: 56+- 24 ml/min Hulot J. S.

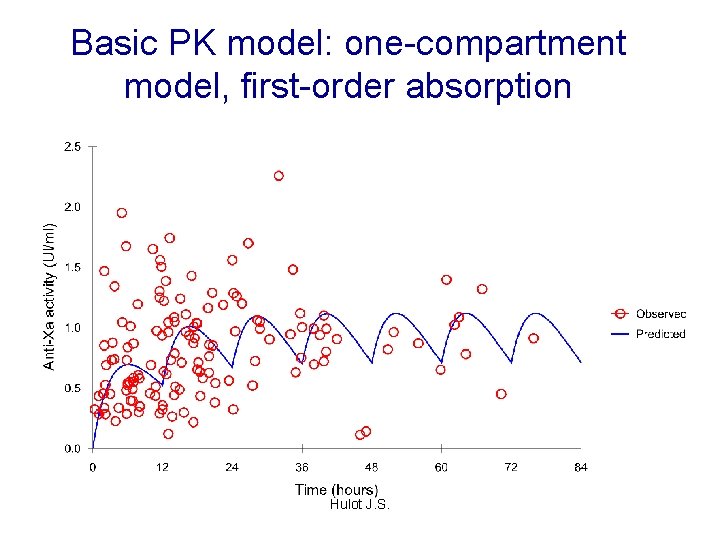
Basic PK model: one-compartment model, first-order absorption Hulot J. S.

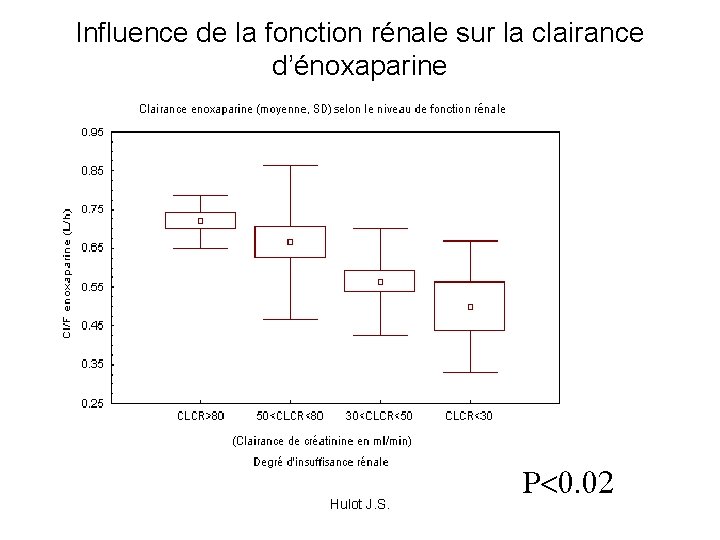
Influence de la fonction rénale sur la clairance d’énoxaparine Hulot J. S. P<0. 02

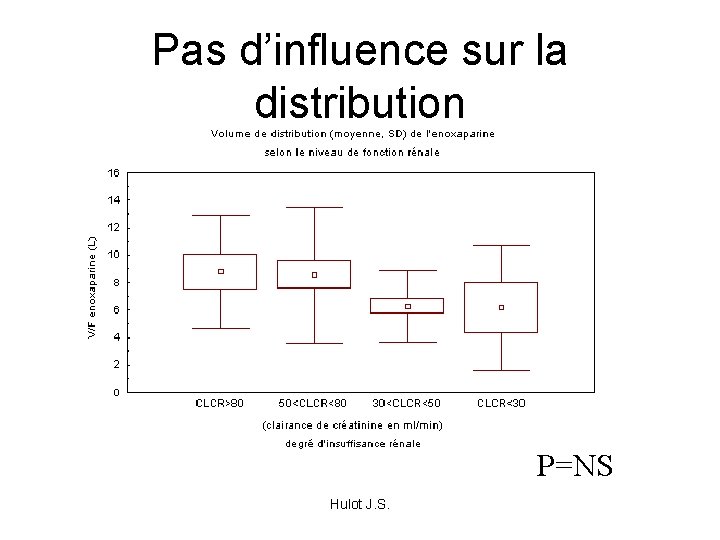
Pas d’influence sur la distribution P=NS Hulot J. S.

‘Résultats’ de la modélisation • 1. Quantifier les paramètres – PK et/ou PD moyens – Leur variabilité • 2. Tester des hypothèses – Influence variables : sous-groupes – Linéarité PK – Type de relation PK / PD • 3. Prédire : Simuler – Autres schémas posologiques – Essais thérapeutiques • 4. Optimiser : individualiser – Prédiction bayesienne Hulot J. S.

Elargissement de la population • 532 patients traités par Enoxaparine pour un SCA • 2 sources de données: – Données issues du suivi thérapeutique de plus de 600 patients ayant reçu de l’enoxaparine pour un AI/ NSTEMI (Registre PARIS) • 472 patients avec une information Anti-Xa (heure, dose), 1 anti-Xa par patient – 60 patients inclus dans EPOX (Hulot et al. TDM 2004) • 661 activités anti-Xa Hulot J. S.

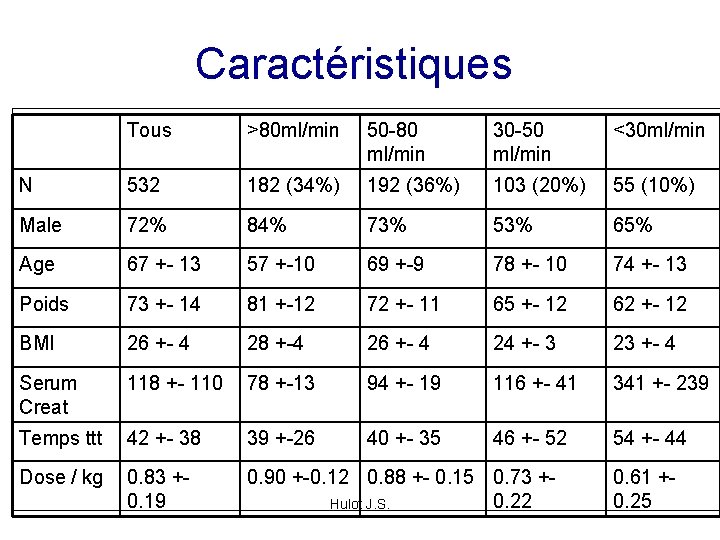
Caractéristiques Tous >80 ml/min 50 -80 ml/min 30 -50 ml/min <30 ml/min N 532 182 (34%) 192 (36%) 103 (20%) 55 (10%) Male 72% 84% 73% 53% 65% Age 67 +- 13 57 +-10 69 +-9 78 +- 10 74 +- 13 Poids 73 +- 14 81 +-12 72 +- 11 65 +- 12 62 +- 12 BMI 26 +- 4 28 +-4 26 +- 4 24 +- 3 23 +- 4 Serum Creat 118 +- 110 78 +-13 94 +- 19 116 +- 41 341 +- 239 Temps ttt 42 +- 38 39 +-26 40 +- 35 46 +- 52 54 +- 44 Dose / kg 0. 83 +- 0. 19 0. 90 +-0. 12 0. 88 +- 0. 15 0. 73 +- 0. 22 Hulot J. S. 0. 61 +- 0. 25

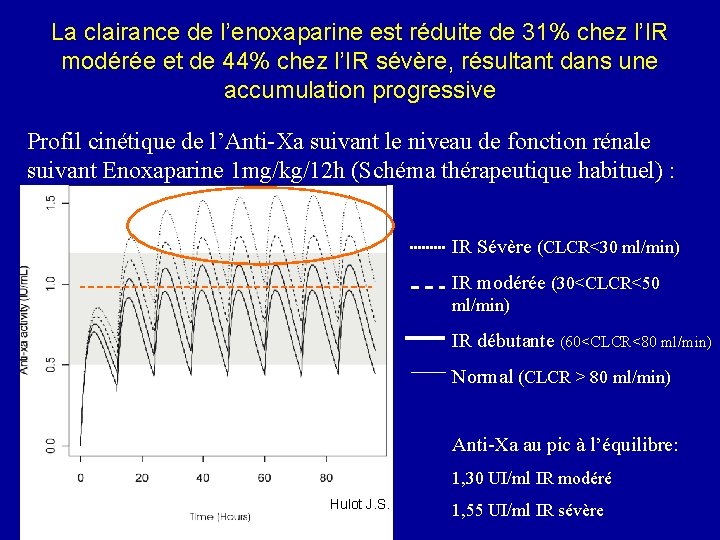
La clairance de l’enoxaparine est réduite de 31% chez l’IR modérée et de 44% chez l’IR sévère, résultant dans une accumulation progressive Profil cinétique de l’Anti-Xa suivant le niveau de fonction rénale suivant Enoxaparine 1 mg/kg/12 h (Schéma thérapeutique habituel) : IR Sévère (CLCR<30 ml/min) IR modérée (30<CLCR<50 ml/min) IR débutante (60<CLCR<80 ml/min) Normal (CLCR > 80 ml/min) Anti-Xa au pic à l’équilibre: 1, 30 UI/ml IR modéré Hulot J. S. 1, 55 UI/ml IR sévère

Stratégie basée sur une réduction de posologie (Hulot et al. 2005; 77: 542 -552) • Cible: Anti-Xa au pic à l’équilibre (Amaxss) – Nécessairement > 0. 5 IU/ml (Montalescot et al. Circulation 2004) – Idéalement compris entre 0. 5 et 1. 2 (Essai TIMI 11 A, Bruno et al. 2003) • Estimée à partir des estimations bayesiennes des paramètres PK • Réduction de dose proportionnelle à la réduction de CL/F : – Amaxss < 0, 5 IU/ml pour 5% des patients • Réduction : - 21% chez l’IR modéré et – 33% chez l’IR sévère : – Aucun sujet avec Amaxss <0, 5 UI/ml – Entre 90 et 95% des sujets avec 0, 5<Amaxss<1. 2 UI/ml Hulot J. S.

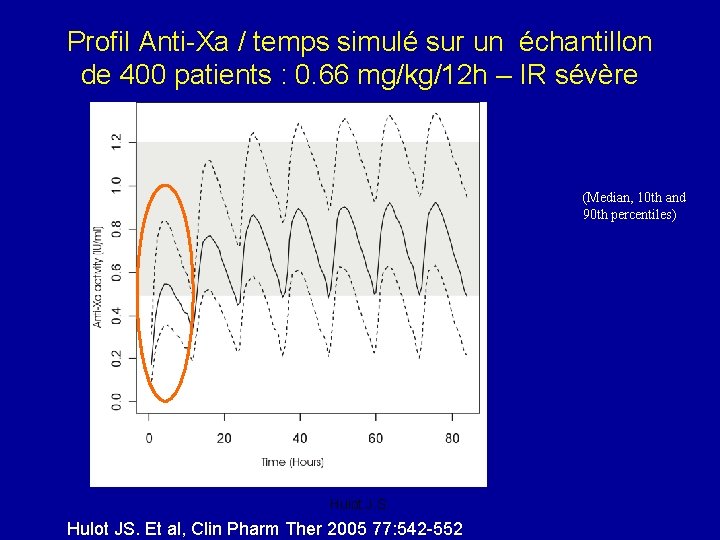
Profil Anti-Xa / temps simulé sur un échantillon de 400 patients : 0. 66 mg/kg/12 h – IR sévère (Median, 10 th and 90 th percentiles) Hulot J. S. Hulot JS. Et al, Clin Pharm Ther 2005 77: 542 -552

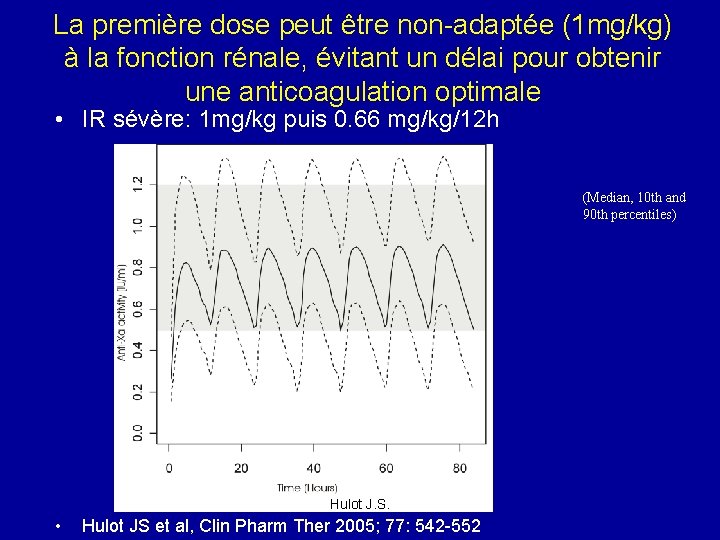
La première dose peut être non-adaptée (1 mg/kg) à la fonction rénale, évitant un délai pour obtenir une anticoagulation optimale • IR sévère: 1 mg/kg puis 0. 66 mg/kg/12 h (Median, 10 th and 90 th percentiles) Hulot J. S. • Hulot JS et al, Clin Pharm Ther 2005; 77: 542 -552

L’administration d’ 1 injection d’enoxaparine / 24 h (recommandation FDA) prévient l’accumulation mais produit des larges fluctuations • IR sévère = 1 mg/kg / 24 h (Median, 10 th and 90 th percentiles) Hulot JS et al Hulot J. S. Clin Pharm Ther 2005; 77 : 542 -552

‘Résultats’ de la modélisation • 1. Quantifier les paramètres – PK et/ou PD moyens – Leur variabilité • 2. Tester des hypothèses – Influence variables : sous-groupes – Linéarité PK – Type de relation PK / PD • 3. Prédire : Simuler – Autres schémas posologiques – Essais thérapeutiques • 4. Optimiser : individualiser – Prédiction bayesienne Hulot J. S.

Optimiser • Evaluation des paramètres d’un sujet à partir des paramètres de population – Simple: à partir des relations établies avec les covariables • Exemple: clairance de créatinine – Prédiction a priori Hulot J. S.

Principes de prédiction • A priori: – 1 modèle PK ; PK/PD; PD – Des prédictions de paramètres du modèle grâce à des covariables du patient • CL = f(CLCR) + f(association med) • Vd = f(Poids) – 1 cible PK (et/ou PD) • Résiduelle ; Pic; AUC; à l’équilibre CARBOPLATINE: Dose (mg) = AUC cible x CL CL=0. 134 x WT + (218 x. WT x(1 -0. 00457 x age) x (0. 686 si femme) Chatelut et al. 1995 Hulot J. S.

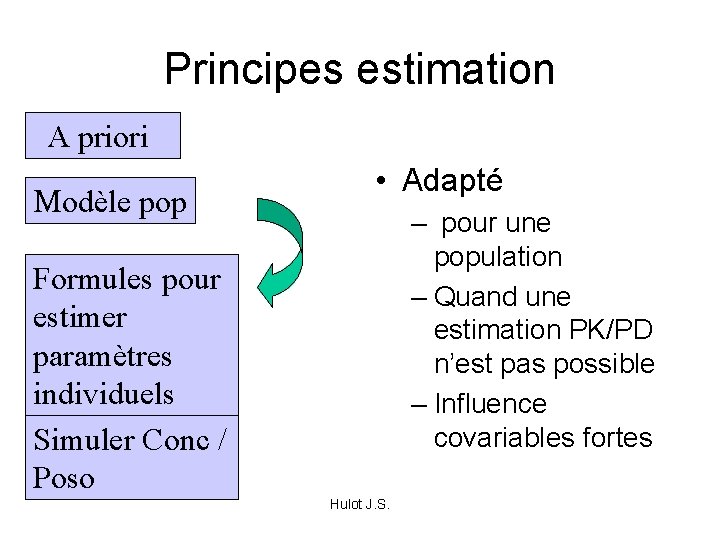
Principes estimation A priori Modèle pop • Adapté – pour une population – Quand une estimation PK/PD n’est pas possible – Influence covariables fortes Formules pour estimer paramètres individuels Simuler Conc / Poso Hulot J. S.

Hulot J. S.

Hulot J. S.

Hulot J. S.

Hulot J. S.

Hulot J. S.

2 niveaux de prédiction • Méthodes a priori: – Simples – Souvent assez imprécises Correction par incorporation de mesures de contrôles Méthodes a posteriori Estimation bayesienne Hulot J. S.

Prédiction individualisée • Formules donnant les paramètres pour 1 individu selon ses caractéristiques – Tous les individus de même caractéristiques ont les mêmes paramètres – Imprécision – Objectif: réviser la prédiction des paramètres en tenant compte de l’erreur de prédiction pour cet individu • Cette info est contenue dans les observations PK / PD Hulot J. S.

Principes Estimateur Bayesien A posteriori Modèle pop + 1 info PK/PD Révision du modèle • Adapté – pour un individu – Quand une estimation PK/PD est possible – Marge therap étroite / Variabilité inexpliquée Estimation bayesienne Simuler Conc / Poso Hulot J. S.

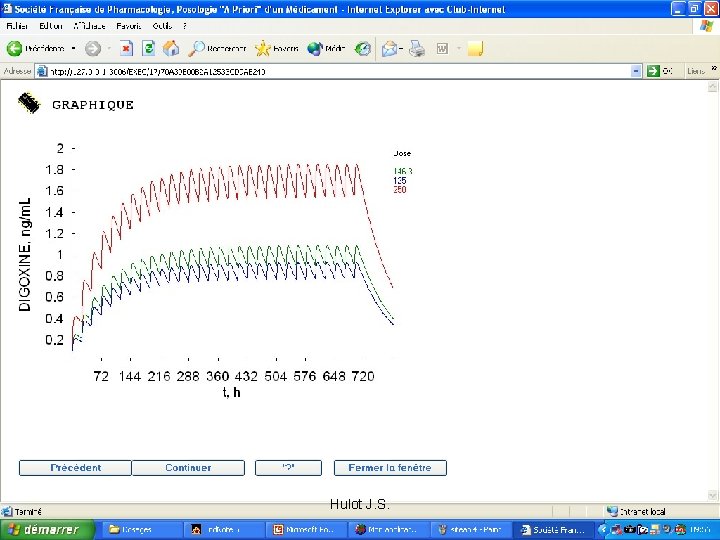
Sheiner et al. 1979 • Prédiction de Digoxinémie – A priori erreur entre – 0. 6 et + 0. 8 (µg/l) – 1 concentration • Erreur – 40% - 0. 5 et + 0. 5 µg/l – 2 Concentrations • Erreur – 67 % - 0. 4 et + 0. 4 µg/l Adaptation Posologique Individualisée Hulot J. S.

Pré- requis Individualisation posologique • A partir des paramètres individualisés PK /PD • A partir du modèle reliant concentration et effet • Avoir une cible déterminée – PK : AUC cible, Résiduelle , Pic cible – PD Hulot J. S.

2ème pré-requis • Outil informatique +++ • Logiciel destiné à l’adaptation posologique – Modèle pop – Variance des paramètres – Capable d’incorporer et de réviser le modèle à partir de la donnée PK/PD individu Hulot J. S.

L’ordinateur peut gérer certaines connaissances plus facilement que nous • Adaptation posologique individualisée = connaissance sur la variabilité des comportements inter-individuels • 2 niveaux: – Connaissance initiale: données morphologiques, biologiques, génétiques… – Connaissance ajustée après mesure de contrôle Hulot J. S.

Intérêt thérapeutique? • Pour des médicaments à marge thérapeutique étroite – Immunosuppresseurs – Antibiotiques • Pour des populations particulières – Sujet âgé, insuffisant rénal • Précision nécessaire ? – A priori / A posteriori ? Hulot J. S.

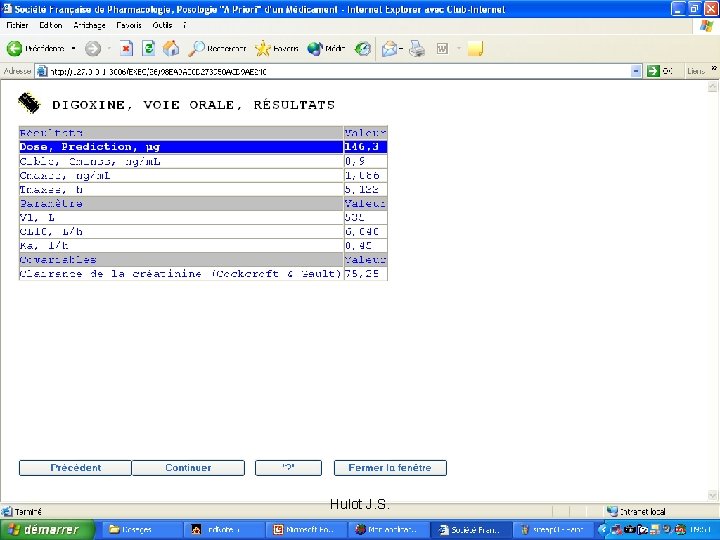
Exemple Digoxine • Idéalement, a posteriori – Eviter intoxication digitalique – Avoir le meilleur bénéfice thérapeutique – Marge 0. 5 à 1. 2 µg/l • Mais exportabilité vers les prescripteurs? – Délai de la prédiction – Dosage fait en consultation • Formule a priori – Erreur résiduelle dans notre population – Responsabilité Hulot J. S.

Digoxine orale Equation Biais ? Précision Konishi Cmin = D/(2. 22 * Ccr(ml/mn) + 25. 7) Non <30% Bauer 1 Cmin = D / (56. 9 + 1. 91 * Ccr (ml / mn)) * Non <30% Bauer 2 Cmin = D / (19. 08 * Screat 0. 650 * IBW 0. 533)* Oui > 30% Yukawa Cmin = D / CL * CL = (0. 036 * TBW + 0. 112 * Ccr) * 0. 77 SPI * 0. 784 CCB Oui > 30% Williams Cmin = F * D * exp[-Ke * ] / Vd / [1 -exp (-Ke * )] F = 0. 82 Vd = [ 4. 03 + 0. 0832 * Ccr (ml / mn) ] * IBW CL = [ 3. 10 + 0. 0516 * Ccr] * Quin Oui > 30% Hulot J. S.

Résumé 1 : Application approche pop pour le médicament • Phase 1: – Modèle préliminaire PK, PK/PD – Simulation escalade de dose – Simulation doses multiples • Phase 2 – PK et PK/PD dans des populations cibles – Préparation phase III • Phase 3 – Modèle final avec covariables – Sous-groupes / interaction • Phase 4 – Adaptation posologique sous-groupe / Hulot J. S. individualisée

Résumé 2: Comparaison approche classique / pop Traditionnel Population Patients Sélectionnés Volontaires sains / sousgroupes Population cible Non sélectionnés Conditions Contrôle strict info médicament (dose; temps prlvt) Dose Simple ou répétée sur un temps Multiple / thérapeutique défini Nb de prélèvements Nombreux (Rich data) Limité (Sparse data) Lieu CRO Protocole délimité Hôpital Suivi thérapeutique Analyse Souvent non-compartimentale Individu par individu Données en 2 étapes Modélisation Analyse en bloc Effets mixtes Hulot J. S.

Avantages approche population • Approche population permet d’arriver – À modéliser la PK/PD à partir de données rares – Dans des populations cibles – À expliquer la variabilité entre les individus – À simuler des comportements du médicaments dans d’autres situations – A envisager une utilisation personnalisée du médicament Hulot J. S.

Contraintes • Mais: – Outil informatique (lourd, expérience) – Définir une cible (concentration, activité, effet) – De connaître les modèles permettant d’obtenir cette cible Hulot J. S.
 Pharmacodynamique
Pharmacodynamique Contreventement fermette
Contreventement fermette Costume traditionnel bourguignon
Costume traditionnel bourguignon Le musique tunisienne
Le musique tunisienne Danse roumaine traditionnelle
Danse roumaine traditionnelle Population ecology section 1 population dynamics
Population ecology section 1 population dynamics Chapter 4 section 1 population dynamics study guide answers
Chapter 4 section 1 population dynamics study guide answers Chapter 4 section 1 population dynamics study guide
Chapter 4 section 1 population dynamics study guide Section 1 population dynamics
Section 1 population dynamics Approche clinique définition
Approche clinique définition Approche par les forces
Approche par les forces Approche par les forces
Approche par les forces Mon anniversaire s'approche
Mon anniversaire s'approche Cmam surge
Cmam surge Approche administrative
Approche administrative Approche actionnelle fle
Approche actionnelle fle Organigramme service maintenance industrielle
Organigramme service maintenance industrielle Approche
Approche Approche index testing
Approche index testing Approche scpd
Approche scpd Gestion axée sur les résultats
Gestion axée sur les résultats Les principes de l'approche communicative
Les principes de l'approche communicative Synoptique toulouse
Synoptique toulouse Bpms definition
Bpms definition Approche transversale psychologie
Approche transversale psychologie Compétence pragmatique anglais
Compétence pragmatique anglais Réforme curriculaire définition
Réforme curriculaire définition Population of brazil
Population of brazil Fish population dynamics and stock assessment
Fish population dynamics and stock assessment Point estimation
Point estimation Sources of population data
Sources of population data Logistic curve method
Logistic curve method Population terminology
Population terminology Description of caste system
Description of caste system Healer personality
Healer personality Répartition population russie
Répartition population russie Whats ukraines religion
Whats ukraines religion Definition of physical distribution
Definition of physical distribution Why population growth is good
Why population growth is good Confidence interval for population mean
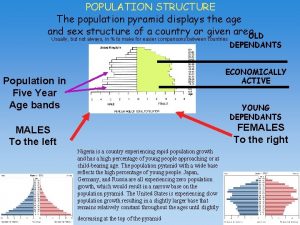
Confidence interval for population mean Types of population pyramids
Types of population pyramids Population trap
Population trap Population pyramids
Population pyramids Key issue 3 why does population growth vary among regions
Key issue 3 why does population growth vary among regions Abiotic or biotic
Abiotic or biotic Us population distribution
Us population distribution How to calculate population density
How to calculate population density Why environmental science is an interdisciplinary science
Why environmental science is an interdisciplinary science Convex population pyramid
Convex population pyramid Population vs community ecology
Population vs community ecology World's population
World's population A population is
A population is Geometric increase method example
Geometric increase method example Population density formula
Population density formula Blackpool population
Blackpool population Hhs office of population affairs
Hhs office of population affairs Population proportion
Population proportion Advantages of sampling
Advantages of sampling Pre reproductive age
Pre reproductive age What is physiological density ap human geography
What is physiological density ap human geography Population health program manager
Population health program manager Volcanic ash
Volcanic ash Population ecologists are primarily interested in
Population ecologists are primarily interested in Europe population in millions
Europe population in millions Population of bondi
Population of bondi Population vs sample
Population vs sample Population intervention comparison outcome
Population intervention comparison outcome Sample regression function (srf)
Sample regression function (srf) Population of cuba
Population of cuba Population pyramid shapes
Population pyramid shapes Population pyramids
Population pyramids Describe the three main properties of a population
Describe the three main properties of a population Sample and population examples
Sample and population examples Confidence interval for population variance formula
Confidence interval for population variance formula Iran population
Iran population Population definition
Population definition Exponential growth equation
Exponential growth equation Population inversion
Population inversion Flow line maps
Flow line maps Population of bassetlaw
Population of bassetlaw New zealand population
New zealand population 600 million
600 million Crossfitness.dk
Crossfitness.dk Ecology vocabulary list
Ecology vocabulary list Rule of 70 in population growth
Rule of 70 in population growth Central tendency of grouped data
Central tendency of grouped data Hypothesis testing for population proportion
Hypothesis testing for population proportion Carrying capacity exponential growth
Carrying capacity exponential growth Comparative graphical method
Comparative graphical method What is europe's population
What is europe's population Attributable risk formula
Attributable risk formula Vietnam population clock
Vietnam population clock Population of limerick
Population of limerick Buffalo county sd population pyramid
Buffalo county sd population pyramid Minimum viable population
Minimum viable population Population genetics
Population genetics Pecan plantation population
Pecan plantation population Physiological density
Physiological density Spain population projections
Spain population projections Newly industrialized country population pyramid
Newly industrialized country population pyramid Under population
Under population Lesson 5 finding one hundred percent
Lesson 5 finding one hundred percent Population mean example
Population mean example Modern synthesis
Modern synthesis 13 colonies timeline
13 colonies timeline Population of argentina
Population of argentina Population decline
Population decline Fertility rate
Fertility rate Beehive population pyramid
Beehive population pyramid Teori populasi dan sampel
Teori populasi dan sampel Percent change
Percent change Population demography definition
Population demography definition Arithmetic population density
Arithmetic population density Population diversity
Population diversity Vocabulary ecology
Vocabulary ecology Spain population
Spain population How to get population mean
How to get population mean Cochran's sample size formula
Cochran's sample size formula Sample population
Sample population Guided reading activity 4-1 world population answer key
Guided reading activity 4-1 world population answer key Chapter 9 the human population section 1
Chapter 9 the human population section 1 What is a population parameter
What is a population parameter Mutualism
Mutualism Human population
Human population Population pyramid stage 1
Population pyramid stage 1 Sea otter population decline
Sea otter population decline Calculating population growth
Calculating population growth Parameters of interest
Parameters of interest The population of smallville in the year 1890 was 6250
The population of smallville in the year 1890 was 6250 Chembakolli population
Chembakolli population Hardy weinberg equilibrium expected values
Hardy weinberg equilibrium expected values Chapter 27 section 1 landforms and resources
Chapter 27 section 1 landforms and resources The population registration act
The population registration act Crude population density
Crude population density Unalaska ak population pyramid
Unalaska ak population pyramid White tiger population graph
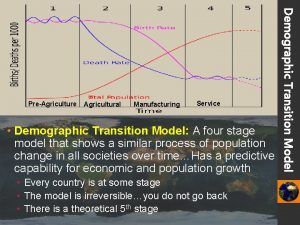
White tiger population graph Autonomous equations and population dynamics
Autonomous equations and population dynamics