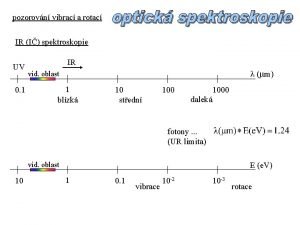
5 Metalle 5 2 der metallische Zustand Intermetallische























































































































- Slides: 150

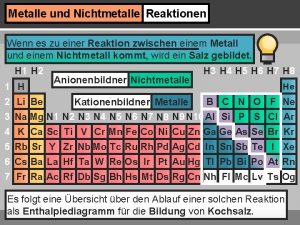
5 Metalle 5. 2 der metallische Zustand Intermetallische Systeme - Ionenverbindungen und kovalente Verbindungen sind meist stöchiometrisch zusammengesetzt - bei Verbindungen zwischen Metallen ist das Gesetz der konstanten Proportionen häufig nicht erfüllt, - die Zusammensetzung kann innerhalb weiter Grenzen schwanken: + Beispiel Messing, Schwankungsbreite von Cu 0, 34 Zn 0, 66 - Cu 0, 42 Zn 0, 58

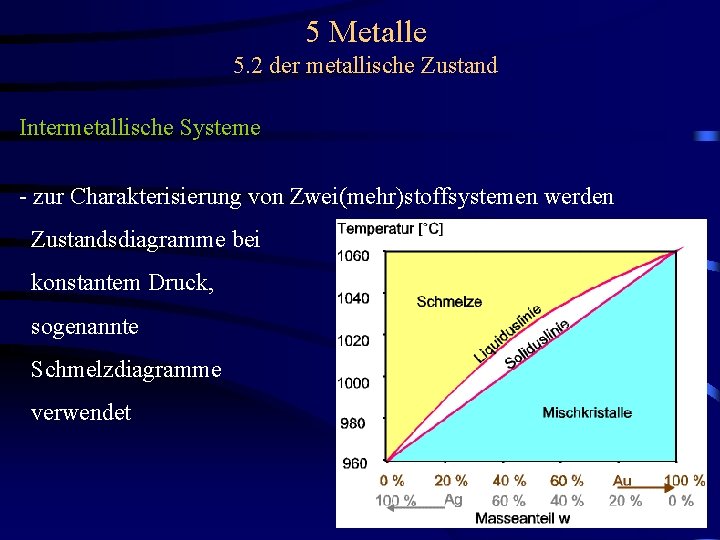
5 Metalle 5. 2 der metallische Zustand Intermetallische Systeme - zur Charakterisierung von Zwei(mehr)stoffsystemen werden Zustandsdiagramme bei konstantem Druck, sogenannte Schmelzdiagramme verwendet

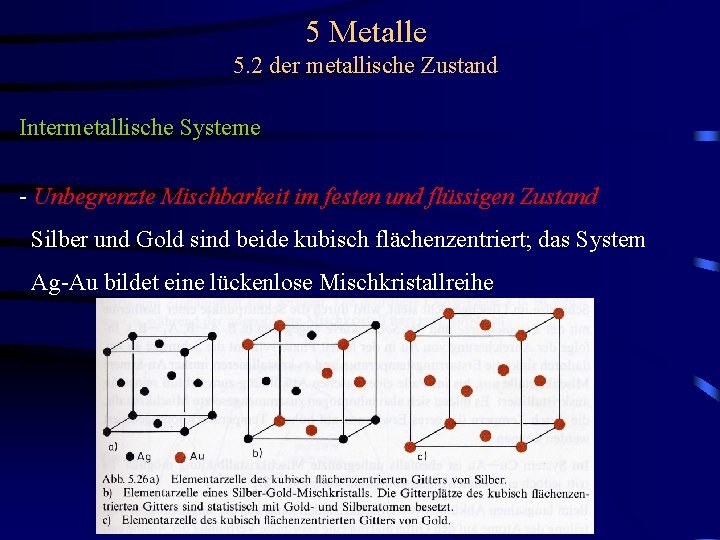
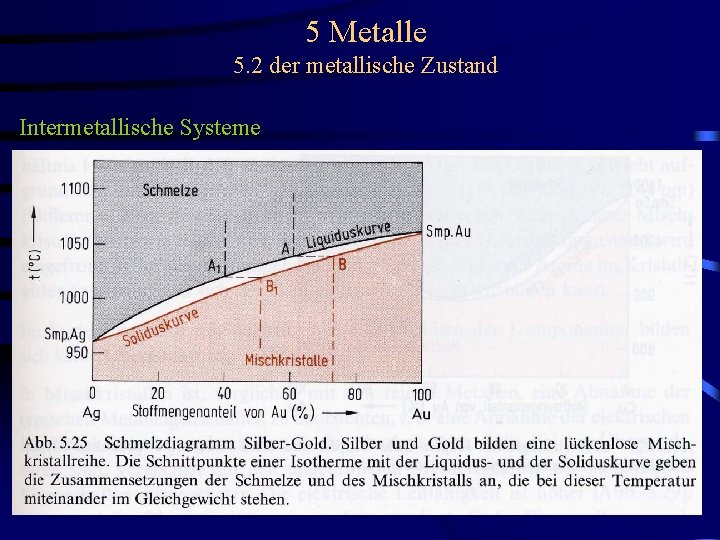
5 Metalle 5. 2 der metallische Zustand Intermetallische Systeme - Unbegrenzte Mischbarkeit im festen und flüssigen Zustand Silber und Gold sind beide kubisch flächenzentriert; das System Ag-Au bildet eine lückenlose Mischkristallreihe

5 Metalle 5. 2 der metallische Zustand Intermetallische Systeme - zur Charakterisierung von Zwei(mehr)stoffsystemen werden Zustandsdiagramme bei konstantem Druck, sogenannte Schmelzdiagramme verwendet

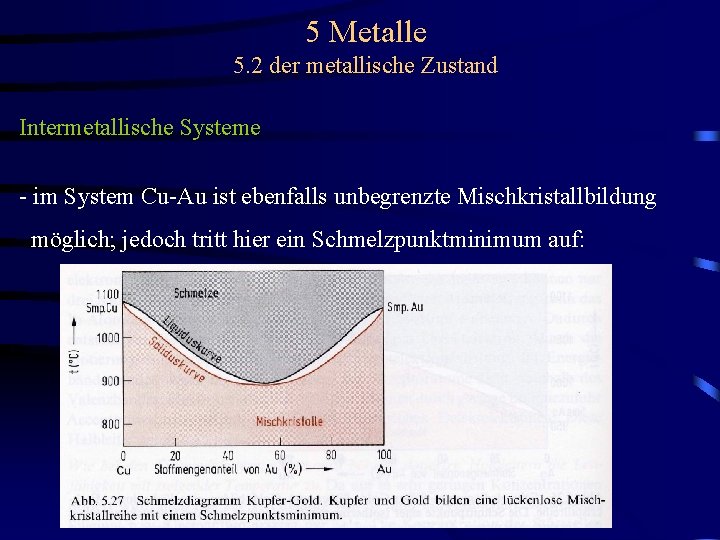
5 Metalle 5. 2 der metallische Zustand Intermetallische Systeme - im System Cu-Au ist ebenfalls unbegrenzte Mischkristallbildung möglich; jedoch tritt hier ein Schmelzpunktminimum auf:

5 Metalle 5. 2 der metallische Zustand Intermetallische Systeme - im System Cu-Au existieren Überstrukturen, die sich durch relativ höhere elektrische Leitfähigkeit auszeichnen:

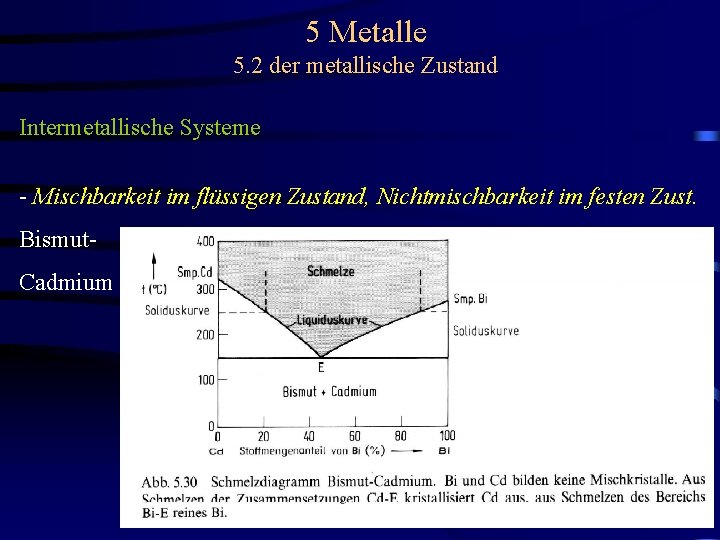
5 Metalle 5. 2 der metallische Zustand Intermetallische Systeme - Mischbarkeit im flüssigen Zustand, Nichtmischbarkeit im festen Zust. Bismut. Cadmium

5 Metalle 5. 2 der metallische Zustand Intermetallische Systeme - unbegrenzte Mischbarkeit im flüssigen Zustand, begrenzte Mischbarkeit im festen Zustand Kupfer. Silber

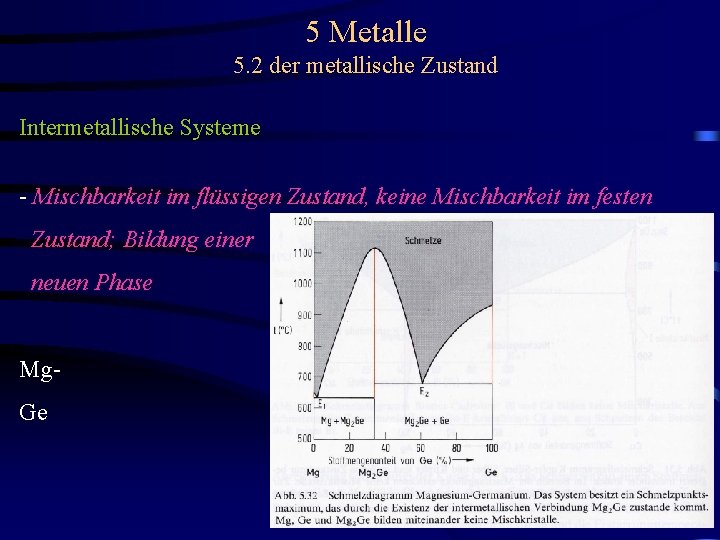
5 Metalle 5. 2 der metallische Zustand Intermetallische Systeme - Mischbarkeit im flüssigen Zustand, keine Mischbarkeit im festen Zustand; Bildung einer neuen Phase Mg. Ge

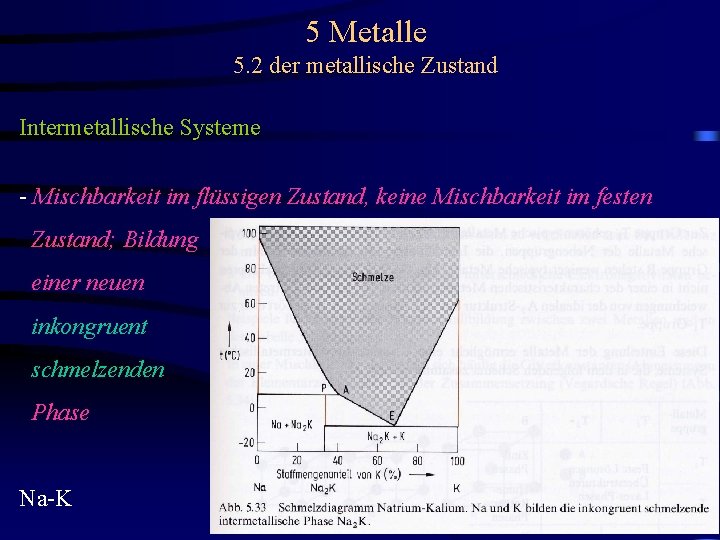
5 Metalle 5. 2 der metallische Zustand Intermetallische Systeme - Mischbarkeit im flüssigen Zustand, keine Mischbarkeit im festen Zustand; Bildung einer neuen inkongruent schmelzenden Phase Na-K

5 Metalle 5. 2 der metallische Zustand Intermetallische Systeme - Nichtmischbarkeit im festen und flüssigen Zustand Eisen-Blei

5 Metalle 5. 2 der metallische Zustand Intermetallische Systeme- häufige intermetallische Phasen - Metalle können ihrer Stellung im PSE nach in 3 Gruppen eingeteilt werden: T 1, T 2 und B

5 Metalle 5. 2 der metallische Zustand Intermetallische Systeme- häufige intermetallische Phasen - Metalle können ihrer Stellung im PSE nach in 3 Gruppen eingeteilt werden: T 1, T 2 und B - hierdurch wird eine Klassifizierung der intermetallischen Systeme möglich:

5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Einleitung - alle Nebengruppenelemente sind Metalle - außer den s-Elektronen der äußersten Schale sind auch d-Elektronen der zweitäußersten Schale an chemischen Bindungen beteiligt - die meisten Ionen haben unvollständig besetzte d-Niveaus

5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Einleitung - alle Nebengruppenelemente sind Metalle - außer den s-Elektronen der äußersten Schale sind auch d-Elektronen der zweitäußersten Schale an chemischen Bindungen beteiligt - die meisten Ionen haben unvollständig besetzte d-Niveaus - Die Ionen sind häufig gefärbt und neigen zur Komplexbildung

5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Einleitung - alle Nebengruppenelemente sind Metalle - außer den s-Elektronen der äußersten Schale sind auch d-Elektronen der zweitäußersten Schale an chemischen Bindungen beteiligt - die meisten Ionen haben unvollständig besetzte d-Niveaus - Die Ionen sind häufig gefärbt und neigen zur Komplexbildung - durch WW paramagnetischer Momente der Ionen kann kollektiver Magnetismus entstehen - viele nichtstöchiometrische Verbindungen

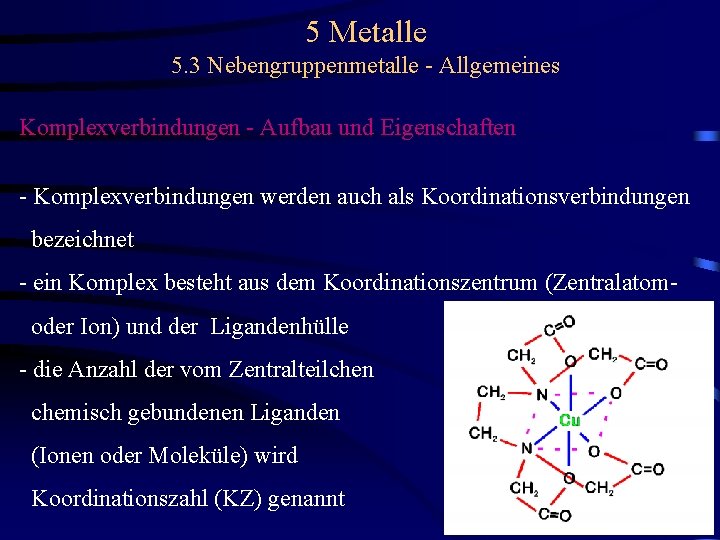
5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - Aufbau und Eigenschaften - Komplexverbindungen werden auch als Koordinationsverbindungen bezeichnet - ein Komplex besteht aus dem Koordinationszentrum (Zentralatomoder Ion) und der Ligandenhülle - die Anzahl der vom Zentralteilchen chemisch gebundenen Liganden (Ionen oder Moleküle) wird Koordinationszahl (KZ) genannt

5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - Aufbau und Eigenschaften - Beispiele für Komplexverbindungen

5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - Aufbau und Eigenschaften - Komplexe sind an ihren typischen Eigenschaften und Reaktionen zu erkennen: + Farbe + elektrolytische Eigenschaften + Ionenreaktionen (z. B. „Maskierung“)

5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - Aufbau und Eigenschaften - Komplexe sind an ihren typischen Eigenschaften und Reaktionen zu erkennen: - Komplexe mit einem Koordinationszentrum sind einkernige Komplexe; mehrkernige Komplexe besitzen mehrere Koordinationszentren:

5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - Aufbau und Eigenschaften - Komplexe sind an ihren typischen Eigenschaften und Reaktionen zu erkennen: - Komplexe mit einem Koordinationszentrum sind einkernige Komplexe; mehrkernige Komplexe besitzen mehrere Koordinationszentren - einzähnige Liganden besetzen im Komplex nur eine Koordinationsstelle, mehrzähnige dagegen mehrere:

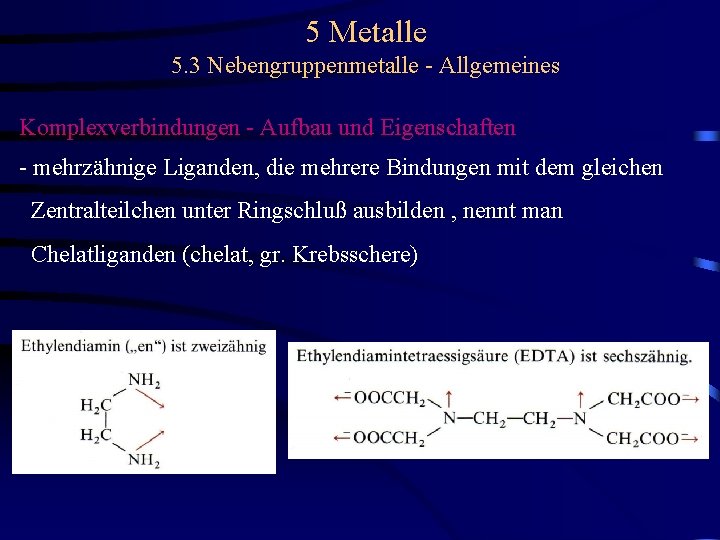
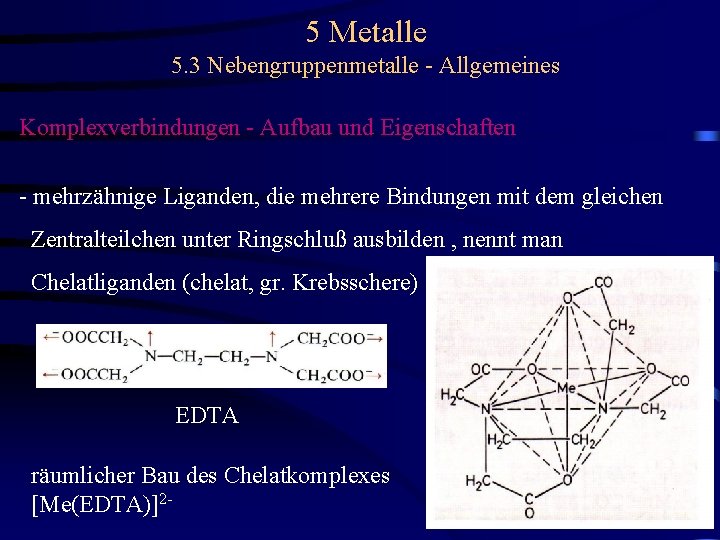
5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - Aufbau und Eigenschaften - mehrzähnige Liganden, die mehrere Bindungen mit dem gleichen Zentralteilchen unter Ringschluß ausbilden , nennt man Chelatliganden (chelat, gr. Krebsschere)

5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - Aufbau und Eigenschaften - mehrzähnige Liganden, die mehrere Bindungen mit dem gleichen Zentralteilchen unter Ringschluß ausbilden , nennt man Chelatliganden (chelat, gr. Krebsschere) EDTA räumlicher Bau des Chelatkomplexes [Me(EDTA)]2 -

5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - Nomenklatur - zuerst wird der Name der Liganden, dann der des Zentralatoms angegeben - anionische Liganden werden durch ein angehängtes o gekennzeichnet

5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - Nomenklatur - zuerst wird der Name der Liganden, dann der des Zentralatoms angegeben - anionische Liganden werden durch ein angehängtes o gekennzeichnet - die Ligandenanzahl wird mit den griechischen Präfixen mono, di, tri, tetra, penta, hexa, hepta, octa bezeichnet:

5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - Nomenklatur - zuerst wird der Name der Liganden, dann der des Zentralatoms angegeben - anionische Liganden werden durch ein angehängtes o gekennzeichnet - die Ligandenanzahl wird mit den griechischen Präfixen mono, di, tri, tetra, penta, hexa, hepta, octa bezeichnet - in negativ geladenen Komplexen endet der Name auf -at:

5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - Nomenklatur - zuerst wird der Name der Liganden, dann der des Zentralatoms angegeben - anionische Liganden werden durch ein angehängtes o gekennzeichnet - die Ligandenanzahl wird mit den griechischen Präfixen mono, di, tri, tetra, penta, hexa, hepta, octa bezeichnet - in negativ geladenen Komplexen endet der Name auf -at: - bei verschiedenen Liganden ist die Reihenfolge alphabetisch:

5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - räumlicher Bau, Stereoisomerie - häufige Kordinationszahlen in Komplexen sind 2, 4 und 6 - die räumliche Anordnung ist dann linear (2), tetraedrisch oder quadratisch-planar (4) und oktaedrisch (6) - für die meisten Komplexe gibt es bei wechselnden Liganden Komplexe mit unterschiedlicher Koordination + z. B. kann Ni 2+ oktaedrisch, tetraedrisch und quadratisch-planar koordiniert sein

5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - räumlicher Bau, Stereoisomerie - für die meisten Komplexe gibt es bei wechselnden Liganden Komplexe mit unterschiedlicher Koordination + z. B. kann Ni 2+ oktaedrisch, tetraedrisch und quadratisch-planar koordiniert sein - andere Ionen bevorzugen dagegen bestimmte Koordinationen: + Cr 3+, Co 3+ und Pt 4+ die oktaedrische, + Pt 2+ und Pd 2+ die quadratisch-planare und + Ag+, Cu+ und Au+ die lineare Koordination

5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Komplexverbindungen räumlicher Bau, Stereoisomerie

5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Komplexverbindungen räumlicher Bau, Stereoisomerie

5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Komplexverbindungen räumlicher Bau, Stereoisomerie

5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Komplexverbindungen räumlicher Bau, Stereoisomerie

5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - räumlicher Bau, Stereoisomerie - Komplexe, dieselbe chemische Zusammensetzung und Ladung, aber einen verschiedenen räumlichen Aufbau haben, sind stereoisomer - man unterscheidet die folgenden Arten der Stereoisomerie:

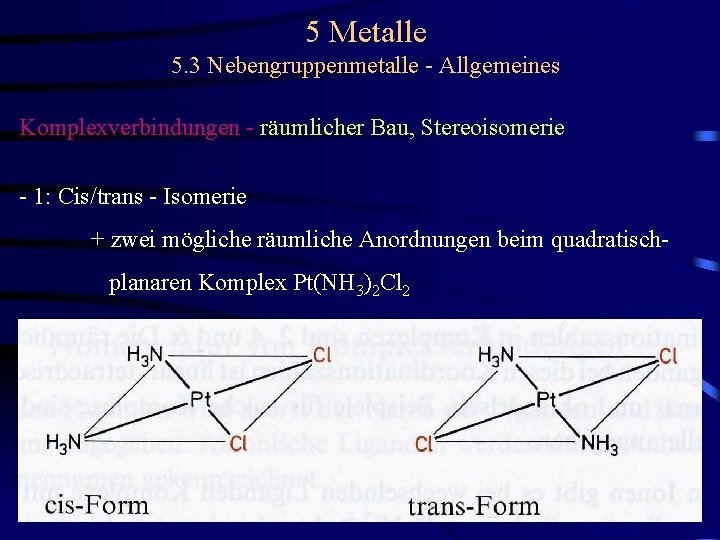
5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - räumlicher Bau, Stereoisomerie - 1: Cis/trans - Isomerie + zwei mögliche räumliche Anordnungen beim quadratischplanaren Komplex Pt(NH 3)2 Cl 2

5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - räumlicher Bau, Stereoisomerie - 1: Cis/trans - Isomerie + auch möglich bei oktaedrischen Komplexen; Beispiel [Cr(NH 3)4 Cl 2]+

5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - räumlicher Bau, Stereoisomerie - 1: Cis/trans - Isomerie + zwei mögliche räumliche Anordnungen beim quadratischplanaren Komplex Pt(NH 3)2 Cl 2 + auch möglich bei oktaedrischen Komplexen; Beispiel [Cr(NH 3)4 Cl 2]+ + bei tetraedrischen Komplexen ist keine cis/trans-Isom. mögl.

5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - räumlicher Bau, Stereoisomerie - 2: Optische Isomerie (Spiegelbildisomerie) + bei tetraedrischer Koordination mit 4 verschiedenen Liganden treten zwei Formen auf, die sich nicht zur Deckung bringen lassen

5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - räumlicher Bau, Stereoisomerie - 2: Optische Isomerie (Spiegelbildisomerie) + bei tetraedrischer Koordination mit 4 verschiedenen Liganden treten zwei Formen auf, die sich nicht zur Deckung bringen lassen

5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - räumlicher Bau, Stereoisomerie - 2: Optische Isomerie (Spiegelbildisomerie) + bei tetraedrischer Koordination mit 4 verschiedenen Liganden treten zwei Formen auf, die sich nicht zur Deckung bringen lassen

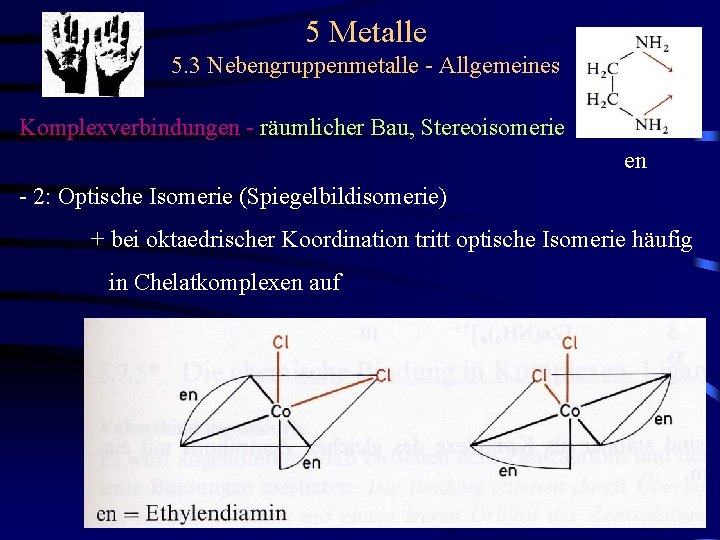
5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - räumlicher Bau, Stereoisomerie en - 2: Optische Isomerie (Spiegelbildisomerie) + bei oktaedrischer Koordination tritt optische Isomerie häufig in Chelatkomplexen auf

5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - räumlicher Bau, Stereoisomerie - 2: Optische Isomerie (Spiegelbildisomerie) + bei tetraedrischer Koordination mit 4 versch. Liganden treten zwei Formen auf, die sich nicht zur Deckung bringen lassen + bei oktaedrischer Koordination tritt optische Isomerie häufig in Chelatkomplexen auf + optische Isomere bezeichnet man auch als enantiomorph oder enantiomer; sie besitzen bis auf eine Ausnahme gleiche phys. Eigenschaften: Polarisiertes Licht wird entgegenges. gedreht

5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - räumlicher Bau, Stereoisomerie - 3: Salzisomerie + tritt auf, wenn Liganden wie CN- oder NO 2 - durch verschiedene Atome an das Zentralteilchen gebunden sind Beispiel:

5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - räumlicher Bau, Stereoisomerie - 4: Koordinationsisomerie + tritt auf bei Verbindungen, bei denen Anionen und Kationen Komplexe sind: Beispiel:

5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - räumlicher Bau, Stereoisomerie - 5: Ionenisomerie + in einer Verbindung kann ein Ion als Ligand im Komplex oder außerhalb des Komplexes gebunden sein: Beispiel: + ein spezieller Fall der Ionenisomerie ist die Hydratisomerie:

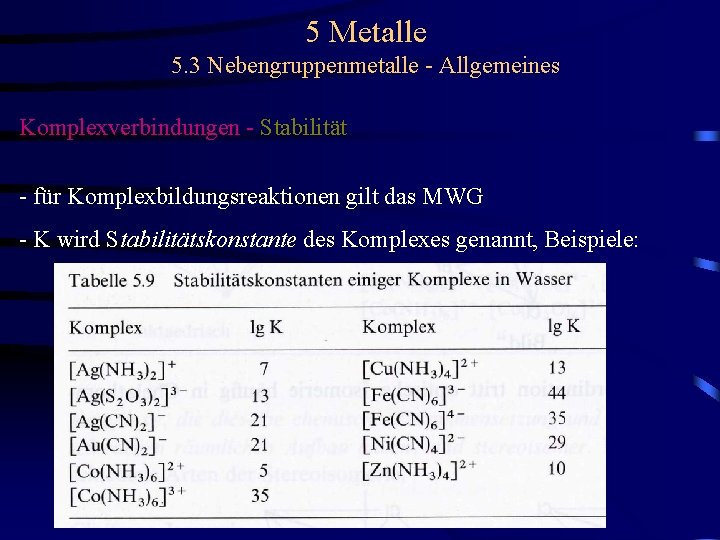
5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - Stabilität - für Komplexbildungsreaktionen gilt das MWG: - K wird Stabilitätskonstante des Komplexes genannt

5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Komplexverbindungen - Stabilität - für Komplexbildungsreaktionen gilt das MWG - K wird Stabilitätskonstante des Komplexes genannt, Beispiele:

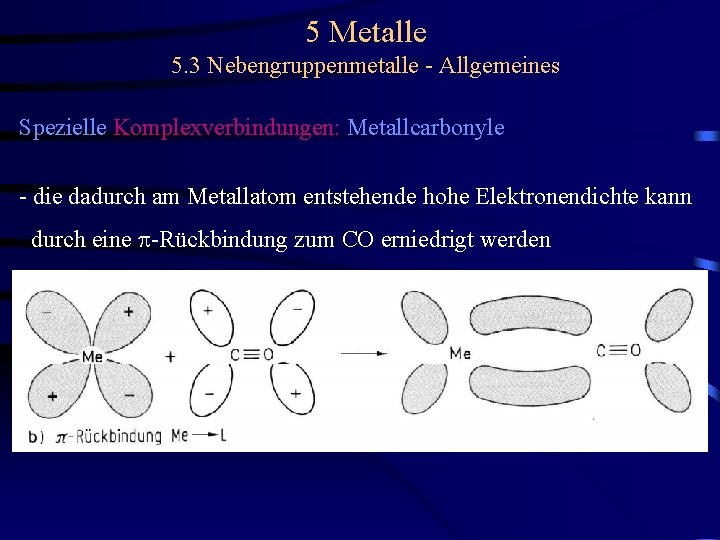
5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Spezielle Komplexverbindungen: Metallcarbonyle - Kohlenmonoxid bildet mit dem einsamen Elektronenpaar am Kohlenstoffatom eine dative s-Bindung Ligand Metall

5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Spezielle Komplexverbindungen: Metallcarbonyle - die dadurch am Metallatom entstehende hohe Elektronendichte kann durch eine p-Rückbindung zum CO erniedrigt werden

5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Spezielle Komplexverbindungen: Metallcarbonyle - Kohlenmonoxid bildet mit dem einsamen Elektronenpaar am Kohlenstoffatom eine dative s-Bindung Ligand Metall - die dadurch am Metallatom entstehende hohe Elektronendichte kann durch eine p-Rückbindung zum CO erniedrigt werden - die resultierende Bindung besitzt zwei mesomere Formeln

5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Spezielle Komplexverbindungen: Metallcarbonyle - die Zusammensetzung der meisten Carbonyle kann mit der 18 -Elektronenregel (Edelgasregel) vorhergesagt werden: + Anzahl der Valenzelektronen des Metallatoms + Anzahl der von den Liganden für s-Bindungen stammenden Elektronen = 18 + es wird die Valenzelektronenkonfiguration des nächsthöheren Edelgases erreicht

5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Spezielle Komplexverbindungen: Metallcarbonyle - die Zusammensetzung der meisten Carbonyle kann mit der 18 -Elektronenregel (Edelgasregel) vorhergesagt werden:

5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Spezielle Komplexverbindungen: Metallcarbonyle - die Zusammensetzung der meisten Carbonyle kann mit der 18 -Elektronenregel (Edelgasregel) vorhergesagt werden - die kristallinen Carbonyle sublimieren im Vakuum - die bei RT flüssigen Carbonyle sind flüchtig, leicht entzündlich und sehr giftig!

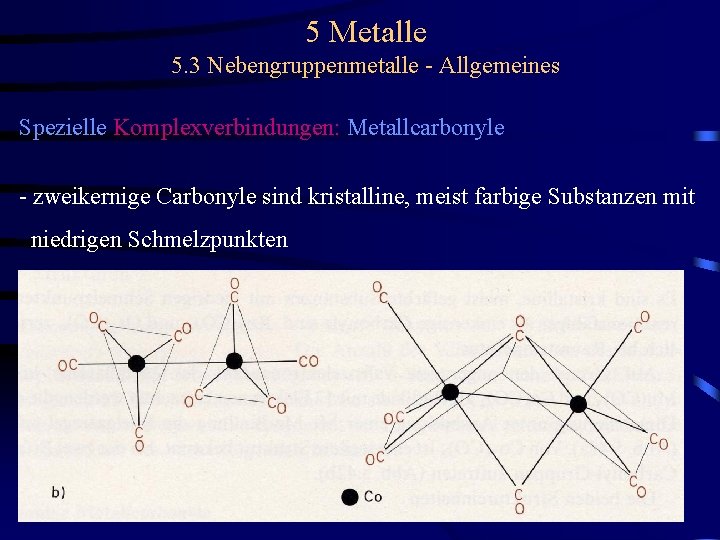
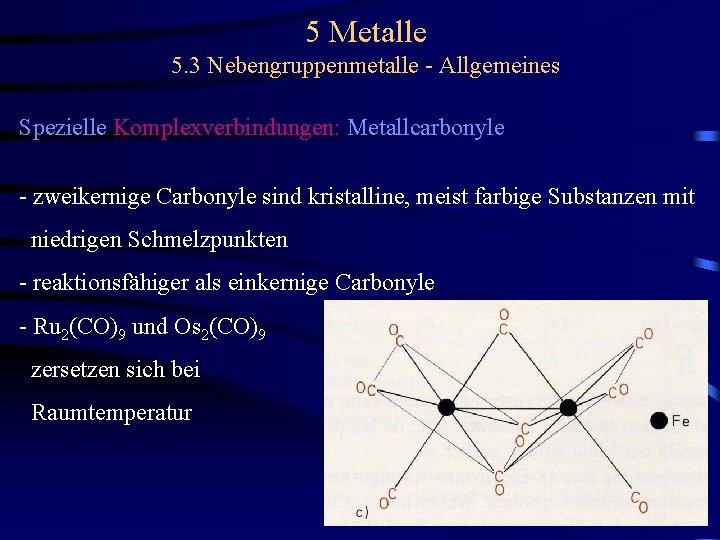
5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Spezielle Komplexverbindungen: Metallcarbonyle - zweikernige Carbonyle sind kristalline, meist farbige Substanzen mit niedrigen Schmelzpunkten - reaktionsfähiger als einkernige Carbonyle - Ru 2(CO)9 und Os 2(CO)9 zersetzen sich bei Raumtemperatur

5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Spezielle Komplexverbindungen: Metallcarbonyle - zweikernige Carbonyle sind kristalline, meist farbige Substanzen mit niedrigen Schmelzpunkten

5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Spezielle Komplexverbindungen: Metallcarbonyle - zweikernige Carbonyle sind kristalline, meist farbige Substanzen mit niedrigen Schmelzpunkten - reaktionsfähiger als einkernige Carbonyle - Ru 2(CO)9 und Os 2(CO)9 zersetzen sich bei Raumtemperatur - wenige mehrkernige Carbonyle sind existent: + Me 3(CO)12 Me = Fe, Ru, Os + sie sind ebenfalls farbig, zersetzlich und sublimierbar

5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Spezielle Komplexverbindungen: Metallcarbonyle - zweikernige Carbonyle sind kristalline, meist farbige Substanzen mit niedrigen Schmelzpunkten - reaktionsfähiger als einkernige Carbonyle - Ru 2(CO)9 und Os 2(CO)9 zersetzen sich bei Raumtemperatur

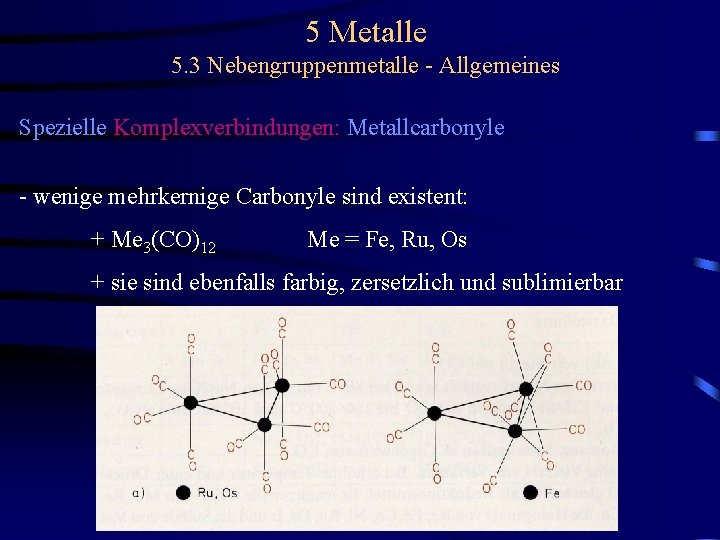
5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Spezielle Komplexverbindungen: Metallcarbonyle - wenige mehrkernige Carbonyle sind existent: + Me 3(CO)12 Me = Fe, Ru, Os + sie sind ebenfalls farbig, zersetzlich und sublimierbar

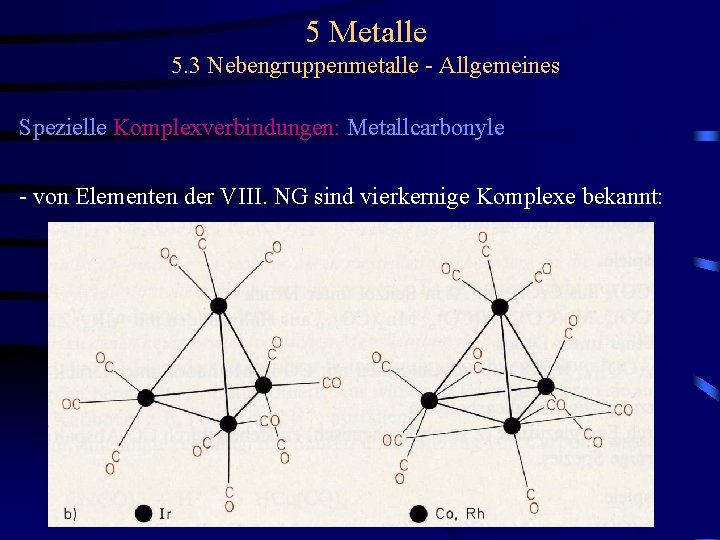
5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Spezielle Komplexverbindungen: Metallcarbonyle - von Elementen der VIII. NG sind vierkernige Komplexe bekannt:

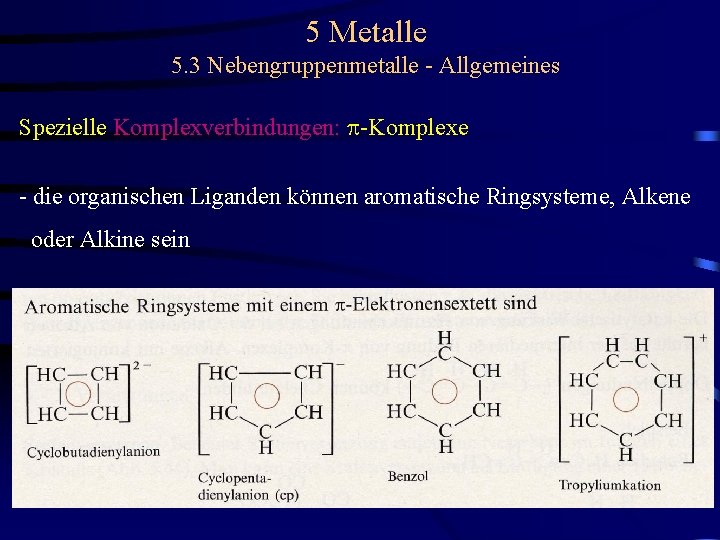
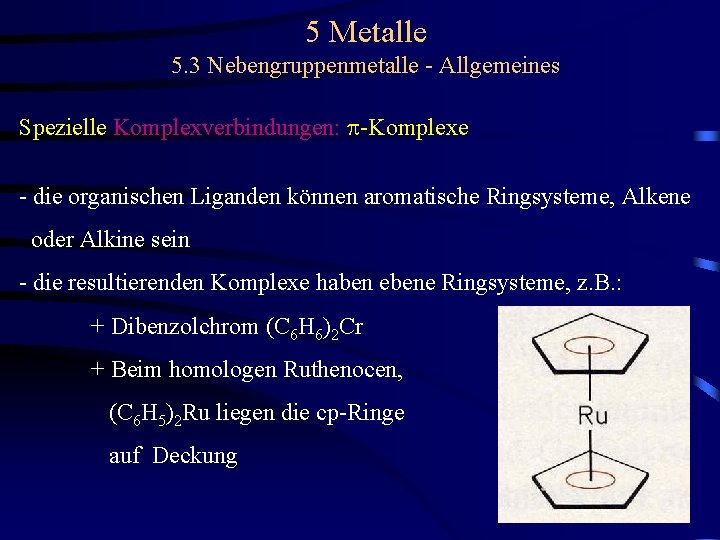
5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Spezielle Komplexverbindungen: p-Komplexe - die Bindung Ligand Metall wird bei diesen Komplexen von den p-Elektronen organischer Verbindungen errichtet. - wie bei den Metallcarbonylen werden auch diese komplexe durch eine p-Rückbindung stabilisiert - die organischen Liganden können aromatische Ringsysteme, Alkene oder Alkine sein

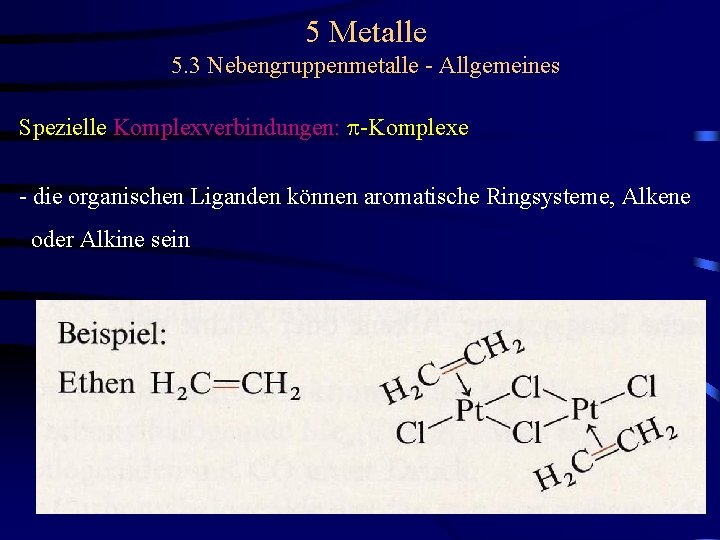
5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Spezielle Komplexverbindungen: p-Komplexe - die organischen Liganden können aromatische Ringsysteme, Alkene oder Alkine sein

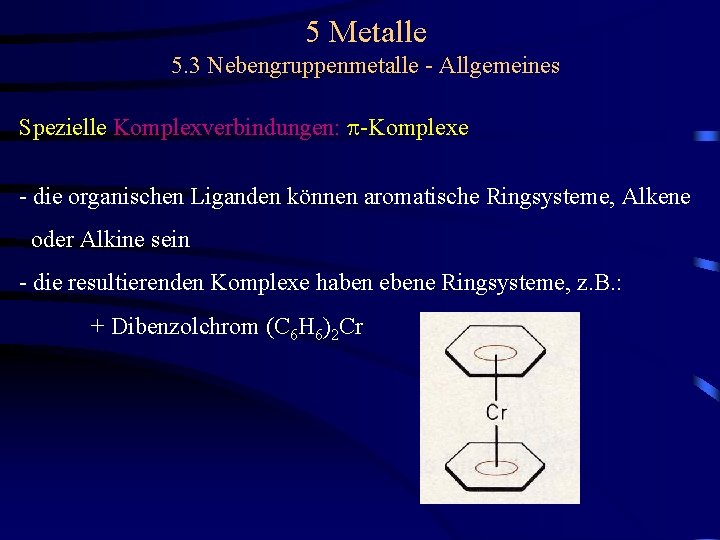
5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Spezielle Komplexverbindungen: p-Komplexe - die organischen Liganden können aromatische Ringsysteme, Alkene oder Alkine sein - die resultierenden Komplexe haben ebene Ringsysteme, z. B. : + Dibenzolchrom (C 6 H 6)2 Cr

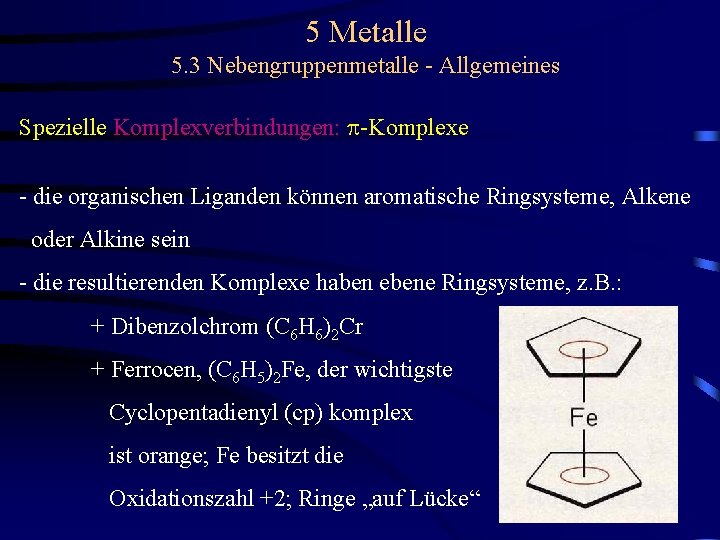
5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Spezielle Komplexverbindungen: p-Komplexe - die organischen Liganden können aromatische Ringsysteme, Alkene oder Alkine sein - die resultierenden Komplexe haben ebene Ringsysteme, z. B. : + Dibenzolchrom (C 6 H 6)2 Cr + Ferrocen, (C 6 H 5)2 Fe, der wichtigste Cyclopentadienyl (cp) komplex ist orange; Fe besitzt die Oxidationszahl +2; Ringe „auf Lücke“

5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Spezielle Komplexverbindungen: p-Komplexe - die organischen Liganden können aromatische Ringsysteme, Alkene oder Alkine sein - die resultierenden Komplexe haben ebene Ringsysteme, z. B. : + Dibenzolchrom (C 6 H 6)2 Cr + Beim homologen Ruthenocen, (C 6 H 5)2 Ru liegen die cp-Ringe auf Deckung

5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Spezielle Komplexverbindungen: p-Komplexe - die organischen Liganden können aromatische Ringsysteme, Alkene oder Alkine sein

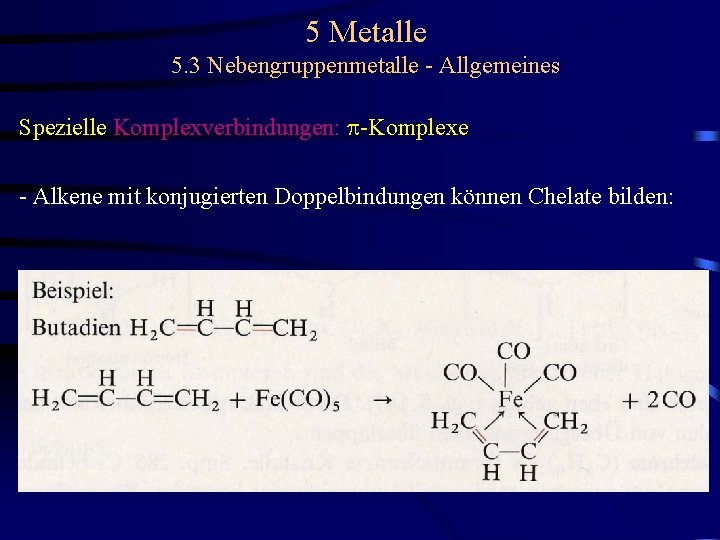
5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Spezielle Komplexverbindungen: p-Komplexe - die organischen Liganden können aromatische Ringsysteme, Alkene oder Alkine sein - die katalytische Wirkung von Platinverbindungen bei der Oxidation von Alkenen beruht auf der intermediären Bildung von p-Komplexen - Alkene mit konjugierten Doppelbindungen können Chelate bilden:

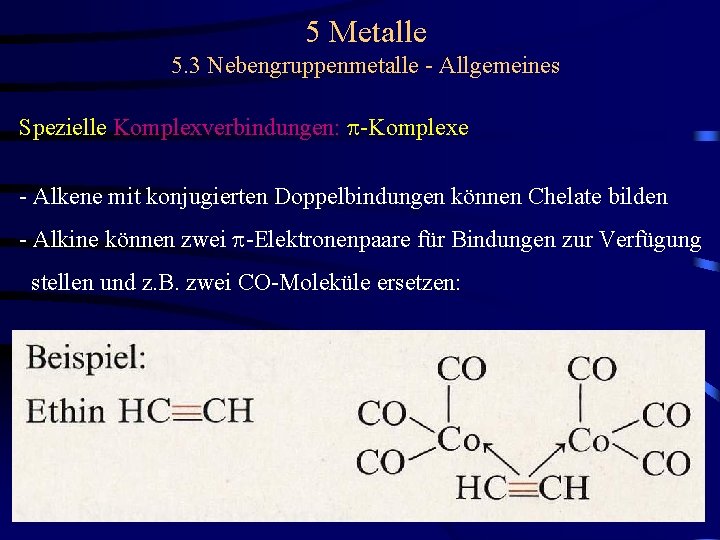
5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Spezielle Komplexverbindungen: p-Komplexe - Alkene mit konjugierten Doppelbindungen können Chelate bilden:

5 Metalle 5. 3 Nebengruppenmetalle - Allgemeines Spezielle Komplexverbindungen: p-Komplexe - Alkene mit konjugierten Doppelbindungen können Chelate bilden - Alkine können zwei p-Elektronenpaare für Bindungen zur Verfügung stellen und z. B. zwei CO-Moleküle ersetzen:

5 Metalle 5. 4 die 1. Nebengruppe Gruppeneigenschaften Cu

5 Metalle 5. 4 die 1. Nebengruppe Gruppeneigenschaften Ag Cu

5 Metalle 5. 4 die 1. Nebengruppe Gruppeneigenschaften Ag Cu Au

5 Metalle 5. 4 die 1. Nebengruppe Gruppeneigenschaften -

5 Metalle 5. 4 die 1. Nebengruppe Gruppeneigenschaften - die Metalle der 1. NG werden auch als Münzmetalle bezeichnet - aufgrund der Elektronenkonfiguration Auftreten in der Ox-stufe +1, daneben auch +2 und +3 möglich, seltener +4, +5 - stabilste Ox-stufen für Cu +2, für Ag +1, für Au +3 - zu den Alkalimetallen besteht nur formale Ähnlichkeit : d 10 - Konfiguration schirmt Kernladung nicht so wirkungsvoll ab wie eine Edelgaskonfiguration, daher Ionisierungsenergien größer edlerer Charakter

5 Metalle 5. 4 die 1. Nebengruppe die Elemente - Cu - alle Münzmetalle kristallisieren kubisch-flächenzentriert mit hohen Schmelzpunkten - Kupfer ist hellrot, zäh und dehnbar - Cu besitzt nach Ag die höchste elektrische Leitfähigkeit

5 Metalle 5. 4 die 1. Nebengruppe die Elemente - Cu - alle Münzmetalle kristallisieren kubisch-flächenzentriert mit hohen Schmelzpunkten - Kupfer ist hellrot, zäh und dehnbar - Cu besitzt nach Ag die höchste elektrische Leitfähigkeit - mit Sauerstoff bildet sich an der Oberfläche eine fest haftende Schicht von Cu 2 O

5 Metalle 5. 4 die 1. Nebengruppe die Elemente - Cu - mit Sauerstoff bildet sich an der Oberfläche eine fest haftende Schicht von Cu 2 O - an CO 2 - und SO 3 - haltiger Luft bilden sich fest haftende Deckschichten von basischem Carbonat Cu 2 CO 3(OH)2 und Cu 2 SO 4(OH)2

5 Metalle 5. 4 die 1. Nebengruppe die Elemente - Cu - mit Sauerstoff bildet sich an der Oberfläche eine fest haftende Schicht von Cu 2 O - an CO 2 - und SO 3 - haltiger Luft bilden sich fest haftende Deckschichten von basischem Carbonat Cu 2 CO 3(OH)2 und Cu 2 SO 4(OH)2 - Cu ist toxisch für niedere Organismen (Bakterien, Algen, Pilze „Hausmittel“ Pfennig in Blumenvase, Kupfernagel in Nachbars Baum)

5 Metalle 5. 4 die 1. Nebengruppe die Elemente - Cu wird von konz. Schwefelsäure und Salpetersäure, nicht aber von Salzsäure gelöst

5 Metalle 5. 4 die 1. Nebengruppe die Elemente - Cu ist ein recht häufiges Metall, am häufigsten sind Sulfide - wichtige Kupfermineralien sind Kupferkies Cu. Fe. S 2, Kupferglanz Cu 2 S, Bornit Cu 5 Fe. S 4, Covellin Cu. S, Rotkupfererz Cu 2 O, Malachit Cu 2(OH)2 CO 3, Azurit Cu 3(OH)2(CO 3)2

5 Metalle 5. 4 die 1. Nebengruppe die Elemente - Cu - Ausgangspunkt der Kupferherstellung ist der Kupferkies Cu. Fe. S 2 - zunächst wird der Eisenanteil in das Oxid überführt - danach erfolgt eine Röst-Reaktion

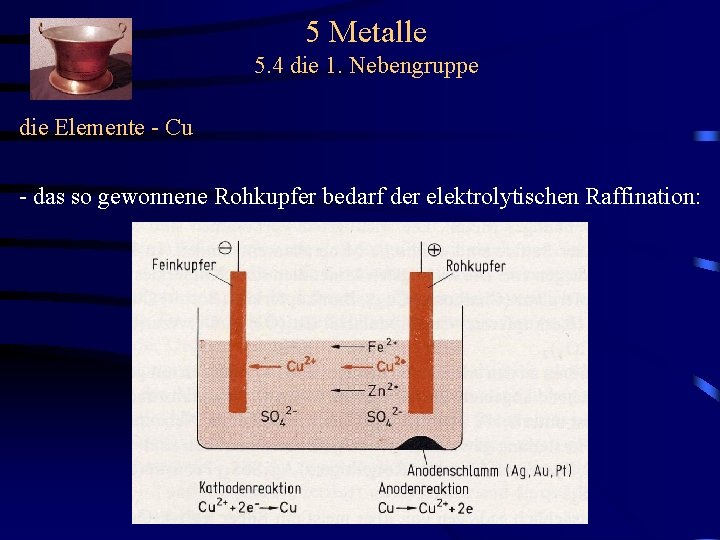
5 Metalle 5. 4 die 1. Nebengruppe die Elemente - Cu - das so gewonnene Rohkupfer bedarf der elektrolytischen Raffination:

5 Metalle 5. 4 die 1. Nebengruppe die Elemente - Cu - das so gewonnene Rohkupfer bedarf der elektrolytischen Raffination - nach Eisen und Aluminium ist Kupfer das wichtigste Gebrauchsmetall - breite Verwendung aufgrund hoher thermischer (Wärmetauscher) und elektrischer (Elektroindustrie) Leitfähigkeit sowie der guten Korrosionsbeständigkeit (Schiffbau, chemischer Apparatebau, Braukessel)

5 Metalle 5. 4 die 1. Nebengruppe die Elemente - Cu - wichtige Kupferlegierungen sind Messing (Cu-Zn)

5 Metalle 5. 4 die 1. Nebengruppe die Elemente - Cu - wichtige Kupferlegierungen sind Messing (Cu-Zn) , Bronze (Cu-Sn)

5 Metalle 5. 4 die 1. Nebengruppe die Elemente - Cu - wichtige Kupferlegierungen sind Messing (Cu-Zn) , Bronze (Cu-Sn) oder Neusilber (Alpaka, 60% Cu, 20% Ni, 20% Zn)

5 Metalle 5. 4 die 1. Nebengruppe die Elemente - Ag - Silber ist ein weißglänzendes, weiches, dehnbares Metall - es besitzt die höchste thermische und elektrische Leitfähigkeit aller Metalle

5 Metalle 5. 4 die 1. Nebengruppe die Elemente - Ag - Silber ist ein weißglänzendes, weiches, dehnbares Metall - es besitzt die höchste thermische und elektrische Leitfähigkeit aller Metalle - wird von O 2 nicht angegriffen - mit H 2 S bildet sich in Gegenwart von Sauerstoff schwarzes Ag 2 S

5 Metalle 5. 4 die 1. Nebengruppe die Elemente - Ag wird nur von oxidierenden Säuren wie Salpetersäure und konz. Schwefelsäure gelöst - in Gegenwart von O 2 löst es sich auch unter Komplexbildung in Cyanidlösungen - Silber ist wie Cu für Mikroorganismen toxisch; Silbersalze finden bei der Wassersterilisation Verwendung

5 Metalle 5. 4 die 1. Nebengruppe die Elemente - Ag (Silber) gehört wie Au (Gold) zu den seltenen Elementen, Lagerstätten mit gediegenem Silber sind weitgehend abgebaut

5 Metalle 5. 4 die 1. Nebengruppe die Elemente - Ag (Silber) gehört wie Au (Gold) zu den seltenen Elementen, Lagerstätten mit gediegenem Silber sind weitgehend abgebaut - in sulfidischen Erzen ist Ag - meist unter 0, 1% - enthalten; daher wird Ag als Nebenprodukt bei der Pb- und Cu-Herstellung gewonnen - wichtige Silbermineralien sind Silberglanz (Argentit) Ag 2 S, Pyrargyrit Ag 3 Sb. S 3 und Proustit Ag 3 As. S 3

5 Metalle 5. 4 die 1. Nebengruppe die Elemente - Ag - Silber fällt als Nebenprodukt bei der Kupferraffination an - aus seinen Erzen wird Silber durch Cyanidlaugerei gewonnen:

5 Metalle 5. 4 die 1. Nebengruppe die Elemente - Ag - Silber ist für die meisten Verwendungen zu weich, daher wird es für den Gebrauch legiert (Ag-Gehalt wird auf 1000 Gewichtsteile bez. ) - Verwendungen: + Münzen + Versilberungen + Elektronik

5 Metalle 5. 4 die 1. Nebengruppe die Elemente - Ag - Silber ist für die meisten Verwendungen zu weich, daher wird es für den Gebrauch legiert (Ag-Gehalt wird auf 1000 Gewichtsteile bez. ) - Verwendungen: + Spiegel + Gebrauchsgegenstände + Fotoindustrie

5 Metalle 5. 4 die 1. Nebengruppe die Elemente - Au - Gold ist „goldgelb“, das geschmeidigste und duktilste Metall + zu einer Dicke von 0, 00001 mm auswalzbar! - 70% der Leitfähigkeit des Silbers - chemisch inert, wird nur von Königswasser und in GG von O 2 von CN- angegriffen Gold + HCl Königswasser

5 Metalle 5. 4 die 1. Nebengruppe die Elemente - Au - Gold kommt hauptsächlich gediegen vor, aber meist mit Ag legiert - Gold in Primärlagerstätten heißt Berggold Goldnugget, AUS

5 Metalle 5. 4 die 1. Nebengruppe die Elemente - Au - Gold kommt hauptsächlich gediegen vor, aber meist mit Ag legiert - Gold in Primärlagerstätten heißt Berggold - Nach Gesteinsverwitterung weggeschmemmtes Gold lagert sich im Flußsand in Form von Goldstaub oder Goldkörnern als Seifenoder Waschgold ab und kann dort durch „Waschen“ gewonnen werden

5 Metalle 5. 4 die 1. Nebengruppe die Elemente - Au - Nach Gesteinsverwitterung weggeschmemmtes Gold lagert sich im Flußsand in Form von Goldstaub oder Goldkörnern als Seifenoder Waschgold ab und kann dort durch „Waschen“ gewonnen werden Altertum, l. Rheingoldwäscher, r.

5 Metalle 5. 4 die 1. Nebengruppe die Elemente - Au - Nach Gesteinsverwitterung weggeschmemmtes Gold lagert sich im Flußsand in Form von Goldstaub oder Goldkörnern als Seifenoder Waschgold ab und kann dort durch „Waschen“ gewonnen werden Brasilien, l. Ekuador, r.

5 Metalle 5. 4 die 1. Nebengruppe die Elemente - Au - aus seinen Erzen wird Gold wie Silber durch Cyanidlaugerei gew. - beim Amalgamverfahren wird aus feingemahlenem Gestein Gold mit Quecksilber als Amalgam abgetrennt, das Hg wird danach destillativ abgetrennt - Effektivität bei der Cyanidlaugerei 95 %, beim Amalgamverfahren 65 % - Au entsteht als Nebenprodukt der Pb- oder Cu-Herstellung Umweltrisiken der Cyanidlaugerei hier die vergiftete Theis (H/ROM)

5 Metalle 5. 4 die 1. Nebengruppe die Elemente - Au - Gold findet Verwendung als Münz- (meist mit 10% Cu) oder als Schmuckmetall

5 Metalle 5. 4 die 1. Nebengruppe die Elemente - Au - Gold findet Verwendung als Münz- (meist mit 10% Cu) oder als Schmuckmetall, der Au-Gehalt wird auf 1000 Gewichtsteile bezogen oder in „Karat“ ausgedrückt: 24 Karat 100 % Au 18 Karat 75 % Au, 750 er Gold - Au wird ebenso wie Ag in der Elektronik verwendet - Weißgold ist eine Legierung mit Cu, Ni, Ag (1/4 bis 1/3 Au)

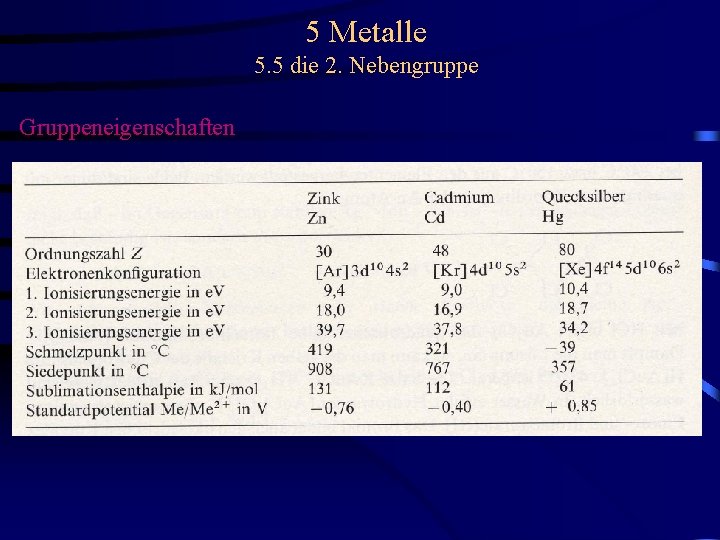
5 Metalle 5. 5 die 2. Nebengruppe Gruppeneigenschaften

5 Metalle 5. 5 die 2. Nebengruppe Gruppeneigenschaften Zn

5 Metalle 5. 5 die 2. Nebengruppe Gruppeneigenschaften Cd Zn

5 Metalle 5. 5 die 2. Nebengruppe Gruppeneigenschaften Cd Zn Hg

5 Metalle 5. 5 die 2. Nebengruppe Gruppeneigenschaften

5 Metalle 5. 5 die 2. Nebengruppe Gruppeneigenschaften - alle Elemente treten in der Oxadationsstufe +2 auf - Verbindungen höherer Oxidationsstufen sind bisher nicht isoliert worden - die Oxidationsstufe +1 ist nur für Hg von Bedeutung (als Hg 22+) - die Elemente bilden nur Verbdg. mit voll besetzten Unterschalen keine Übergangselemente - die Ionen Me 2+ und Hg 22+ sind daher farblos - ähnlich den Übergangselemente gibt es jedoch mit Ausnahme von Carbonylen zahlreiche Komplexe

5 Metalle 5. 5 die 2. Nebengruppe Gruppeneigenschaften - Zink und Cadmium sind sich chemisch recht ähnlich, Hg ist edler - Hg 22+ ist stärker polarisierbar und bildet kovalente Verbindungen - analoge Zn- und Cd- Verbdg. sind besser löslich als die Hg-Verbdg. - Hg 22+ - Komplexe sind stabiler als die von Zn 2+ und Cd 2+ - Zn 2+ - Ionen sind tetraedrisch- Cd 2+ - Ionen oktaedrisch koordiniert - für Hg(II) ist (ähnlich Cu(I), Ag(I) und Au(I)) die lineare Koordination typisch - geringe Ähnlichkeit zu Elementen der 2. HG (Ausn. Zn 2+ Mg 2+ )

5 Metalle 5. 5 die 2. Nebengruppe die Elemente - Zn - Zink ist ein bläulich - weißes Metall; hochrein ist es duktil - oberhalb 200 °C und verunreinigt ist es spröde - der Dampf besteht aus Zn - Atomen - Zn ist ein unedles Metall alchemistisches Symbol

5 Metalle 5. 5 die 2. Nebengruppe die Elemente - Zn - Zink ist ein bläulich - weißes Metall; hochrein ist es duktil - oberhalb 200 °C und verunreinigt ist es spröde - der Dampf besteht aus Zn - Atomen - Zn ist ein unedles Metall, - jedoch wird es durch Schutzschichten aus Oxid, Carbonat bzw. Hydroxid passiviert - Zn löst sich auch in Laugen (amphoter) unter Wasserstoffentwicklung und Bildung von Hydroxokomplexen

5 Metalle 5. 5 die 2. Nebengruppe die Elemente - Zn - Zink kommt in der Natur nicht elementar vor - die wichtigsten Zinkerze sind Zinkblende Zn. S und Zinkspat Zn. CO 3 Zinkblende Zinkspat

5 Metalle 5. 5 die 2. Nebengruppe die Elemente - Zn - Zink kommt in der Natur nicht elementar vor - die wichtigsten Zinkerze sind Zinkblende Zn. S und Zinkspat Zn. CO 3 - Zink wird thermisch oder elektrolytisch dargestellt; zunächst erfolgt die Röstung von Zinkerz:

5 Metalle 5. 5 die 2. Nebengruppe die Elemente - Zn - Zink wird thermisch oder elektrolytisch dargestellt; zunächst erfolgt die Röstung von Zinkerz: -

5 Metalle 5. 5 die 2. Nebengruppe die Elemente - Zn - Zinkverwendungen : + Dächer, Dachrinnen + Trockenbatterien

5 Metalle 5. 5 die 2. Nebengruppe die Elemente - Zn - Zinkverwendungen: + Dächer, Dachrinnen + Trockenbatterien + Zn-Staub als Reduktionsmittel + Zinküberzüge (Feuerverzinken o. galvanisch) + Legierungen (Messing)

5 Metalle 5. 5 die 2. Nebengruppe die Elemente - Zn einige Reaktionen des Zinks: - alle wichtigen Zinkverbindungen enthalten Zink in der Oxidationsstufe +2 - Zinkoxid entsteht durch Entwässerung von Zn(OH)2, durch thermische Zersetzung von Zn. CO 3 oder durch Oxidation von Zinkdampf an der Luft dargestellt:

5 Metalle 5. 5 die 2. Nebengruppe die Elemente - Zn einige Reaktionen des Zinks: - die Darstellung von Zinkhalogeniden kann durch Auflösen von Zn in Halogenwasserstoffsäuren erfolgen: - das technisch wichtigste Zinksalz Zn. SO 4 wird technisch durch Auflösen von Zinkschrott in verdünnter Schwefelsäure hergestellt

5 Metalle 5. 5 die 2. Nebengruppe die Elemente - Zn einige Reaktionen des Zinks: - Zinksulfid Zn. S kann aus den Elementen dargestellt werden Zn + S Zn. S

5 Metalle 5. 5 die 2. Nebengruppe die Elemente - Cd - Cadmium ist ein silberweißes Metall, edler und duktiler als Zink - beständig an der Luft, schwerlöslich in nichtoxidierenden Säuren, leicht in verdünnter Salpetersäure - von Laugen wird Cd nicht gelöst - Cadmium ist stark toxisch; sowohl die Aufnahme löslicher Cadmiumsalze als auch die Inhalation von Cadmiumdämpfen ist gefährlich

5 Metalle 5. 5 die 2. Nebengruppe die Elemente - Cd - Cadmium kommt wie Zink nicht elementar vor - Cd ist in den meisten Zinkerzen mit 0, 2 - 0, 4% enthalten; daher wird es als Nebenprodukt bei der Zinkherstellung gewonnen - Cadmiumminerale spielen für die technische Erzeugung keine Rolle - Cd-Verwendungen: + in wiederaufladbaren Batterien

5 Metalle 5. 5 die 2. Nebengruppe die Elemente - Cd-Verwendungen: + Schutzüberzüge wie bei Zink + aufgrund des hohen Neutroneneinfangquerschnittes Einsatz als Material für Regelstäbe (3) in Kernreaktoren + Bestandteil niedrig schmelzender Legierungen (z. B. im Woodschen Metall)

5 Metalle 5. 5 die 2. Nebengruppe die Elemente - Cd einige Reaktionen des Cadmiums: - Cd(OH)2 löst sich in Säuren und in sehr starken Basen als [Cd(OH)4]2 - in NH 3 löst sich Cd(OH)2 unter Bildung von [Cd(NH 3)4]2+ - die Cd-Halogenide Cd. X 2 bilden mit Halogenidionen die Komplexe Cd. X 3 - und Cd. X 42 - Cd. S (Cadmiumgelb wird als gelbes Pigment verw. , Cd. Se als rotes Pigment

5 Metalle 5. 5 die 2. Nebengruppe die Elemente - Cd einige Reaktionen des Cadmiums: - Cd(OH)2 löst sich in Säuren und in sehr starken Basen als [Cd(OH)4]2 - in NH 3 löst sich Cd(OH)2 unter Bildung von [Cd(NH 3)4]2+ - die Cd-Halogenide Cd. X 2 bilden mit Halogenidionen die Komplexe Cd. X 3 - und Cd. X 42 - Cd. S (Cadmiumgelb wird als gelbes Pigment verw. , Cd. Se als rotes Pigment - Cd. S ist photoleitend Belichtungsmesser

5 Metalle 5. 5 die 2. Nebengruppe die Elemente - Hg - Quecksilber (engl. mercury)

5 Metalle 5. 5 die 2. Nebengruppe die Elemente - Hg - Quecksilber ist ein silberglänzendes Metall, das bei -39 °C erstarrt - hoher Dampfdruck; der Dampf besteht aus Hg-Atomen - Hg-Dämpfe sind sehr giftig und verursachen chronische Vergiftungen; verschüttetes Hg ist deshalb sofort mit Zinkstaub (Amalgambildung) oder Iodkohle (Reduktion zu Hg. I 2) unschädlich zu machen

5 Metalle 5. 5 die 2. Nebengruppe die Elemente - Hg - Quecksilber ist ein edles Metall und unterscheidet sich in seinen Rkn von Zink und Cadmium - wird von Salpeter- nicht aber von Salz- oder Schwefelsäure gelöst - bei RT ist Hg beständig gegen O 2, Wasser, CO 2, SO 2, HCl, H 2 S, NH 3 - reagiert mit Halogenen und Schwefel, ab 300 °C mit O 2 Hg. O Hg + 0, 5 O 2

5 Metalle 5. 5 die 2. Nebengruppe die Elemente - Hg - das einzige für die Gewinnung von Quecksilber bedeutende Mineral ist der Zinnober Hg. S - Quecksilber erhält man hieraus durch Rösten: - Hg entweicht dampfförmig und wird kondensiert

5 Metalle 5. 5 die 2. Nebengruppe die Elemente - Hg - Quecksilber findet vielseitige Verwendung: + Füllung in wiss. Geräten (Thermometer, Barometer) + Hg-Dampflampen (hoher UV-Anteil)

5 Metalle 5. 5 die 2. Nebengruppe die Elemente - Hg - Quecksilber findet vielseitige Verwendung: + Füllung in wiss. Geräten (Thermometer, Barometer) + Hg-Dampflampen (hoher UV-Anteil) + Kathodenmaterial für die Chloralkalielekrolyse + Extraktionsmittel bei der Goldgewinnung + als Silberamalgam in der Zahnmedizin

5 Metalle 5. 5 die 2. Nebengruppe die Elemente - Hg einige Reaktionen des Quecksilbers: - wichtig ist das Disproportionierungsgleichgewicht - die dadurch eingeschränkte Stabilität von Hg(I)-Verbindungen zeigt sich exemplarisch in folgenden Rkn:

5 Metalle 5. 5 die 2. Nebengruppe die Elemente - Hg einige Reaktionen des Quecksilbers: - beim Erhitzen an der Luft auf 300 - 350 °C erhält man orthorhomb. rotes Hg. O, das oberhalb 400 °C wieder zerfällt - es ist polymer aus Zickzackketten aufgebaut:

5 Metalle 5. 5 die 2. Nebengruppe die Elemente - Hg einige Reaktionen des Quecksilbers: - beim Erhitzen an der

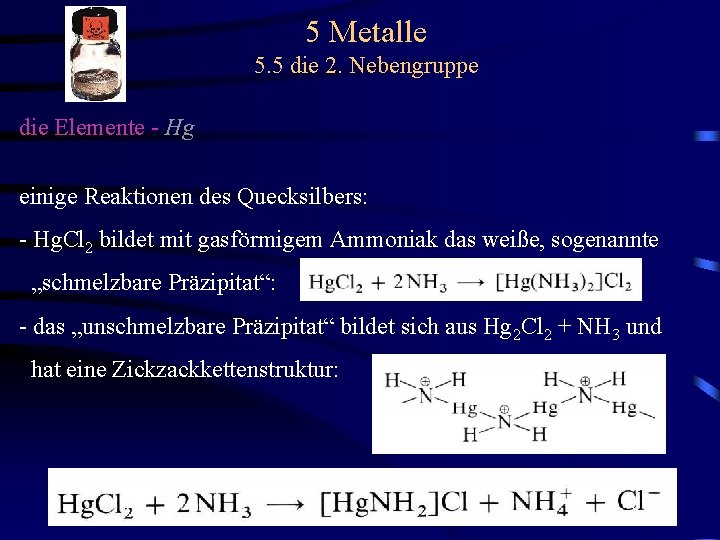
5 Metalle 5. 5 die 2. Nebengruppe die Elemente - Hg einige Reaktionen des Quecksilbers: - Hg. Cl 2 bildet mit gasförmigem Ammoniak das weiße, sogenannte „schmelzbare Präzipitat“: - das „unschmelzbare Präzipitat“ bildet sich aus Hg 2 Cl 2 + NH 3 und hat eine Zickzackkettenstruktur:

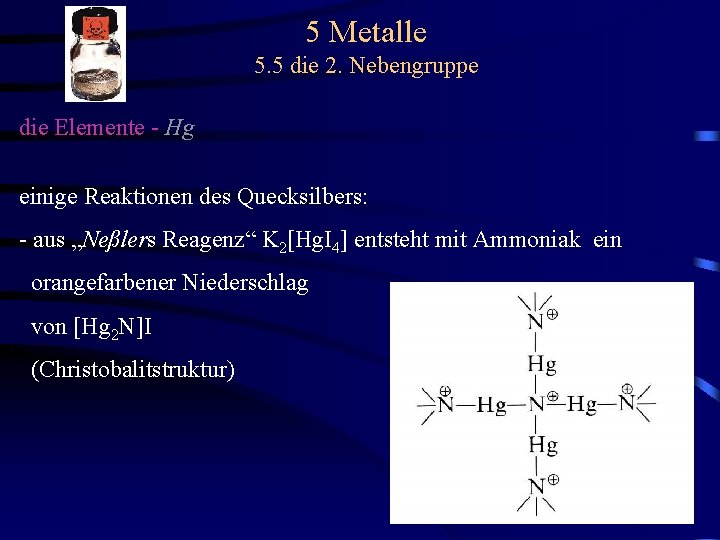
5 Metalle 5. 5 die 2. Nebengruppe die Elemente - Hg einige Reaktionen des Quecksilbers: - aus „Neßlers Reagenz“ K 2[Hg. I 4] entsteht mit Ammoniak ein orangefarbener Niederschlag von [Hg 2 N]I (Christobalitstruktur)

5 Metalle 5. 6 die 3. Nebengruppe Gruppeneigenschaften

5 Metalle 5. 6 die 3. Nebengruppe Gruppeneigenschaften Sc

5 Metalle 5. 6 die 3. Nebengruppe Gruppeneigenschaften Y Sc

5 Metalle 5. 6 die 3. Nebengruppe Gruppeneigenschaften Y Sc La

5 Metalle 5. 6 die 3. Nebengruppe Gruppeneigenschaften

5 Metalle 5. 6 die 3. Nebengruppe Gruppeneigenschaften - aufgrund ihrer Elektronenkonfiguration treten die Elemente der 3. NG ausschließlich in der Oxidationsstufe +3 auf - die Me 3+ - Ionen besitzen Edelgaskonfiguration und sind farblos - Eigenschaften ähneln mehr denen der 2. HG denn denen der 2. NG - es bestehen Ähnlichkeiten zur Chemie des Aluminiums

5 Metalle 5. 6 die 3. Nebengruppe Gruppeneigenschaften - aufgrund ihrer Elektronenkonfiguration treten die Elemente der 3. NG ausschließlich in der Oxidationsstufe +3 auf - die Me 3+ - Ionen besitzen Edelgaskonfiguration und sind farblos - Eigenschaften ähneln mehr denen der 2. HG denn denen der 2. NG - es bestehen Ähnlichkeiten zur Chemie des Aluminiums - insbesondere Scandium ist wie Al amphoter - zusammen mit den Lanthanoiden werden Scandium, Yttrium und Lanthan als Seltenerdmetalle bezeichnet

5 Metalle 5. 6 die 3. Nebengruppe Gruppeneigenschaften - die Metalle sind unedel und reaktionsfreudig - Zunahme der Ionenradien bewirkt Zunahme der Basizität der Hydroxide: + Sc(OH)3 ist amphoter + La(OH)3 eine ziemlich starke Base - Fluoride, Sulfate, Oxalate und Carbonate sind schwerlöslich - geringe Neigung zur Komplexbildung - Actinium Ac ist radioaktiv und kommt als radioaktives Zerfallsprodukt vor

5 Metalle 5. 6 die 3. Nebengruppe die Elemente - in elementarem Zustand kristallisieren Sc, Y und La in typischen Metallstrukturen - es sind silberweiße, duktile Metalle - Sc und Y sind Leichtmetalle Lanthan

5 Metalle 5. 6 die 3. Nebengruppe die Elemente - in elementarem Zustand kristallisieren Sc, Y und La in typischen Metallstrukturen - es sind silberweiße, duktile Metalle - Sc und Y sind Leichtmetalle - die Elemente der NG 3 sind unedler als Al und reagieren dementsprechend mit Säuren unter Wasserstoffentwicklung - in der Atmosphäre und in Wasser sind sie beständig, da sich passivierende Deckschichten bilden

5 Metalle 5. 6 die 3. Nebengruppe die Elemente - entgegen ihrem Namen sind Sc, Y und La nicht selten, sondern ebenso häufig wie Blei und Zink - die Anreicherung in Lagerstätten ist allerdings gering - die wenigen wichtigen Mineralien sind: + Thortveitit (Y, Sc)2[Si 2 O 7]

5 Metalle 5. 6 die 3. Nebengruppe die Elemente - entgegen ihrem Namen sind Sc, Y und La nicht selten, sondern ebenso häufig wie Blei und Zink - die Anreicherung in Lagerstätten ist allerdings gering - die wenigen wichtigen Mineralien sind: + Thortveitit (Y, Sc)2[Si 2 O 7] + Gadolinit Be 2 Y 2 Fe[Si 2 O 8]O 2 + Xenotim YPO 4 - La kommt als Begleiter der Lanthanoiden, vor allem des Cers, vor

5 Metalle 5. 6 die 3. Nebengruppe die Elemente - alle Metalle können durch Reduktion der Fluoride mit Ca oder Mg hergestellt werden: - Mg-Sc - Legierungen werden in der Kerntechnik als Neutronenfilter verwendet - in Magnetspeichern erhöht Dotierung mit Sc 2 O 3 eine schnelle Ummagnetisierung - Rohre aus Yttrium dienen in der Kerntechnik als Brennstabummantel.

5 Metalle 5. 6 die 3. Nebengruppe die Elemente - große Mengen Yttriumverbindungen werden in der Farbfernsehtecnik als Farbkörper (rote Fluoreszenz) verwendet - flüssiges Lanthan dient zur Plutoniumextraktion aus geschmolzenem Uran - eine Co. Y - Legierung dient als hervorragendes Material für Permanentmagnete

5 Metalle 5. 6 die 3. Nebengruppe die Elemente einige Reaktionen von Sc, Y und La - Scandiumverbindungen ähneln den Aluminiumverbindungen - Sc. F 3 ist schwerlöslich in Wasser, Sc. Cl 3 Sc. Br 3 und Sc. I 3 sind hygroskopisch und leichtlöslich - mit Halogeniden bilden sich die Halogenokomplexe [Sc. F 6]3(Kryolith-Analoga!) und [Sc. Cl 6]3 - Sc(OH)3 ist eine schwache Base und weniger amphoter als Al(OH)3, in Na. OH-Lösungen löst es sich unter Bildung von Na 3[Sc(OH)6]

5 Metalle 5. 6 die 3. Nebengruppe die Elemente einige Reaktionen von Sc, Y und La - Yttriumverbindungen ähneln den Scandiumverbindungen - Yttriumhydroxid ist stärker basisch und stärker löslich als Sc(OH)3 - La. F 3 ist in Wasser schwerlöslich, es existieren die Fluorokomplexe [La. F 4]- und [La. F 6]3 - La 2 O 3 wird durch Erhitzen von La(OH)3 oder durch Verbrennen von Lanthan erhalten
 Metallischer glanz erklärung
Metallischer glanz erklärung Tonbandstimmen
Tonbandstimmen Intoxikierten zustand
Intoxikierten zustand Zustand
Zustand Ausgangssituation beschreiben
Ausgangssituation beschreiben Entwurfsmuster zustand beispiel
Entwurfsmuster zustand beispiel Erster tag der woche
Erster tag der woche Der seele heimat ist der sinn
Der seele heimat ist der sinn Der daumen pflückt die pflaumen
Der daumen pflückt die pflaumen Gründer der modernen türkei
Gründer der modernen türkei Brustkorbverletzung lagerung
Brustkorbverletzung lagerung Ezekiel 25 17 der pfad der gerechten
Ezekiel 25 17 der pfad der gerechten Geschichte frosch skorpion
Geschichte frosch skorpion Aufbau einer mittelalterlichen burg
Aufbau einer mittelalterlichen burg Georg heym der gott der stadt
Georg heym der gott der stadt Gegenstand der arbeitspsychologie
Gegenstand der arbeitspsychologie An der schwelle der ewigkeit
An der schwelle der ewigkeit Warum kommen fluor chlor und brom nicht in der natur vor
Warum kommen fluor chlor und brom nicht in der natur vor Sandsteinzone
Sandsteinzone Sharon van der sloot
Sharon van der sloot Theoretische phonetik der deutschen sprache
Theoretische phonetik der deutschen sprache Peter in the wolf instruments
Peter in the wolf instruments Nettostrahlungsbilanz
Nettostrahlungsbilanz Feuerwehr schmallenberg einsätze
Feuerwehr schmallenberg einsätze Michiel van der vlies
Michiel van der vlies Vom himmel fällt der regen und macht die erde nass
Vom himmel fällt der regen und macht die erde nass 7 weltwunder der antike
7 weltwunder der antike Reibungsarten der größe nach
Reibungsarten der größe nach Quando tudo não der mais certo
Quando tudo não der mais certo Wikipedia
Wikipedia Cms limburg an der lahn
Cms limburg an der lahn Negativwiederholungen
Negativwiederholungen Casa farnsworth cortes
Casa farnsworth cortes Simon van der weele
Simon van der weele Ckredit
Ckredit Die rückkehr der jedi-ritter rollen
Die rückkehr der jedi-ritter rollen Ruby van der wekken
Ruby van der wekken Kinderzeichnung phasen
Kinderzeichnung phasen Pflegegrad 4 geld
Pflegegrad 4 geld Ao prinzipien der frakturversorgung
Ao prinzipien der frakturversorgung Van der waals equation matlab
Van der waals equation matlab Bilder für gemeinde in der bibel
Bilder für gemeinde in der bibel Der wie vielte ist heute
Der wie vielte ist heute Direktion der justiz und des innern kanton zürich
Direktion der justiz und des innern kanton zürich Gefahren an der einsatzstelle
Gefahren an der einsatzstelle Heinz erhardt die raupe
Heinz erhardt die raupe Gestaltungsprinzipien der sozialen sicherung
Gestaltungsprinzipien der sozialen sicherung Wievielter dalai lama
Wievielter dalai lama Fugacidad
Fugacidad Schattenkonstruktion übungen
Schattenkonstruktion übungen Probleme der heutigen jugend
Probleme der heutigen jugend Mija van der wege
Mija van der wege Ausbau reutlingen
Ausbau reutlingen Welcher tag ist heute
Welcher tag ist heute Aufbau interpretation kurzgeschichte
Aufbau interpretation kurzgeschichte Caspar david friedrich religion
Caspar david friedrich religion Beregning af golfhandicap
Beregning af golfhandicap Nationaler kriterienkatalog checklisten
Nationaler kriterienkatalog checklisten Ferdinand hodler sterbende frau
Ferdinand hodler sterbende frau Arten der personalbeurteilung
Arten der personalbeurteilung Homologe reihe der alkane
Homologe reihe der alkane Hagener woche der philosophie
Hagener woche der philosophie Biologie klasse 5 fische atmung
Biologie klasse 5 fische atmung Martijn van der heide
Martijn van der heide Harm van der werf
Harm van der werf 2 hauptsatz der thermodynamik
2 hauptsatz der thermodynamik Totalkapazität der lunge
Totalkapazität der lunge Das leben ist eine zugfahrt
Das leben ist eine zugfahrt Chenonceau schloss der frauen
Chenonceau schloss der frauen Arotac
Arotac Valenzgrammatik beispiel
Valenzgrammatik beispiel Jakobus 1 19
Jakobus 1 19 Der natur zuliebe
Der natur zuliebe 5 säulen der traumapädagogik
5 säulen der traumapädagogik Bruder der grossmutter
Bruder der grossmutter Seow ta wee
Seow ta wee Der mensch hat dreierlei wege klug zu handeln
Der mensch hat dreierlei wege klug zu handeln Abschluss warenkonten
Abschluss warenkonten Digitale medien im mathematikunterricht der grundschule
Digitale medien im mathematikunterricht der grundschule Worüber der franz unzufrieden ist
Worüber der franz unzufrieden ist Ineke van der vlugt
Ineke van der vlugt Albert van der kaap
Albert van der kaap Van der waals kuvvetleri
Van der waals kuvvetleri Der filialleiter zusammenfassung
Der filialleiter zusammenfassung Erster hauptsatz der thermodynamik
Erster hauptsatz der thermodynamik Bezugskalkulation absatzkalkulation
Bezugskalkulation absatzkalkulation Bau der blütenpflanze
Bau der blütenpflanze Friedrich der große hitler
Friedrich der große hitler Woche dativ
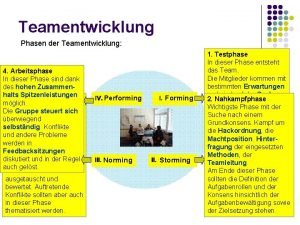
Woche dativ Phasen der teamentwicklung
Phasen der teamentwicklung Las fuerzas de van der waals
Las fuerzas de van der waals Goethe war gut man der konnte reimen
Goethe war gut man der konnte reimen Bart van der sloot
Bart van der sloot Optimale bestellmenge berechnen tabelle
Optimale bestellmenge berechnen tabelle Suzan van der lee
Suzan van der lee Patrick van der lem
Patrick van der lem Van der waals gleichung
Van der waals gleichung Strahlungshaushalt der erde arbeitsblatt
Strahlungshaushalt der erde arbeitsblatt Der låg han med høy til pute
Der låg han med høy til pute Habakuk roger liebi
Habakuk roger liebi Aukje molenaar
Aukje molenaar Was sind satzglieder
Was sind satzglieder Vier dimensionen der lebensqualität nach lawton
Vier dimensionen der lebensqualität nach lawton Van der valsova jednacina
Van der valsova jednacina Servaas van der berg
Servaas van der berg Mas achse
Mas achse Plinius der jüngere calpurnia
Plinius der jüngere calpurnia Kleinste teile der wortbildung
Kleinste teile der wortbildung Ronald van der horst
Ronald van der horst Fiedler auf dem dach
Fiedler auf dem dach Wer erfand den flaschenzug
Wer erfand den flaschenzug Edgar van der grift
Edgar van der grift Alle hatten die hosen voll nur bei mir liefs flüssig
Alle hatten die hosen voll nur bei mir liefs flüssig Erkundigen präposition
Erkundigen präposition Viewer discretion is advised'' warning intro
Viewer discretion is advised'' warning intro Ibr wirtschaftskreislauf
Ibr wirtschaftskreislauf Kollegiale fallberatung in der pflege
Kollegiale fallberatung in der pflege Probleme der heutigen jugend
Probleme der heutigen jugend Frans g. von der dunk
Frans g. von der dunk Ecuacion de van der waals
Ecuacion de van der waals Ein metterschling mit flauen
Ein metterschling mit flauen Erziehung in der ddr referat
Erziehung in der ddr referat Wie weit ist der mond entfernt
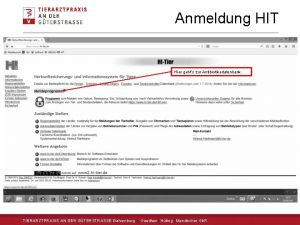
Wie weit ist der mond entfernt Tierarztpraxis an der güterstraße
Tierarztpraxis an der güterstraße Roger liebi entrückung vor drangsal
Roger liebi entrückung vor drangsal Fieberkurve der amerikanisch-sowjetischen beziehungen
Fieberkurve der amerikanisch-sowjetischen beziehungen Deutschlands weg zum nationalstaat
Deutschlands weg zum nationalstaat Merkmale der weimarer klassik
Merkmale der weimarer klassik Kokosfett basisch oder sauer
Kokosfett basisch oder sauer Brom im alltag
Brom im alltag En lille båd der gynger tekst
En lille båd der gynger tekst Dipole induit
Dipole induit Saldo der abschlussposten
Saldo der abschlussposten Spekulationsaufgabe
Spekulationsaufgabe Dornsavanne
Dornsavanne Herbert birken achmed der narr
Herbert birken achmed der narr Sakrament der ehe unterrichtsmaterial
Sakrament der ehe unterrichtsmaterial Erst wenn der letzte baum greenpeace
Erst wenn der letzte baum greenpeace Schritte der konzeptionsentwicklung
Schritte der konzeptionsentwicklung Genitiv du
Genitiv du Buchhaltungsarten
Buchhaltungsarten Mario und der zauberer epoche
Mario und der zauberer epoche Schule an der altenau
Schule an der altenau Rijkscultuurkamer
Rijkscultuurkamer Haus der vierecke pikas
Haus der vierecke pikas Der er noget galt i danmark
Der er noget galt i danmark Investitionsarten bwl
Investitionsarten bwl Bund der schwerhörigen hamburg
Bund der schwerhörigen hamburg An der liebe untereinander
An der liebe untereinander Forze di van der waals
Forze di van der waals In der folgenden tabelle
In der folgenden tabelle