Ca 2 Experimentalvortrag Anorganische Chemie Metalle in Lebewesen

Ca 2+ Experimentalvortrag Anorganische Chemie „Metalle in Lebewesen“ Birgit Schubert

Gliederung 1. Allgemeine Einführung 2. Metalle in Lebewesen 2. 1 Calcium 2. 2 Blei 2. 3 Eisen 2. 4 Magnesium 3. Schulrelevanz 4. „Zusammenfassung“

1. Allgemeine Einführung 1. Welche Elemente zählen zu den Metallen?

1. Allgemeine Einführung Häufigkeit von 3 d-Elementen

1. Allgemeine Einführung Häufigkeit von Alkali- und Erdalkalimetallen

2. Metalle in Lebewesen • Vorkommen in Form von Ionen • Metalle essentiell für Leben • Schlüsselelement für Leben auf der Erde: Magnesium • Menschliche Körper benötigt 14 Metalle

2. Metalle in Lebewesen Die 14 essentiellen Metalle für den menschlichen Körper Metall m [g]/70 kg Metall Person m [g]/ 70 kg Person Ca K Na Mg Fe Zn Cu 1000 140 100 25 4, 2 2, 3 0, 072 0, 02 0, 014 0, 012 0, 005 0, 003 0, 001 Sn V Cr Mn Mo Co Ni

2. Metalle in Lebewesen Definition: Spurenelemente = chemische Stoffe, von denen kleinste Mengen (unter 25 mg) vom menschlichen Körper pro Tag benötigt werden, um lebensnotwendige Stoffwechselfunktionen aufrecht zu erhalten.

2. Metalle in Lebewesen Biologische Funktionen von Metallen Strukturfunktion Regel- und Signalfunktion Struktur. Informations- Gradienten- Regulation aufbau stabilisierung leitung aufbau

2. 1 Calcium Versuch 1: Calciumnachweis in Knochen

2. 1 Calcium Auswertung: Ca 5(PO 4)3 OH(s) + H 3 O+(aq) 5 Ca 2+(aq) + 3 PO 43 -(aq) + 2 H 2 O CH 3 COOH(aq) + NH 4+(aq) + OH-(aq) H 2 O Ca 2+(aq) + C 2 O 42 -(aq) Ca. C weiß 2 O 4(s) NH 4+(aq) + CH 3 COO-(aq) +

2. 1 Calcium • Element der 2. Gruppe • Tagesbedarf ~ 1000 mg • Nahrungsquellen: Milchprodukte, Hülsenfrüchte, Eier

2. 1 Calcium • Hauptfunktionen im Körper: - Knochen- und Zahnbildung - Nerven- und Muskelfunktion - Blutgerinnung - Konstanthaltung des Ca 2+-Spiegels im Blut • Mangelerscheinungen: - Vermindertes Wachstum, Verlust von Knochensubstanz
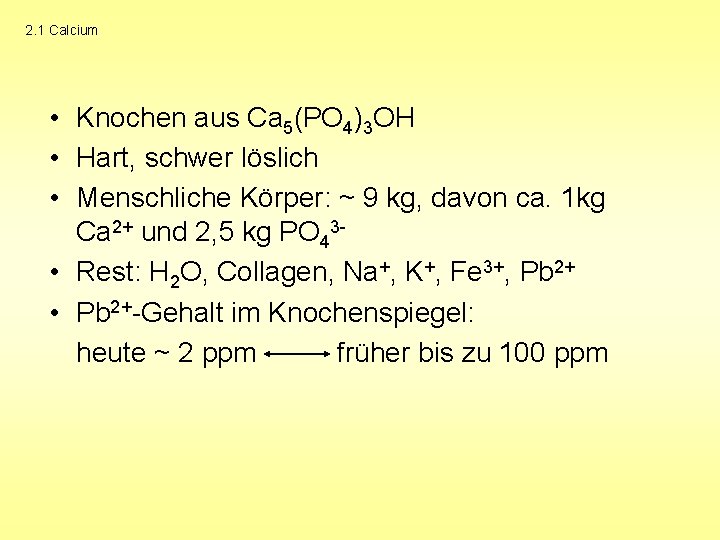
2. 1 Calcium • Knochen aus Ca 5(PO 4)3 OH • Hart, schwer löslich • Menschliche Körper: ~ 9 kg, davon ca. 1 kg Ca 2+ und 2, 5 kg PO 43 • Rest: H 2 O, Collagen, Na+, K+, Fe 3+, Pb 2+ • Pb 2+-Gehalt im Knochenspiegel: heute ~ 2 ppm früher bis zu 100 ppm

2. 2 Blei Demonstration 1: Giftige Wirkung des Bleis

2. 2 Blei Auswertung • Je größer Pb 2+-Konzentration, desto geringer Zellzahl • Chlorophyllsynthese gehemmt verminderte Grünfärbung mit Pb 2+

2. 2 Blei • Element der 14. Gruppe • MAK-Wert: 0, 1 mg/m 3 • Folgen einer Bleikontamination: Anfangsstadium: Müdigkeit, Erbrechen, Gewichtsverlust, Kopfschmerzen

2. 2 Blei Höheres Vergiftungsstadium: Darmkoliken, Nervosität, Nierenschäden, Schädigung des ZNS, Anämie, Bleisaum am Zahnfleisch, Schädigung der Fertilität • Retentionszeiten: im Blut/weichem Gewebe: ~ 1 Monat in Knochen: ~ 30 Jahre

2. 2 Blei Versuch 2: Hemmung der α-Amylase
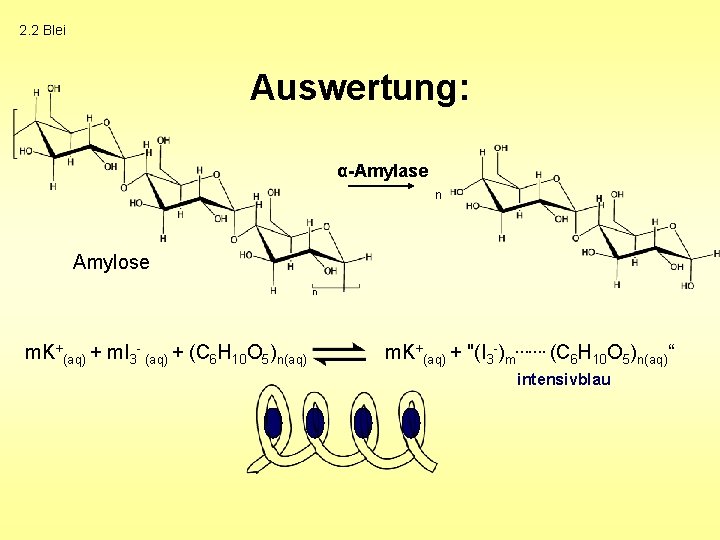
2. 2 Blei Auswertung: α-Amylase n Amylose n m. K+(aq) + m. I 3 - (aq) + (C 6 H 10 O 5)n(aq) m. K+(aq) + "(I 3 -)m……. (C 6 H 10 O 5)n(aq)“ intensivblau

2. 2 Blei Auswertung: + Pb 2+(aq) + H+(aq) + Pb 2+(aq) + 2 H+(aq)

2. 3 Eisen • Element der 8. Gruppe • Tagesbedarf Frauen: ~ 14 -28 mg, Männer: ~ 5 -9 mg • Im Knochenmark 75% des Fe • Nahrungsquellen: Fleisch, Kakao, Eier, Getreide, Kaviar

2. 3 Eisenproteine Hämproteine Eisenporphin- Funktionen proteine Nichthämproteine Fe-SProteine Funktionen Ferredoxine e--Transfer Hämoglobin Tier. O 2 -Transport Myoglobin Tier. O 2 -Speicherung Nitrogenasen Cytochrome e--Transport Fe-Proteine Funktionen Oxygenasen Oxygenierg. mit O 2 Ferritine Tier. Fe-Transport Oxidasen O 2 -Red Transferrine Fe-Speicherung Peroxidasen Ox mit H 2 O 2 Katalasen H 2 O 2 Disproportionierg. N 2 -Red zu NH 3

2. 3 Eisen • Krankheit vermehrte Fe-Speicherung: - im Gehirn: degenerative Krankheiten - im Pankreas, Leber, Milz, Herz: Hämochromatase - Krebserkrankungen verminderte Fe-Speicherung/Aufnahme: - Anämie, Thalassämie - geschwächte Immunabwehr

2. 3 Eisen Versuch 3: Atmungskette
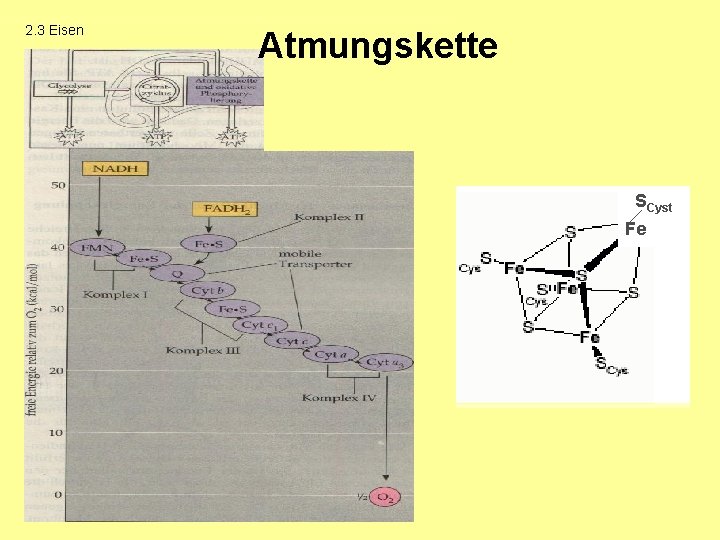
2. 3 Eisen Atmungskette SCyst Fe

2. 3 Eisen Auswertung OX 1. Ox. : -2 Red. : +3 Fe 3+ + 2 2 e- Red/OX Red -1 -1 2 Cyst-SH Red. : 2 2. Ox. : 2 e- + 2 H+ + Cyst-S-S-Cyst +2 e- 2 Fe 2+ +2 +3 2 Fe 2+ 2 Fe 3+ + 2 e- 0 ½ O 2 + -2 -2 2 e- O 20 Gesamt: 2 Cyst-SH + ½ O 2 -1 -1 -2 Cyst-S-S-Cyst + H 2 O

2. 3 Eisen - Fe(III)- Komplex - oktaedrisch umgeben von 2 Cystein blauviolett

2. 3 Eisen Versuch 4: Enzymatische Wirkung der Katalase

2. 3 Eisen Auswertung • Enzymatisch katalysierte Disproportionierung +1 -1 <Katalase> 2 H 2 O 2(aq) +1 -2 0 2 H 2 O + O 2(g) Red Ox

2. 3 Eisen Mg Fe Phytyl Häm Chlorophyll

2. 4 Magnesium • Element der 2. Gruppe • Tagesbedarf ~ 200 mg überschüssiges abführend • Nahrungsquellen: Getreide, grünes Blattgemüse • Funktionen im Körper: - Baustein von Enzymen - Regulation des Stofftransportes durch Membranen - ZA des Chlorophylls

2. 4 Magnesium Versuch 5 : Magnesiumnachweis

2. 4 Magnesium Auswertung H+ Mg Mg 2+ +

2. 4 Magnesium Auswertung • Nachweis mit Titangelb: Mg 2+ + hellroter NS

2. 4 Magnesium Demonstration 2: Dünnschichtchromatographie

2. 4 Magnesium Auswertung Carotine Phaeophytin Chlorophyll a Rf = Laufstrecke Substanz Laufstrecke Fließmittelfront -Typische Rf-Werte: Carotin: 0, 82 Chlorophyll b Chlorophyll a: 0, 61 Chlorophyll b: 0, 45 Xanthophylle

3. Schulrelevanz • 8: • 10: • 11/1: • 12/1: 12/2: Trennverfahren für Stoffgemische Chromatographie Katalysatoren Aufbau und Funktion von Böden Redoxreaktionen Kohlenstoffverbindungen und funkt. Gruppen Technisch und biologisch wichtige Kohlenstoffverbindungen

3. Schulrelevanz 12/2: • 13/1: 13/2: Enzyme: Aufbau und Bedeutung in Stoffwechselprozessen Kohlenhydrate: Photosynthese (Energiestoffwechsel und Zellatmung) Enzymkinetik: Bedeutung im Stoffwechsel Wahlthema Komplexchemie Nahrungsmittel und deren Abbau im Körper Umweltchemie: chemische Untersuchung von Stoffen im Alltag (Ionen/Moleküle); Chromatographische Verfahren

„ 4. Zusammenfassung“ Paracelsus (1493 -1541): „Was ist das nit gifft ist? Alle ding sind gifft/ und nichts ohn gifft/ allein die dosis macht das ein ding kein gifft ist. “

Vielen Dank für Ihre Aufmerksamkeit!

3. Schulrelevanz Biologie • 7/1 • 7/2 Bau einer Zelle einer grünen Pflanze Bedeutung des Lichtes für grüne Pflanzen: Experimentelles Arbeiten, Nachweisreaktionen für Stärke Bedeutung der Photosynthese für das Leben auf der Erde und unsere Ernähung: Nachweisreaktionen für Zucker, Stärke, Fett, Eiweiße • 9/1 Aufnahme und Verarbeitung von Informationen im Nervensystem, Schädigung des Nervensystems durch Gifte, Drogen

3. Schulrelevanz • 9/2 • 11 • 12/1 12/2 • 13/1 Blut und Immunsystem: Blutgerinnung, O 2 -Bindung an Hämoglobin Membrane, Katalyse (Enzyme), Transportmechanismen DNA, RNA: Bausteine Übersicht über Stoffwechselzusammenhänge: Energieaufnahme Photosynthese, Zellatmung Regulation Versuche zur Enzymwirkung Signalübertragung und Verrechnung: Nervenzellen, Ruhepotential, Aktionspotential

2) Einführung in die Metalle Charakteristische Eigenschaften • • Metallischer Glanz Elektrische Leitfähigkeit Wärmeleitfähigkeit Duktilität
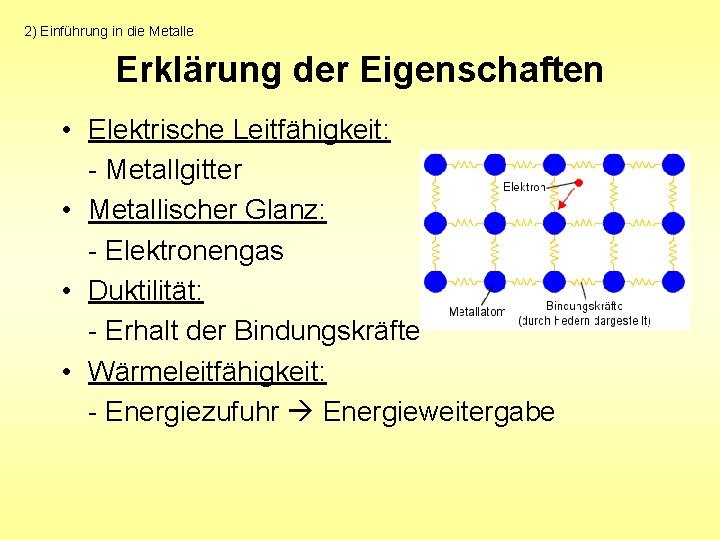
2) Einführung in die Metalle Erklärung der Eigenschaften • Elektrische Leitfähigkeit: - Metallgitter • Metallischer Glanz: - Elektronengas • Duktilität: - Erhalt der Bindungskräfte • Wärmeleitfähigkeit: - Energiezufuhr Energieweitergabe

2) Einführung in die Metalle Einteilung der Metalle Nach Reaktivität Edle Unedle Nach Dichte Leichte Bsp. : Cu, Bsp. : Na, Bsp. : Al, Ag, Au, Pt Zn, Mg, Ca Mg, Na, Ca Schwere Bsp. : Pb, Hg, Cr, Fe

5)1 Blei Heutige Verwendung des Bleis • In manchen Ländern noch als Antiklopfmittel im Benzin • Bleifarben: Pb. Cr. O 4 Chromgelb Pb. Cr. O 4. Pb. O Chromrot Pb(OH)2. 2 Pb. CO 3 Bleiweiß • Bleiakkumulatoren
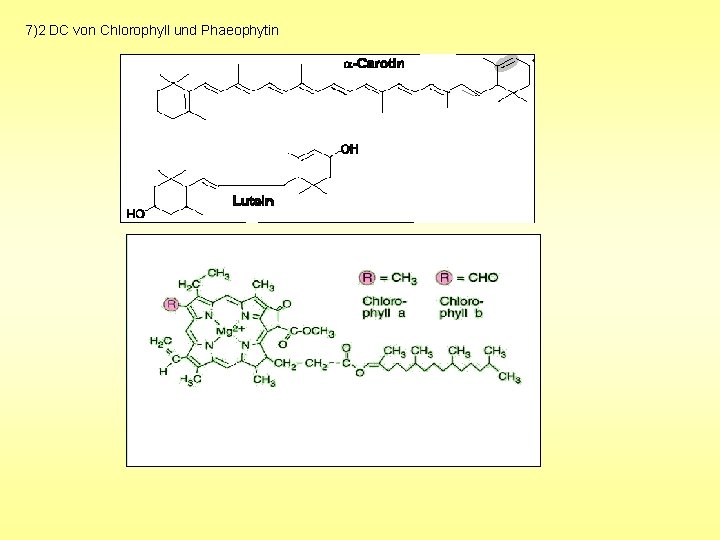
7)2 DC von Chlorophyll und Phaeophytin
- Slides: 48