Thermodynamik Wdh letzte Stunde 2 4 Reale Gase










- Slides: 27

Thermodynamik Wdh. letzte Stunde 2. 4. Reale Gase 2. 5. Erster Hauptsatz der Thermodynamik innere Energie, Arbeit, Wärme Vorzeichenkonvention Arbeit in der Thermodynamik - Adiabatische Expansion Wärme, Wärmekapazität, Enthalpie Berechnung von U, H, Cp, CV für ein Ideales Gas - kinetische Gastheorie Berechnung von U, H, Cp, CV für reale Gase (reale Stoffe) aus molekularen Eigenschaften Messung von U, H für reale Stoffe -Verknüpfung von U, H mit leicht messbaren Größen kein Wärmekontakt zu Umgebung (Q=0), Temp. variabel W = ∆U Problem: Welchen Wert hat CV für ein ideales Gas ?

Thermodynamik Wdh. letzte Stunde 2. 4. Reale Gase 2. 5. Erster Hauptsatz der Thermodynamik innere Energie, Arbeit, Wärme Vorzeichenkonvention Arbeit in der Thermodynamik - Adiabatische Expansion Wärme, Wärmekapazität, Enthalpie Berechnung von U, H, Cp, CV für ein Ideales Gas - kinetische Gastheorie Berechnung von U, H, Cp, CV für reale Gase (reale Stoffe) aus molekularen Eigenschaften Messung von U, H für reale Stoffe -Verknüpfung von U, H mit leicht messbaren Größen kein Wärmekontakt zu Umgebung (Q=0), Temp. variabel W = ∆U

Thermodynamik Wdh. letzte Stunde 2. 4. Reale Gase 2. 5. Erster Hauptsatz der Thermodynamik innere Energie, Arbeit, Wärme Vorzeichenkonvention Arbeit in der Thermodynamik - Adiabatische Expansion Wärme, Wärmekapazität, Enthalpie Berechnung von U, H, Cp, CV für ein Ideales Gas - kinetische Gastheorie Berechnung von U, H, Cp, CV für reale Gase (reale Stoffe) aus molekularen Eigenschaften Messung von U, H für reale Stoffe -Verknüpfung von U, H mit leicht messbaren Größen kein Wärmekontakt zu Umgebung (Q=0), Temp. variabel W = ∆U Problem: wie groß ist T 2? Ansatz: liefert: für ideales Gas

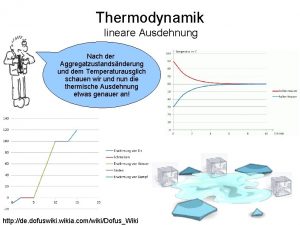
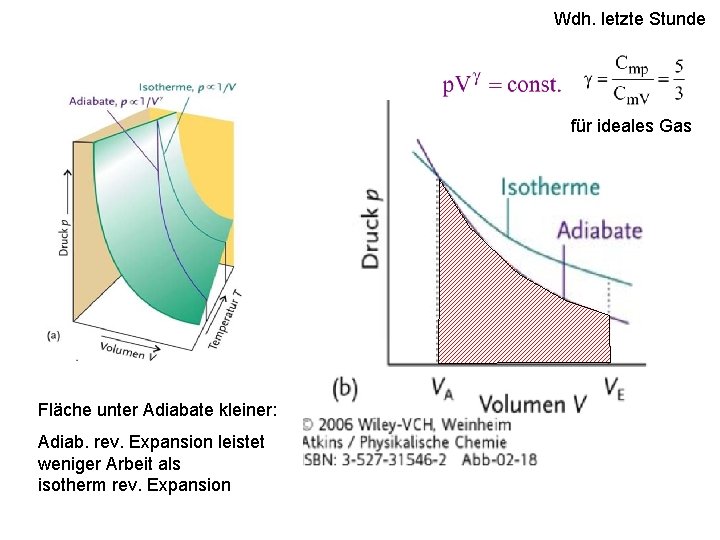
Wdh. letzte Stunde für ideales Gas Fläche unter Adiabate kleiner: Adiab. rev. Expansion leistet weniger Arbeit als isotherm rev. Expansion

Thermodynamik Wdh. letzte Stunde 2. 4. Reale Gase 2. 5. Erster Hauptsatz der Thermodynamik innere Energie, Arbeit, Wärme Vorzeichenkonvention Arbeit in der Thermodynamik - Adiabatische Expansion Wärme, Wärmekapazität, Enthalpie Berechnung von U, H, Cp, CV für ein Ideales Gas - kinetische Gastheorie Berechnung von U, H, Cp, CV für reale Gase (reale Stoffe) aus molekularen Eigenschaften Messung von U, H für reale Stoffe -Verknüpfung von U, H mit leicht messbaren Größen

Thermodynamik Wdh. letzte Stunde 2. 4. Reale Gase 2. 5. Erster Hauptsatz der Thermodynamik innere Energie, Arbeit, Wärme Vorzeichenkonvention Arbeit in der Thermodynamik - Adiabatische Expansion Wärme, Wärmekapazität, Enthalpie Berechnung von U, H, Cp, CV für ein Ideales Gas - kinetische Gastheorie Berechnung von U, H, Cp, CV für reale Gase (reale Stoffe) aus molekularen Eigenschaften Messung von U, H für reale Stoffe -Verknüpfung von U, H mit leicht messbaren Größen

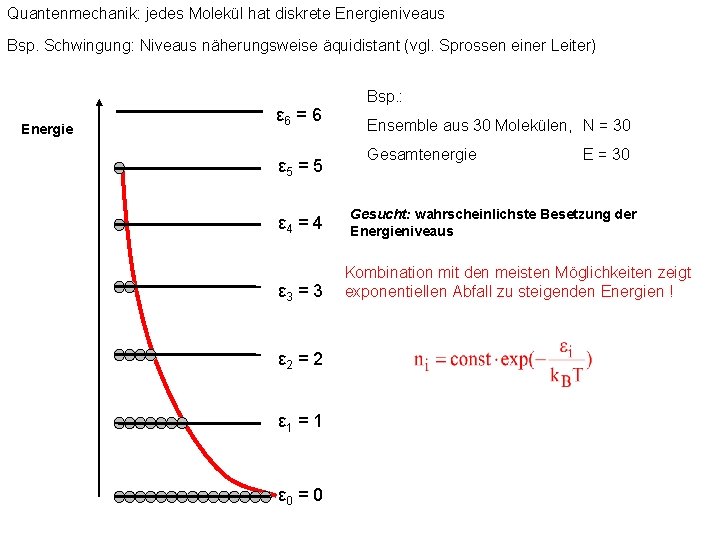
Quantenmechanik: jedes Molekül hat diskrete Energieniveaus Bsp. Schwingung: Niveaus näherungsweise äquidistant (vgl. Sprossen einer Leiter) Energie ε 6 = 6 ε 5 = 5 ε 4 = 4 ε 3 = 3 ε 2 = 2 ε 1 = 1 ε 0 = 0 Bsp. : Ensemble aus 30 Molekülen, N = 30 Gesamtenergie E = 30 Gesucht: wahrscheinlichste Besetzung der Energieniveaus Kombination mit den meisten Möglichkeiten zeigt exponentiellen Abfall zu steigenden Energien !

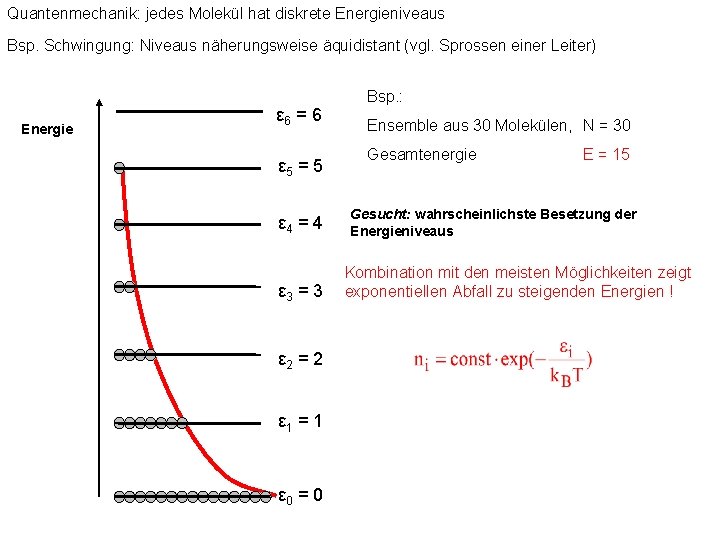
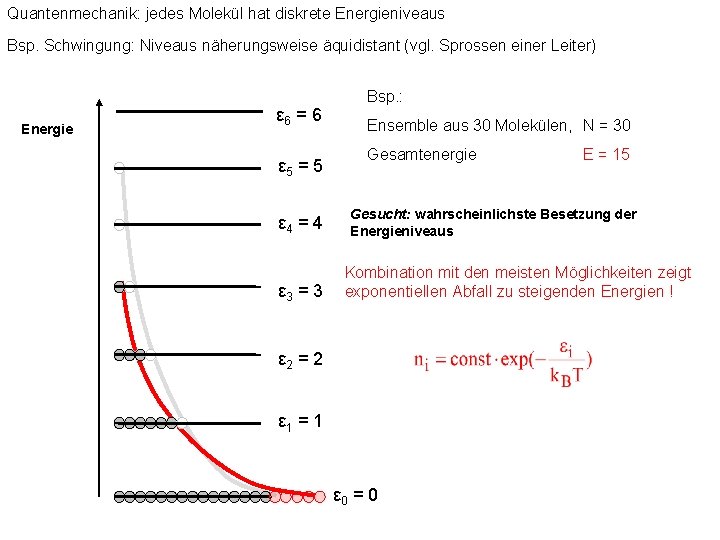
Quantenmechanik: jedes Molekül hat diskrete Energieniveaus Bsp. Schwingung: Niveaus näherungsweise äquidistant (vgl. Sprossen einer Leiter) Energie ε 6 = 6 ε 5 = 5 ε 4 = 4 ε 3 = 3 ε 2 = 2 ε 1 = 1 ε 0 = 0 Bsp. : Ensemble aus 30 Molekülen, N = 30 Gesamtenergie E = 15 Gesucht: wahrscheinlichste Besetzung der Energieniveaus Kombination mit den meisten Möglichkeiten zeigt exponentiellen Abfall zu steigenden Energien !

Quantenmechanik: jedes Molekül hat diskrete Energieniveaus Bsp. Schwingung: Niveaus näherungsweise äquidistant (vgl. Sprossen einer Leiter) Energie ε 6 = 6 ε 5 = 5 ε 4 = 4 ε 3 = 3 Bsp. : Ensemble aus 30 Molekülen, N = 30 Gesamtenergie E = 15 Gesucht: wahrscheinlichste Besetzung der Energieniveaus Kombination mit den meisten Möglichkeiten zeigt exponentiellen Abfall zu steigenden Energien ! ε 2 = 2 ε 1 = 1 ε 0 = 0

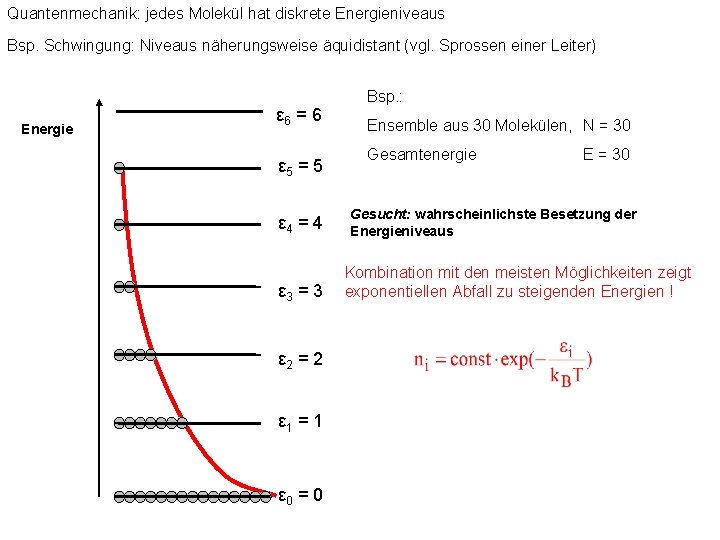
Quantenmechanik: jedes Molekül hat diskrete Energieniveaus Bsp. Schwingung: Niveaus näherungsweise äquidistant (vgl. Sprossen einer Leiter) Energie ε 6 = 6 ε 5 = 5 ε 4 = 4 ε 3 = 3 ε 2 = 2 ε 1 = 1 ε 0 = 0 Bsp. : Ensemble aus 30 Molekülen, N = 30 Gesamtenergie E = 30 Gesucht: wahrscheinlichste Besetzung der Energieniveaus Kombination mit den meisten Möglichkeiten zeigt exponentiellen Abfall zu steigenden Energien !

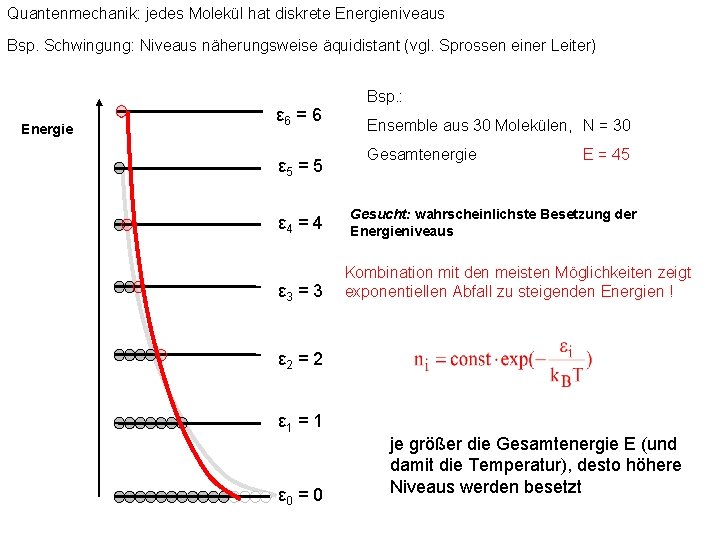
Quantenmechanik: jedes Molekül hat diskrete Energieniveaus Bsp. Schwingung: Niveaus näherungsweise äquidistant (vgl. Sprossen einer Leiter) Energie ε 6 = 6 ε 5 = 5 ε 4 = 4 ε 3 = 3 Bsp. : Ensemble aus 30 Molekülen, N = 30 Gesamtenergie E = 45 Gesucht: wahrscheinlichste Besetzung der Energieniveaus Kombination mit den meisten Möglichkeiten zeigt exponentiellen Abfall zu steigenden Energien ! ε 2 = 2 ε 1 = 1 ε 0 = 0 je größer die Gesamtenergie E (und damit die Temperatur), desto höhere Niveaus werden besetzt


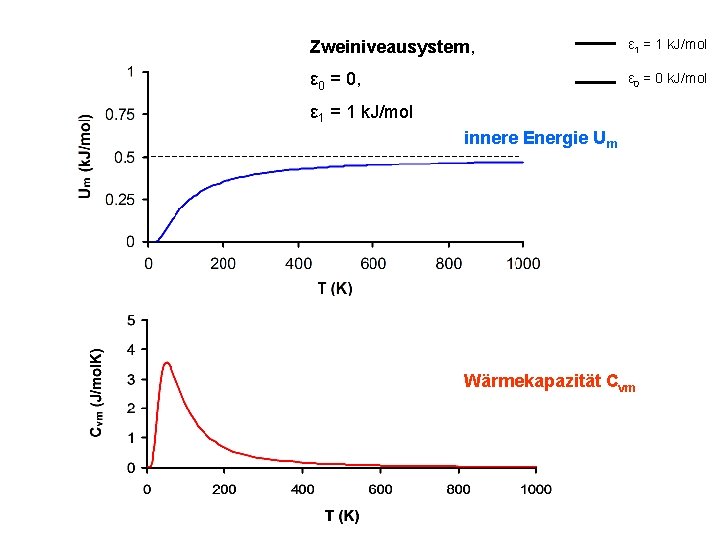
Zweiniveausystem, ε 1 = 1 k. J/mol ε 0 = 0, ε 0 = 0 k. J/mol ε 1 = 1 k. J/mol innere Energie Um Wärmekapazität Cvm

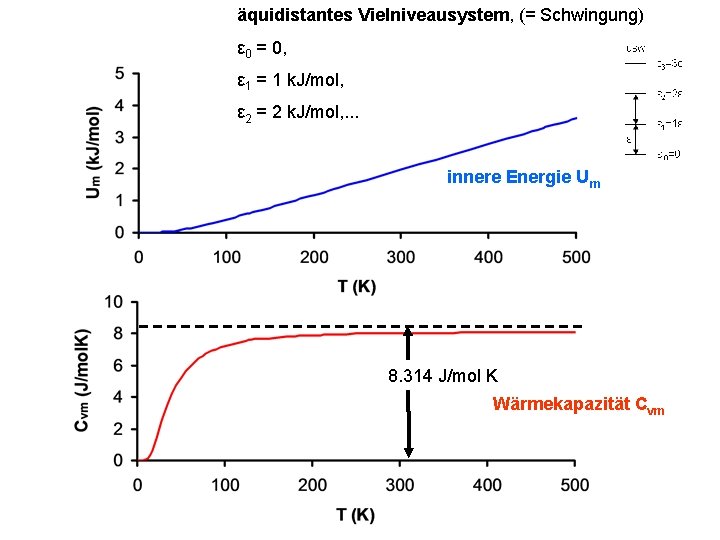
äquidistantes Vielniveausystem, (= Schwingung) ε 0 = 0, ε 1 = 1 k. J/mol, ε 2 = 2 k. J/mol, . . . innere Energie Um 8. 314 J/mol K Wärmekapazität Cvm

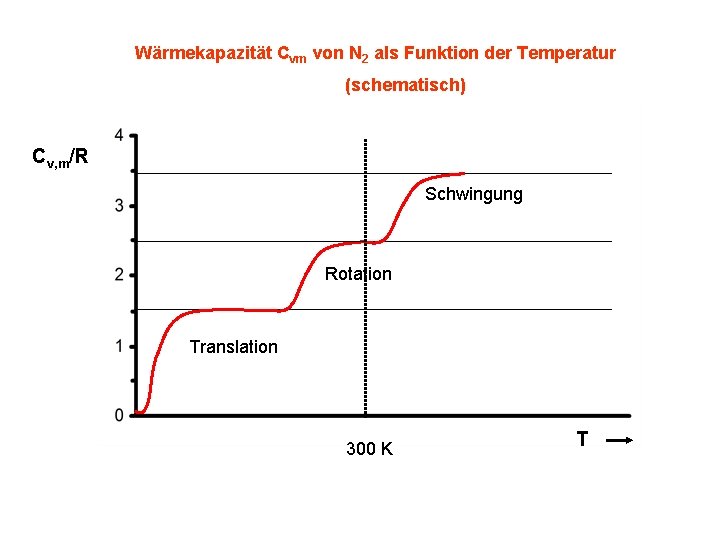
Wärmekapazität Cvm von N 2 als Funktion der Temperatur (schematisch) Cv, m/R Schwingung Rotation Translation 300 K T

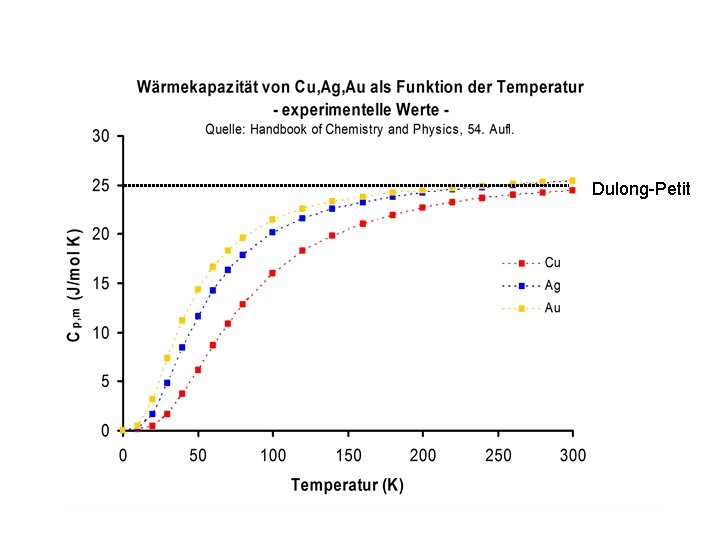
Regel von Dulong-Petit: molare Wärmekapazität vieler Festkörper bei Raumtemperatur: ≈3 R (≈ 25 J/mol K) experimentelle Werte (Atkins, 3. Aufl. , Tabelle 2. 12. ) Eisen 25. 1 J/mol K 3. 02 R Kupfer 24. 4 J/mol K 2. 93 R Silber 25. 4 J/mol K 3. 06 R Gold 25. 4 J/mol K 3. 06 R Phosphor (weiß) 23. 8 J/mol K 2. 86 R Antimon 3. 03 R 25. 2 J/mol K

Dulong-Petit

C ~ T 3

Einstein-Modell des Festkörpers Atome schwingen um ihre Gitterplätze mit einer festen Frequenz



Thermodynamik 2. 4. Reale Gase 2. 5. Erster Hauptsatz der Thermodynamik innere Energie, Arbeit, Wärme Vorzeichenkonvention Arbeit in der Thermodynamik - Adiabatische Expansion Wärme, Wärmekapazität, Enthalpie Berechnung von U, H, Cp, CV für ein Ideales Gas - kinetische Gastheorie Berechnung von U, H, Cp, CV für reale Gase (reale Stoffe) aus molekularen Eigenschaften Messung von U, H für reale Stoffe -Verknüpfung von U, H mit leicht messbaren Größen

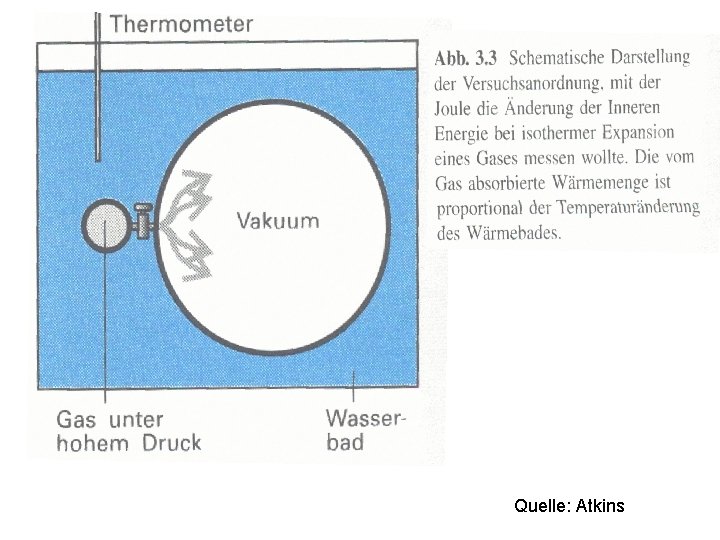
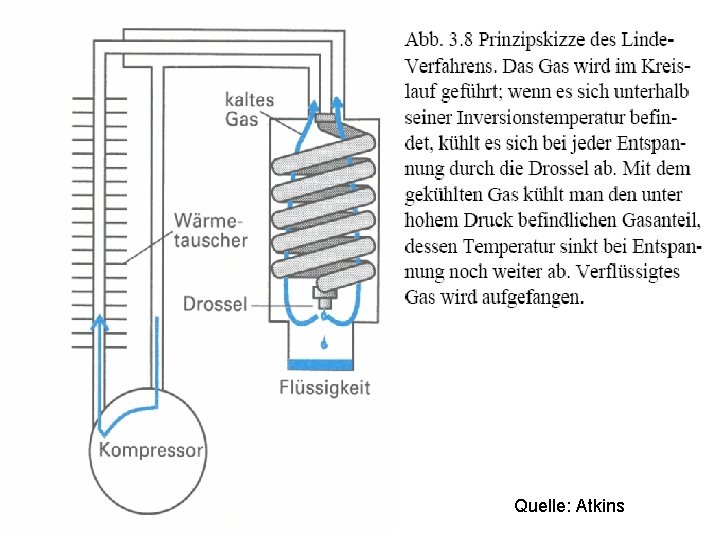
Quelle: Atkins

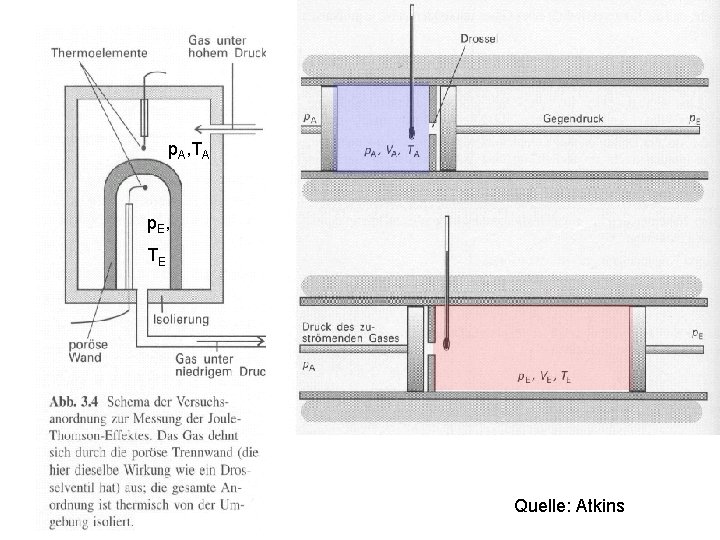
p. A, TA p. E, TE Quelle: Atkins

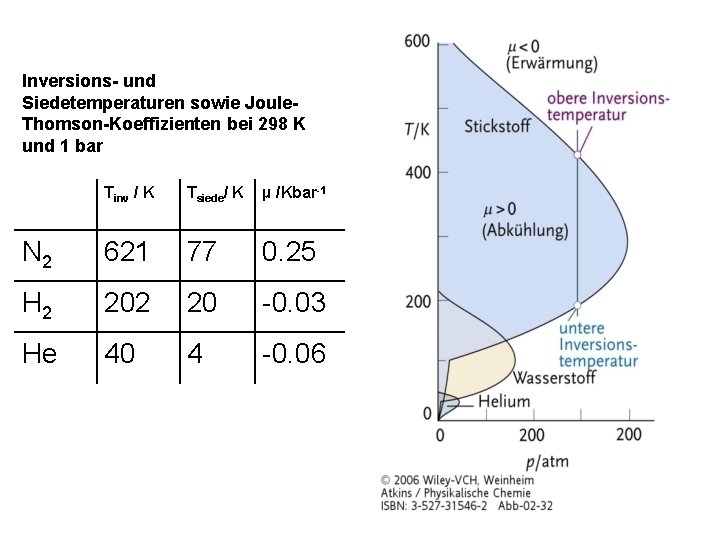
Inversions- und Siedetemperaturen sowie Joule. Thomson-Koeffizienten bei 298 K und 1 bar Tinv / K Tsiede/ K µ /Kbar-1 N 2 621 77 0. 25 H 2 20 -0. 03 He 40 4 -0. 06

Quelle: Atkins

Thermischer Ausdehnungskoeffizient Joule-Thomson. Koeffizient Isotherme Kompressibilität 1/T 1/p 3/2 R 0 5/2 R 0 0 3/2 R R 5/2 R ideales Gas
 Stille stunde zeitmanagement
Stille stunde zeitmanagement Gase meinerzhagen
Gase meinerzhagen Gesetz von amontons
Gesetz von amontons Erst wenn der letzte baum greenpeace
Erst wenn der letzte baum greenpeace Wo wird einst des wandermüden
Wo wird einst des wandermüden Erst wenn die letzte tankstelle geschlossen
Erst wenn die letzte tankstelle geschlossen Das letzte hemd hat keine taschen bedeutung
Das letzte hemd hat keine taschen bedeutung Komma vor aber
Komma vor aber Wahlplakate nsdap 1932
Wahlplakate nsdap 1932 Stirlingmotor leifi
Stirlingmotor leifi Thermodynamik
Thermodynamik H thermodynamik
H thermodynamik Erster hauptsatz der thermodynamik
Erster hauptsatz der thermodynamik T v diagramm thermodynamik
T v diagramm thermodynamik 2ter hauptsatz der thermodynamik
2ter hauptsatz der thermodynamik Satz von schwarz thermodynamik
Satz von schwarz thermodynamik Oberflächenenergie
Oberflächenenergie 2 hauptsatz der thermodynamik
2 hauptsatz der thermodynamik Thermodynamik
Thermodynamik Tripelpunkt des wassers
Tripelpunkt des wassers Lufterwärmung
Lufterwärmung Erster hauptsatz der thermodynamik
Erster hauptsatz der thermodynamik Volume molare
Volume molare Simplificarea rapoartelor
Simplificarea rapoartelor Real vs virtual
Real vs virtual Immagini reali e virtuali
Immagini reali e virtuali Instrumente optice care formeaza imagini reale
Instrumente optice care formeaza imagini reale Tutela reale attenuata
Tutela reale attenuata