Physik fr Mediziner und Zahnmediziner Vorlesung 21 Prof



![Geschwindigkeitsverteilung T[K] <v> [m/s] 300 476 500 614 1000 862 Die mittlere Geschwindigkeit der Geschwindigkeitsverteilung T[K] <v> [m/s] 300 476 500 614 1000 862 Die mittlere Geschwindigkeit der](https://slidetodoc.com/presentation_image_h/c375b6a0eb568ce299955dbbb0f9460f/image-5.jpg)




![Gasgemische: Partialdruck Zusammensetzung der Luft Gas Volumenanteil [%] N 2 78. 1 O 2 Gasgemische: Partialdruck Zusammensetzung der Luft Gas Volumenanteil [%] N 2 78. 1 O 2](https://slidetodoc.com/presentation_image_h/c375b6a0eb568ce299955dbbb0f9460f/image-25.jpg)
![Gasgemische: Partialdruck Zusammensetzung der Luft Gas pi [k. Pa] N 2 79. 7 O Gasgemische: Partialdruck Zusammensetzung der Luft Gas pi [k. Pa] N 2 79. 7 O](https://slidetodoc.com/presentation_image_h/c375b6a0eb568ce299955dbbb0f9460f/image-26.jpg)


![Löslichkeiten α [1/k. Pa] Lösungsmittel O 2 CO 2 N 2 H 2 O Löslichkeiten α [1/k. Pa] Lösungsmittel O 2 CO 2 N 2 H 2 O](https://slidetodoc.com/presentation_image_h/c375b6a0eb568ce299955dbbb0f9460f/image-35.jpg)






- Slides: 42

Physik für Mediziner und Zahnmediziner Vorlesung 21 Prof. F. Wörgötter (nach M. Seibt) -- Physik für Mediziner und Zahnmediziner 1

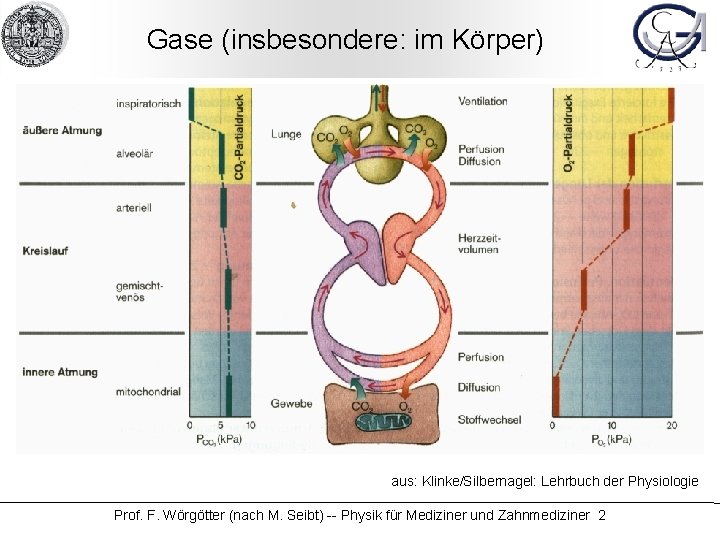
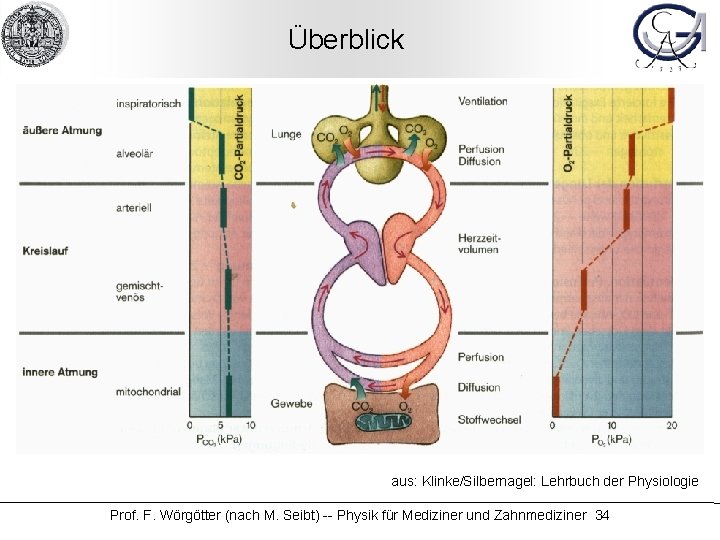
Gase (insbesondere: im Körper) aus: Klinke/Silbernagel: Lehrbuch der Physiologie Prof. F. Wörgötter (nach M. Seibt) -- Physik für Mediziner und Zahnmediziner 2

Gase im Körper: Lernziele • Gase: Zusammenhang der Zustandsgrößen Druck p, Volumen V, Temperatur T • mikroskopische Interpretation von Druck und Temperatur • Messbedingungen: BTPS, ATPS, STPD • Dampfdruck • Gasgemische: Partialdrücke pi • Lösung von Gasen in Flüssigkeiten • O 2 -Bindungskurve • die Taucherkrankheit und die Sektflasche Prof. F. Wörgötter (nach M. Seibt) -- Physik für Mediziner und Zahnmediziner 3

Bewegung in Gasen: Impuls und Druck Experiment Beobachtung: Deutung: Prof. F. Wörgötter (nach M. Seibt) -- Physik für Mediziner und Zahnmediziner 4
![Geschwindigkeitsverteilung TK v ms 300 476 500 614 1000 862 Die mittlere Geschwindigkeit der Geschwindigkeitsverteilung T[K] <v> [m/s] 300 476 500 614 1000 862 Die mittlere Geschwindigkeit der](https://slidetodoc.com/presentation_image_h/c375b6a0eb568ce299955dbbb0f9460f/image-5.jpg)
Geschwindigkeitsverteilung T[K] <v> [m/s] 300 476 500 614 1000 862 Die mittlere Geschwindigkeit der Teilchen hängt auch von der Teilchenart ab (von deren Masse)! Die mittlere Geschwindigkeit der Teilchen hängt von der Temperatur ab. Prof. F. Wörgötter (nach M. Seibt) -- Physik für Mediziner und Zahnmediziner 5

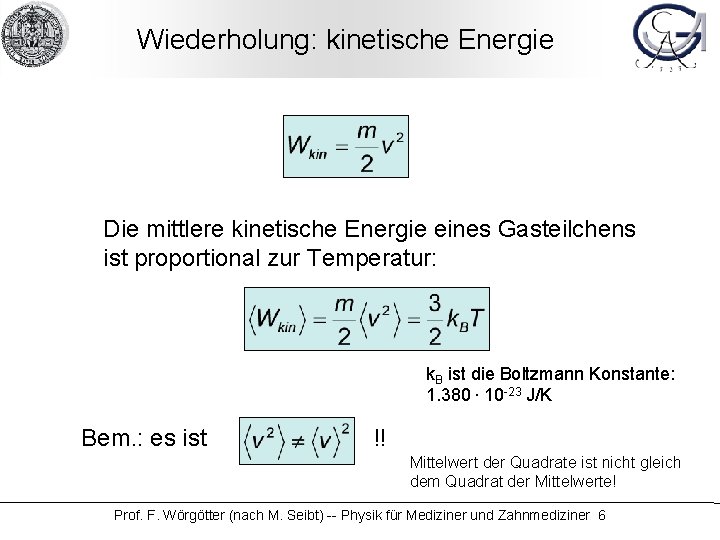
Wiederholung: kinetische Energie Die mittlere kinetische Energie eines Gasteilchens ist proportional zur Temperatur: k. B ist die Boltzmann Konstante: 1. 380. 10 -23 J/K Bem. : es ist !! Mittelwert der Quadrate ist nicht gleich dem Quadrat der Mittelwerte! Prof. F. Wörgötter (nach M. Seibt) -- Physik für Mediziner und Zahnmediziner 6

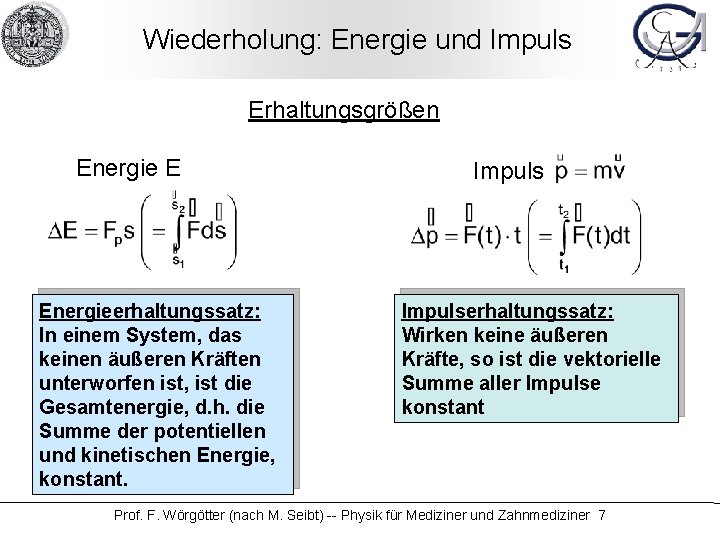
Wiederholung: Energie und Impuls Erhaltungsgrößen Energie E Energieerhaltungssatz: In einem System, das keinen äußeren Kräften unterworfen ist, ist die Gesamtenergie, d. h. die Summe der potentiellen und kinetischen Energie, konstant. Impulserhaltungssatz: Wirken keine äußeren Kräfte, so ist die vektorielle Summe aller Impulse konstant Prof. F. Wörgötter (nach M. Seibt) -- Physik für Mediziner und Zahnmediziner 7

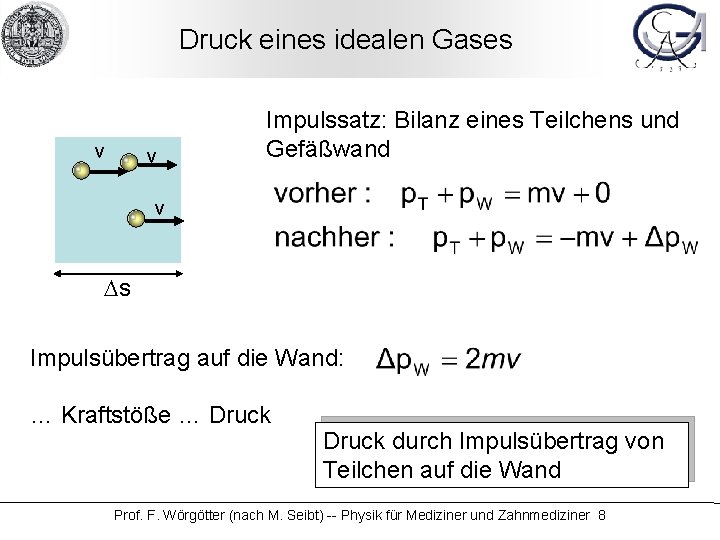
Druck eines idealen Gases v v Impulssatz: Bilanz eines Teilchens und Gefäßwand A v Ds Impulsübertrag auf die Wand: … Kraftstöße … Druck durch Impulsübertrag von Teilchen auf die Wand Prof. F. Wörgötter (nach M. Seibt) -- Physik für Mediziner und Zahnmediziner 8

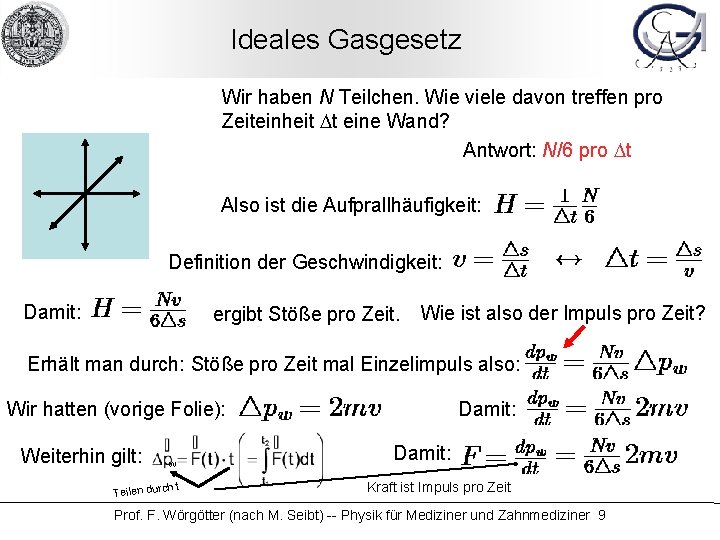
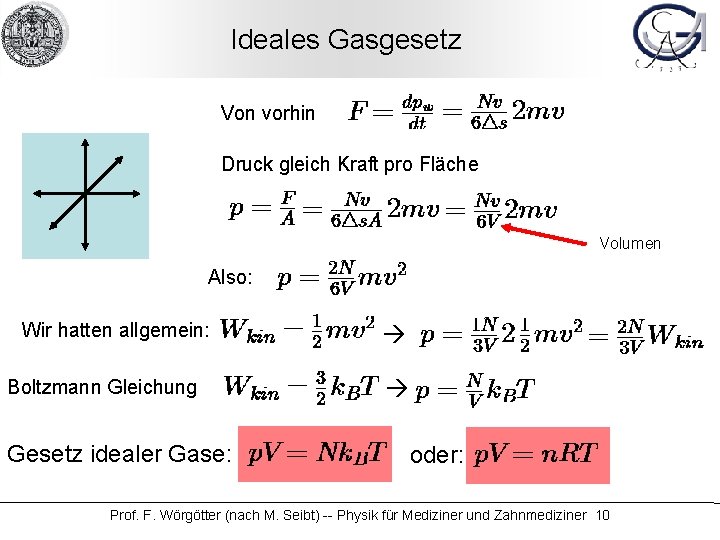
Ideales Gasgesetz Wir haben N Teilchen. Wie viele davon treffen pro Zeiteinheit Dt eine Wand? Antwort: N/6 pro Dt Also ist die Aufprallhäufigkeit: Definition der Geschwindigkeit: Damit: ergibt Stöße pro Zeit. Wie ist also der Impuls pro Zeit? Erhält man durch: Stöße pro Zeit mal Einzelimpuls also: Damit: Wir hatten (vorige Folie): Weiterhin gilt: w ht Teilen durc Damit: Kraft ist Impuls pro Zeit Prof. F. Wörgötter (nach M. Seibt) -- Physik für Mediziner und Zahnmediziner 9

Ideales Gasgesetz Von vorhin Druck gleich Kraft pro Fläche Volumen Also: Wir hatten allgemein: Boltzmann Gleichung Gesetz idealer Gase: oder: Prof. F. Wörgötter (nach M. Seibt) -- Physik für Mediziner und Zahnmediziner 10

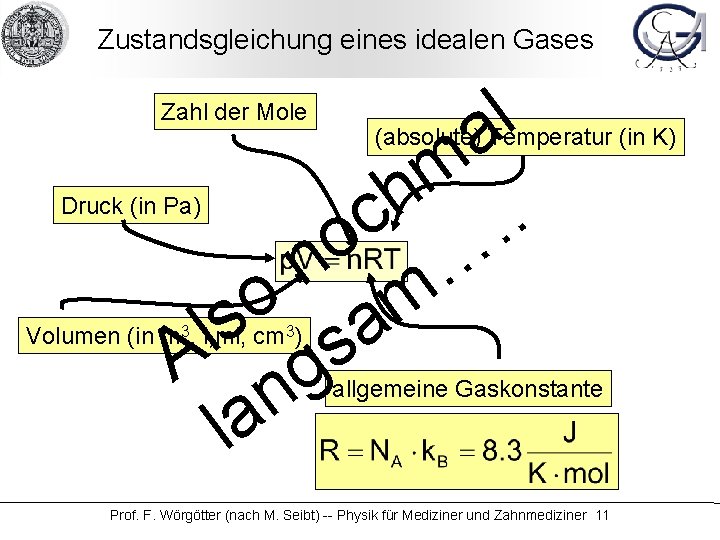
Zustandsgleichung eines idealen Gases l a m h. c. o n … o m s sa l A g n la Zahl der Mole (absolute) Temperatur (in K) Druck (in Pa) Volumen (in m 3, l, ml, cm 3) allgemeine Gaskonstante Prof. F. Wörgötter (nach M. Seibt) -- Physik für Mediziner und Zahnmediziner 11

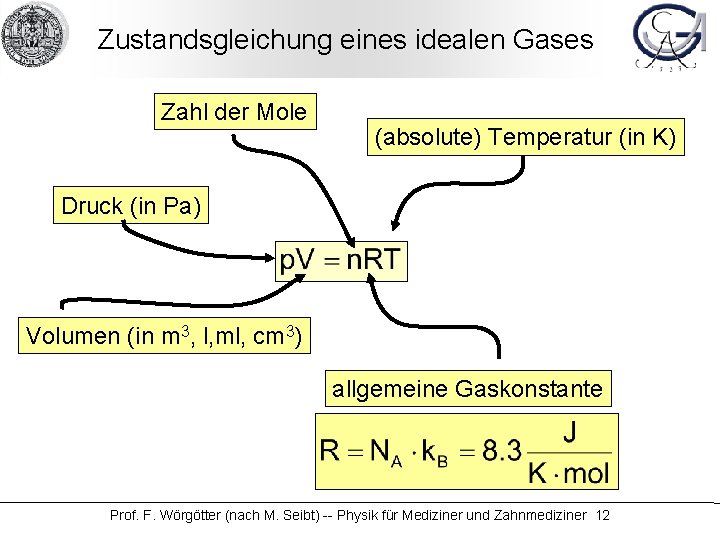
Zustandsgleichung eines idealen Gases Zahl der Mole (absolute) Temperatur (in K) Druck (in Pa) Volumen (in m 3, l, ml, cm 3) allgemeine Gaskonstante Prof. F. Wörgötter (nach M. Seibt) -- Physik für Mediziner und Zahnmediziner 12

Molvolumen Oder aber: 18 g Wasser ergeben 22. 4 Liter Dampfffffff Oder aber 1 l Wasser ergeben 1244 l Dampfffffffffffff (Sauna!) Prof. F. Wörgötter (nach M. Seibt) -- Physik für Mediziner und Zahnmediziner 13

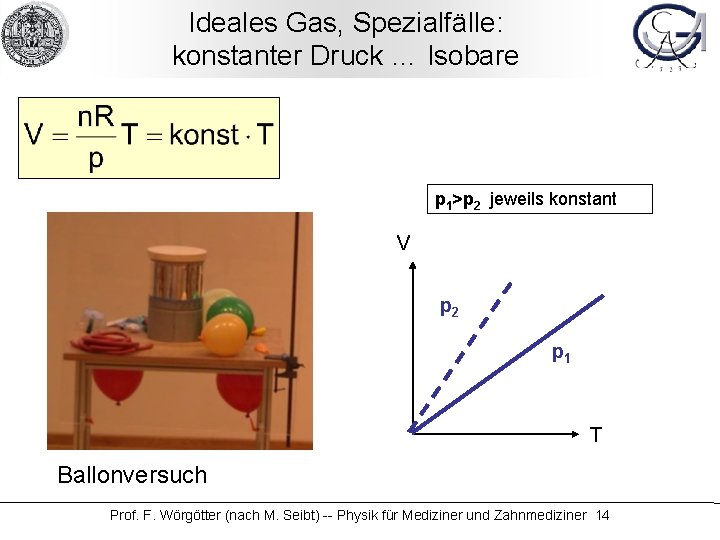
Ideales Gas, Spezialfälle: konstanter Druck … Isobare p 1>p 2 jeweils konstant V p 2 p 1 T Ballonversuch Prof. F. Wörgötter (nach M. Seibt) -- Physik für Mediziner und Zahnmediziner 14

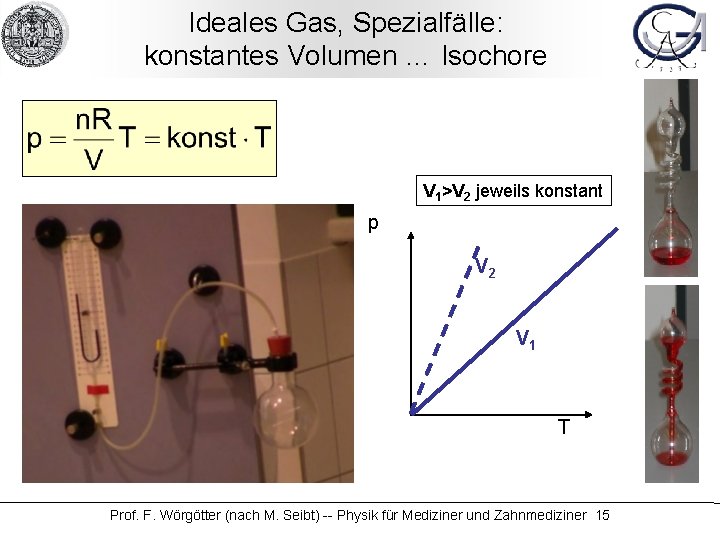
Ideales Gas, Spezialfälle: konstantes Volumen … Isochore V 1>V 2 jeweils konstant p V 2 V 1 T Prof. F. Wörgötter (nach M. Seibt) -- Physik für Mediziner und Zahnmediziner 15

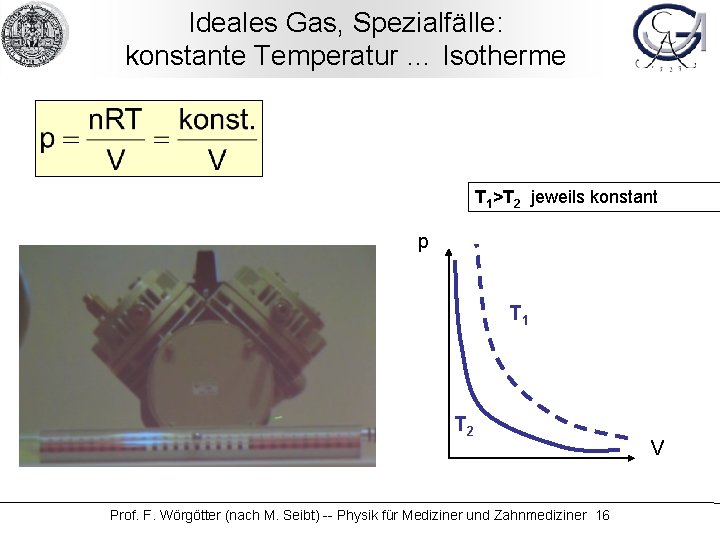
Ideales Gas, Spezialfälle: konstante Temperatur … Isotherme T 1>T 2 jeweils konstant p T 1 T 2 Prof. F. Wörgötter (nach M. Seibt) -- Physik für Mediziner und Zahnmediziner 16 V

Ideales Gas, Spezialfälle: Kein Wärmetransport: adiabatisch Alle Größen der Gleichung ändern sich da keine Wärme an die Umgebung abgegeben wird (kein Wärmeaustausch) p. V=FA-1 V=Fs=W Prozesse innerhalb einer Thermoskanne sind adiabatisch. Prof. F. Wörgötter (nach M. Seibt) -- Physik für Mediziner und Zahnmediziner 17

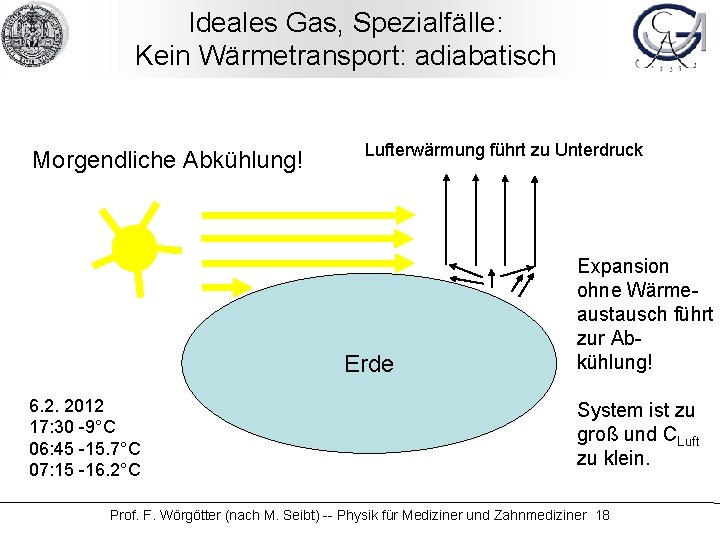
Ideales Gas, Spezialfälle: Kein Wärmetransport: adiabatisch Morgendliche Abkühlung! Lufterwärmung führt zu Unterdruck Erde 6. 2. 2012 17: 30 -9°C 06: 45 -15. 7°C 07: 15 -16. 2°C Expansion ohne Wärmeaustausch führt zur Abkühlung! System ist zu groß und CLuft zu klein. Prof. F. Wörgötter (nach M. Seibt) -- Physik für Mediziner und Zahnmediziner 18

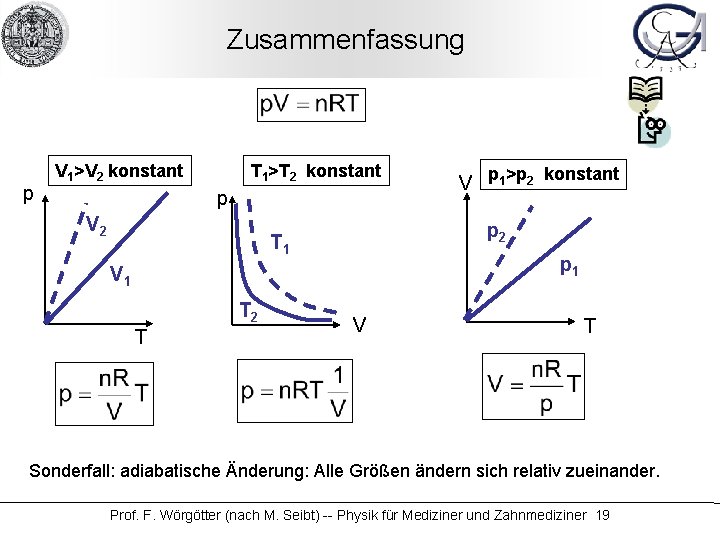
Zusammenfassung p T 1>T 2 konstant V 1>V 2 konstant p V 2 p 2 T 1 p 1 V 1 T 2 T V p 1>p 2 konstant V T Sonderfall: adiabatische Änderung: Alle Größen ändern sich relativ zueinander. Prof. F. Wörgötter (nach M. Seibt) -- Physik für Mediziner und Zahnmediziner 19

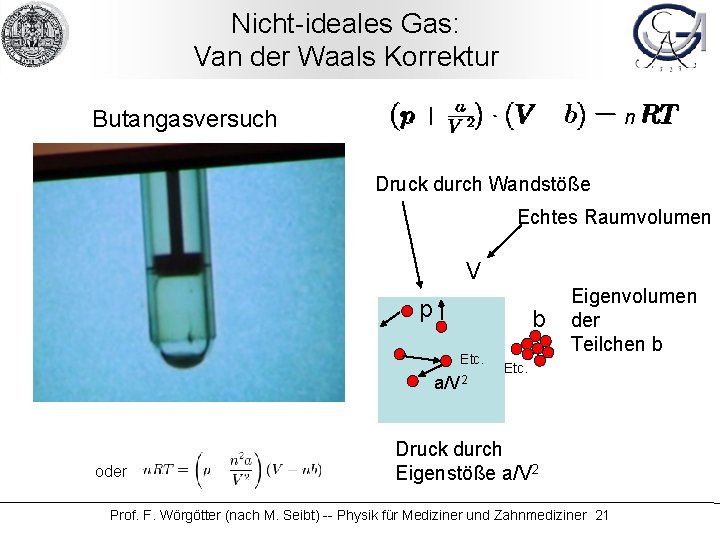
Nicht-ideales Gas: Van der Waals Korrektur Butangasversuch Prof. F. Wörgötter (nach M. Seibt) -- Physik für Mediziner und Zahnmediziner 20

Nicht-ideales Gas: Van der Waals Korrektur Butangasversuch n Druck durch Wandstöße Echtes Raumvolumen V p b Etc. a/V 2 oder Eigenvolumen der Teilchen b Etc. Druck durch Eigenstöße a/V 2 Prof. F. Wörgötter (nach M. Seibt) -- Physik für Mediziner und Zahnmediziner 21

Standardbedingungen Angabe von Volumina erfordert Angabe von Druck und Temperatur STPD: Standard Temperature Pressure Dry Tn =0°C, pn =101 k. Pa, p. H 2 O=0 (trockenes Gas) BTPS: Body Temperature Pressure Saturated T=37°C (310 K), p. H 2 O=6. 3 k. Pa ATPS: Ambient Temperature Pressure Saturated T= Umgebungstemperatur, p= Umgebungsdruck, p. H 2 O=p. H 2 O(T) Prof. F. Wörgötter (nach M. Seibt) -- Physik für Mediziner und Zahnmediziner 22

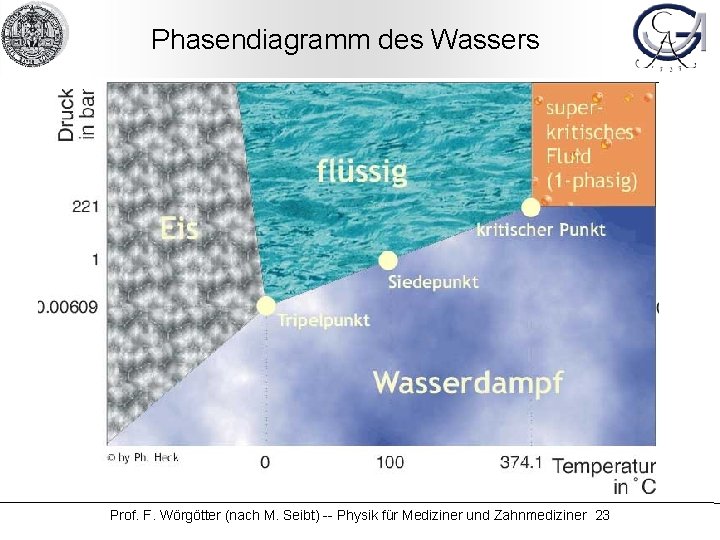
Phasendiagramm des Wassers Prof. F. Wörgötter (nach M. Seibt) -- Physik für Mediziner und Zahnmediziner 23

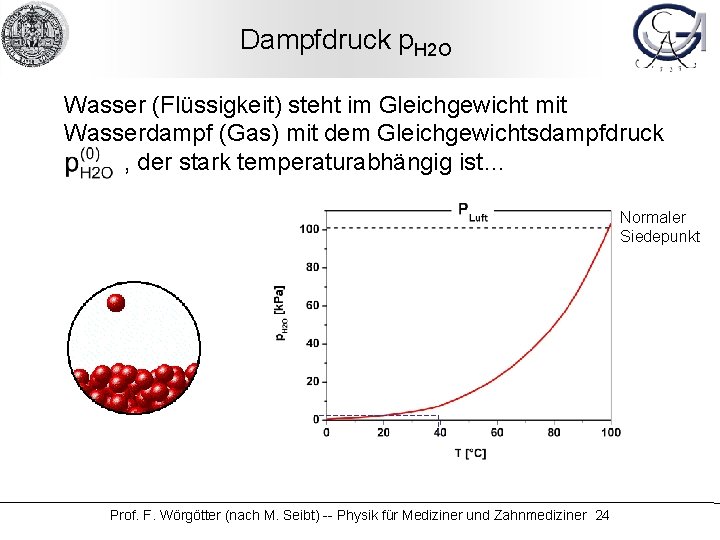
Dampfdruck p. H 2 O Wasser (Flüssigkeit) steht im Gleichgewicht mit Wasserdampf (Gas) mit dem Gleichgewichtsdampfdruck , der stark temperaturabhängig ist… Normaler Siedepunkt Prof. F. Wörgötter (nach M. Seibt) -- Physik für Mediziner und Zahnmediziner 24
![Gasgemische Partialdruck Zusammensetzung der Luft Gas Volumenanteil N 2 78 1 O 2 Gasgemische: Partialdruck Zusammensetzung der Luft Gas Volumenanteil [%] N 2 78. 1 O 2](https://slidetodoc.com/presentation_image_h/c375b6a0eb568ce299955dbbb0f9460f/image-25.jpg)
Gasgemische: Partialdruck Zusammensetzung der Luft Gas Volumenanteil [%] N 2 78. 1 O 2 20. 9 Ar 0. 93 CO 2 0. 03 Rest 0. 04 ideales Gas: Zustandsgleichung gilt für jede Komponente i … d. h. jede Komponente verhält sich so, als ob keine weiteren Gasteilchen vorhanden wären… Prof. F. Wörgötter (nach M. Seibt) -- Physik für Mediziner und Zahnmediziner 25
![Gasgemische Partialdruck Zusammensetzung der Luft Gas pi k Pa N 2 79 7 O Gasgemische: Partialdruck Zusammensetzung der Luft Gas pi [k. Pa] N 2 79. 7 O](https://slidetodoc.com/presentation_image_h/c375b6a0eb568ce299955dbbb0f9460f/image-26.jpg)
Gasgemische: Partialdruck Zusammensetzung der Luft Gas pi [k. Pa] N 2 79. 7 O 2 21. 2 Ar 0. 94 CO 2 0. 03 Rest 0. 04 Summe 101. 3 Prof. F. Wörgötter (nach M. Seibt) -- Physik für Mediziner und Zahnmediziner 26

Schmidt/Thews: Physiologie des Menschen Jedes O 2 - bzw. CO 2 - Molekül, das in der Lunge oder den Geweben ausgetauscht wird, durchläuft den Zustand der physikalischen Lösung. Prof. F. Wörgötter (nach M. Seibt) -- Physik für Mediziner und Zahnmediziner 27

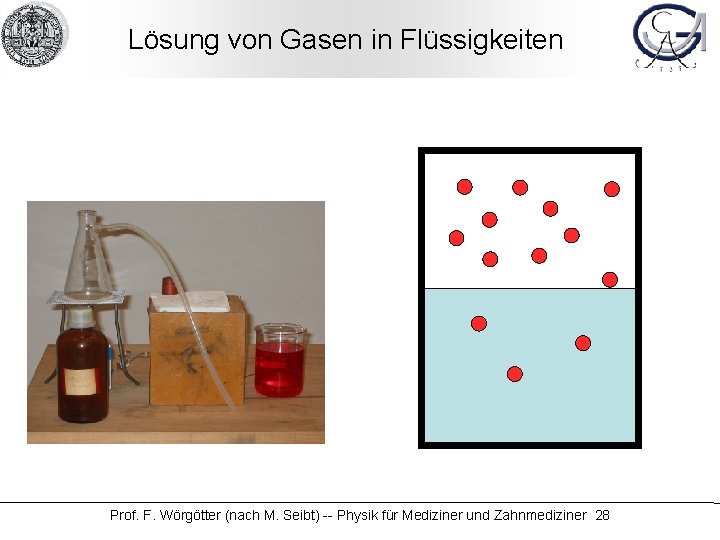
Lösung von Gasen in Flüssigkeiten Prof. F. Wörgötter (nach M. Seibt) -- Physik für Mediziner und Zahnmediziner 28

Löslichkeit: Henry-Gesetz gelöstes Gasvolumen (STPD) Flüssigkeitsvolumen Löslichkeit (Einheit: k. Pa-1) Die Konzentration des in der Flüssigkeit gelösten Gases ist proportional zu seinem Partialdruck im umgebenden Gasraum. Zusammenhang von Konzentration und Partialdruck Prof. F. Wörgötter (nach M. Seibt) -- Physik für Mediziner und Zahnmediziner 29

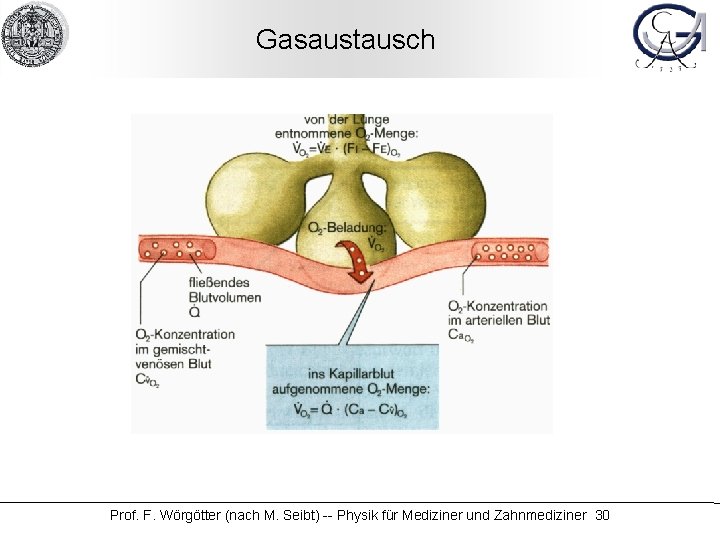
Gasaustausch Prof. F. Wörgötter (nach M. Seibt) -- Physik für Mediziner und Zahnmediziner 30

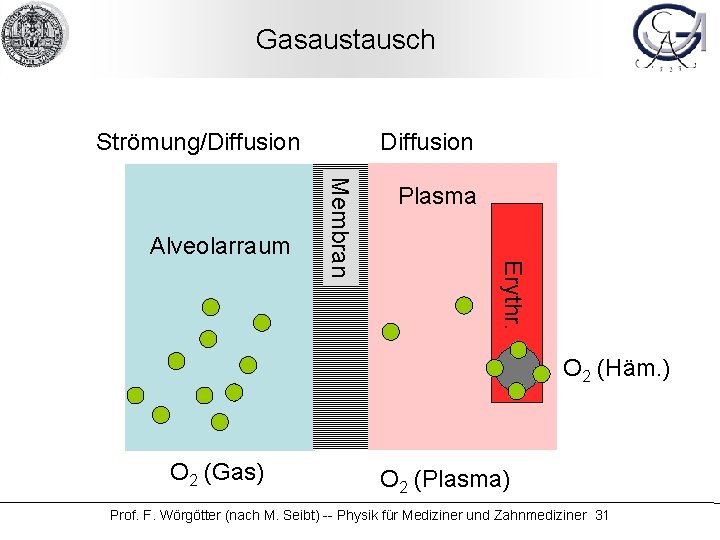
Gasaustausch Strömung/Diffusion Plasma Erythr. Membran Alveolarraum Diffusion O 2 (Häm. ) O 2 (Gas) O 2 (Plasma) Prof. F. Wörgötter (nach M. Seibt) -- Physik für Mediziner und Zahnmediziner 31

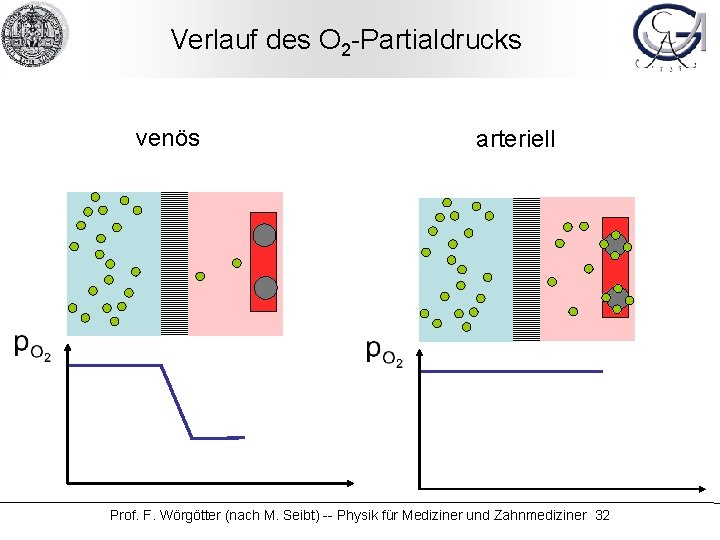
Verlauf des O 2 -Partialdrucks venös arteriell Prof. F. Wörgötter (nach M. Seibt) -- Physik für Mediziner und Zahnmediziner 32

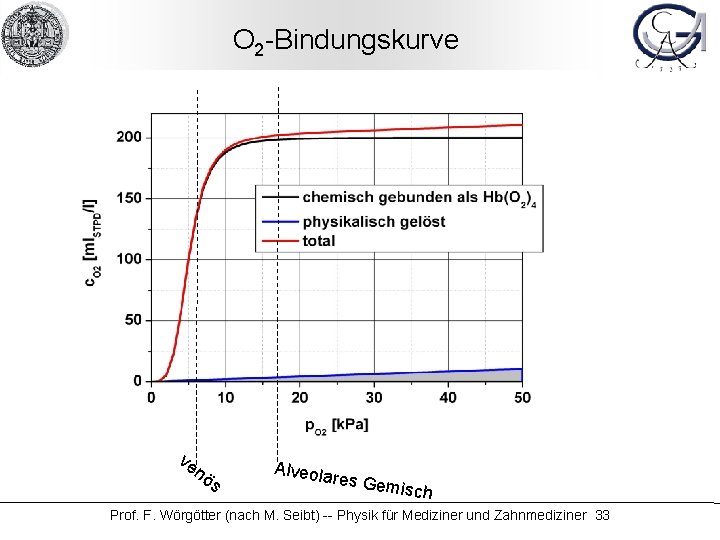
O 2 -Bindungskurve ve nö s Alveola res Gem isch Prof. F. Wörgötter (nach M. Seibt) -- Physik für Mediziner und Zahnmediziner 33

Überblick aus: Klinke/Silbernagel: Lehrbuch der Physiologie Prof. F. Wörgötter (nach M. Seibt) -- Physik für Mediziner und Zahnmediziner 34
![Löslichkeiten α 1k Pa Lösungsmittel O 2 CO 2 N 2 H 2 O Löslichkeiten α [1/k. Pa] Lösungsmittel O 2 CO 2 N 2 H 2 O](https://slidetodoc.com/presentation_image_h/c375b6a0eb568ce299955dbbb0f9460f/image-35.jpg)
Löslichkeiten α [1/k. Pa] Lösungsmittel O 2 CO 2 N 2 H 2 O T=20°C 3. 1∙ 10 -4 88∙ 10 -4 1. 6∙ 10 -4 H 2 O T=37°C 2. 4∙ 10 -4 57∙ 10 -4 1. 2∙ 10 -4 Blut T=37°C 2. 4∙ 10 -4 49∙ 10 -4 1. 2∙ 10 -4 Prof. F. Wörgötter (nach M. Seibt) -- Physik für Mediziner und Zahnmediziner 35

Taucherkrankheit und Sektflasche • (hydrostatischer) Druck steigt mit Tauchtiefe um ca. 100 k. Pa/10 m • Folge: Lösung eines größeren Volumens der Atemgase im Blut und im Gewebe • überschüssiges gelöstes Gas kann Blasen beim (zu schnellen) Auftauchen bilden… • Dekompression Prof. F. Wörgötter (nach M. Seibt) -- Physik für Mediziner und Zahnmediziner 36


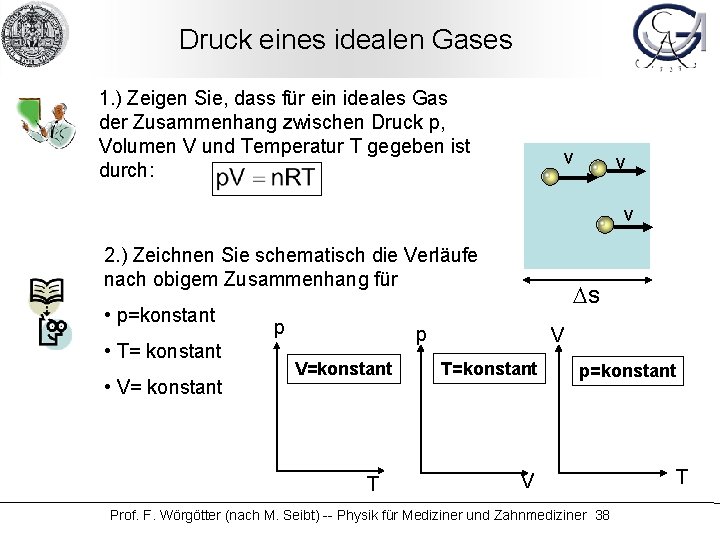
Druck eines idealen Gases 1. ) Zeigen Sie, dass für ein ideales Gas der Zusammenhang zwischen Druck p, Volumen V und Temperatur T gegeben ist durch: v v A v 2. ) Zeichnen Sie schematisch die Verläufe nach obigem Zusammenhang für • p=konstant • T= konstant • V= konstant p Ds p V=konstant T V T=konstant p=konstant V Prof. F. Wörgötter (nach M. Seibt) -- Physik für Mediziner und Zahnmediziner 38 T

Aufgabe Die mittlere kinetische Energie idealer Gase beträgt pro Teilchen (Atom oder Molekül): wobei k. B=1. 38· 10 -23 J/K (Boltzmann-Konstante) und T die absolute Temperatur bezeichnen. Berechnen Sie die mittlere Geschwindigkeit eines O 2 -Moleküls bei Raumtemperatur, T=300 K. Die Masse eines Mols (=6· 1023 Teilchen) O 2 beträgt M=32 g. Prof. F. Wörgötter (nach M. Seibt) -- Physik für Mediziner und Zahnmediziner 39

Lösung Die mittlere kinetische Energie idealer Gase beträgt pro Teilchen (Atom oder Molekül): wobei k. B=1. 38· 10 -23 J/K (Boltzmann-Konstante) und T die absolute Temperatur bezeichnen. Berechnen Sie die mittlere Geschwindigkeit eines O 2 -Moleküls bei Raumtemperatur, T=300 K. Die Masse eines Mols (=6· 1023 Teilchen) O 2 beträgt M=32 g. Prof. F. Wörgötter (nach M. Seibt) -- Physik für Mediziner und Zahnmediziner 40

Prof. F. Wörgötter (nach M. Seibt) -- Physik für Mediziner und Zahnmediziner 41

Prof. F. Wörgötter (nach M. Seibt) -- Physik für Mediziner und Zahnmediziner 42
 Chemie für mediziner
Chemie für mediziner Gesamtbanksteuerung vorlesung
Gesamtbanksteuerung vorlesung De morgansche regel
De morgansche regel Gesamtbanksteuerung
Gesamtbanksteuerung Sachenrecht vorlesung
Sachenrecht vorlesung Vorlesung
Vorlesung Vorlesung finanzmathematik
Vorlesung finanzmathematik Gesamtbanksteuerung vorlesung
Gesamtbanksteuerung vorlesung Technische zeichnung
Technische zeichnung Metechnik
Metechnik Lehrplan ahs oberstufe physik
Lehrplan ahs oberstufe physik Fr physik
Fr physik Natürlicher und künstlicher treibhauseffekt
Natürlicher und künstlicher treibhauseffekt Atome
Atome Hüpfender ball physik
Hüpfender ball physik Leifi physik hall effekt
Leifi physik hall effekt Experiment garnrolle
Experiment garnrolle Impuls physik 3
Impuls physik 3 Einseitiger und zweiseitiger hebel
Einseitiger und zweiseitiger hebel Impuls physik 3
Impuls physik 3 Bewegungsdiagramme physik
Bewegungsdiagramme physik Impuls physik 2
Impuls physik 2 Facharbeit physik astronomie
Facharbeit physik astronomie Kirchhoff institut für physik
Kirchhoff institut für physik Aufbau der physik
Aufbau der physik Reibungsarten
Reibungsarten Impuls physik 3
Impuls physik 3 Verschiedene linsen physik
Verschiedene linsen physik Extraterrestrische physik lehrbuch
Extraterrestrische physik lehrbuch Newtonsche gesetze
Newtonsche gesetze Impuls physik 2
Impuls physik 2 Physik multimedial
Physik multimedial Mgh physik
Mgh physik Wärmepumpe funktionsweise physik
Wärmepumpe funktionsweise physik Nf physik
Nf physik Hydrostatisches paradoxon experiment
Hydrostatisches paradoxon experiment Gefahrensymbole physik
Gefahrensymbole physik Ist der mond eine natürliche lichtquelle
Ist der mond eine natürliche lichtquelle Impuls physik 2
Impuls physik 2 Fr physik
Fr physik Flaschenzug und hebel
Flaschenzug und hebel Wie funktioniert ein hebel physik
Wie funktioniert ein hebel physik Impuls physik 2
Impuls physik 2