FISICOQUIMICA I Semestre 2011 1 Presentacin 2 Profesor


































- Slides: 51

FISICOQUIMICA I Semestre 2011 -1

Presentación 2

Profesor de teoría: Lic. Juan Carlos Morales Gomero Horario de clase: Martes: 12 -14 hrs Jueves: 10 -12 hrs e-mail: gomero_uni@hotmail. com Profesores de práctica: 1. Lic. Rosario López Cisneros Horario de laboratorio: Martes: 8 -11 hrs 2. Lic. Juan Montes de Oca Horario de laboratorio: Martes: 15 -19 hrs 3

http: //cq 251. wordpress. com/ 4

Bienvenidos al Espacio Virtual de Fisicoquímica I El Espacio Virtual de Fisicoquímica tiene como objetivo proveer al alumno de un rápido acceso a la información referente a la asignatura, así como generar una instancia alternativa para la comunicación con sus docentes. La mayor parte de la información suministrada en este Espacio es consistente y equivalente a la información brindada durante las clases presenciales. . Adicionalmente hay información en este Espacio que no aparecerá en la página web, como son los videos mostrativos de Trabajos Prácticos y las actividades adicionales de Fisicoquímica. A través de los Foros de Discusión se espera que el alumno pueda interaccionar con sus docentes en materia de Trabajos Prácticos, Seminarios y Teóricas. Estas interacciones son de carácter consultivo y no reemplazan la información provista por el material impreso del curso, el material de apoyo de las clases y/o los libros de consulta. Los docentes de Fisicoquímica esperamos seguir enriqueciendo esta modalidad y para ello promovemos tanto el uso del Espacio como la generación de ideas y críticas que el alumno pueda aportar.

Fisicoquímica Aplicación de la física a la química ØDesarrolla explicaciones rigurosas y detalladas unificando conceptos de la química ØContiene modelos matemáticos que proporcionan predicciones cuantitativas. ØIncluye conceptos escenciales para estudiar cursos avanzados de química Fuente: American Chemical Society

Ø Physical chemists generally describe themselves as having a strong curiosity about how things work at the atomic level… American Chemical Society, 2009

Temas de la Fisicoquímica Ø Problemas centrales: » Posición del equilibrio químico A+B C+D Estrategia tradicional Termodinámica de equilibrio Capítulos 1 -12 Tasa de reacción: Cinética » Estructura electrónica Estrategias: » Ø » De arriba hacia abajo (tradicion/histórica) ® ® » Comienza con la observación Examina cómo dependen los observables de la estructura de la materia De abajo hacia arriba (aproximación molecular) ® ® Cinética Capítulos 26 -32 Estructura electrónica Considera la estructura de la materia y luego Deriva los observables Termodinámica estadística espectroscopía

CONTENIDO Ø Ø Ø Capítulo 1: Gases reales Capítulo 2: Primera ley de la termodinámica Capítulo 3: Segunda y Tercera ley de la termodinámica Capítulo 4: Equilibrio químico Capítulo 5: Cambios de Estado. Sustancias puras. Capítulo 6: Cambios de Estado. Reglas de fases 9

CAPÍTULO 1 Ø Ø Gases ideales: propiedades, leyes y mezclas. Teoría Cinética de los gases. Gas Real: propiedades, ecuaciones de estados y mezclas. Gráficos de dependencia de un gas real con la temperatura y presión. 10

Ecuaciones de estado Ø Gases son el estado de agregación molecular más simple » » Ø Ecuación de estado – ecuación que relaciona las variables que describen el estado físico del sistema » » Ø Llenan completamente el recipiente que los contiene Son totalmente solubles entre ellos Ecuación de estado para un gas: p = f (T, V, n) Propiedades de Gases (puros) – cuatro, pero con sólo tres especificamos el estado del sistema Presión (p), Volumen (V), Temperatura (T), cantidad de sustancia (moles, n) 11

Ecuaciones de estado Ø Presión, p, fuerza por unidad de área, N/m 2 = Pa (pascal) » » presión estándar = pø = 105 Pa = 1 bar Medida por manómetro (tubo abierto o cerrado), p = pexterna + rgh ®g » Ø = 9. 81 ms-2 Equilibrio mecánico – las presiones deben ser las mismas a uno y otro lado de las paredes Volumen, V » m 3 , L Ø Cantidad de sustancia (número de moles), n Temperatura, T, indica dirección del flujo de energía (calor) Ø Fronteras entre sistemas Ø » » Diatérmicas – permiten flujo de calor. Ocurre un cambio de estado cuando entran en contacto sistemas con diferentes temperaturas Adiabáticas – no permiten el flujo de calor. 12

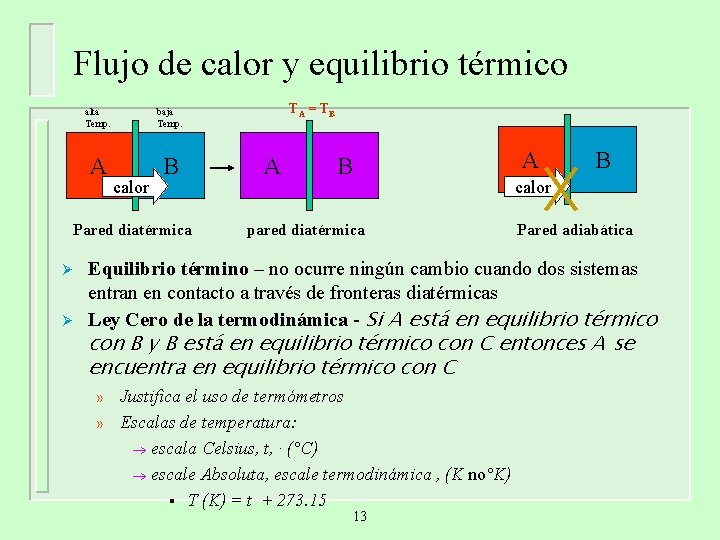
Flujo de calor y equilibrio térmico alta Temp. baja Temp. A B calor Pared diatérmica Ø Ø TA = T B A A B B calor pared diatérmica Pared adiabática Equilibrio término – no ocurre ningún cambio cuando dos sistemas entran en contacto a través de fronteras diatérmicas Ley Cero de la termodinámica - Si A está en equilibrio térmico con B y B está en equilibrio térmico con C entonces A se encuentra en equilibrio térmico con C » » Justifica el uso de termómetros Escalas de temperatura: ® escala Celsius, t, · (°C) ® escale Absoluta, escale termodinámica , (K no°K) § T (K) = t + 273. 15 13

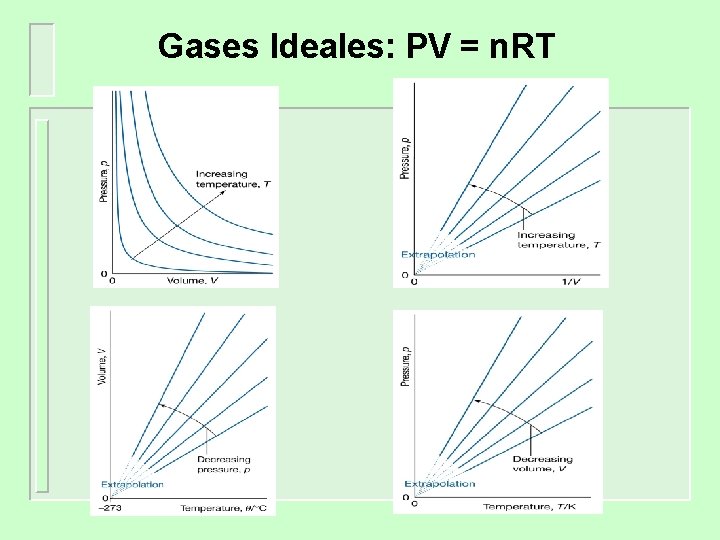
Ecuación de estado ( p = f(V, T, N) Ley del Gas Ideal (gas perfecto) Ø Es una ecuación de estado, aproximada, para cualquier gas » p. V = n. RT; p. Vm = RT » R, constante general del edo. gaseoso, 8. 31447 JK-1 mol -1 ® Los » » gases se acercan más a este comportamiento cuando p ® 0. Es una ley límite ® para n y V fijos, si T ® 0, p ® 0 linealmente Casos particulares (antecedentes históricos): Ley de Boyle (1661), Ley de Charles [Gay-Lussac (1802 -08)]; principio de Avogodro (1811) Muy importante a STP (T= 298. 15, p = pø =1 bar), V/n (volumen molar) = 24. 789 L/mol 14

Ecuación de estado ( p = f(V, T, N) Ley del Gas Ideal (gas perfecto) Ø Para una cantidad fija de gas (n constante) la gráfica p. VT genera una superficie » » » Isobara - presión constante recta, V T Isoterma - temperatura constante, hipérbola, p. V = constante Isocora - volumen constante - recta p T http: //www. chem 1. com/acad/webtext/gas_2. html#PVT 15

Gases Ideales: PV = n. RT

Resumen Leyes de los Gases p T n V Boyle aumenta constante disminuye V 1/p Charles constante aumenta T V Avogadro constante aumenta n V 17

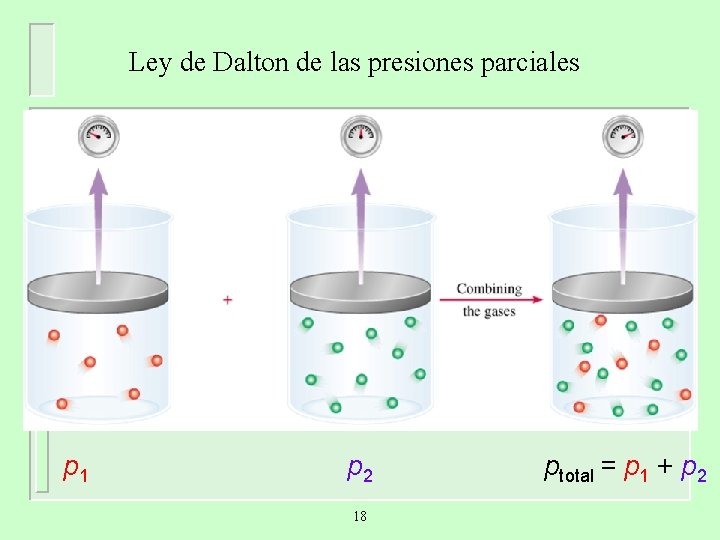
Ley de Dalton de las presiones parciales V y T son constantes p 1 p 2 18 ptotal = p 1 + p 2

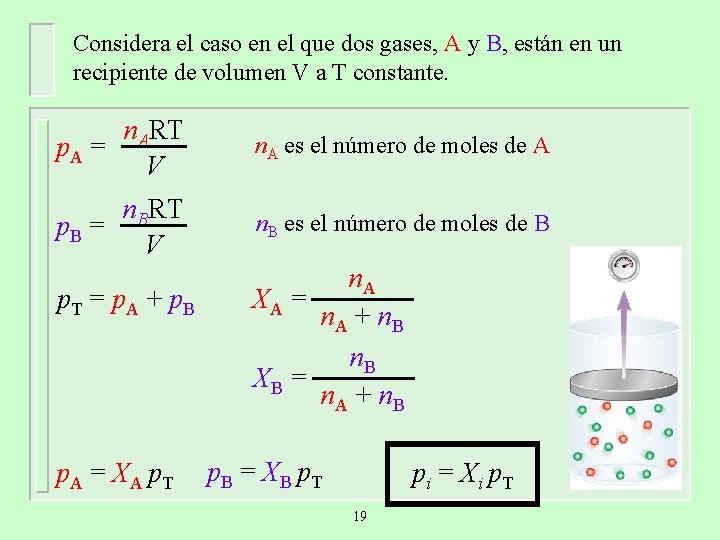
Considera el caso en el que dos gases, A y B, están en un recipiente de volumen V a T constante. n. ART p. A = V n. A es el número de moles de A n. BRT p. B = V n. B es el número de moles de B p. T = p. A + p. B p. A = XA p. T n. A XA = n. A + n. B XB = n. A + n. B p. B = XB p. T pi = Xi p. T 19

Considera el siguiente aparato. Calcula las presiones parciales de helio y de neón después de abrir la válvula. La temperatura se mantiene constante. He 1. 2 L, 0. 63 atm Ne 3. 4 L, 2. 8 atm 20

El etileno gaseoso, C 2 H 4, reacciona con gas hidrógeno en presencia de un catalizador de Pt para formar etano, C 2 H 6, según C 2 H 4(g) + H 2(g) C 2 H 6(g) Una mezcla de C 2 H 4 y H 2 de la que sólo se sabe que contiene más moles de H 2 que de C 2 H 4 tiene una presión de 52 torr en un volumen desconocido. Después de haber pasado la mezcla por un catalizador de Pt, su presión es de 34 torr en el mismo volumen y a la misma temperatura ¿qué fracción molar de la mezcla original era etileno? 21

Gases Teoría cinético-molecular 22

Teoría cinético molecular de los gases 1. Un gas está compuesto de moléculas que están separadas por distancias mucho mayores que sus propias dimensiones. Las moléculas pueden considerarse como puntos, es decir, poseen masa pero el volumen que ocupan es despreciable frente al volumen del recipiente que las contiene. 2. Las moléculas de los gases están en movimiento constante, y se desplazan en línea recta en direcciones aleatorias. 3. Las moléculas de gas no ejercen fuerzas atractivas ni repulsivas entre sí y son esferas duras. 4. Los impactos de las moléculas, unas con otras y contra las paredes del recipiente son perfectamente elásticos. 5. La energía cinética promedio de las moléculas es proporcional a la temperatura del gas en kelvins. Cualquiera de los gases a la misma temperatura tendrán la misma energía cinética promedio. 23

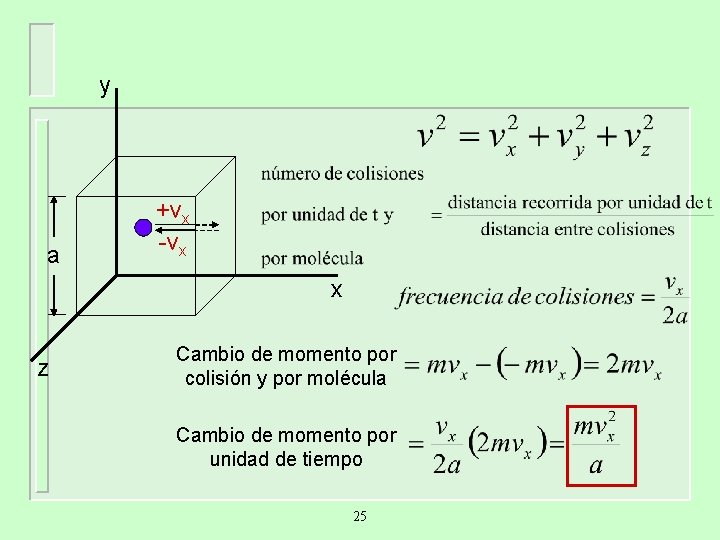
Derivación de la ecuación de un gas ideal Fuerza es la velocidad de cambio del momento. Al multiplicar esta cantidad por el número total de colisiones con las paredes del recipiente, en un tiempo dado t, obtendremos la fuerza total que se ejerce sobre las paredes. Al dividir la fuerza por el área de la pared se obtendrá la presión del gas 24

y a +vx -vx x z Cambio de momento por colisión y por molécula Cambio de momento por unidad de tiempo 25

Ø Dado que hay un gran número de moléculas, es necesario utilizar la velocidad de todas las N moléculas: Ø Esta cantidad es la fuerza total promedio, si la dividimos por el área (a 2) obtendremos la presión 26

Ø Puesto que los movimientos de las moléculas son totalmente fortuitos, los valores promedio de los cuadrados de las velocidades en las tres direcciones son iguales Ø Como la velocidad depende de la temperatura, y dado un número fijo de moléculas, a temperatura constante tendremos: Ley de Boyle 27

Energía cinética Ahora, si N es igual al número de Avogadro NA, entonces: ------- ec. 1 Comparando la ecuación 1 con la ecuación del gas ideal: La energía cinética promedio de translación de un gas depende exclusivamente de su temperatura

Ley de difusión de Graham Ø La ley de difusión de Graham establece que las velocidades a las que se difunden diferentes gases son inversamente proporcionales a las raíces cuadradas de sus densidades respectivas. Ø Comencemos por: 29

Cálculo de la raíz cuadrada media de la velocidad vrcm y, por lo tanto: 30

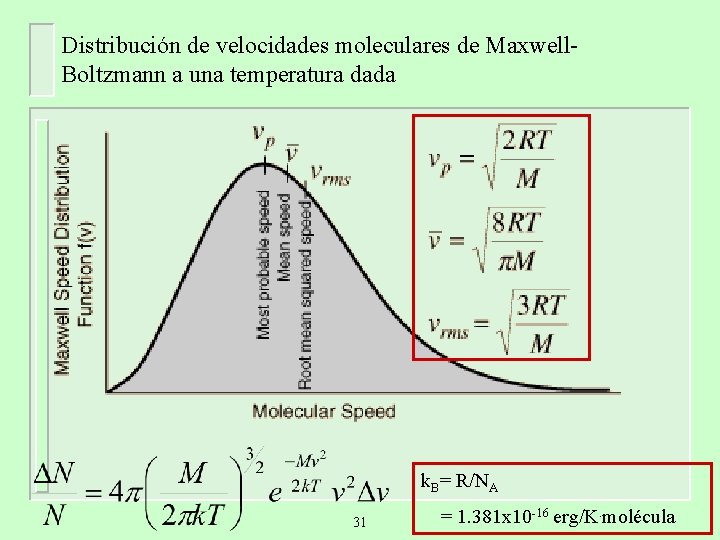
Distribución de velocidades moleculares de Maxwell. Boltzmann a una temperatura dada k. B= R/NA 31 = 1. 381 x 10 -16 erg/K. molécula

32

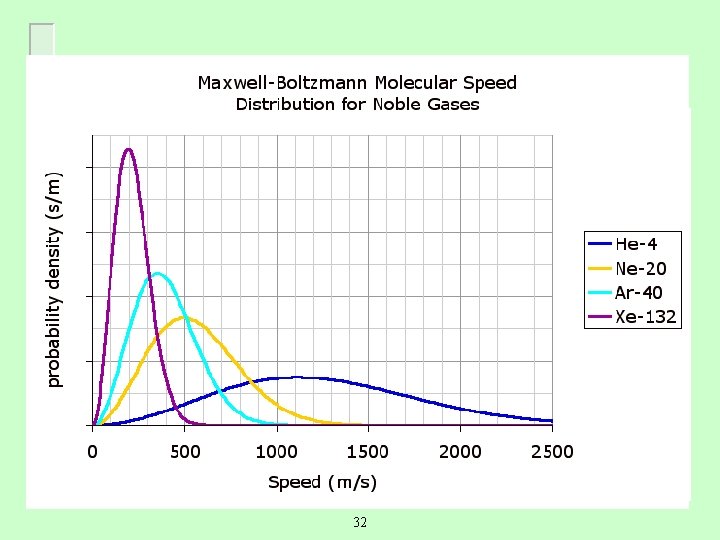
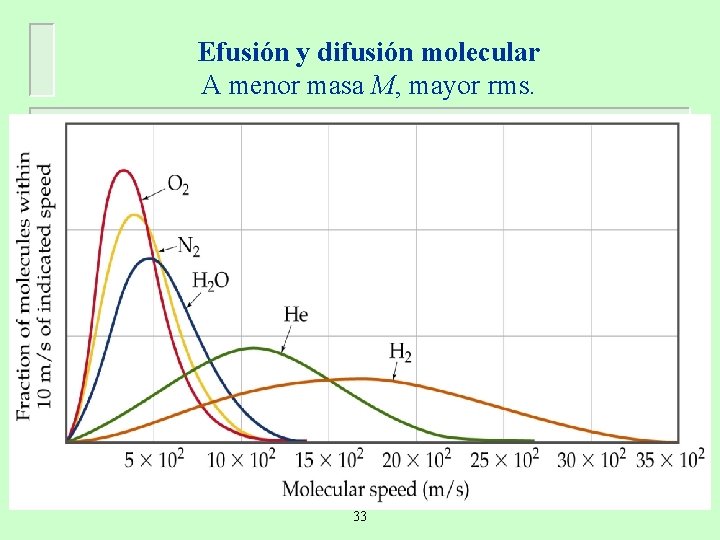
Efusión y difusión molecular A menor masa M, mayor rms. 33

Calcula vrcm, v y vp para He, Ne, Ar y Xe a 25 o. C 34

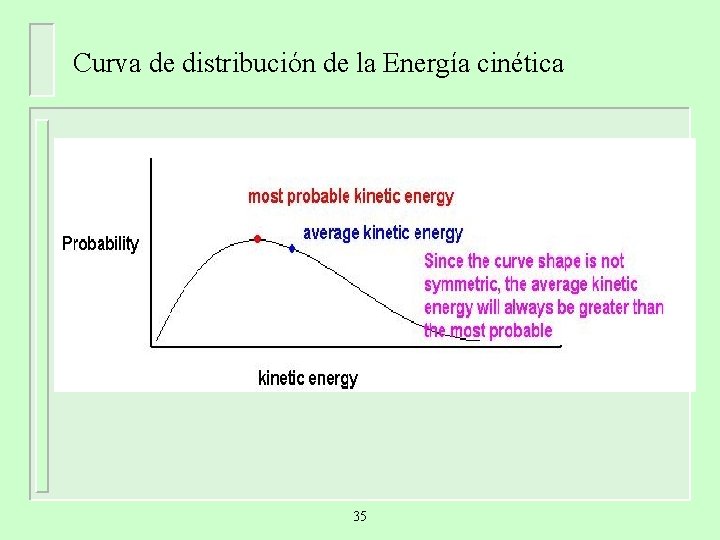
Curva de distribución de la Energía cinética 35

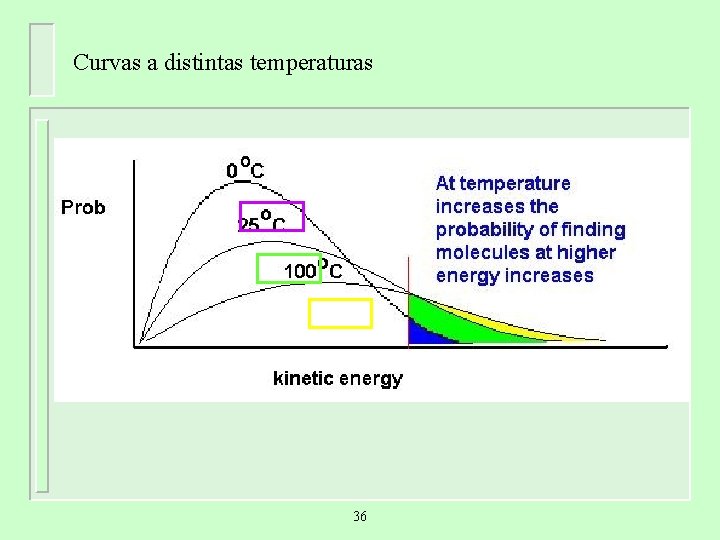
Curvas a distintas temperaturas 36

Teoría cinética de los gases y… • Compresibilidad de los gases • Ley de Boyle P es proporcional a la velocidad de colisión con las paredes Velocidad de colisión a densidad numérica Densidad numérica a 1/V p α 1/V • Ley de Charles P α velocidad de colisión con las paredes Velocidad de colisión α energía cinética promedio de las moléculas de gas Energía cinética promedio α T pαT

Teoría cinética de los gases y… • Ley de Avogadro p velocidad de colisión con las paredes Velocidad de colisión a densidad numérica Densidad numérica n pan • Ley de Dalton de las presiones parciales Las moléculas no se atraen o repelen entre ellas P ejercida por un tipo de molécula no se afectará por la presencia de otro gas ptotal = Spi

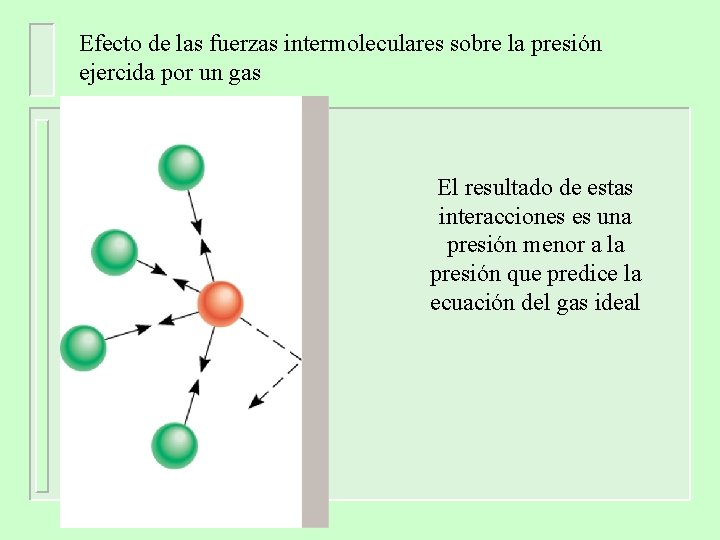
Efecto de las fuerzas intermoleculares sobre la presión ejercida por un gas El resultado de estas interacciones es una presión menor a la presión que predice la ecuación del gas ideal

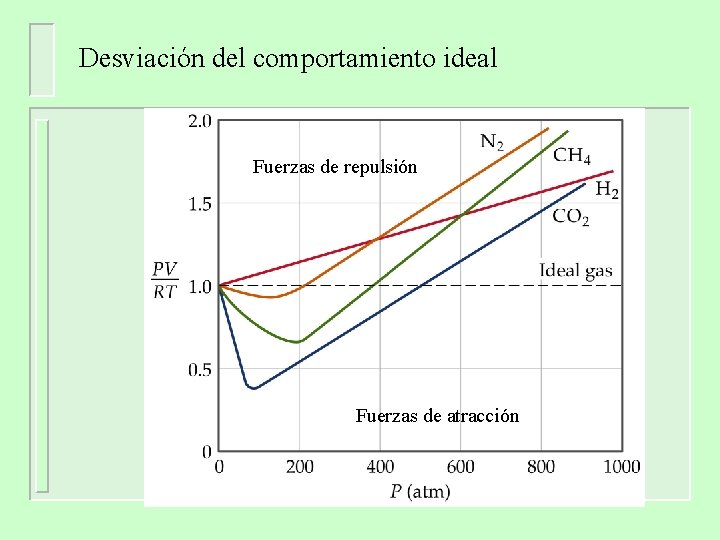
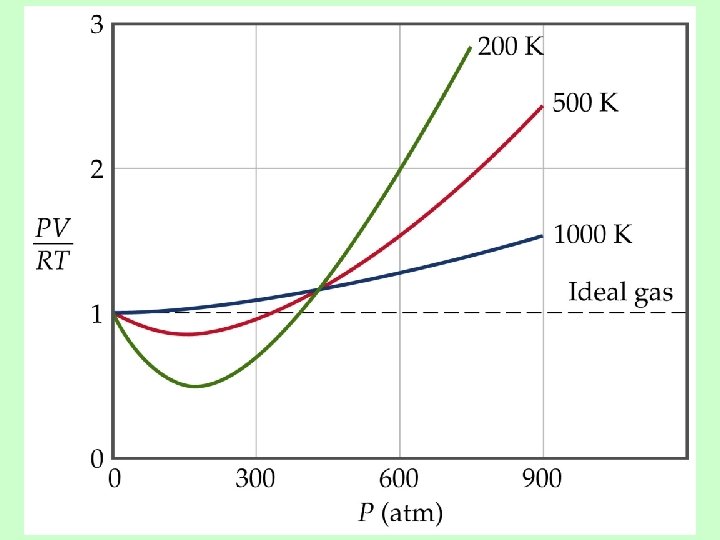
Desviación del comportamiento ideal 1 mol de gas ideal PV = n. RT PV = 1. 0 n= RT

Desviación del comportamiento ideal Fuerzas de repulsión Fuerzas de atracción


La ecuación de van der Waals Corrige las fuerzas de interacción molecular Ø Ø Ø Donde a es una constante y n y V son el número de moles y el volumen del recipiente, respectivamente. Las moléculas de gas si tienen volumen! El volumen efectivo para el movimiento molecular es menor al volumen del recipiente: Vef= V – nb

Constantes de van der Waals Gas a (atm. L 2/mol 2) b (L/mol) He 0. 034 0. 0237 Ar 1. 34 0. 0322 H 2 0. 244 0. 0266 N 2 1. 39 0. 0391 O 2 1. 36 0. 0318

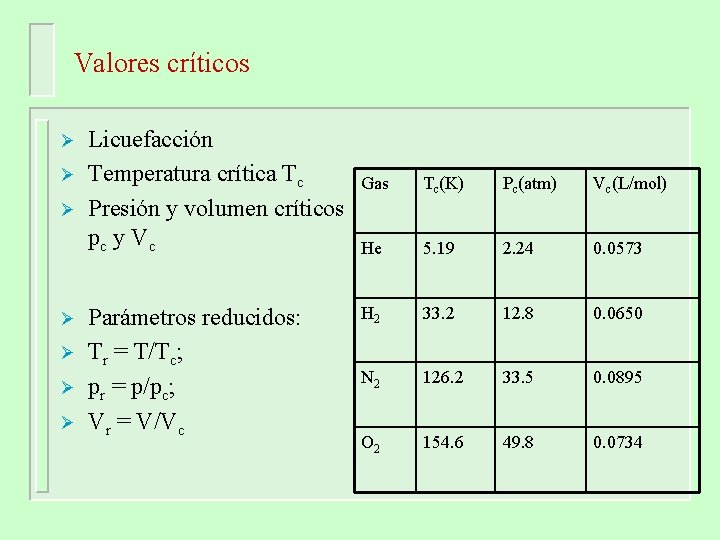
Valores críticos Ø Ø Ø Ø Licuefacción Temperatura crítica Tc Presión y volumen críticos pc y Vc Parámetros reducidos: Tr = T/Tc; pr = p/pc; Vr = V/Vc Gas Tc(K) Pc(atm) Vc(L/mol) He 5. 19 2. 24 0. 0573 H 2 33. 2 12. 8 0. 0650 N 2 126. 2 33. 5 0. 0895 O 2 154. 6 49. 8 0. 0734

Gases Reales - Otras Ecuaciones de estado » Berthelot (1898) ® Mejor que van der Waals a presiones no mucho mayores a 1 atm ®a es constante » van der Waals (1873) » Dieterici (1899)

La serie virial Ø Recordemos el factor de compresibilidad: Ø esta cantidad es 1 para el gas ideal y se aproxima a 1 cuando la presión tiende a cero para gases reales. Podemos representar z como una serie de potencias de la concentración molar n/V = 1/Vm: Ø Los coeficientes de esta expansión son función de T y se llaman los coeficientes viriales. » » B(T) es el segundo coeficiente virial y se puede calcular de las fuerzas de interacción entre pares. C(T) es el tercero e implica la interacción entre tres partículas… La ecuación virial tiene limitaciones, en particular a altas densidades o bajas temperaturas.

La serie virial Ø Ø El factor de compresibilidad también se puede escribir como una seria de potencias con la presión: z = 1 + Bp + Cp 2 + Dp 3 Esta ecuación es menos fundamental que la anterior pero tiene la ventaja de que puede resolverse explícitamente para el volumen. La forma más usada es: p. Vm = RT + bp +gp 2 + dp 3 + … Debería ser obvio que estos conjuntos de coeficientes viriales están relacionados como b = BRT, g = CRT, d = DRT, … Puede mostrarse que b = B y g = C – B 2/RT

Estimación de los coeficientes viriales Ø Si se conocen los coeficientes de Beattie-Bridgeman: Ø Si no se tienen a la mano dichos coeficientes, puede calcularse B(T) del estado crítico del gas:

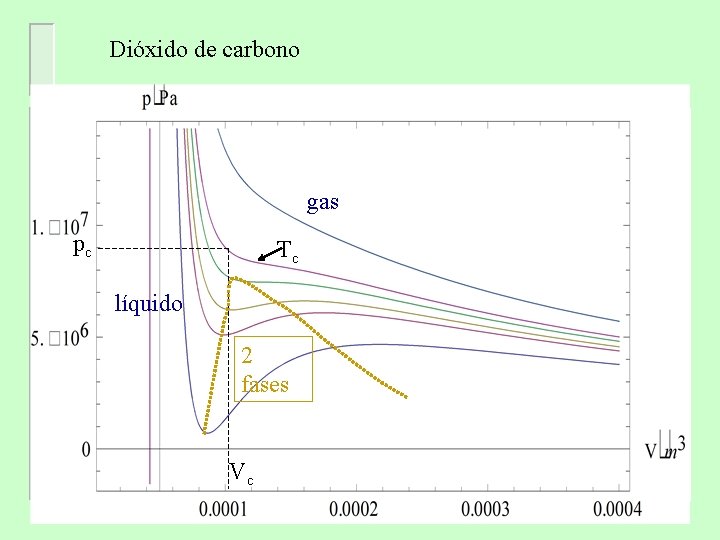
Ver la figura de la siguiente diapositiva. p(V, t) es la presión de van der Waals con el volumen V en m 3/mol, y la temperatura T (kelvin). Para CO 2 la temperatura critica es 31. 15 o. C y las ctes. de van der Waals son a=0. 364 m 6 Pa mol-2 y b=4. 27 10 -5 m 3/mol. Abajo de Tc, la región entre los mínimos y máximos de p versus V en cualquier isotérmica no tiene sentido físico, pues indica que el volumen aumenta con la presión. Se señala una curva que conecta todos los mínimos y todos los máximos de las isotermas, p(V); esta es la región “virtual” de la ecuación de van der Waals.

Dióxido de carbono gas pc Tc líquido 2 fases Vc
 Fisicoquimica
Fisicoquimica Intervalos automáticos o manuales
Intervalos automáticos o manuales Pasantia rae
Pasantia rae Rapport semestre 1
Rapport semestre 1 10 semestre
10 semestre Que se ve en el primer semestre de derecho
Que se ve en el primer semestre de derecho Atributos
Atributos El tiempo de permanencia del profesor santos
El tiempo de permanencia del profesor santos El asesinato del profesor de matematicas
El asesinato del profesor de matematicas Itk vtk
Itk vtk Milic simic profesor
Milic simic profesor Profesor jano
Profesor jano Gred pensyarah universiti awam
Gred pensyarah universiti awam Ass amina
Ass amina Nebojsa pusara
Nebojsa pusara El profesor nelson explica a sus alumnos
El profesor nelson explica a sus alumnos Profesor donde lleva acento
Profesor donde lleva acento Nombre pas
Nombre pas Ron.clark
Ron.clark Postmodernismul definitie trasaturi
Postmodernismul definitie trasaturi 1. mis hermanos ____ conducir, pero yo no ____.
1. mis hermanos ____ conducir, pero yo no ____. Perfil del profesor de religión
Perfil del profesor de religión Profesor magdalena strus
Profesor magdalena strus Porofessor gg tr
Porofessor gg tr El profesor holland
El profesor holland Placement of adjectives
Placement of adjectives Profesor indrumator
Profesor indrumator Ruiz de peñate
Ruiz de peñate Adraz
Adraz Profesor neřád rozbor
Profesor neřád rozbor Glumbic fasper
Glumbic fasper Profesor pdf
Profesor pdf Profesor milorad jankovic
Profesor milorad jankovic Web del profesor
Web del profesor Ass amina
Ass amina Don gregorio la lengua de las mariposas
Don gregorio la lengua de las mariposas Basta de bullying
Basta de bullying Gabriel él, es yo, soy ellas, son
Gabriel él, es yo, soy ellas, son Profesor newton
Profesor newton Iluminism definitie
Iluminism definitie Structura semintei
Structura semintei Profesor baltazar sreća u dvoje
Profesor baltazar sreća u dvoje Profesor a
Profesor a Elena doamna
Elena doamna Istilah jejaring sosial diperkenalkan oleh profesor j
Istilah jejaring sosial diperkenalkan oleh profesor j Profesor tica
Profesor tica Profesor
Profesor Fisa postului profesor itinerant de sprijin
Fisa postului profesor itinerant de sprijin Hulubul pacii desen
Hulubul pacii desen Maestro luis alvarado cieza
Maestro luis alvarado cieza Profesor hel
Profesor hel Web del profesor ula
Web del profesor ula