ENLACE QUMICO CURVAS DE ENERGA DE ENLACE tomos




















- Slides: 62

ENLACE QUÍMICO

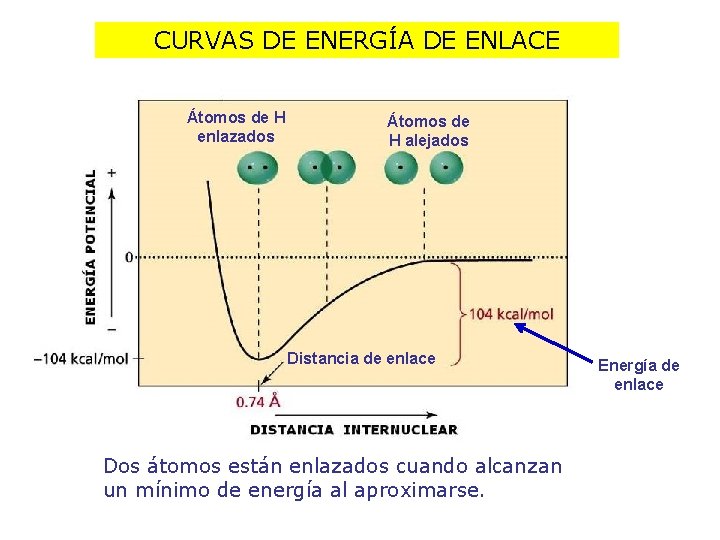
CURVAS DE ENERGÍA DE ENLACE Átomos de H enlazados Átomos de H alejados Distancia de enlace Dos átomos están enlazados cuando alcanzan un mínimo de energía al aproximarse. Energía de enlace

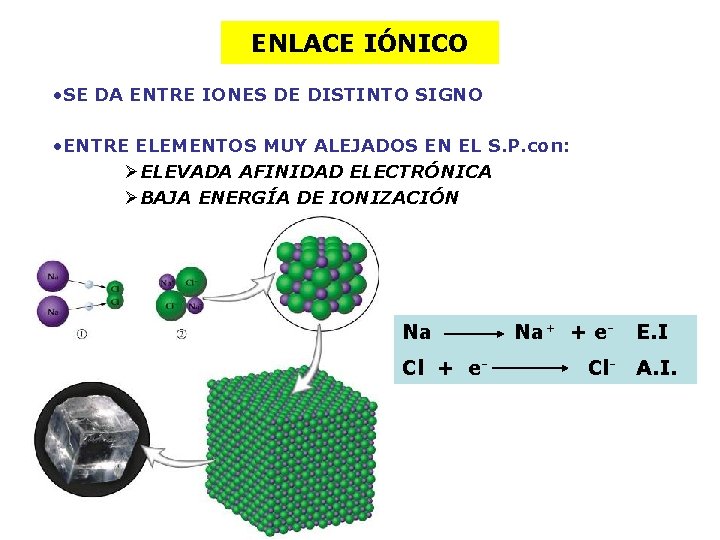
ENLACE IÓNICO • SE DA ENTRE IONES DE DISTINTO SIGNO • ENTRE ELEMENTOS MUY ALEJADOS EN EL S. P. con: ØELEVADA AFINIDAD ELECTRÓNICA ØBAJA ENERGÍA DE IONIZACIÓN Na Cl + e- Na+ + e. Cl- E. I A. I.

ENLACE IÓNICO • SE FORMAN REDES CRISTALINAS, NO HAY MOLÉCULAS • CADA ION SE RODEARÁ DEL MAYOR NÚMERO POSIBLE DE IONES DE SIGNO CONTRARIO (NÚMERO DE COORDINACIÓN)

REDES CRISTALINAS

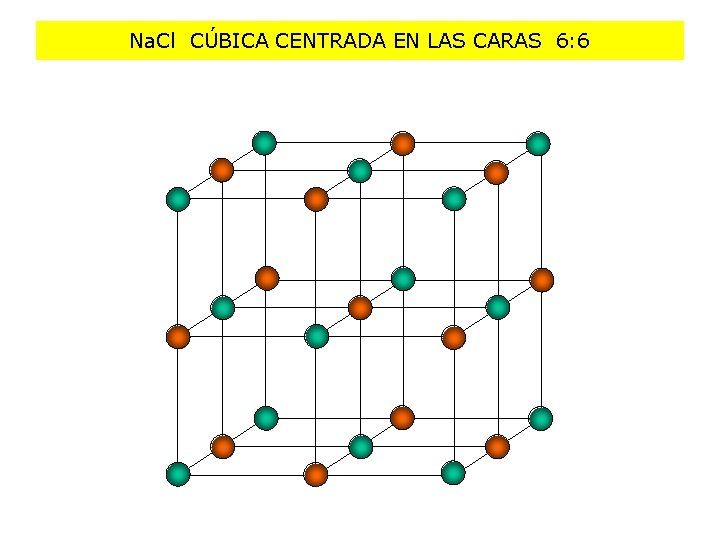
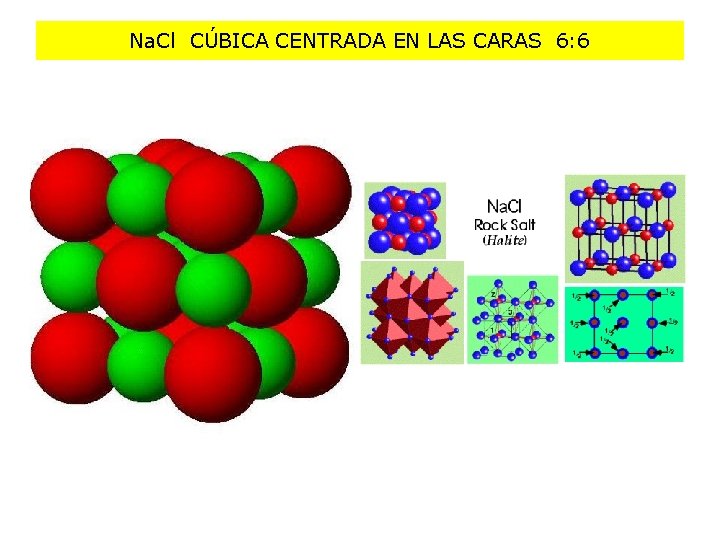
Na. Cl CÚBICA CENTRADA EN LAS CARAS 6: 6

Na. Cl CÚBICA CENTRADA EN LAS CARAS 6: 6

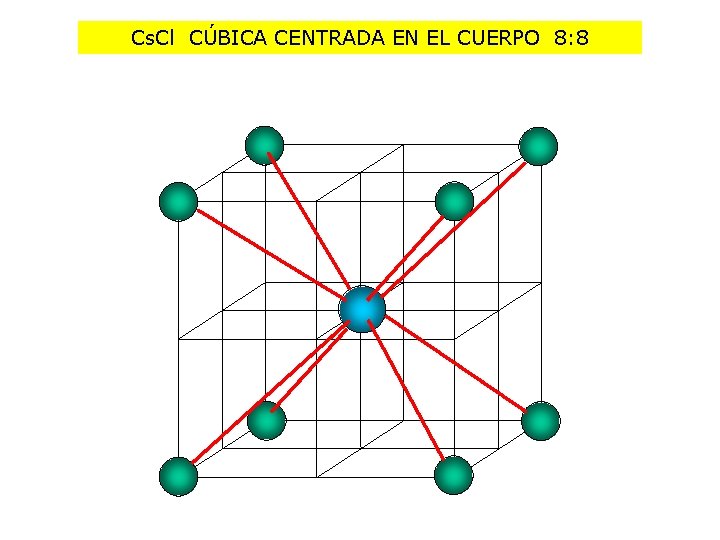
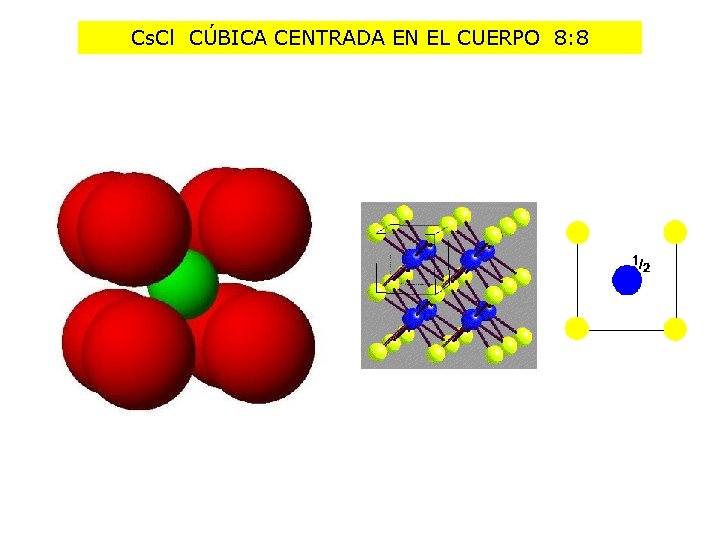
Cs. Cl CÚBICA CENTRADA EN EL CUERPO 8: 8

Cs. Cl CÚBICA CENTRADA EN EL CUERPO 8: 8

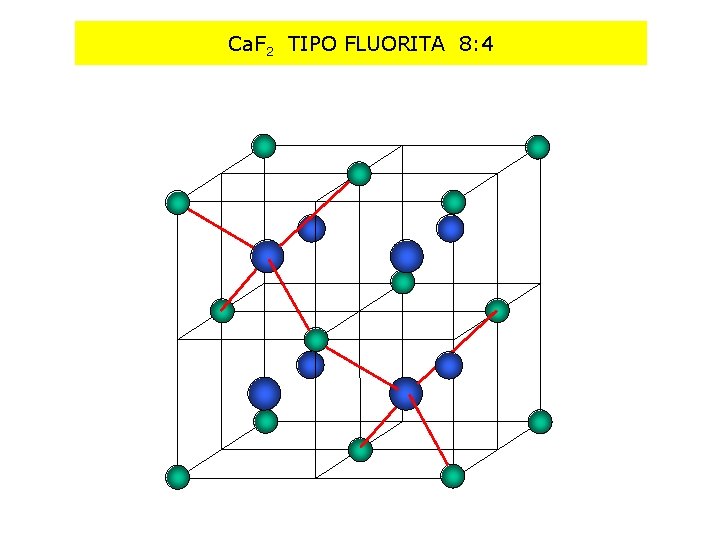
Ca. F 2 TIPO FLUORITA 8: 4

Ca. F 2 TIPO FLUORITA 8: 4

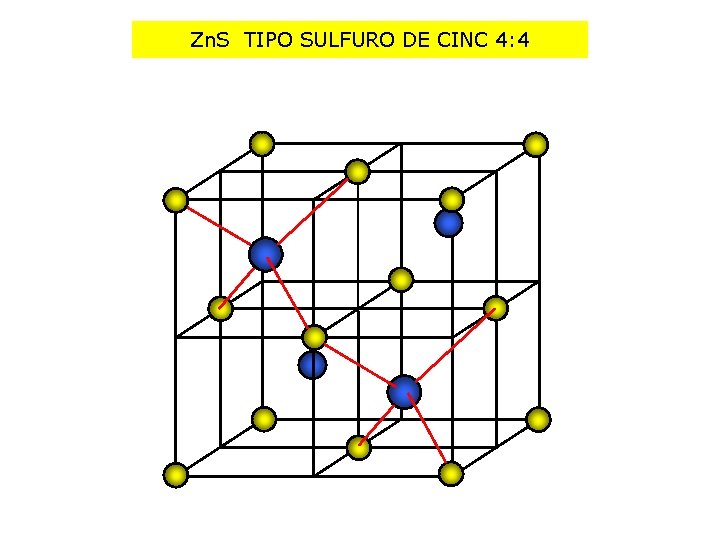
Zn. S TIPO SULFURO DE CINC 4: 4

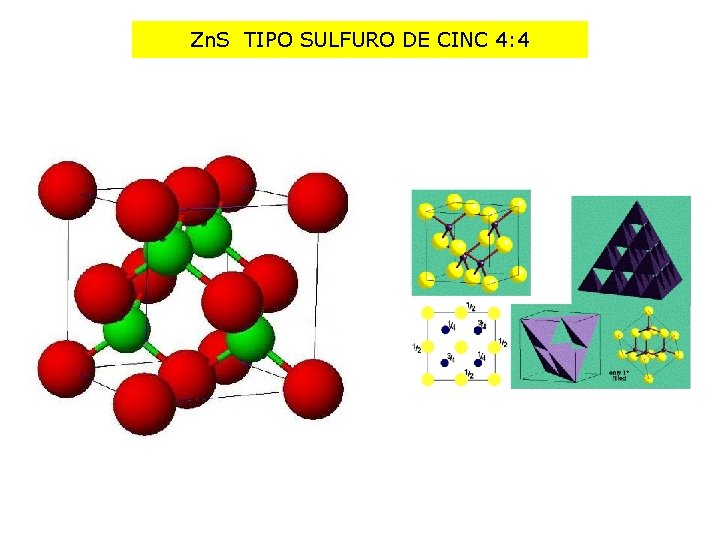
Zn. S TIPO SULFURO DE CINC 4: 4


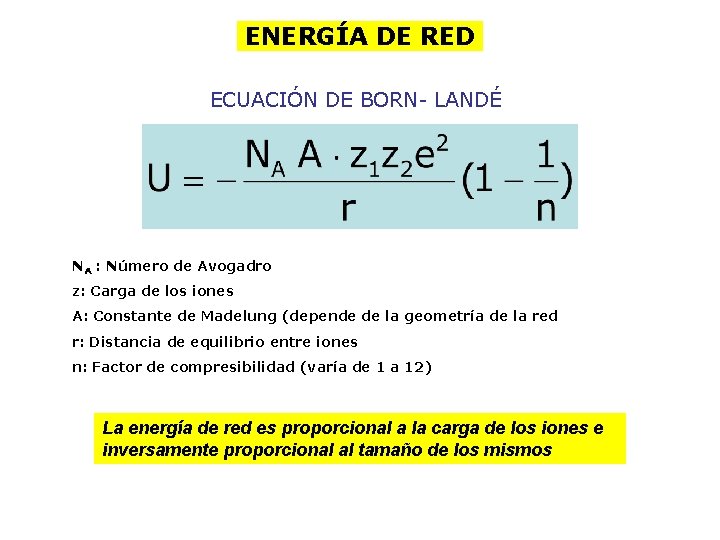
ENERGÍA DE RED ECUACIÓN DE BORN- LANDÉ NA : Número de Avogadro z: Carga de los iones A: Constante de Madelung (depende de la geometría de la red r: Distancia de equilibrio entre iones n: Factor de compresibilidad (varía de 1 a 12) La energía de red es proporcional a la carga de los iones e inversamente proporcional al tamaño de los mismos

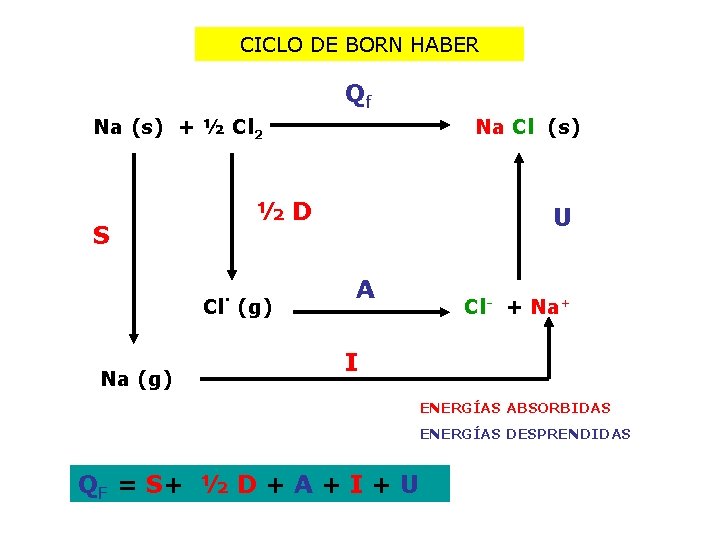
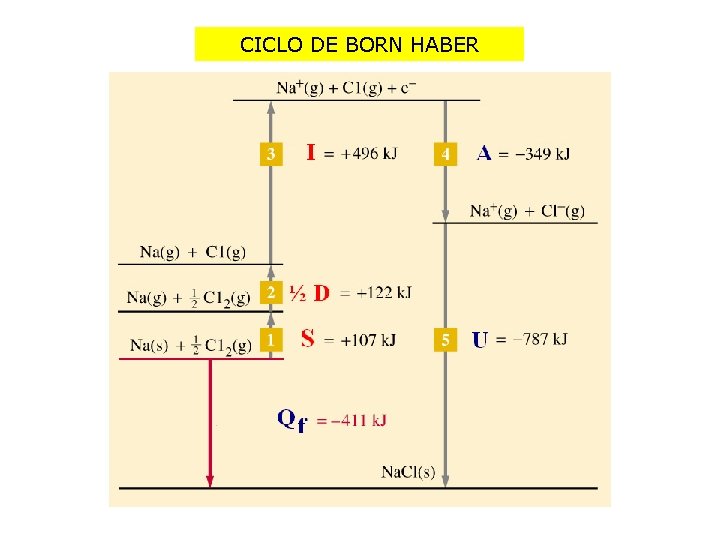
CICLO DE BORN HABER Qf Na (s) + ½ Cl 2 S ½D Cl· (g) Na Cl (s) U A Cl- + Na+ I ENERGÍAS ABSORBIDAS ENERGÍAS DESPRENDIDAS QF = S+ ½ D + A + I + U

CICLO DE BORN HABER

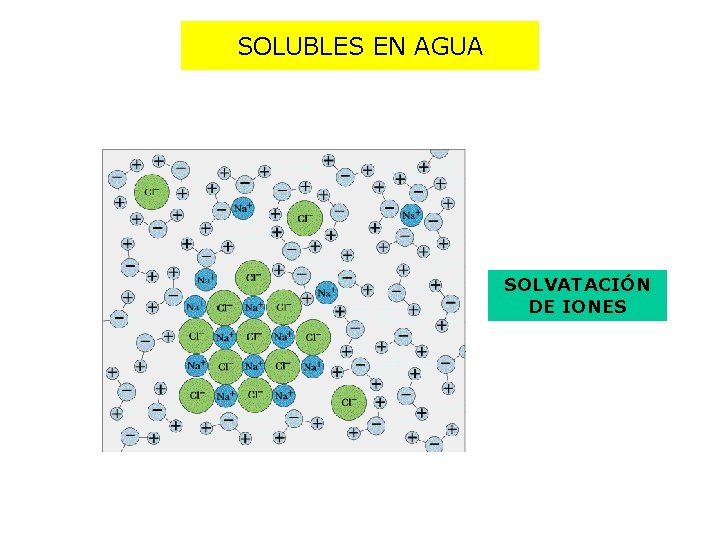
SOLUBLES EN AGUA SOLVATACIÓN DE IONES

• Solubles en agua • Conductores en disolución o fundidos

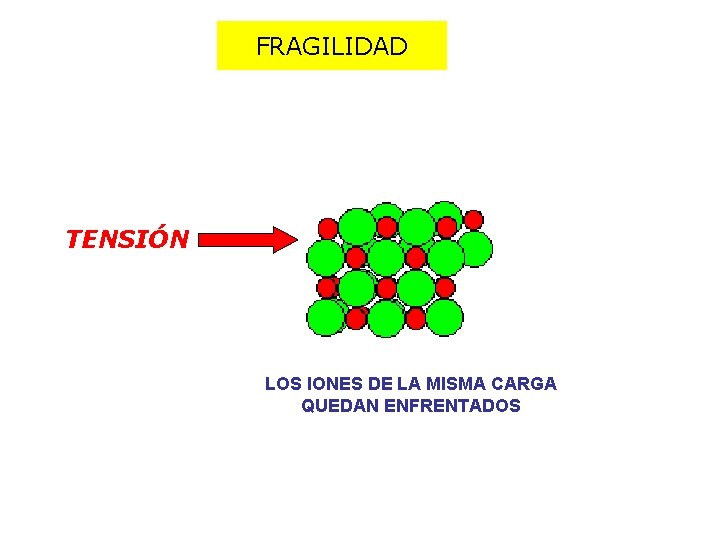
FRAGILIDAD TENSIÓN LOS IONES DE LA MISMA CARGA QUEDAN ENFRENTADOS

ENLACE COVALENTE Los gases nobles presentan gran estabilidad química, y existen como moléculas mono-atómicas. Su configuración electrónica es muy estable y contiene 8 e- en la capa de valencia (excepto el He). La idea de enlace covalente fue sugerida en 1916 por G. N. Lewis: G. N. Lewis Los átomos pueden adquirir estructura de gas noble compartiendo electrones para formar un enlace de pares de electrones. e- de valencia He Ne Ar Kr Xe Rn 2 8 8 8

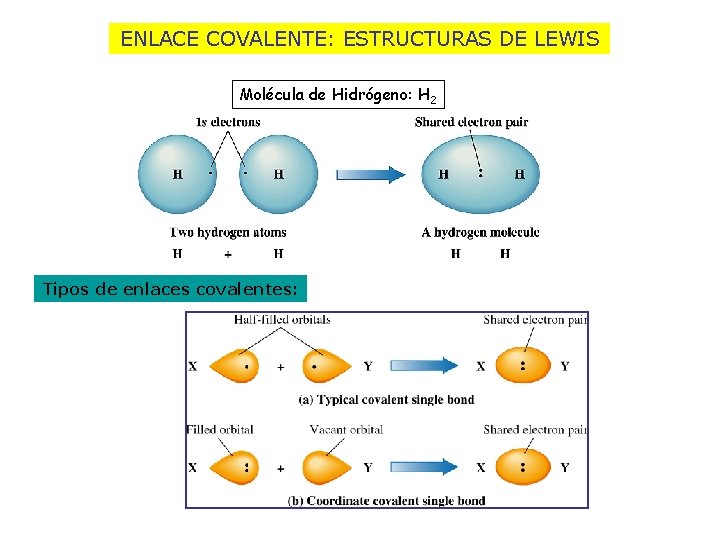
ENLACE COVALENTE: ESTRUCTURAS DE LEWIS Molécula de Hidrógeno: H 2 Tipos de enlaces covalentes:

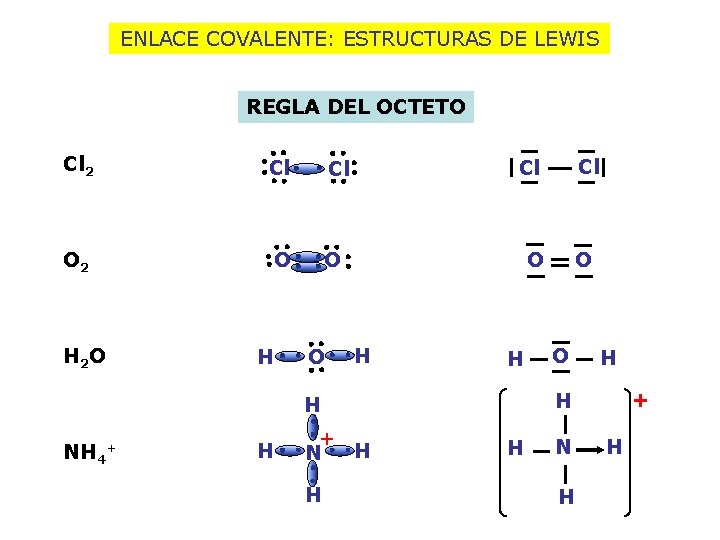
ENLACE COVALENTE: ESTRUCTURAS DE LEWIS REGLA DEL OCTETO Cl 2 Cl Cl O 2 O O H 2 O H Cl Cl O O H H + N H H + H H NH 4+ O H H N H H

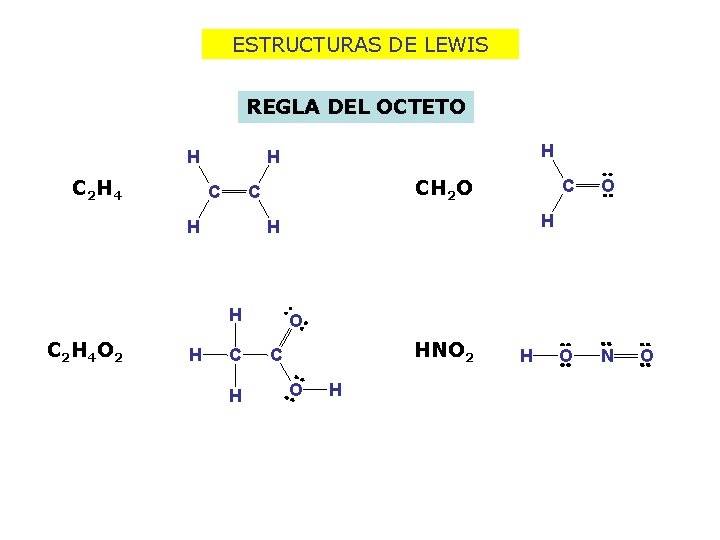
ESTRUCTURAS DE LEWIS REGLA DEL OCTETO H C 2 H 4 C CH 2 O C H H C O O N H H H C 2 H 4 O 2 H H O HNO 2 C O H H O

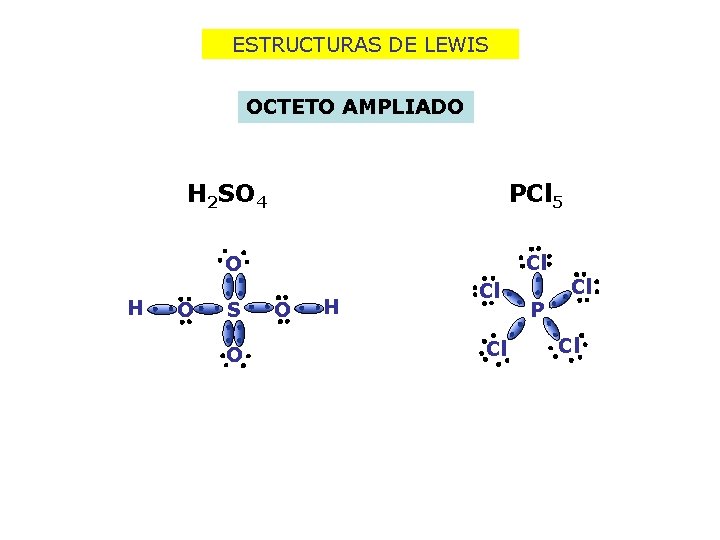
ESTRUCTURAS DE LEWIS OCTETO AMPLIADO H 2 SO 4 PCl 5 Cl O H O S O O H Cl Cl P Cl Cl

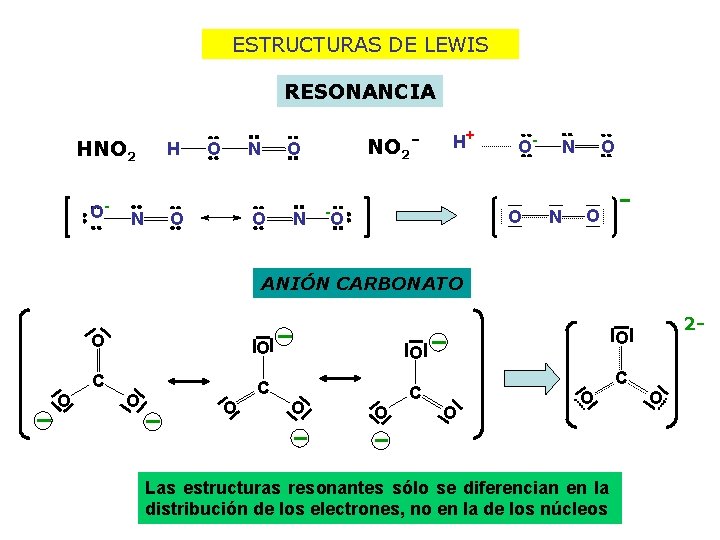
ESTRUCTURAS DE LEWIS RESONANCIA HNO 2 O- N H O O N NO 2 - H+ -O O- O N N O O ANIÓN CARBONATO O O C C C O O 2 - O C O O Las estructuras resonantes sólo se diferencian en la distribución de los electrones, no en la de los núcleos O

TEORÍA DE LA REPULSIÓN ENTRE PARES ELECTRÓNICOS DE VALENCIA. N. Sidgwick H. Powell e- GEOMETRÍA MOLECULAR EJEMPLO 2 LINEAL Be. Cl 2 3 TRIGONAL PLANA BF 3 4 TETRAÉDICA CH 4 PARES

TEORÍA DE LA REPULSIÓN ENTRE PARES ELECTRÓNICOS DE VALENCIA. N. Sidgwick H. Powell PARES e- GEOMETRÍA MOLECULAR EJEMPLO 5 BIPIRÁMIDE TRIGONAL PCl 5 6 OCTAÉDRICA SF 6 ORDEN DE LAS FUERZAS DE REPULSIÓN P. S-P. PS. > P. S. -P. E. > P. E-P. E.

TEORÍA DEL ENLACE DE VALENCIA (T. E. V) L. Pauling. The Nature of Chemical Bonding (1931) • Los electrones compartidos pertenecen a los orbitales de los átomos implicados • Electrones en un antiparalelos mismo orbital tienen spines • Un átomo forma tantos enlaces como electrones desapareados tenga (puede haber promoción)

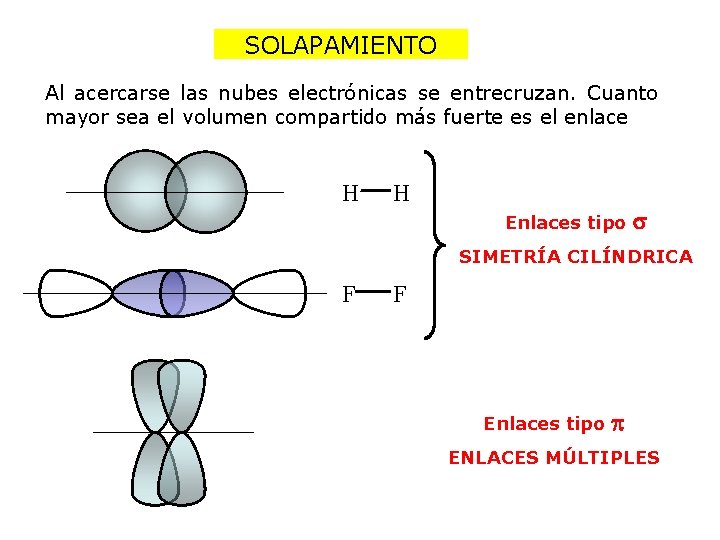
SOLAPAMIENTO Al acercarse las nubes electrónicas se entrecruzan. Cuanto mayor sea el volumen compartido más fuerte es el enlace H H Enlaces tipo SIMETRÍA CILÍNDRICA F F Enlaces tipo ENLACES MÚLTIPLES

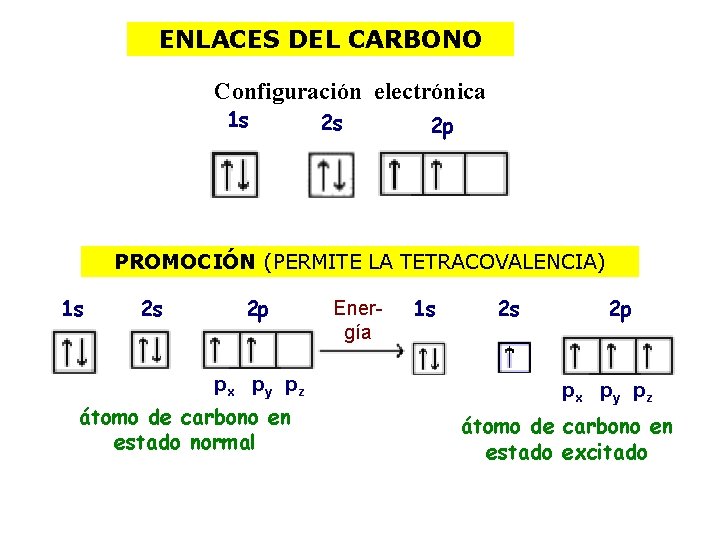
ENLACES DEL CARBONO Configuración electrónica 1 s 2 s 2 p PROMOCIÓN (PERMITE LA TETRACOVALENCIA) 1 s 2 p px p y p z carbono átomo de en estado normal Energía 1 s 2 s 2 p px p y p z átomo de carbono en estado excitado

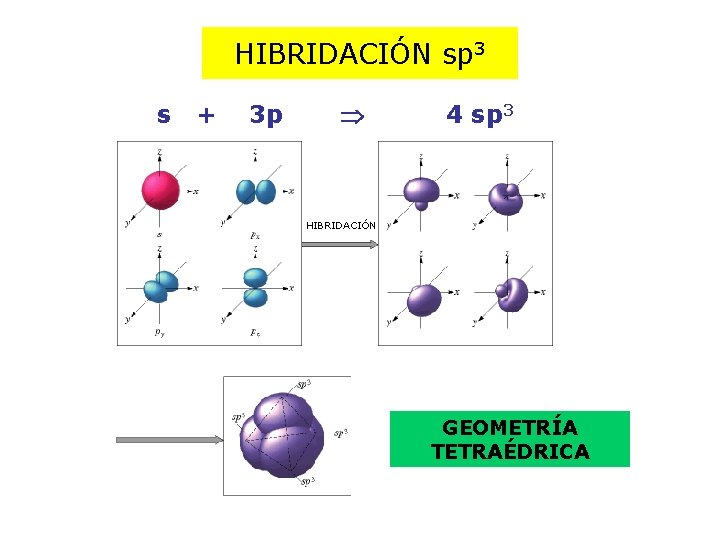
HIBRIDACIÓN sp 3 s + 3 p 4 sp 3 HIBRIDACIÓN GEOMETRÍA TETRAÉDRICA

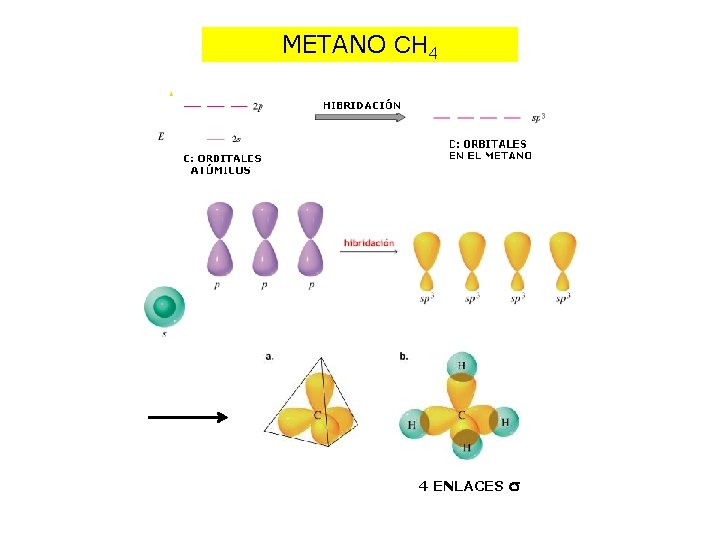
METANO CH 4 4 ENLACES

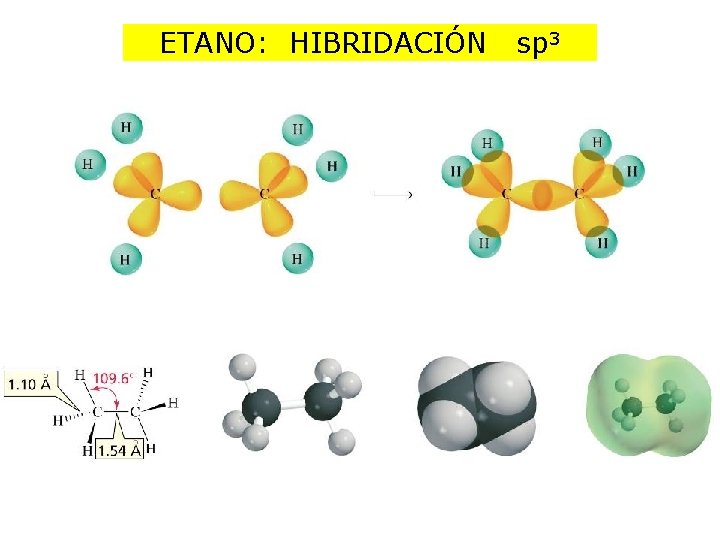
ETANO: HIBRIDACIÓN sp 3

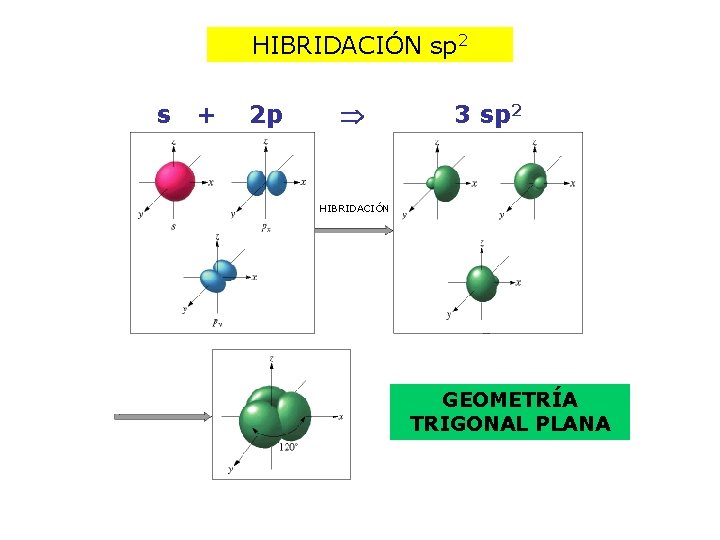
HIBRIDACIÓN sp 2 s + 2 p 3 sp 2 HIBRIDACIÓN GEOMETRÍA TRIGONAL PLANA

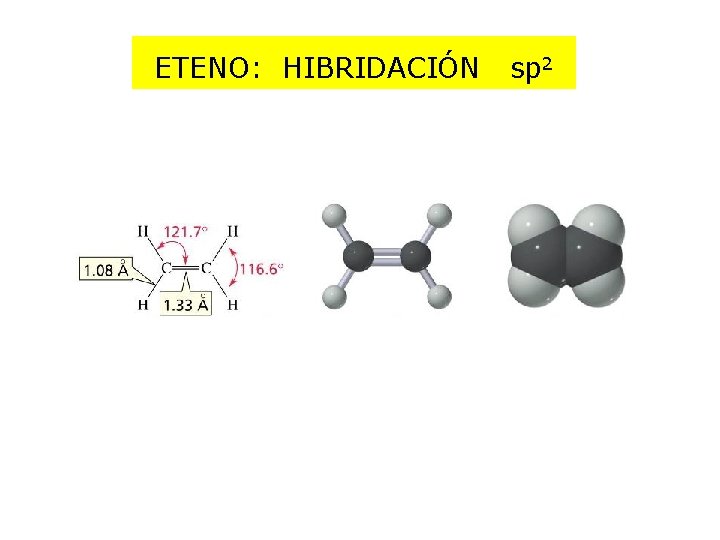
ETENO: HIBRIDACIÓN sp 2

ETENO: HIBRIDACIÓN sp 2

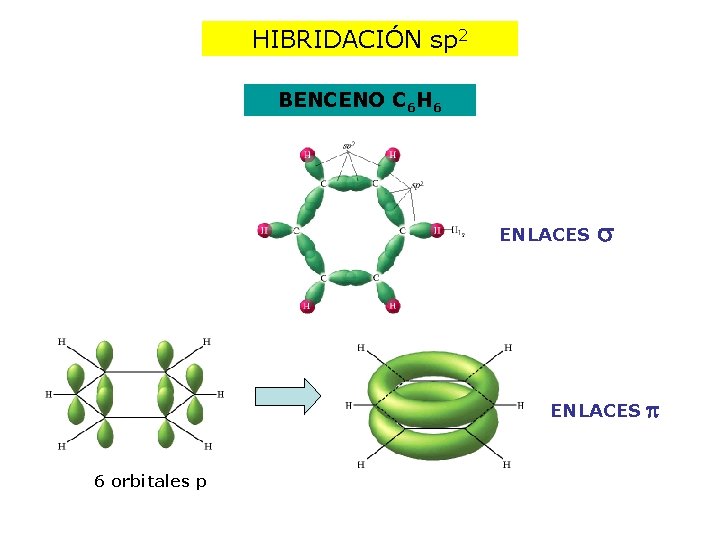
HIBRIDACIÓN sp 2 BENCENO C 6 H 6 ENLACES 6 orbitales p

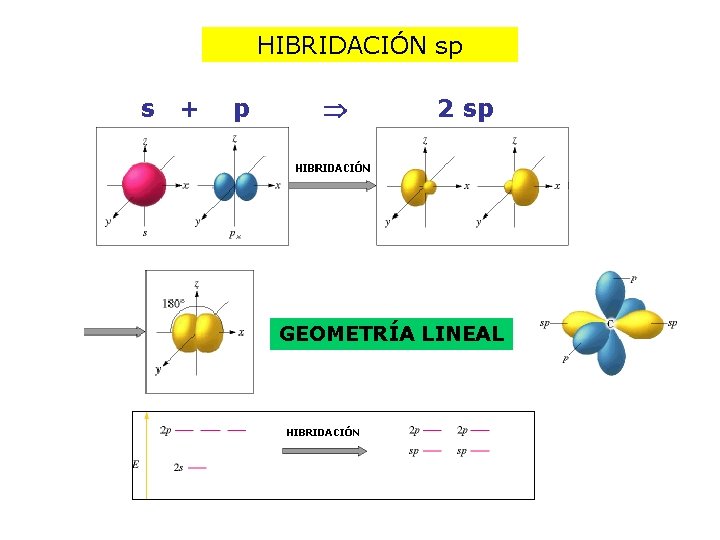
HIBRIDACIÓN sp s + p 2 sp GEOMETRÍA LINEAL

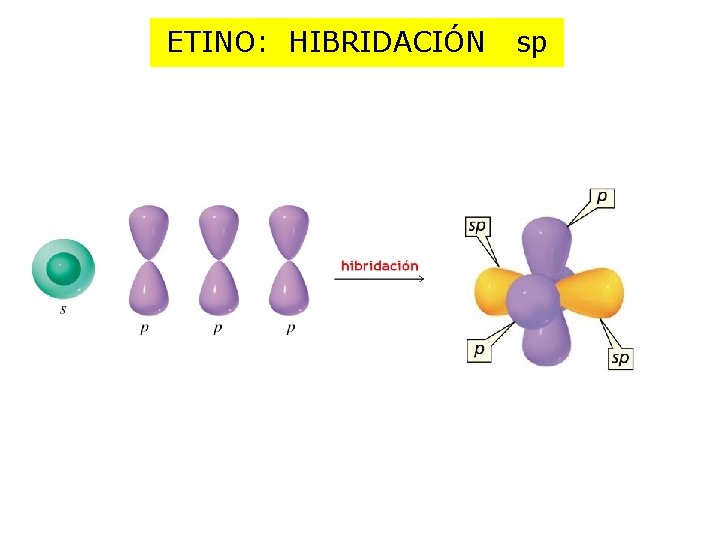
ETINO: HIBRIDACIÓN sp

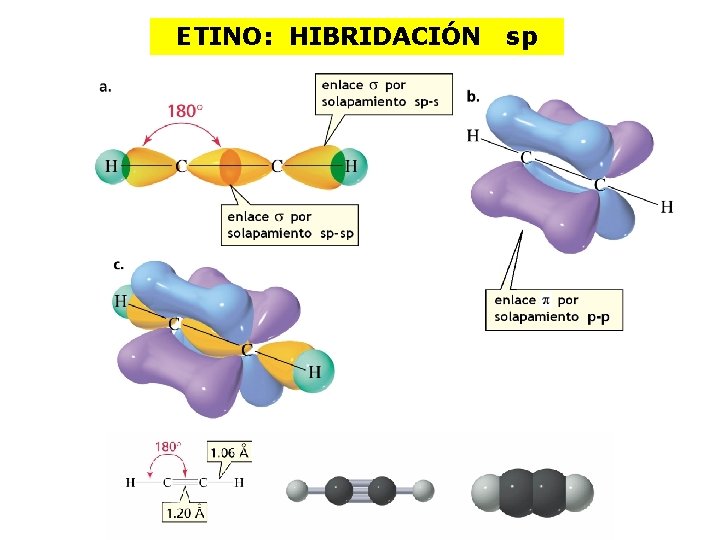
ETINO: HIBRIDACIÓN sp

POLARIDAD DE LOS ENLACES LOS ELECTRONES NO SIEMPE SON COMPARTIDOS AL 50% DEBIDO A DIFERENCIAS DE ELECTRONEGATIVIDAD ENTRE LOS ÁTOMOS QUE FORMAN EL ENLACE

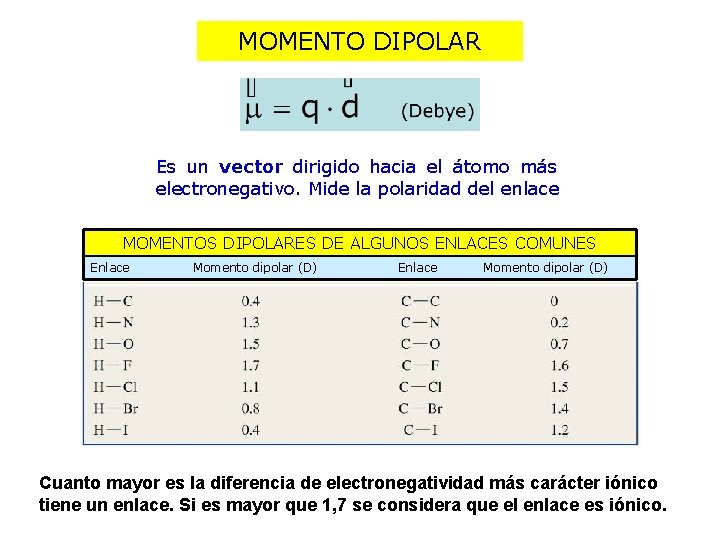
MOMENTO DIPOLAR Es un vector dirigido hacia el átomo más electronegativo. Mide la polaridad del enlace MOMENTOS DIPOLARES DE ALGUNOS ENLACES COMUNES Enlace Momento dipolar (D) Cuanto mayor es la diferencia de electronegatividad más carácter iónico tiene un enlace. Si es mayor que 1, 7 se considera que el enlace es iónico.

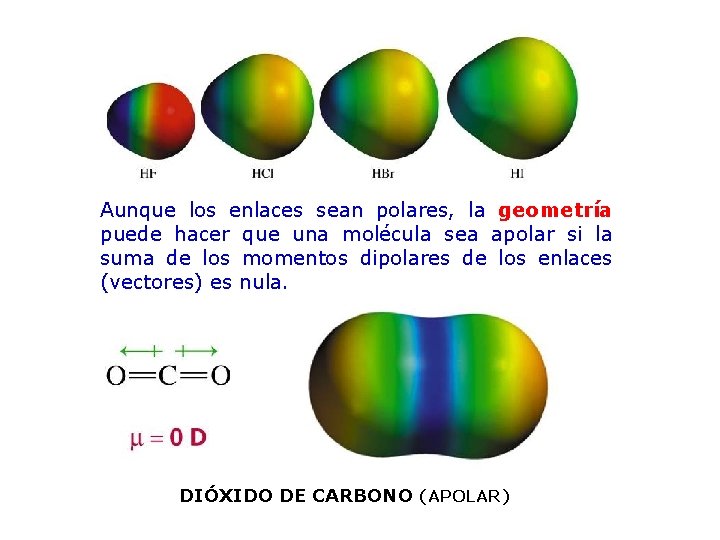
Aunque los enlaces sean polares, la geometría puede hacer que una molécula sea apolar si la suma de los momentos dipolares de los enlaces (vectores) es nula. DIÓXIDO DE CARBONO (APOLAR)

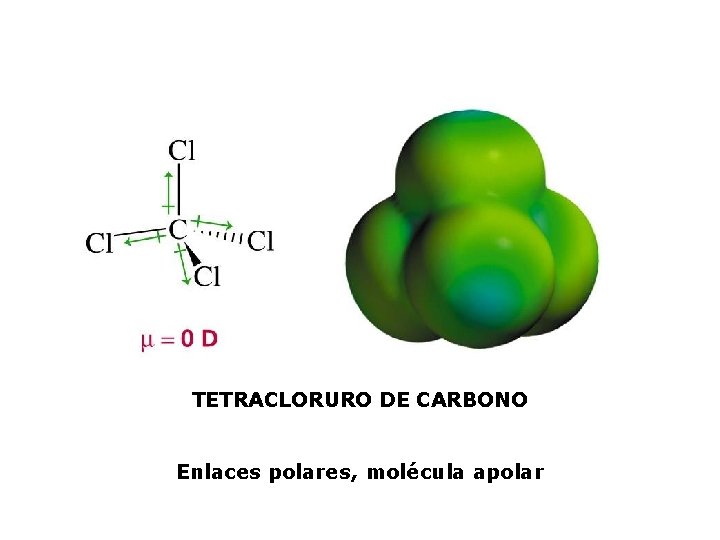
TETRACLORURO DE CARBONO Enlaces polares, molécula apolar

Cloroformo Agua Amoniaco

FUERZAS INTERMOLECULARES • ENTRE MOLÉCULAS DIFERENTES • DEBIDAS A DÉBILES INTERACCIONES ELECTROSTÁTICAS • PUENTES DE HIDRÓGENO • FUERZAS DE VAN DER WAALS

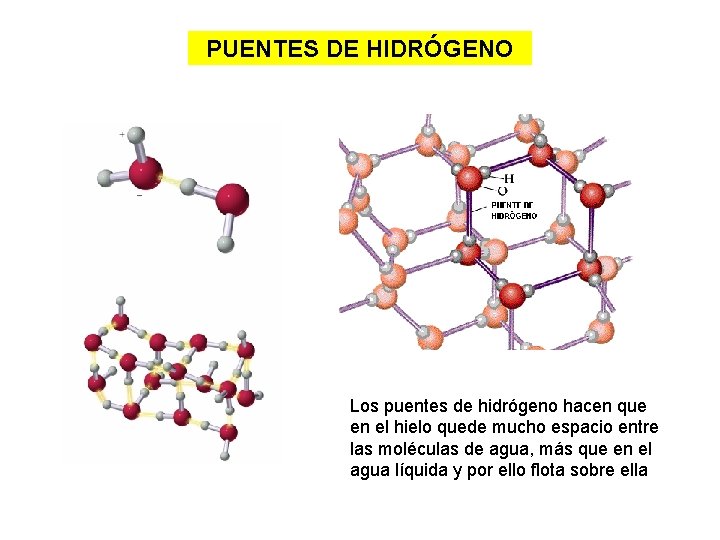
PUENTES DE HIDRÓGENO SE FORMAN SÓLO EN MOLÉCULAS CON ENLACES DE TRES TIPOS: F H O H N H ÁTOMOS PEQUEÑOS Y ENLACES MUY POLARES La anomalía del agua indica que debe haber un enlace extra entre las moléculas de agua y por ello hay que suministrar más energía para separar las moléculas.

PUENTES DE HIDRÓGENO Los puentes de hidrógeno hacen que en el hielo quede mucho espacio entre las moléculas de agua, más que en el agua líquida y por ello flota sobre ella

PUENTES DE HIDRÓGENO ÁCIDO SALICÍLICO

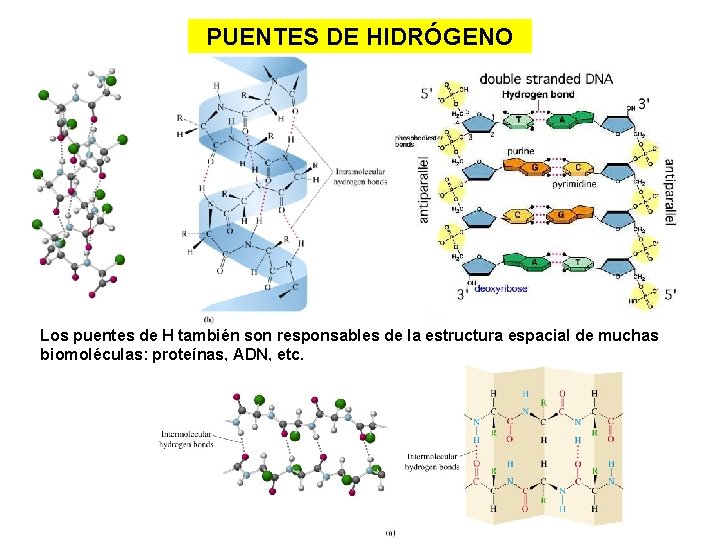
PUENTES DE HIDRÓGENO Los puentes de H también son responsables de la estructura espacial de muchas biomoléculas: proteínas, ADN, etc.

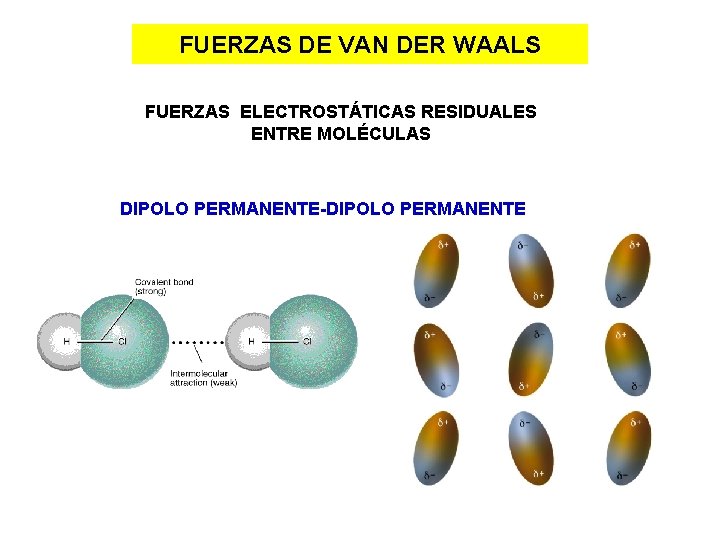
FUERZAS DE VAN DER WAALS FUERZAS ELECTROSTÁTICAS RESIDUALES ENTRE MOLÉCULAS DIPOLO PERMANENTE-DIPOLO PERMANENTE

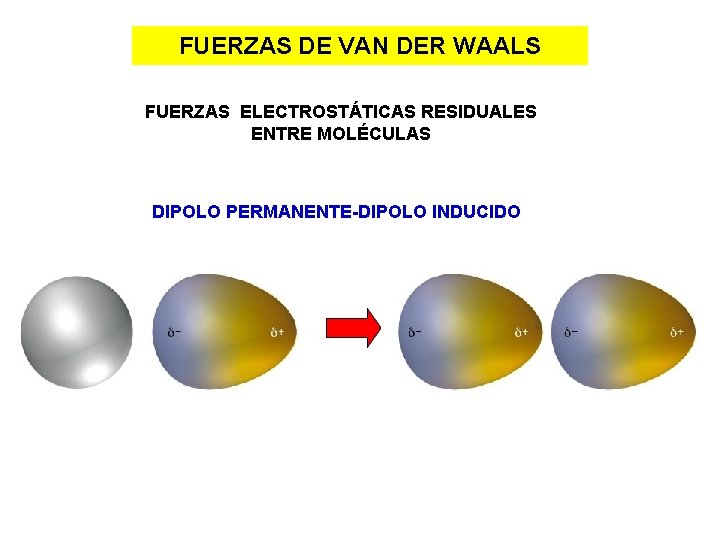
FUERZAS DE VAN DER WAALS FUERZAS ELECTROSTÁTICAS RESIDUALES ENTRE MOLÉCULAS DIPOLO PERMANENTE-DIPOLO INDUCIDO

FUERZAS DE VAN DER WAALS FUERZAS ELECTROSTÁTICAS RESIDUALES ENTRE MOLÉCULAS DIPOLO INDUCIDO - DIPOLO INDUCIDO (FUERZAS DE DISPERSIÓN DE LONDON)

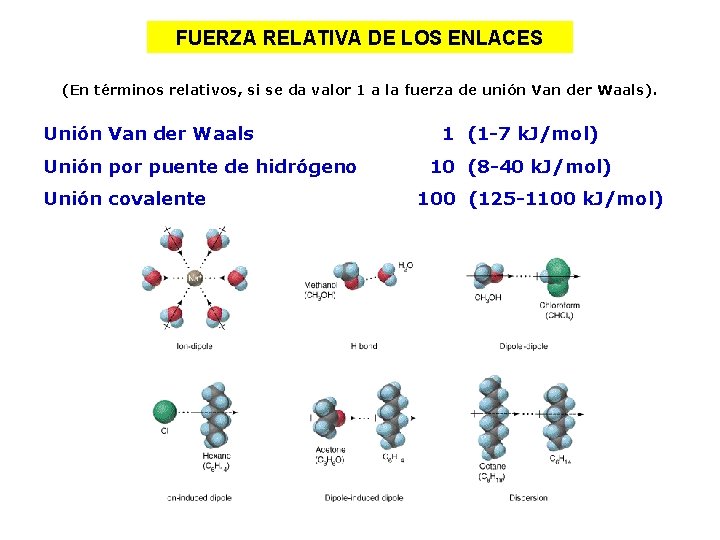
FUERZA RELATIVA DE LOS ENLACES (En términos relativos, si se da valor 1 a la fuerza de unión Van der Waals). Unión Van der Waals Unión por puente de hidrógeno Unión covalente 1 (1 -7 k. J/mol) 10 (8 -40 k. J/mol) 100 (125 -1100 k. J/mol)

PROPIEDADES DE LAS SUSTANCIAS COVALENTES SÓLIDOS MOLECULARES • BAJOS PUNTOS DE FUSIÓN Y EBULLICIÓN • NO CONDUCTORES • SOLUBLES SEGÚN SU POLARIDAD AGUA, HELIO, GLUCOSA, BUTANO, ETANOL…

PROPIEDADES DE LAS SUSTANCIAS COVALENTES SÓLIDOS COVALENTES FORMAN REDES DE ÁTOMOS UNIDOS POR ENLACE COVALENTE • ALTOS PUNTOS DE FUSIÓN Y EBULLICIÓN • INSOLUBLES DIAMANTE GRAFITO

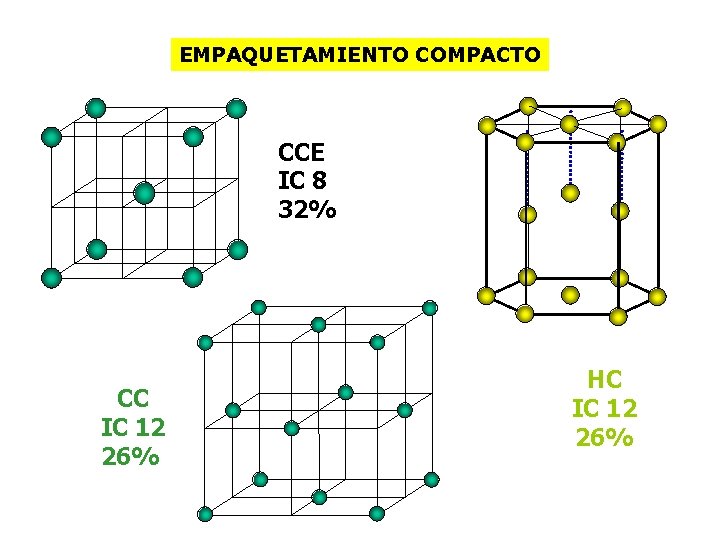
CARACTERÍSTICAS FÍSICAS DE LOS METALES q q q q conductividad eléctrica conductividad térmica ductilidad maleabilidad elasticidad dureza y densidad brillo metálico y opacidad estructuras cristalinas compactas: • cúbica centrada en el espacio (cce) • cúbica compacta (cc) • hexagonal compacta (hc)

EMPAQUETAMIENTO COMPACTO CCE IC 8 32% CC IC 12 26% HC IC 12 26%

MODELO DEL GAS ELECTRÓNICO El corazón del átomo metálico, positivo, está bañado en un gas de electrones de la capa de valencia de todos los átomos del cristal.

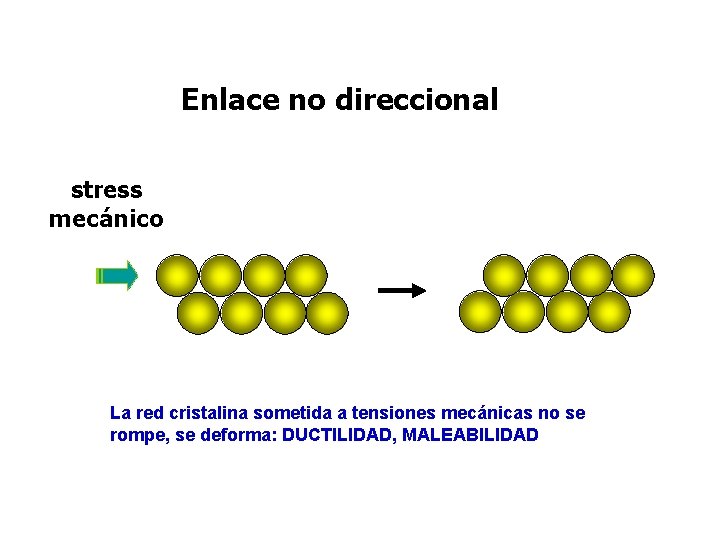
Enlace no direccional stress mecánico La red cristalina sometida a tensiones mecánicas no se rompe, se deforma: DUCTILIDAD, MALEABILIDAD

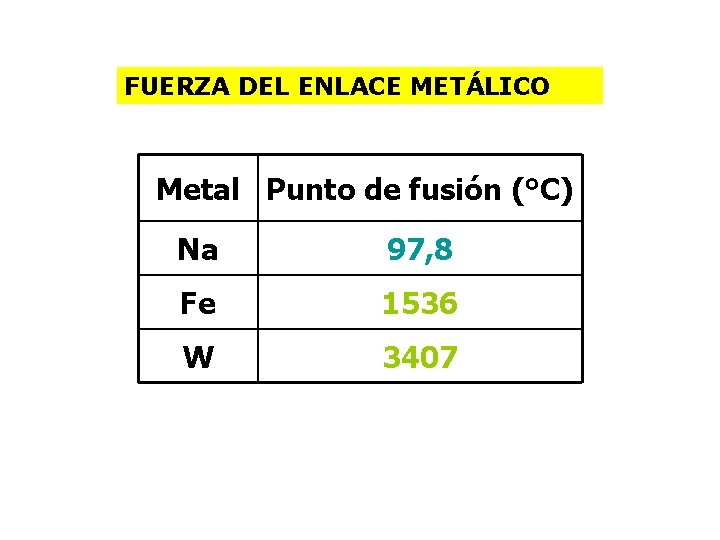
FUERZA DEL ENLACE METÁLICO Metal Punto de fusión (°C) Na 97, 8 Fe 1536 W 3407
 Tipo de enlace del oxígeno
Tipo de enlace del oxígeno Enlace qumico
Enlace qumico Enlace qumico
Enlace qumico Enlace qumico
Enlace qumico Fqcolindres 2 eso
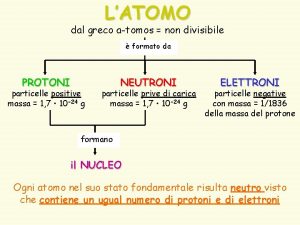
Fqcolindres 2 eso Tomos greco
Tomos greco Energia potencial gravitacional
Energia potencial gravitacional Energa solar
Energa solar Tomos trivia answers
Tomos trivia answers Exergonico y exotermico
Exergonico y exotermico Pi y sigma
Pi y sigma Curvas roc spss
Curvas roc spss Cerchas combinadas
Cerchas combinadas Curvas cot adn
Curvas cot adn Molaridad
Molaridad Terreno dibujo
Terreno dibujo Nessa obra predominam as linhas retas ou curvas
Nessa obra predominam as linhas retas ou curvas Solubilidad
Solubilidad Curvas de solubilidad ejercicios resueltos
Curvas de solubilidad ejercicios resueltos Curvas características
Curvas características Dificultad de introyecciones adecuadas
Dificultad de introyecciones adecuadas Rnpt aeg
Rnpt aeg Curvas conicas en la vida cotidiana
Curvas conicas en la vida cotidiana Curvas de indiferencia atipicas
Curvas de indiferencia atipicas Curvas paramétricas en el espacio
Curvas paramétricas en el espacio Curvas de nivel isotermas
Curvas de nivel isotermas Asincronia de flujo
Asincronia de flujo Setas curvas
Setas curvas Erro
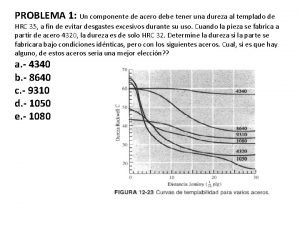
Erro Curvas de templabilidad
Curvas de templabilidad Curvas y mapas de indiferencia
Curvas y mapas de indiferencia Que es un sistema material?
Que es un sistema material? Ajuste de curvas métodos numéricos
Ajuste de curvas métodos numéricos As curvas
As curvas Curvas flujo volumen
Curvas flujo volumen Area entre dos curvas
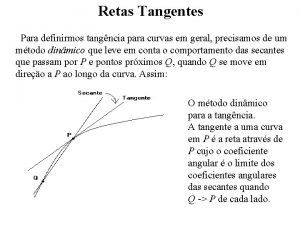
Area entre dos curvas Retas tangentes
Retas tangentes Enfoque de curvas de indiferencia
Enfoque de curvas de indiferencia Estereoespecificidade
Estereoespecificidade As curvas
As curvas Insulinas curvas
Insulinas curvas Curvas de schade
Curvas de schade Recta presupuestaria formula
Recta presupuestaria formula Insulinas curvas
Insulinas curvas Tipos de curvas
Tipos de curvas Curva de capabilidad
Curva de capabilidad Setas curvas
Setas curvas Curva de aquecimento
Curva de aquecimento Caja timpánica
Caja timpánica Carmen curvas
Carmen curvas Enlace covalente apolar
Enlace covalente apolar Polaridad
Polaridad Grupo funcional hs
Grupo funcional hs Lactosa estructura de haworth
Lactosa estructura de haworth Enlace
Enlace Modelo de watson y crick
Modelo de watson y crick Momento dipolar resultante
Momento dipolar resultante Particulas unitarias del enlace ionico
Particulas unitarias del enlace ionico Electrones de valencia
Electrones de valencia Obtencion de amidas
Obtencion de amidas Enlace dativo
Enlace dativo Polisacárido de reserva vegetal
Polisacárido de reserva vegetal Ejemplos de cromoproteinas
Ejemplos de cromoproteinas