Leccin 6 El Enlace Covalente Estructuras de Lewis








- Slides: 36

Lección 6. El Enlace Covalente. » Estructuras de Lewis: · Regla del Octete · Formas resonantes · Carga formal · Excepciones a la regla del octete » Geometría Molecular: · Teoría VSEPR » Polaridad de las Moléculas: · Enlaces covalentes polares y no polares · Moléculas polares y no polares » Orbitales Atómicos-Hibridación: · Orbitales híbridos · Enlaces sigma y pi 6. El Enlace Covalente.

Estructuras de Lewis Los gases nobles presentan gran estabilidad química, y existen como moléculas mono-atómicas. Su configuración electrónica es muy estable y contiene 8 e- en la capa de valencia (excepto el He). La idea de enlace covalente fue sugerida en 1916 por G. N. Lewis: G. N. Lewis Los átomos pueden adquirir estructura de gas noble compartiendo electrones para formar un enlace de pares de electrones. 6. El Enlace Covalente. e- de valencia He Ne Ar Kr Xe Rn 2 8 8 8

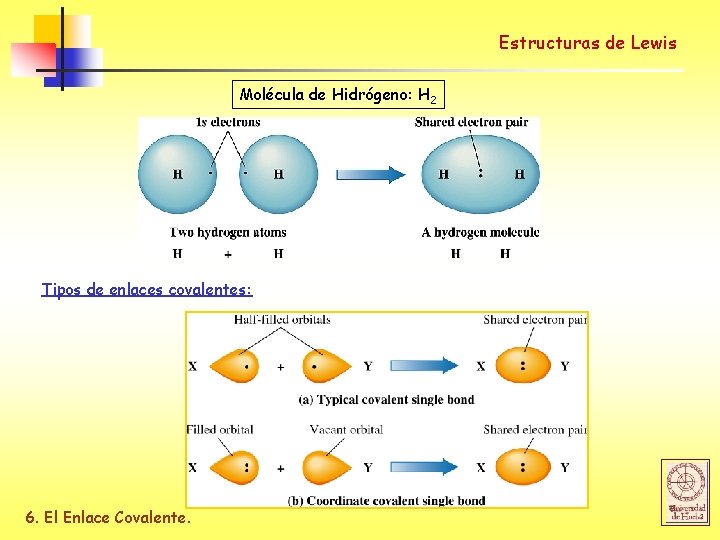
Estructuras de Lewis Molécula de Hidrógeno: H 2 Tipos de enlaces covalentes: 6. El Enlace Covalente.

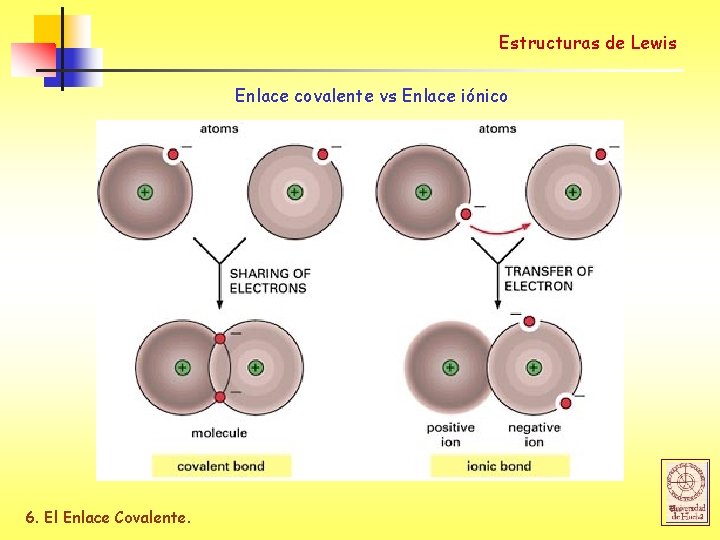
Estructuras de Lewis Enlace covalente vs Enlace iónico 6. El Enlace Covalente.

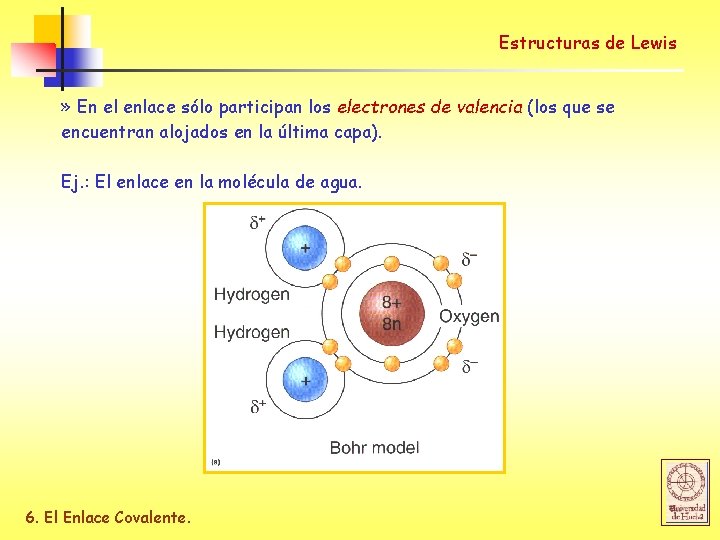
Estructuras de Lewis » En el enlace sólo participan los electrones de valencia (los que se encuentran alojados en la última capa). Ej. : El enlace en la molécula de agua. 6. El Enlace Covalente.

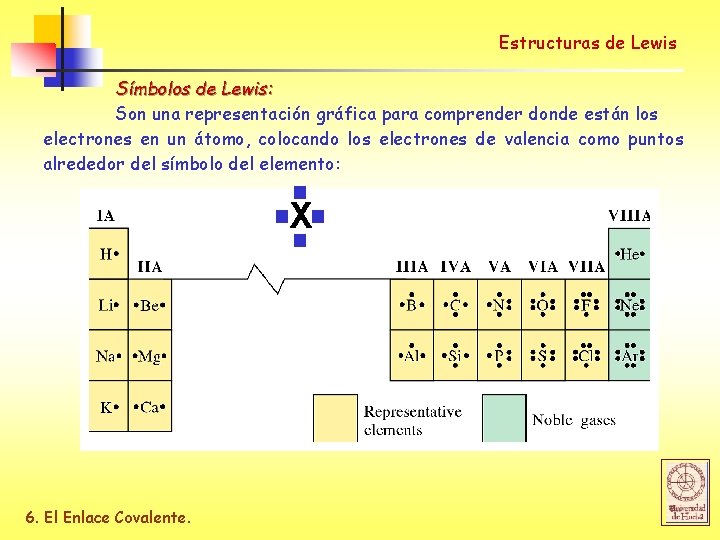
Estructuras de Lewis Símbolos de Lewis: Son una representación gráfica para comprender donde están los electrones en un átomo, colocando los electrones de valencia como puntos alrededor del símbolo del elemento: Xv v 6. El Enlace Covalente.

Estructuras de Lewis Regla del octeto: Los átomos se unen compartiendo electrones hasta conseguir completar la última capa con 8 e- (4 pares de e-) es decir conseguir la configuración de gas noble: s 2 p 6 Tipos de pares de electrones: 1 - Pares de e- compartidos entre dos átomos (representado con una línea entre los at. unidos) · enlaces sencillos · enlaces dobles · enlaces triples 2 - Pares de e- no compartidos (ó par solitario) 6. El Enlace Covalente.

Estructuras de Lewis ¿Como se dibujan las estructuras de Lewis? 1 - Se suman los e- de valencia de los átomos presentes en la molécula. Para un anión poliatómico se le añade un e- más por cada carga negativa y para un catión se restan tantos electrones como cargas positivas. 2 - Se dibuja una estructura esquemática con los símbolos atómicos unidos mediante enlaces sencillos. 3 - Se calcula el nº de e- de valencia quedan disponibles. 4 - Se distribuyen los e- de forma que se complete un octete para cada átomo. Ejemplo 1: CH 4 1) C: 1 s 22 s 2 p 2 4 e. H: 1 s 1 1 e- x 4= 4 e 2) 8 e- Ejemplo 2: H 2 CO 1) C: 1 s 22 s 2 p 2 4 e. H: 1 s 1 1 e- x 2= 2 e. O: 1 s 22 s 2 p 4 6 e- 12 e- 2) 3) e- de v. libres: 12 -6= 6 4) 6. El Enlace Covalente.

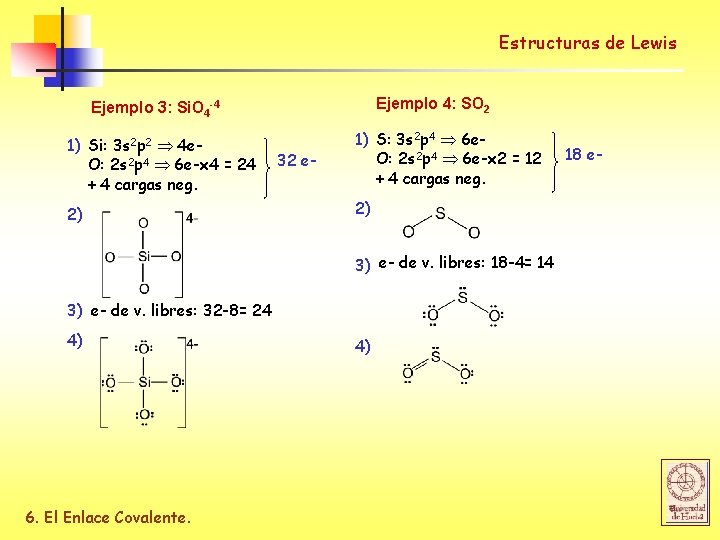
Estructuras de Lewis Ejemplo 4: SO 2 Ejemplo 3: Si. O 4 -4 1) Si: 3 s 2 p 2 4 e. O: 2 s 2 p 4 6 e-x 4 = 24 + 4 cargas neg. 2) 32 e- 1) S: 3 s 2 p 4 6 e. O: 2 s 2 p 4 6 e-x 2 = 12 + 4 cargas neg. 2) 3) e- de v. libres: 18 -4= 14 3) e- de v. libres: 32 -8= 24 4) 6. El Enlace Covalente. 4) 18 e-

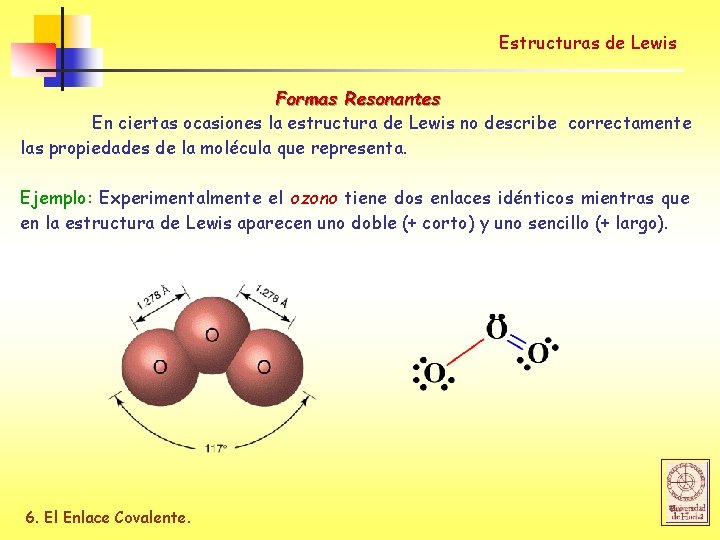
Estructuras de Lewis Formas Resonantes En ciertas ocasiones la estructura de Lewis no describe correctamente las propiedades de la molécula que representa. Ejemplo: Experimentalmente el ozono tiene dos enlaces idénticos mientras que en la estructura de Lewis aparecen uno doble (+ corto) y uno sencillo (+ largo). 6. El Enlace Covalente.

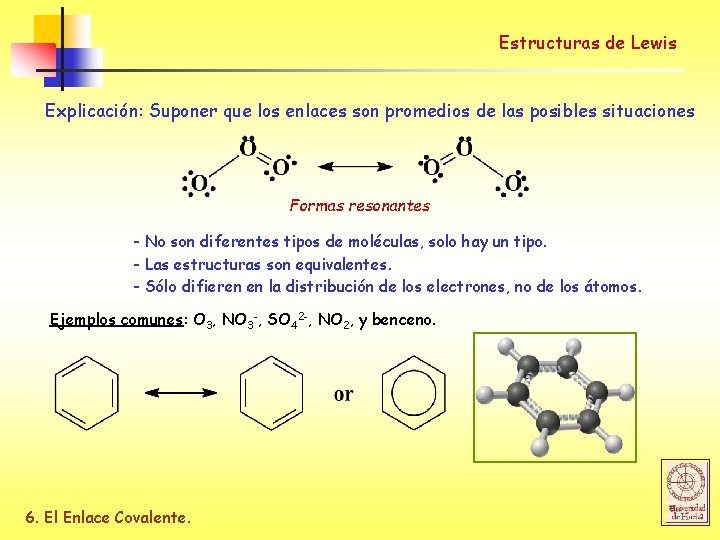
Estructuras de Lewis Explicación: Suponer que los enlaces son promedios de las posibles situaciones Formas resonantes - No son diferentes tipos de moléculas, solo hay un tipo. - Las estructuras son equivalentes. - Sólo difieren en la distribución de los electrones, no de los átomos. Ejemplos comunes: O 3, NO 3 -, SO 42 -, NO 2, y benceno. 6. El Enlace Covalente.

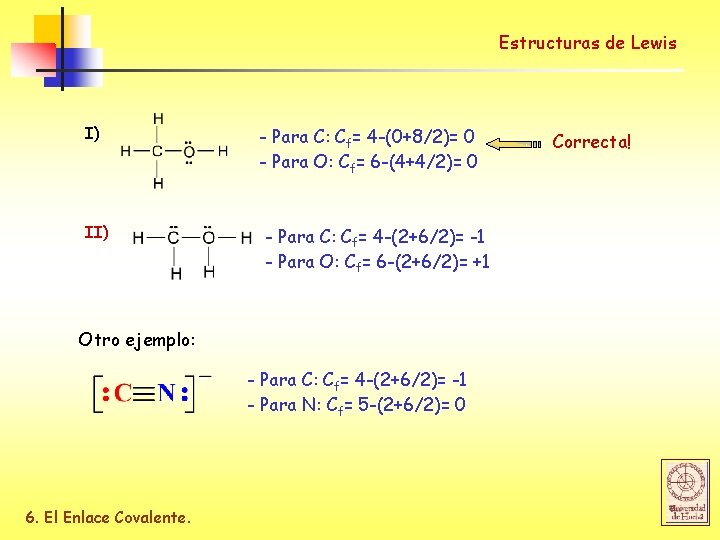
Estructuras de Lewis Carga Formal La carga formal es la diferencia entre el nº de e- de valencia y el nº de e- asignado en la estructura de Lewis (los e- no compartidos y la mitad de los e- compartidos). X= nº de e- de valencia Cf = X – (Y + Z/2) Y= nº de e- no compartidos Z= nº de e- compartidos En ocasiones es posible escribir más de una estructura de Lewis para una misma molécula: I II Utilizando el concepto de carga formal podemos determinar cual es la estructura de Lewis más probable: El valor de Cf sea mas proximo a 0 La Cf negativa debe estar localizada sobre el átomo + electronegativo 6. El Enlace Covalente.

Estructuras de Lewis I) II) - Para C: Cf= 4 -(0+8/2)= 0 - Para O: Cf= 6 -(4+4/2)= 0 - Para C: Cf= 4 -(2+6/2)= -1 - Para O: Cf= 6 -(2+6/2)= +1 Otro ejemplo: - Para C: Cf= 4 -(2+6/2)= -1 - Para N: Cf= 5 -(2+6/2)= 0 6. El Enlace Covalente. Correcta!

Estructuras de Lewis Excepciones a la regla del Octeto Hay tres clases de excepciones a la regla del Octete: a) Moléculas con nº de e- impar. NO (5+6=11 e- de valencia) Otros ejemplos: Cl. O 2, NO 2 b) Moléculas en las cuales un átomo tiene menos de un octete. BF 3 (3+7 x 3= 24 e- de valencia). Ej: Compuestos de los grupos 1 A, 2 A y 3 A. 6. El Enlace Covalente.

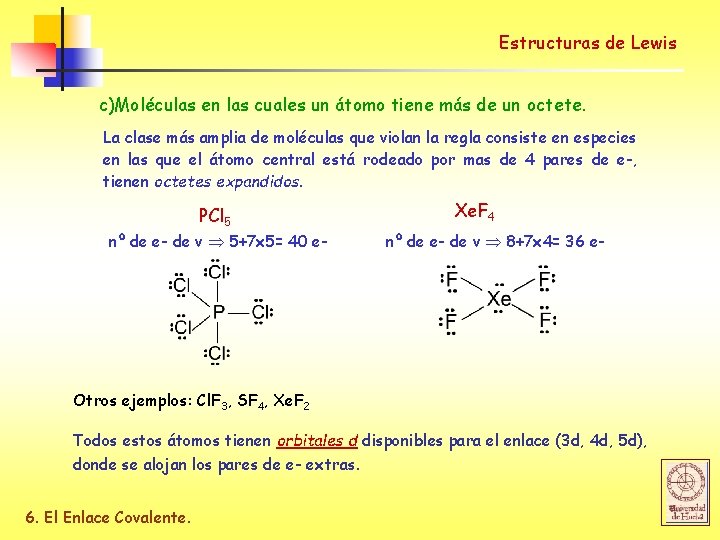
Estructuras de Lewis c)Moléculas en las cuales un átomo tiene más de un octete. La clase más amplia de moléculas que violan la regla consiste en especies en las que el átomo central está rodeado por mas de 4 pares de e-, tienen octetes expandidos. PCl 5 nº de e- de v 5+7 x 5= 40 e- Xe. F 4 nº de e- de v 8+7 x 4= 36 e- Otros ejemplos: Cl. F 3, SF 4, Xe. F 2 Todos estos átomos tienen orbitales d disponibles para el enlace (3 d, 4 d, 5 d), donde se alojan los pares de e- extras. 6. El Enlace Covalente.

Geometría Molecular Forma molecular está determinada por: » Distancia de enlace Distancia en línea recta, entre los núcleos de los dos átomos enlazados. » Angulo de enlace Angulo formado entre dos enlaces que contienen un átomo en común. Modelo de Repulsión de los Pares de Electrones de la Capa de Valencia La geometría molecular puede predecirse fácilmente basándonos en la repulsión entre pares electrónicos. En el modelo de RPECV, [Valence Shell Electron Pair Repulsion Theory (VSEPR)] los pares de e- alrededor de un átomo se repelen entre sí, por ello, los orbitales que contienen estos pares de e-, se orientan de forma queden lo más alejados que puedan unos de otros. 6. El Enlace Covalente.

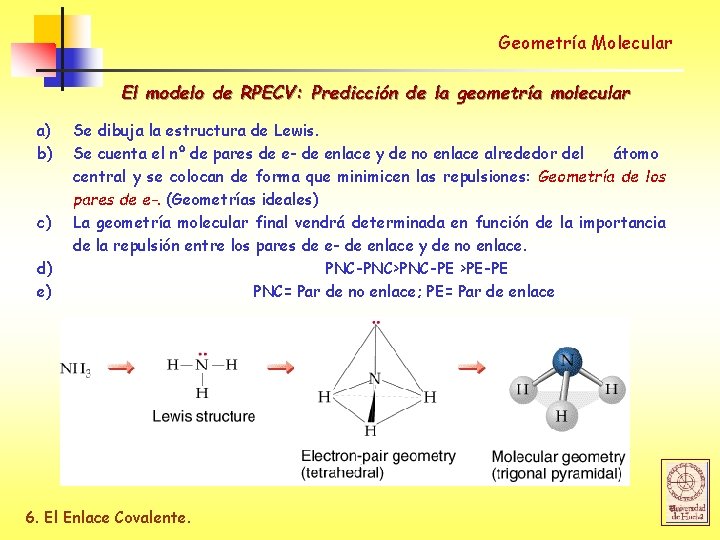
Geometría Molecular El modelo de RPECV: Predicción de la geometría molecular a) b) c) d) e) Se dibuja la estructura de Lewis. Se cuenta el nº de pares de e- de enlace y de no enlace alrededor del átomo central y se colocan de forma que minimicen las repulsiones: Geometría de los pares de e-. (Geometrías ideales) La geometría molecular final vendrá determinada en función de la importancia de la repulsión entre los pares de e- de enlace y de no enlace. PNC-PNC>PNC-PE >PE-PE PNC= Par de no enlace; PE= Par de enlace 6. El Enlace Covalente.

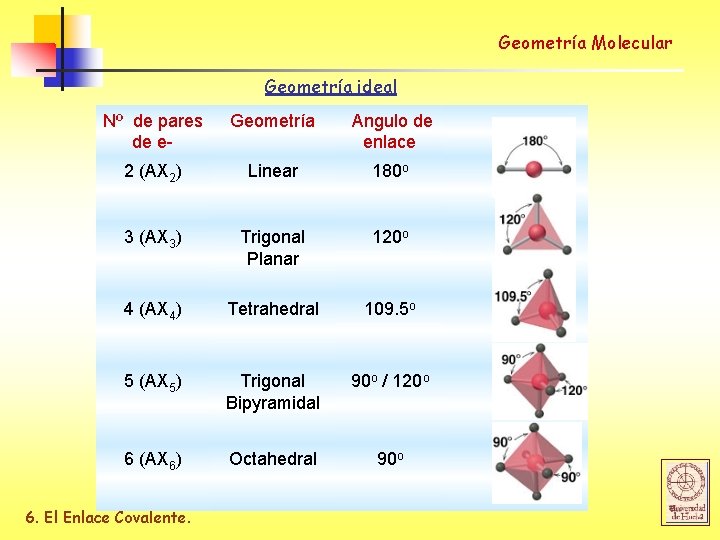
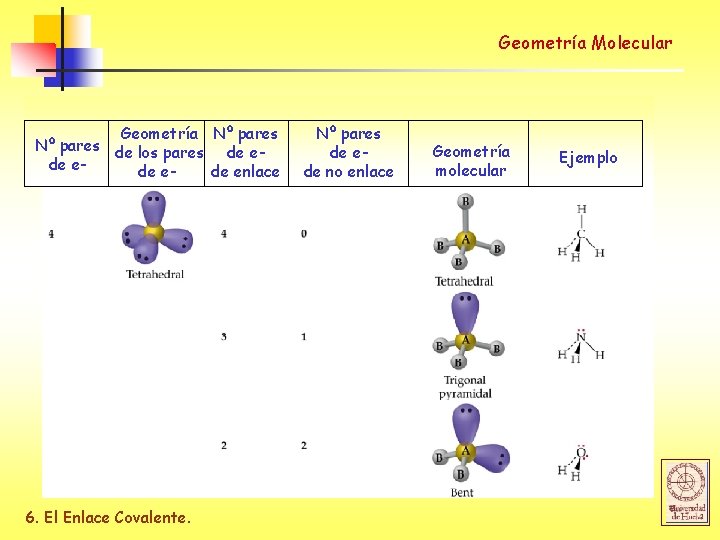
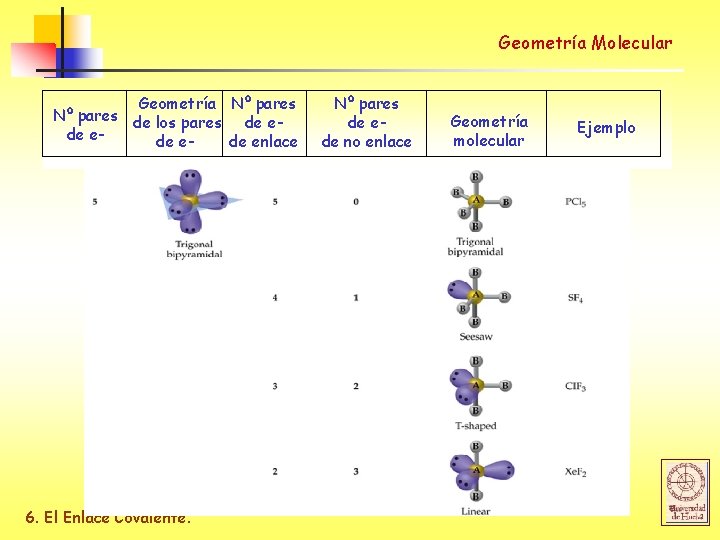
Geometría Molecular Geometría ideal Nº de pares de e- Geometría Angulo de enlace 2 (AX 2) Linear 180 o 3 (AX 3) Trigonal Planar 120 o 4 (AX 4) Tetrahedral 109. 5 o 5 (AX 5) Trigonal Bipyramidal 90 o / 120 o 6 (AX 6) Octahedral 90 o 6. El Enlace Covalente.

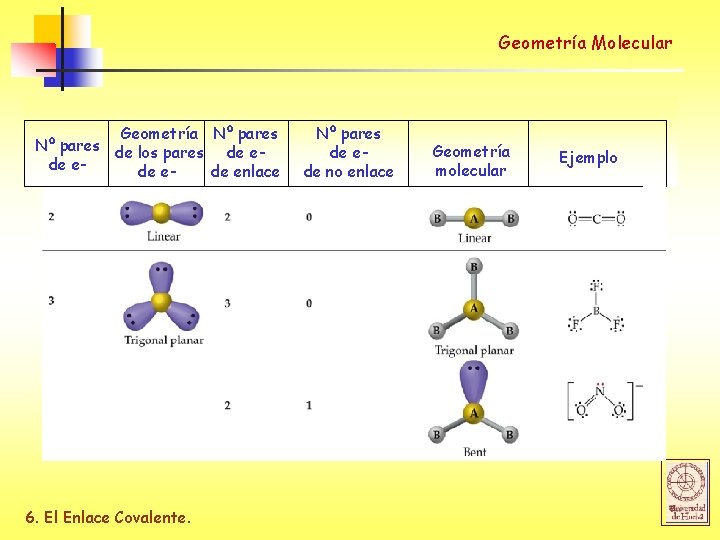
Geometría Molecular Geometría Nº pares de los pares de ede enlace 6. El Enlace Covalente. Nº pares de ede no enlace Geometría molecular Ejemplo

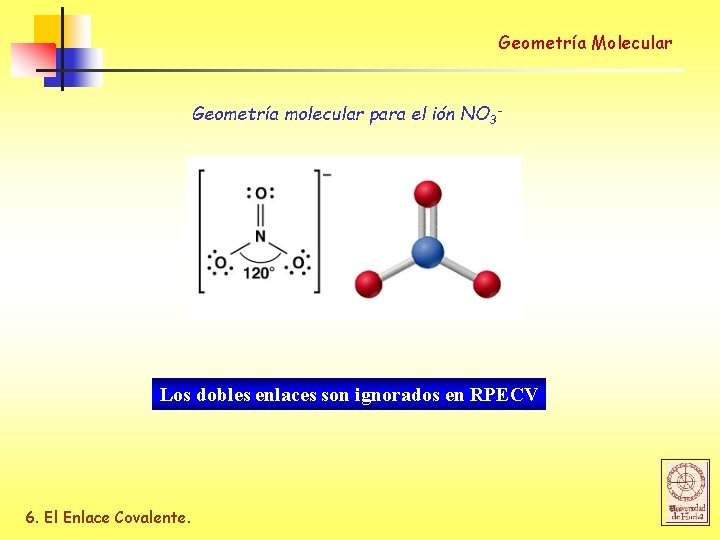
Geometría Molecular Geometría molecular para el ión NO 3 - Los dobles enlaces son ignorados en RPECV 6. El Enlace Covalente.

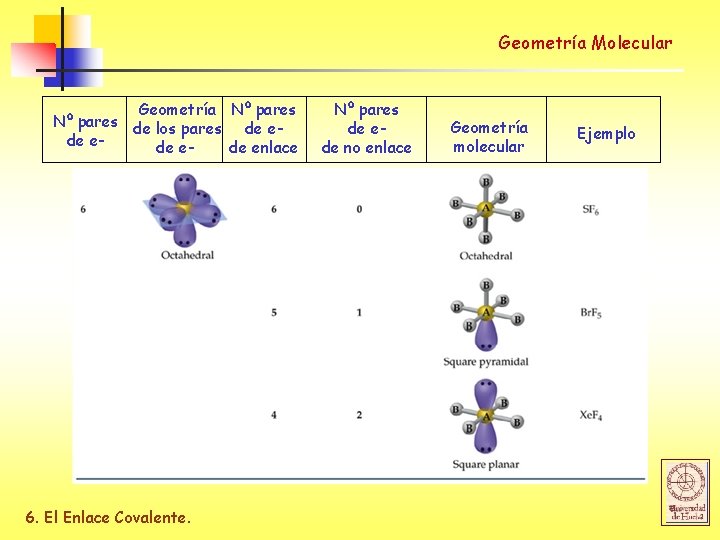
Geometría Molecular Geometría Nº pares de los pares de ede enlace 6. El Enlace Covalente. Nº pares de ede no enlace Geometría molecular Ejemplo

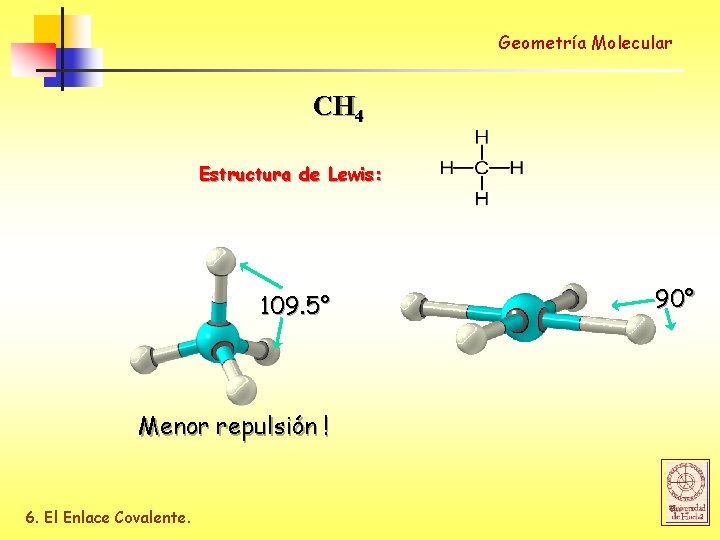
Geometría Molecular CH 4 Estructura de Lewis: 109. 5° Menor repulsión ! 6. El Enlace Covalente. 90°

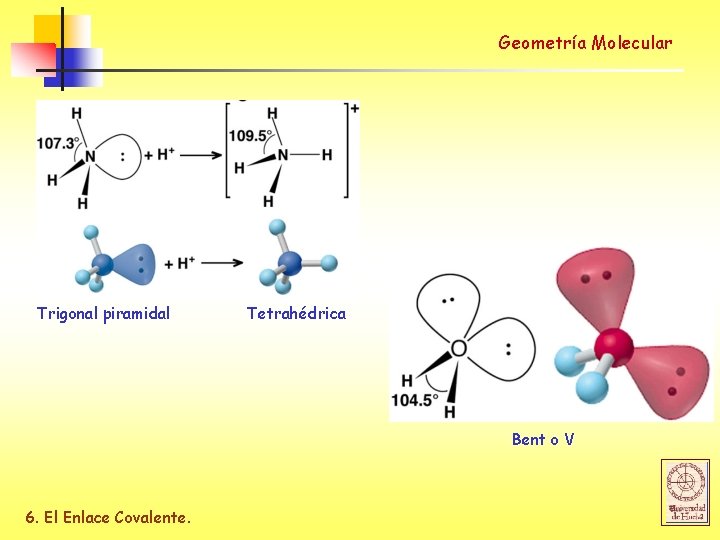
Geometría Molecular Trigonal piramidal Tetrahédrica Bent o V 6. El Enlace Covalente.

Geometría Molecular Geometría Nº pares de los pares de ede enlace 6. El Enlace Covalente. Nº pares de ede no enlace Geometría molecular Ejemplo

Geometría Molecular Geometría Nº pares de los pares de ede enlace 6. El Enlace Covalente. Nº pares de ede no enlace Geometría molecular Ejemplo

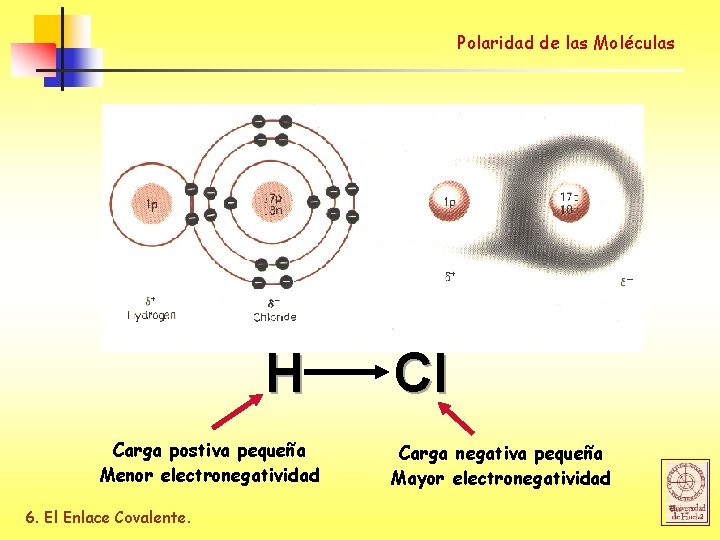
Polaridad de las Moléculas POLARIDAD Los enlaces covalentes y las moléculas unidas por ellos pueden ser: Polares: Existe una distribución asimétrica de los electrones, el enlace o la molécula posee un polo + y uno -, o un dipolo No polares: Existe una distribución simétrica de los e-, produciendo un enlace o molécula sin dipolo. Enlaces covalentes polares Enlaces covalentes no polares H-H F-F El grado de polaridad de un enlace covalente está relacionado con la diferencia de electronegatividad de los átomos unidos. 6. El Enlace Covalente.

Polaridad de las Moléculas Polarity of bonds H Carga postiva pequeña Menor electronegatividad 6. El Enlace Covalente. Cl Carga negativa pequeña Mayor electronegatividad

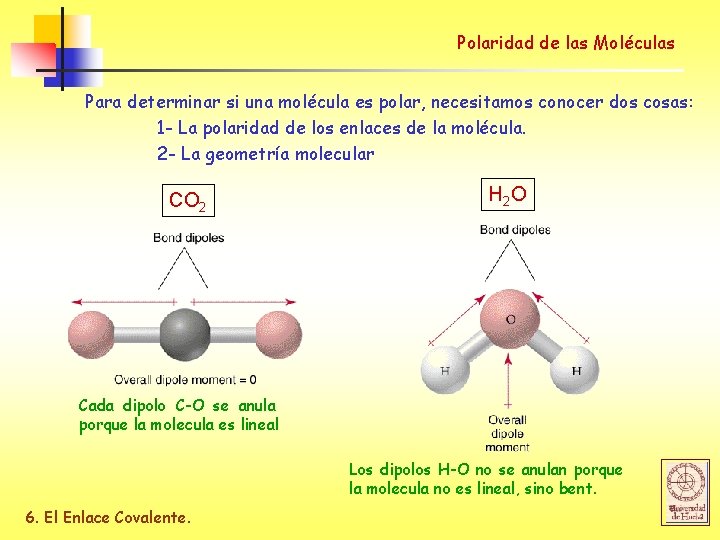
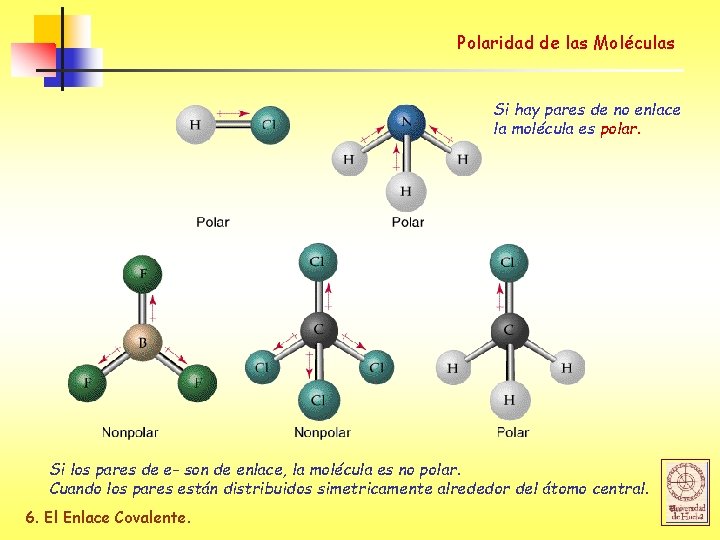
Polaridad de las Moléculas Para determinar si una molécula es polar, necesitamos conocer dos cosas: 1 - La polaridad de los enlaces de la molécula. 2 - La geometría molecular CO 2 H 2 O Cada dipolo C-O se anula porque la molecula es lineal Los dipolos H-O no se anulan porque la molecula no es lineal, sino bent. 6. El Enlace Covalente.

Polaridad de las Moléculas Si hay pares de no enlace la molécula es polar. Si los pares de e- son de enlace, la molécula es no polar. Cuando los pares están distribuidos simetricamente alrededor del átomo central. 6. El Enlace Covalente.

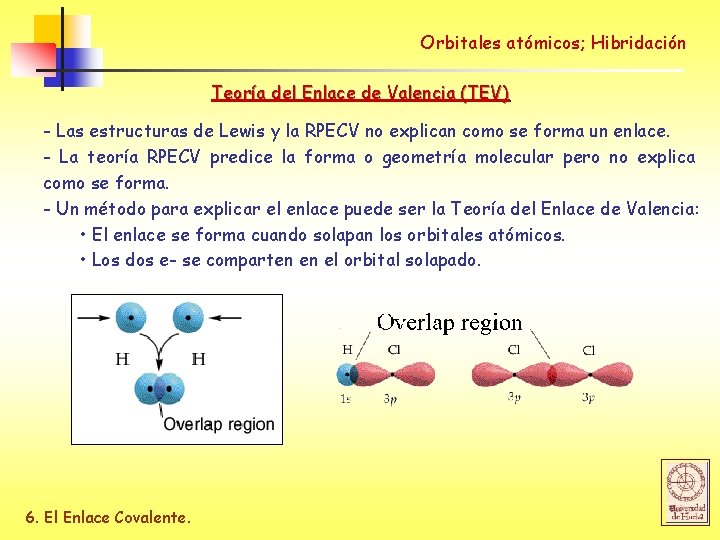
Orbitales atómicos; Hibridación Teoría del Enlace de Valencia (TEV) - Las estructuras de Lewis y la RPECV no explican como se forma un enlace. - La teoría RPECV predice la forma o geometría molecular pero no explica como se forma. - Un método para explicar el enlace puede ser la Teoría del Enlace de Valencia: • El enlace se forma cuando solapan los orbitales atómicos. • Los dos e- se comparten en el orbital solapado. 6. El Enlace Covalente.

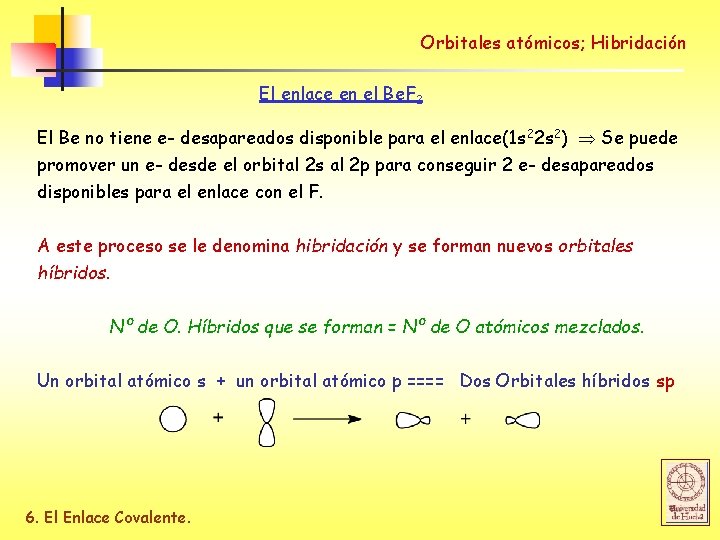
Orbitales atómicos; Hibridación El enlace en el Be. F 2 El Be no tiene e- desapareados disponible para el enlace(1 s 22 s 2) Se puede promover un e- desde el orbital 2 s al 2 p para conseguir 2 e- desapareados disponibles para el enlace con el F. A este proceso se le denomina hibridación y se forman nuevos orbitales híbridos. Nº de O. Híbridos que se forman = Nº de O atómicos mezclados. Un orbital atómico s + un orbital atómico p ==== Dos Orbitales híbridos sp 6. El Enlace Covalente.

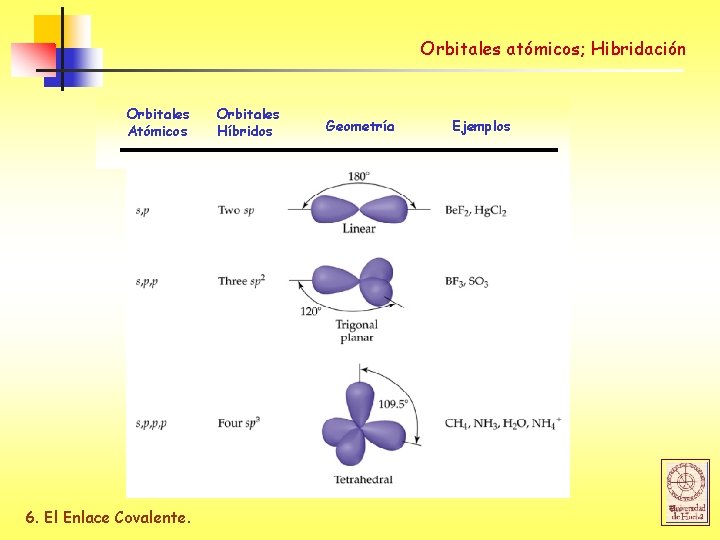
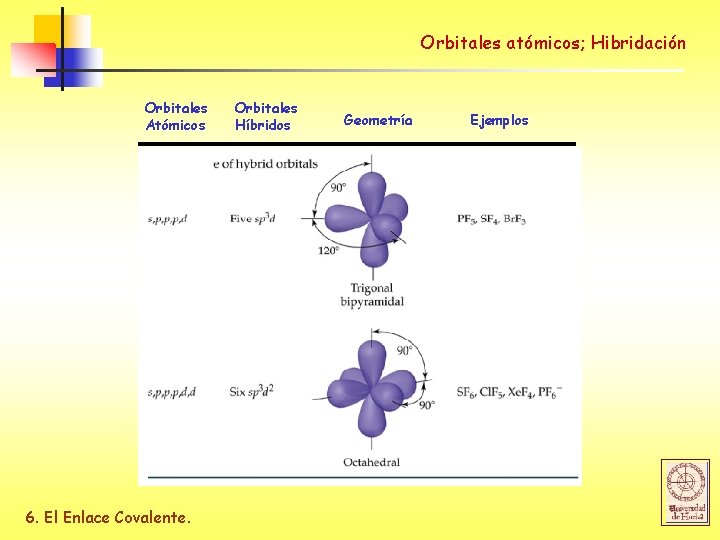
Orbitales atómicos; Hibridación Orbitales Atómicos 6. El Enlace Covalente. Orbitales Híbridos Geometría Ejemplos

Orbitales atómicos; Hibridación Orbitales Atómicos 6. El Enlace Covalente. Orbitales Híbridos Geometría Ejemplos

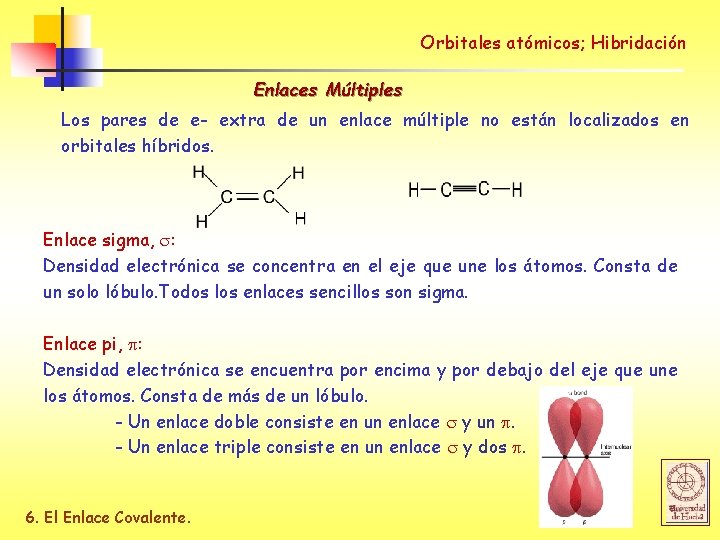
Orbitales atómicos; Hibridación Enlaces Múltiples Los pares de e- extra de un enlace múltiple no están localizados en orbitales híbridos. Enlace sigma, : Densidad electrónica se concentra en el eje que une los átomos. Consta de un solo lóbulo. Todos los enlaces sencillos son sigma. Enlace pi, : Densidad electrónica se encuentra por encima y por debajo del eje que une los átomos. Consta de más de un lóbulo. - Un enlace doble consiste en un enlace y un . - Un enlace triple consiste en un enlace y dos . 6. El Enlace Covalente.

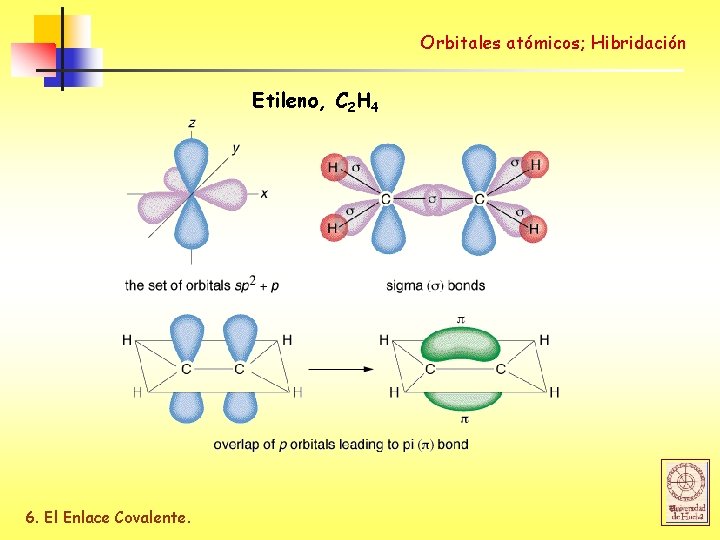
Orbitales atómicos; Hibridación Etileno, C 2 H 4 6. El Enlace Covalente.

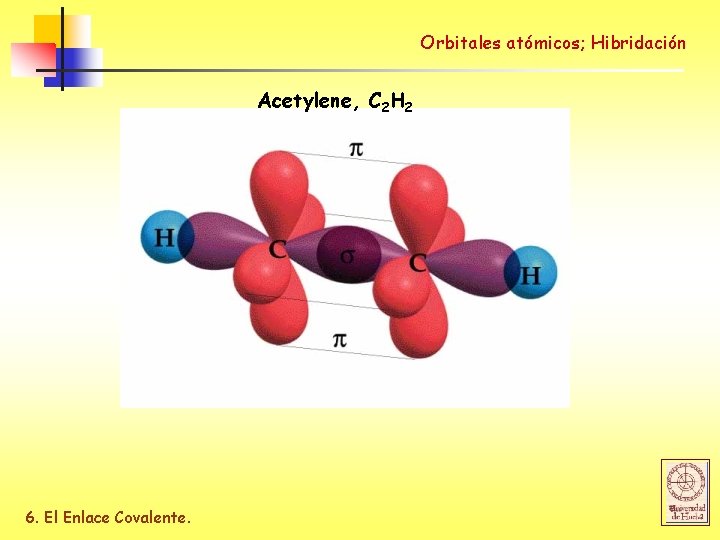
Orbitales atómicos; Hibridación Acetylene, C 2 H 2 6. El Enlace Covalente.
 Enlace covalente heteronuclear
Enlace covalente heteronuclear Enlaces metalicos
Enlaces metalicos Rango de valor de covalente puro
Rango de valor de covalente puro Enlaces sigma y pi
Enlaces sigma y pi Enlace covalente polar
Enlace covalente polar Tetrahédrica
Tetrahédrica Enlace covalente normal
Enlace covalente normal El litio cumple con la regla del dueto
El litio cumple con la regla del dueto Covalente no polar ejemplos
Covalente no polar ejemplos Enlace dativo
Enlace dativo Enlace covalente homopolar
Enlace covalente homopolar Propiedades fisicas del enlace metalico
Propiedades fisicas del enlace metalico Como calcular diferencia de electronegatividad
Como calcular diferencia de electronegatividad Enlace covalente simple doble y triple ejemplos
Enlace covalente simple doble y triple ejemplos F2 estructura de lewis
F2 estructura de lewis H y h tipo de enlace
H y h tipo de enlace Enlace covalente
Enlace covalente Orbitales sigma y pi
Orbitales sigma y pi Uniones metalicas ejemplos
Uniones metalicas ejemplos Leccin
Leccin Leccin
Leccin Leccin
Leccin Leccin
Leccin Leccin
Leccin Leccin
Leccin Saber imperfect subjunctive
Saber imperfect subjunctive Leccin
Leccin Leccin
Leccin Leccin
Leccin Leccin
Leccin Las clases empiezan a las nueve. cierto falso
Las clases empiezan a las nueve. cierto falso Leccin
Leccin Leccin
Leccin Tener preterite
Tener preterite Leccin
Leccin Leccin
Leccin![(you [form., sing.] left) aquí la radiografía. (you [form., sing.] left) aquí la radiografía.](data:image/svg+xml,%3Csvg%20xmlns=%22http://www.w3.org/2000/svg%22%20viewBox=%220%200%20200%20200%22%3E%3C/svg%3E) (you [form., sing.] left) aquí la radiografía.
(you [form., sing.] left) aquí la radiografía.




































![(you [form., sing.] left) aquí la radiografía. (you [form., sing.] left) aquí la radiografía.](https://slidetodoc.com/wp-content/uploads/2020/12/2869291_b74ccaebd8876676efceeaa1f1a8fa04-300x225.jpg)




















