ENLACE COVALENTE El enlace covalente se forma cuando






- Slides: 7


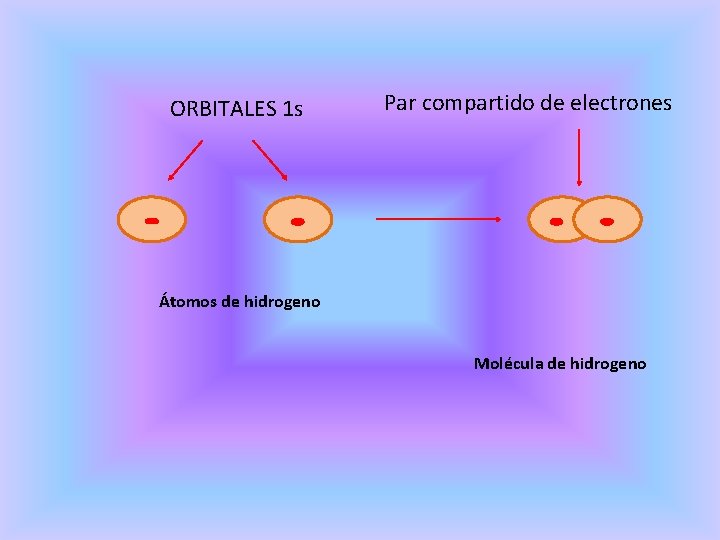
ENLACE COVALENTE El enlace covalente se forma cuando dos átomos comparten uno o mas pares de electrones. Se produce porque los átomos que forman el compuesto tienen una tendencia similar hacia los electrones, generalmente a ganarlos. Este enlace se forma por la unión de dos aromos que poseen igual electronegatividad, o poca diferencia entre sus valores. en ninguno de los casos, ocurre transferencia de electrones. Los electrones que participan en el enlace actúan como estabilizantes para ambos átomos, así adquieren la configuración electrónica del gas noble. Este enlace se forma especialmente entre átomos de un no metal o con átomos de otro no metal.

ORBITALES 1 s Par compartido de electrones Átomos de hidrogeno Molécula de hidrogeno

Clasificación del enlace covalente Por diferencia de electronegatividad v. Enlace covalente polar: este enlace es polar debido a que los atomos que participan en él presentan diferentes valores de electronegatividad, su diferencia se encuentra entre 0, 8 y 1, 7. la polaridad se debe a la distribución desigual de los electrones ya que el átomo mas electronegativo tiene una mayor atracción hacia el par de electrones compartido. El átomo con menor electronegatividad adquiere una carga positiva parcial. Ejemplo, la molécula de acido clorhídrico (Hcl).

v Enlace covalente no polar: se forma cuando los átomos que forman el compuesto presentan igual o muy semejante valor de electronegatividad, la diferencia entre ellas esta entre 0, 0 y 0, 8. cuando se unen dos átomos del mismo elemento, se forma un enlace covalente no polar. En este tipo de enlace, el par de electrones compartido es atraído con igual fuerza por los núcleos de los átomos que lo forman. Por esto, la moléculas de los compuestos no polares son eléctricamente neutras. Son ejemplos, las moléculas de hidrogeno, la molécula de cloro y de ni 8 trogeno.

El numero de electrones compartidos v. Enlace covalente sencillo: se presenta cuando los átomos que forman el enlace comparten solo un par de electrones. En este tipo de enlace cada átomo aporta un electrón. Los enlaces sencillos se representan mediante una barra o guion que representa cada par de electrones compartidos. v. Enlace covalente doble: se forma cuando los átomos comparten mas de un par de electrones. En este tipo de enlace cada átomo que participa en el enlace aporta dos electrones, es decir, son cuatro electrones los que participan en el enlace.

El numero de electrones que aporta cada átomo enlace covalente coordinado: se presenta cuando el par de electrones compartido pertenece a uno solo atomo. El atomo que aporta los electrones es siempre el elemento menos electronegativo y adquiere una carga ligeramente positiva, mientras que el atomo aceptor adquiere una carga ligeramente negativa. Enlace covalente triple: se presenta cuando los átomos que forman el enlace comparten tres pares de electrones. Cada átomo aporta tres electrones en la formación del enlace, es decir seis electrones forman el enlace.












