UNIONES Y ENLACE QUMICO SEMANA 2 2015 Licda





















- Slides: 29

UNIONES Y ENLACE QUÍMICO SEMANA 2 - 2015 Licda: Isabel Fratti de Del Cid Diapositivas con imágenes e ilustraciones cortesía de Licda. Lilian Guzmán 2015

ENLACE QUÍMICO 2 Son las atracciones, fuerzas, uniones e interacciones, que mantienen unidas a las partículas ( átomos , iones ó moléculas)en la materia. Estas partículas al unirse, tienden a formar estructuras más estables. El enlace químico puede ser: § Covalente § Iónico Se da entre átomos y § Metálico Iones §Intermolecular : se da entre moléculas

REGLA DEL OCTETO 3 Se aplica a la unión entre átomos : Cuando dos o más átomos se combinan para formar compuestos tienden a ganar, perder ó compartir electrones, en número suficiente para llegar a tener capas externas con 8 electrones ( octeto) similares a las de los gases nobles ó inertes. Note en la tabla periódica que los gases nobles(VIIIA) sus configuraciones terminan en xs 2 xp 6 ( 8 e- es decir un octeto).

Electronegatividad 4 Capacidad relativa de un átomo para atraer los electrones de otro ú otros átomos al formar un enlace. Esta posee un valor numérico dado en la tabla periódica. Los valores numéricos , presentan las siguientes tendencias: En un período aumenta de izquierda a derecha. En un grupo disminuye de arriba hacia abajo. Con esto concluimos que los elementos : más electronegativos se hallan en la parte superior derecha de la tabla periódica ej: los no metales F y O ( se excluyen de ésta regla a los gases nobles) Los menos electronegativos en la parte inferior izquierda (los metales Cs y Rb).

Tendencias del valor de la electronegatividad en la tabla periódica. 5

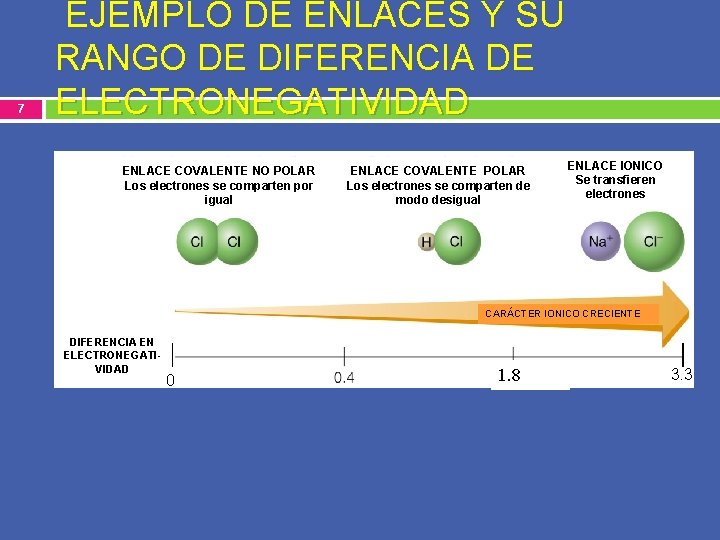
6 Criterio usando la electronegatividad para definir si un enlace es iónico ó covalente. A-Reste le electronegatividad mayor de la menor, sin importar el orden en que los átomos aparecen en la fórmula del compuesto. B- No debe multiplicar la electronegatividad por el número de veces que aparece el elemento en el compuesto. Solo se toma en cuenta una vez. Diferenciq de electronegatividad Tipo de enlace 0. 0 a 0. 4 Covalente no polar ( apolar) >0. 4 y < 1. 8 Covalente polar 1. 8 en adelante Iónico.

7 EJEMPLO DE ENLACES Y SU RANGO DE DIFERENCIA DE ELECTRONEGATIVIDAD ENLACE COVALENTE NO POLAR Los electrones se comparten por igual ENLACE COVALENTE POLAR Los electrones se comparten de modo desigual ENLACE IONICO Se transfieren electrones CARÁCTER IONICO CRECIENTE DIFERENCIA EN ELECTRONEGATIVIDAD 0 1. 8 3. 3

8 Predicción del tipo de enlaces a partir de las diferencias de electronegatividad

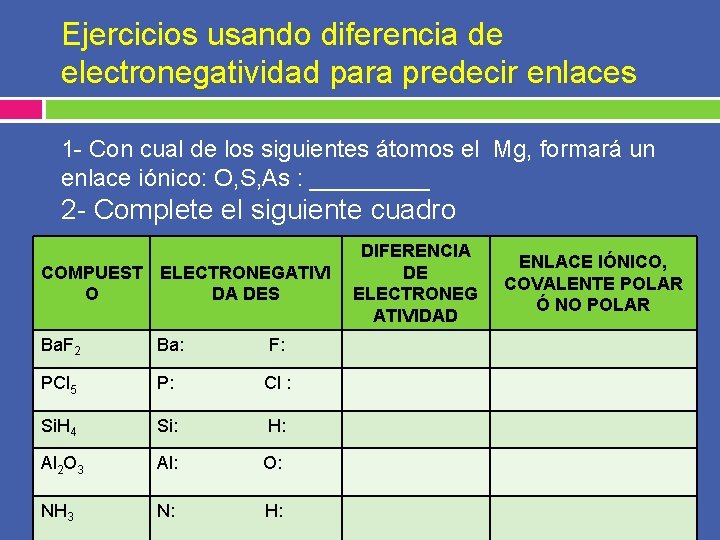
Ejercicios usando diferencia de electronegatividad para predecir enlaces 1 - Con cual de los siguientes átomos el Mg, formará un enlace iónico: O, S, As : _____ 2 - Complete el siguiente cuadro COMPUEST ELECTRONEGATIVI O DA DES Ba. F 2 Ba: F: PCl 5 P: Cl : Si. H 4 Si: H: Al 2 O 3 Al: O: NH 3 N: H: DIFERENCIA DE ELECTRONEG ATIVIDAD ENLACE IÓNICO, COVALENTE POLAR Ó NO POLAR

Enlace iónico 10 Al unirse átomos muy electronegativos con átomos de poca electronegatividad ; el más electronegativo «gana» electrones y se convierte en un ión con carga negativa ( anión) y el menos electronegativo «pierde» electrones y se convierte en un ión con carga positiva ( catión). Recordar que esto sucede generalmente si la diferencia de electronegatividad es de 1. 8 en adelante. Hay transferencia de electrones ( uno gana otro pierde). Lo que mantiene unidos a cationes (+) y aniones (-) es la fuerza de atracción electrostática entre cargas opuestas.

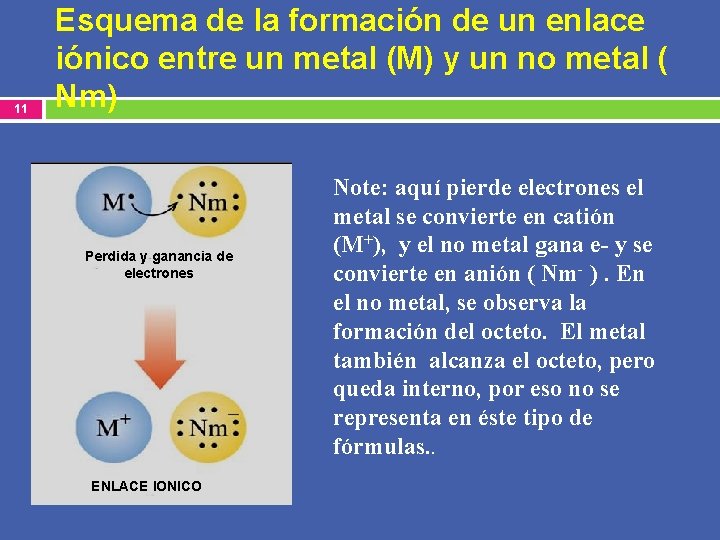
11 Esquema de la formación de un enlace iónico entre un metal (M) y un no metal ( Nm) Perdida y ganancia de electrones ENLACE IONICO Note: aquí pierde electrones el metal se convierte en catión (M+), y el no metal gana e- y se convierte en anión ( Nm- ). En el no metal, se observa la formación del octeto. El metal también alcanza el octeto, pero queda interno, por eso no se representa en éste tipo de fórmulas. .

Ejemplo de ENLACE IONICO 12 a) Ca + F 2 Ca F 2 (formado de Ca+2 y 2 F - ) 2 2 s 2 2 p 6 3 s 23 p 64 s 2 Ca = 1 s 20 20 Ca +2 = 1 s 22 p 63 s 23 p 6 ( pierde 2 e-) 9 F = 1 s 2 2 p 5 9 F - = 1 s 22 p 6 ( ganó 1 e-) La formación de éstos iones también puede predecirse por la diferencia de electronegatividad: Ca=1. 0 y F=3. 99, diferencia 2. 99, por lo tanto es iónico el Ca, pierde electrones por ser menos electronegativo y el F, gana electrones por ser mas electronegativo.

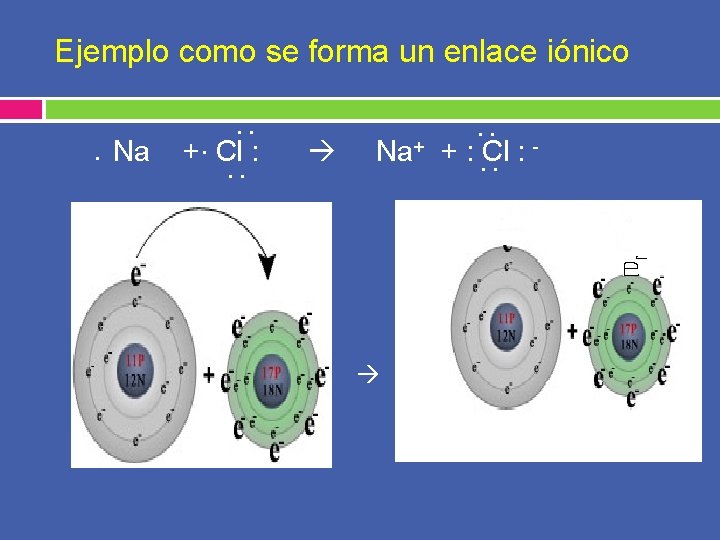
Ejemplo como se forma un enlace iónico. Na . . +. Cl : . . Na+ + . . : . Cl. : -

Enlaces Covalentes simple 14 Un Enlace covalente simple es cuando se comparte un par de electrones, donde cada átomo aporta un electrón. El enlace simple se puede representar con un guión entre los átomos que lo forman. Ejemplo: H-Cl

ENLACE COVALENTE 15 Si los átomos poseen electronegatividades similares, éstos no ganan ni pierden electrones entonces se comparten los e- del enlace á esto se le conoce como enlace covalente. Para efectos prácticos se considera que un enlace covalente se forma cuando la diferencia de electronegatividades es< de 1. 8 Estos enlaces se representan Con líneas Ej: H-H ó puntos H: H

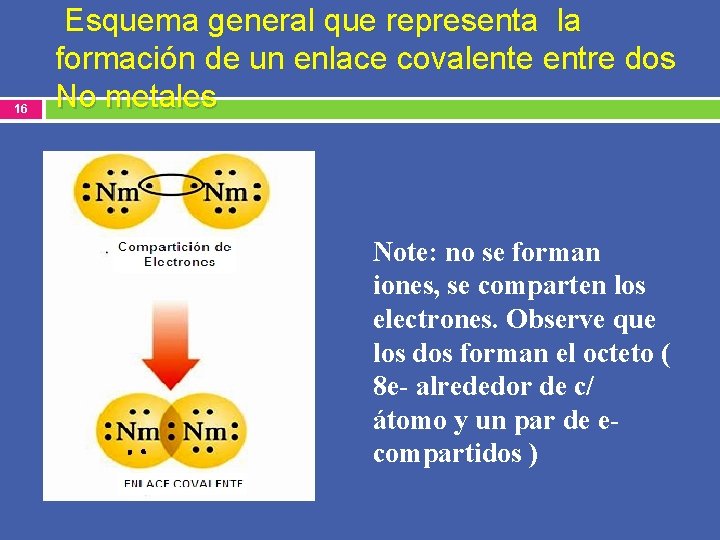
16 Esquema general que representa la formación de un enlace covalente entre dos No metales Note: no se forman iones, se comparten los electrones. Observe que los dos forman el octeto ( 8 e- alrededor de c/ átomo y un par de ecompartidos )

Tipos de enlace covalente I-De acuerdo al numero de parejas de electrones que comparten: A-Covalente simple se comparte una pareja de electrones. Cada átomo pone un electrón. B-Covalente doble: se comparten dos parejas de electrones. Cada átomo pone dos electrones. C-Covalente triple: se comparten tres parejas de electrones. C / átomo pone tres electrones. D-Covalente coordinado ó dativo: Se comparte una pareja de electrones, pero éstos provienen de uno solo de los átomos.

Cont. Tipos de enlace covalente II- De acuerdo a diferencia de electronegatividad: A- Covalente no polar( apolar) : Diferencia de 0. 0 -0. 4. B-Covalente polar diferencia >0. 4 y < 1. 8. Nota: Todo enlace covalente: simple, doble, triple, coordinado puede a la vez ser No polar ó polar.

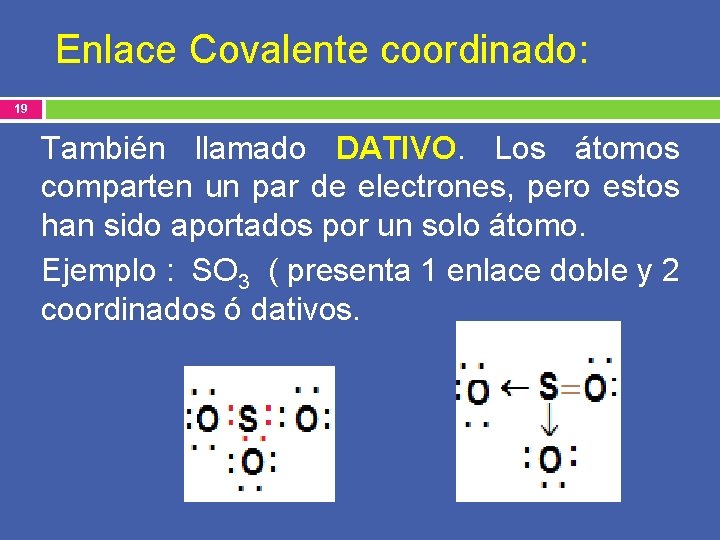
Enlace Covalente coordinado: 19 También llamado DATIVO. Los átomos comparten un par de electrones, pero estos han sido aportados por un solo átomo. Ejemplo : SO 3 ( presenta 1 enlace doble y 2 coordinados ó dativos.

Enlaces covalentes múltiples : Dobles ó triples 20 Son múltiples cuando entre ellos forman enlaces: A-Dobles CH 2=CH 2 C/átomo pone un par de e- : Se com. Parten dos parejas de e- ( 4 e-) B- Triples N N Se comparten 3 parejas de e- c/ átomo pone 3 e- ( 6 e-)

Enlace covalente polar 21 Los electrones se comparten de manera desigual entre átomos , debido a que poseen diferente electronegatividad, pero no Hay suficiente diferencia forman enlaces iónicos. Los enlaces covalentes polares pueden ser: simples, coordinados, dobles ó triples. Para efectos prácticos son polares si la diferencia de electronegatividad Oscila de (>0. 4 y < 1, 8) Ejemplo : HCl SO 2 CO 2

Enlace covalente no polar (apolar) 22 Se dan cuando los pares de electrones se comparten de manera equitativa ó muy pareja. Se da en todas las moléculas diatómicas. Para efectos prácticos es no polar si la diferencia de electronegatividad está en el rango : (0. 0 a 0. 4) Ejemplo : Cl 2 , Si. H 4 , Sb. H 3

Enlace covalente puro 23 Enlace covalente “puro”, También es un enlace No polar donde la diferencia de electronegatividad es 0. 0 debido a que el enlace se da entre átomos idénticos: Ejemplo todos los elementos diatómicos: N 2, O 2, F 2, H 2 , Cl 2 , I 2 , Br 2

Los enlaces covalentes simples, dobles ó triples, a su vez pueden ser polares ó NO polares. H 2 y Si. H 4 : Covalente simple NO polar HCl ; NH 3 : Covalente simple polar. O 2 : Covalente doble NO polar SO 2: Posee un covalente doble polar y un coordinado polar. N 2 : covalente triple NO polar.

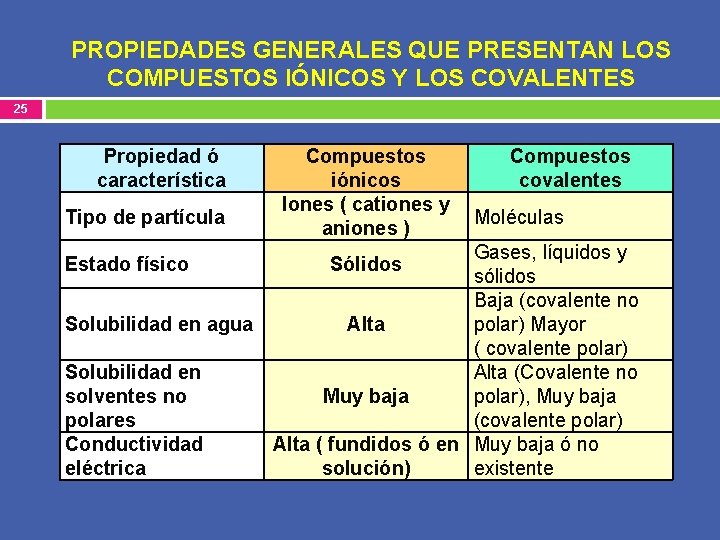
PROPIEDADES GENERALES QUE PRESENTAN LOS COMPUESTOS IÓNICOS Y LOS COVALENTES 25 Propiedad ó característica Tipo de partícula Compuestos iónicos Iones ( cationes y aniones ) Compuestos covalentes Moléculas Gases, líquidos y sólidos Baja (covalente no Solubilidad en agua Alta polar) Mayor ( covalente polar) Solubilidad en Alta (Covalente no solventes no Muy baja polar), Muy baja polares (covalente polar) Conductividad Alta ( fundidos ó en Muy baja ó no eléctrica solución) existente Estado físico Sólidos

ESTRUCTURAS DE LEWIS de átomos Es la representación de un elemento y sus electrones de valencia. El símbolo de cada elemento se utiliza para representar el núcleo y todos los electrones internos. Los electrones de valencia ( los que se hallan en el último nivel de energía) se representan como puntos alrededor del símbolo. Ejemplos: º 26 º Al º . . Cl . Na ∧

Los electrones de valencia para los elementos representativos corresponden al número de grupo 27 EJEMPLO GRUPO IA Tiene 1 electrón de valencia, entonces se dibuja 1 punto IIA Tienen 2 electrones de valencia, entonces se dibuja 2 puntos IIIA Tienen 3 electrones de valencia , entonces se dibujan 3 puntos IVA Tienen 4 electrones de valencia , entonces se dibujan 4 puntos H. . Mg. . B. . Si. .

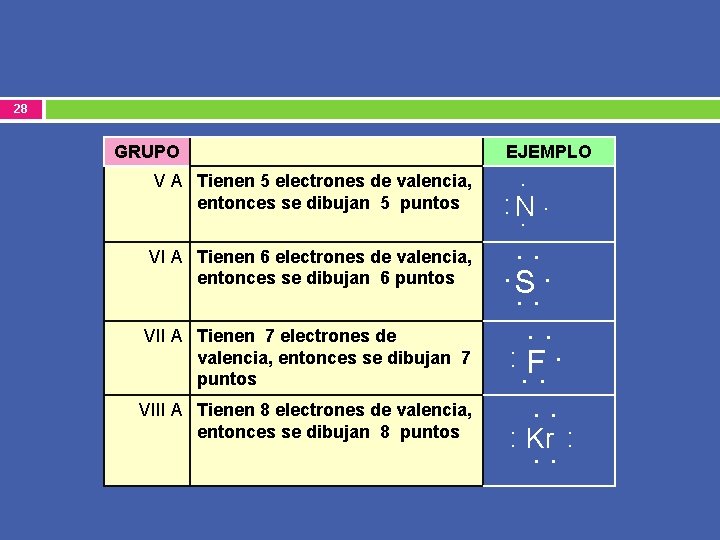
28 GRUPO V A Tienen 5 electrones de valencia, entonces se dibujan 5 puntos VI A Tienen 6 electrones de valencia, entonces se dibujan 6 puntos VII A Tienen 7 electrones de valencia, entonces se dibujan 7 puntos VIII A Tienen 8 electrones de valencia, entonces se dibujan 8 puntos EJEMPLO . . : . N. . S. . . : F. . . : Kr : . .

29 Fin
 Enlace qumico
Enlace qumico Enlace qumico
Enlace qumico Polar y no polar
Polar y no polar Tipo de enlace del oxígeno
Tipo de enlace del oxígeno Enlace qumico
Enlace qumico Enlace sigma y pi
Enlace sigma y pi El agua mineral es disoluciones coloides o suspensiones
El agua mineral es disoluciones coloides o suspensiones Aparato de golgi
Aparato de golgi Union traslapada
Union traslapada Endocitosis
Endocitosis Integrinas
Integrinas Fuerzas de london
Fuerzas de london Uniones y conexiones wan
Uniones y conexiones wan Uniones soldadas a tope y de filete
Uniones soldadas a tope y de filete Tipos de soldadura de filete
Tipos de soldadura de filete Escinucleasa
Escinucleasa Modelo de holliday
Modelo de holliday Hemidesmosoma
Hemidesmosoma Uniones fijas y desmontables
Uniones fijas y desmontables Como se clasifica el enlace covalente
Como se clasifica el enlace covalente 10 ejemplos fuerzas de van der waals ejemplos
10 ejemplos fuerzas de van der waals ejemplos Transitria
Transitria Moleculas de adhesion
Moleculas de adhesion Tejido cartilaginoso
Tejido cartilaginoso Uniones intercelulares
Uniones intercelulares Bulones
Bulones Uniones celulares
Uniones celulares Enlace polimerizante
Enlace polimerizante Isomeros entre si
Isomeros entre si Mutarrotación de la fructosa
Mutarrotación de la fructosa