EL ENLACE QUMICO Las propiedades caractersticas de las



















- Slides: 28

EL ENLACE QUÍMICO

Las propiedades características de las sustancias están relacionadas con la forma en que están unidas sus partículas y las fuerzas entre ellas, es decir, con el tipo de ENLACE que existe entre sus partículas.


Una primera aproximación para interpretar el enlace Ø A principios del siglo XX, el científico Lewis, observando la poca reactividad de los gases nobles (estructura de 8 electrones en su último nivel), sugirió que los átomos al enlazarse “tienden” a adquirir una distribución de electrones de valencia igual a la del gas noble más próximo REGLA DEL OCTETO

Clasificación de los elementos de acuerdo con la regla del octeto Ø Metales: baja electronegatividad, baja energía de ionización. Tienden a soltar electrones. Ø No metales: alta electronegatividad. Tienden a coger electrones

Según el tipo de átomos que se unen: Ø Metal – No metal: uno cede y otro coge electrones (cationes y aniones) Ø No metal – No metal: ambos cogen electrones, comparten electrones Ø Metal – Metal: ambos ceden electrones

Algunos ejemplos…

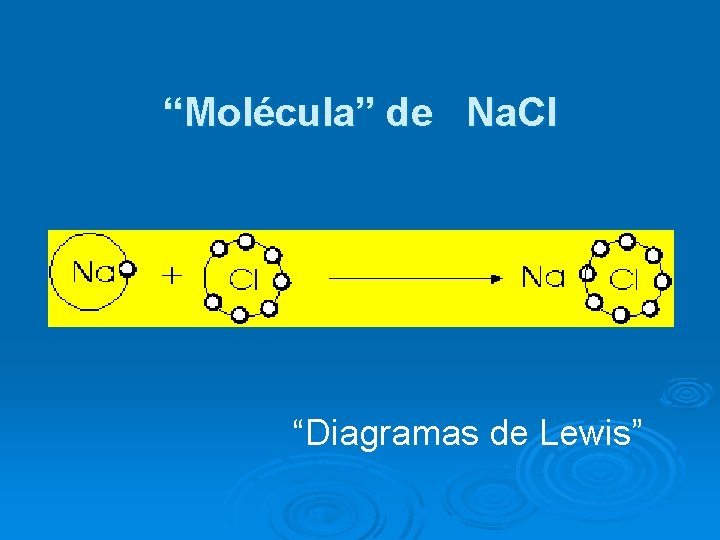
“Molécula” de Na. Cl “Diagramas de Lewis”

“Molécula” de Mg. F 2

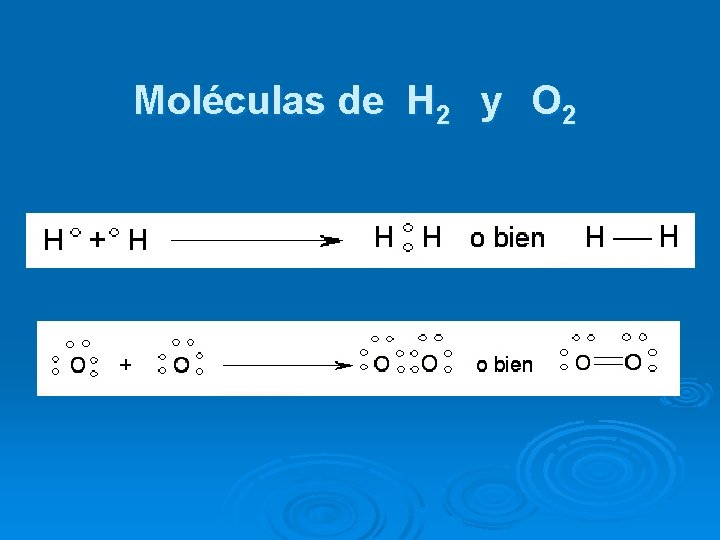
Moléculas de H 2 y O 2

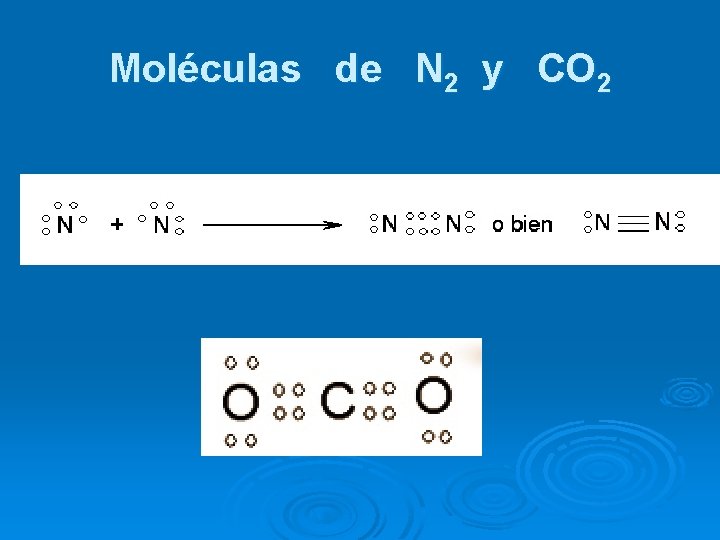
Moléculas de N 2 y CO 2

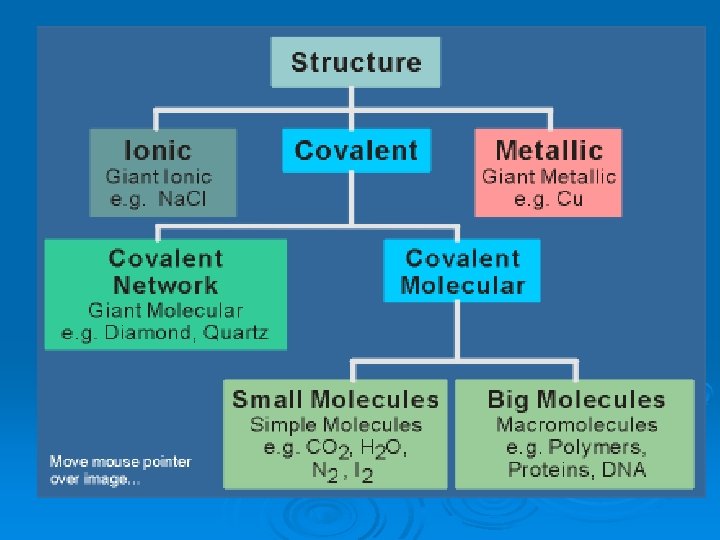
Tipos de enlace ØIónico ØMetálico ØCovalente

Enlace iónico Ø El compuesto iónico se forma al reaccionar un metal con un no metal. Ø Los átomos del metal pierden electrones (se forma un catión) y los acepta el no metal (se forma un anión). Ø Los iones de distinta carga se atraen eléctricamente, se ordenan y forman una red iónica. Los compuestos iónicos no están formados por moléculas.

Enlace iónico entre Cl y Na: formación del ión Cl- y Na+

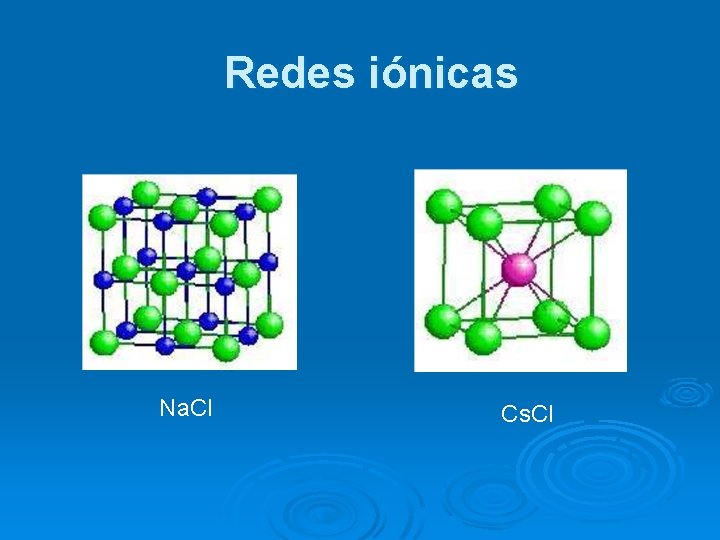
Redes iónicas Na. Cl Cs. Cl

Propiedades compuestos iónicos Ø Elevados puntos de fusión y ebullición Ø Solubles en agua Ø No conducen la electricidad en estado sólido, pero sí en estado disuelto o fundido (Reacción química: electrolisis) Ø Al intentar deformarlos se rompe el cristal (fragilidad)

Enlace metálico Ø Las sustancias metálicas están formadas por átomos de un mismo elemento metálico (baja electronegatividad). Ø Los átomos del elemento metálico pierden algunos electrones, formándose un catión o “resto metálico”. Ø Se forma al mismo tiempo una nube o mar de electrones: conjunto de electrones libres, deslocalizados, que no pertenecen a ningún átomo en particular. Ø Los cationes se repelen entre sí, pero son atraídos por el mar de electrones que hay entre ellos. Se forma así una red metálica: las sustancias metálicas tampoco están formadas por moléculas.

Propiedades sustancias metálicas Ø Elevados puntos de fusión y ebullición Ø Insolubles en agua Ø Conducen la electricidad incluso en estado sólido (sólo se calientan: cambio físico). La conductividad es mayor a bajas temperaturas. Ø Pueden deformarse sin romperse

Enlace covalente Los compuestos covalentes se originan por la compartición de electrones entre átomos no metálicos. Electrones muy localizados.

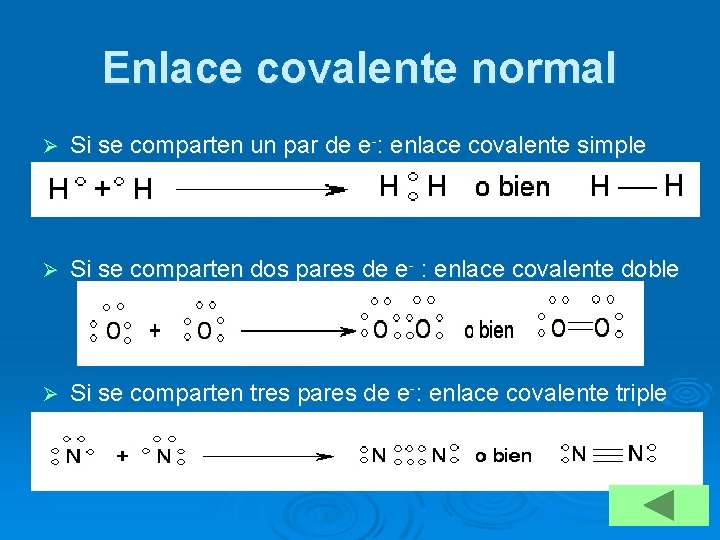
Diferentes tipos de enlace covalente Ø Enlace covalente normal: l l Simple Múltiple: doble o triple Ø Polaridad del enlace: l l Apolar Polar Ø Enlace covalente dativo o coordinado

Enlace covalente normal Ø Si se comparten un par de e-: enlace covalente simple Ø Si se comparten dos pares de e- : enlace covalente doble Ø Si se comparten tres pares de e-: enlace covalente triple

Polaridad del enlace covalente Ø Enlace covalente apolar: entre átomos de idéntica electronegatividad (H 2, Cl 2, N 2…). Los electrones compartidos pertenencen por igual a los dos átomos. Ø Enlace covalente polar: entre átomos de distinta electronegatividad (HCl, CO…). Los electrones compartidos están más desplazados hacia el átomo más electronegativo. Aparecen zonas de mayor densidad de carga positiva (δ+) y zonas de mayor densidad de carga negativa (δ-)

Enlace covalente dativo o coordinado Ø Cuando el par de electrones compartidos pertenece sólo a uno de los átomos se presenta un enlace covalente coordinado o dativo. El átomo que aporta el par de electrones se llama donador (siempre el menos electronegativo) y el que los recibe receptor o aceptor (siempre el más electronegativo)

Enlace de átomos de azufre (S) y oxígeno (O) : S ═ O: ˙˙ ˙˙ Molécula de SO: enlace covalente doble Molécula de SO 2: enlace covalente doble y un enlace covalente coordinado o dativo ˙ ˙ ← S ═ O: : O ˙˙ ˙˙ ˙˙ Molécula de SO 3: enlace covalente doble y dos enlaces covalentes coordinado o dativo ˙ ˙ ← S ═ O: : O ↓ ˙˙ ˙˙ : O: ˙˙

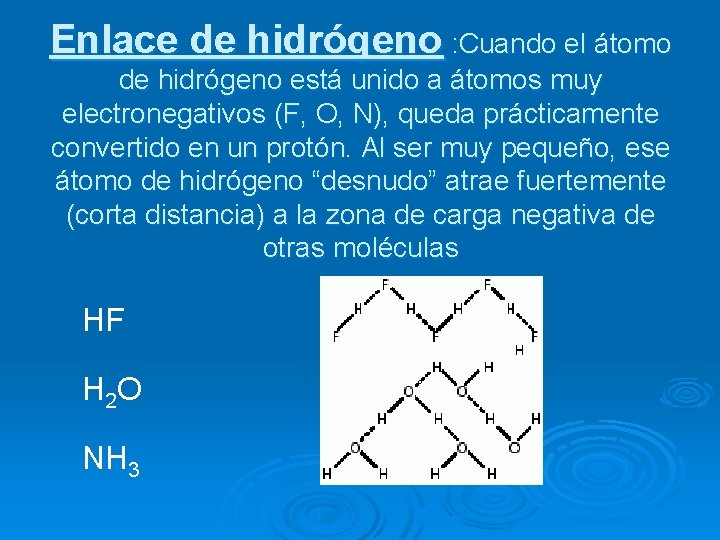
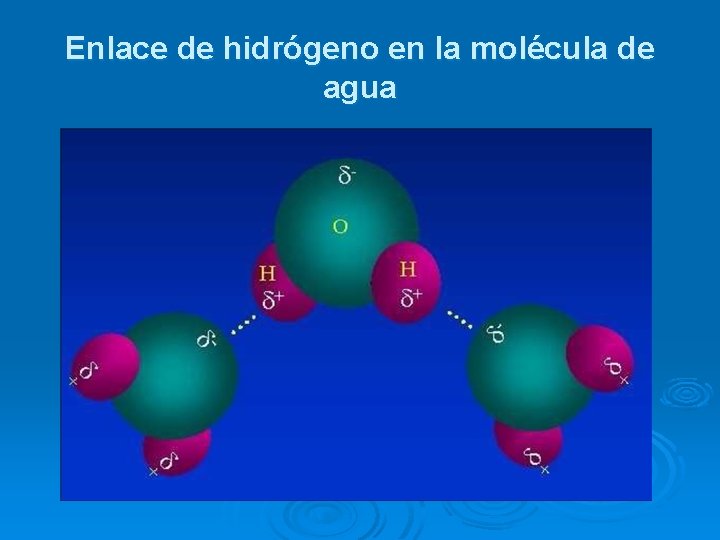
Enlace de hidrógeno : Cuando el átomo de hidrógeno está unido a átomos muy electronegativos (F, O, N), queda prácticamente convertido en un protón. Al ser muy pequeño, ese átomo de hidrógeno “desnudo” atrae fuertemente (corta distancia) a la zona de carga negativa de otras moléculas HF H 2 O NH 3

Enlace de hidrógeno en la molécula de agua

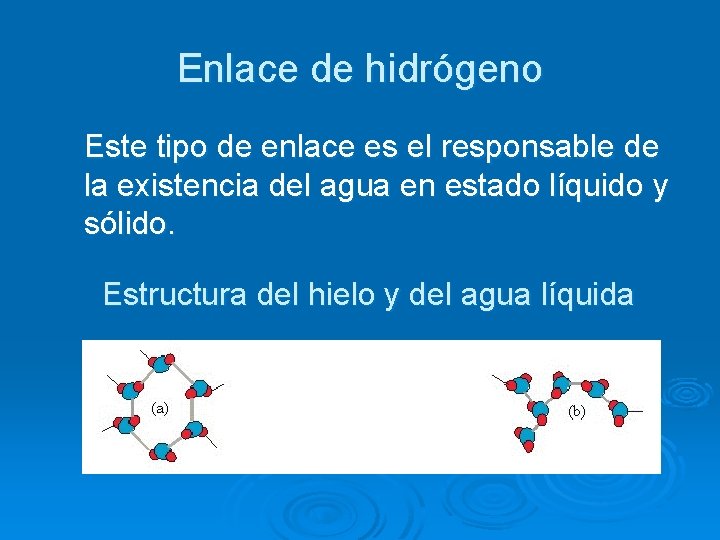
Enlace de hidrógeno Este tipo de enlace es el responsable de la existencia del agua en estado líquido y sólido. Estructura del hielo y del agua líquida

Enlaces de hidrógeno en el ADN Apilamiento de las bases. Esqueleto desoxiribosa fosfato Enlaces de Repul electrostá hidrógeno Bases nitrogenada s A: adenina G: guanina C: citosina T: timina Enlaces de hidrógeno Interior hidrófobo Exteri hidróf
 Enlace qumico
Enlace qumico Enlace qumico
Enlace qumico Polar y no polar
Polar y no polar Estructura enlace ionico
Estructura enlace ionico Enlace qumico
Enlace qumico Cinetoplastideos
Cinetoplastideos Enlaces sigma y pi del carbono
Enlaces sigma y pi del carbono Enlace metálico
Enlace metálico Osmosis globulos rojos
Osmosis globulos rojos Sustancias puras y mezclas ppt
Sustancias puras y mezclas ppt Potencia de una fraccion
Potencia de una fraccion Se contrata un obrero para cavar en busca de fosiles
Se contrata un obrero para cavar en busca de fosiles Propiedades coligativas
Propiedades coligativas Propiedades forma
Propiedades forma La propiedad de la luz
La propiedad de la luz Cuales son las propiedades de los gases
Cuales son las propiedades de los gases Propiedades ondulatorias de las partículas
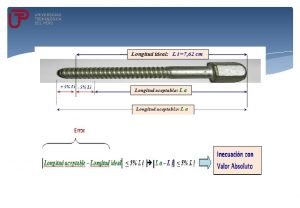
Propiedades ondulatorias de las partículas Inecuaciones con valor absoluto
Inecuaciones con valor absoluto Numeros enteros
Numeros enteros Cuales son las propiedades de los materiales
Cuales son las propiedades de los materiales Propiedades sensoriales de los metales
Propiedades sensoriales de los metales Nivel supramolecular
Nivel supramolecular Propiedades y características de la materia
Propiedades y características de la materia Como resolver inecuaciones con valor absoluto
Como resolver inecuaciones con valor absoluto Simbolos matematicos
Simbolos matematicos Cuales son las propiedades de los compuestos ionicos
Cuales son las propiedades de los compuestos ionicos Adecuacin
Adecuacin Desigualdades propiedades
Desigualdades propiedades Propiedades físicas de cetonas
Propiedades físicas de cetonas