Propiedades Coligativas OBJETIVO DE LA CLASE Valorar la

Propiedades Coligativas

OBJETIVO DE LA CLASE Valorar la importancia de las propiedades coligativas de las disoluciones para la comprensión de fenómenos comunes asociado a dichas propiedades.

Vivimos rodeados de disoluciones que contienen cantidades variables de distintos solutos. • El plasma de la sangre contiene el 90 % de agua y el 10 % de solutos como azúcar, proteínas y vitaminas en cantidades que pueden variar

¿ Qué ocurre cuando aumenta la concentración de gases tóxicos como CO, CO 2 Y SO 2 en el aire? ¿qué tipo de mezcla es el smog?

Para expresar la composición de una disolución , se utiliza el concepto de concentración de una disolución. Concentración : es la cantidad de soluto disuelto en una cantidad unitaria de disolvente o de disolución. Concentración Molar o Molaridad ( C) M = molaridad : cantidad de soluto ( mol) volumen de disolución ( L)

Molaridad (M) Cantidad de moles de soluto que existen en un litro de solución.

Densidad La densidad absoluta o masa específica de una sustancia es la masa de la unidad de volumen de esa sustancia. Se mide en g/cm 3
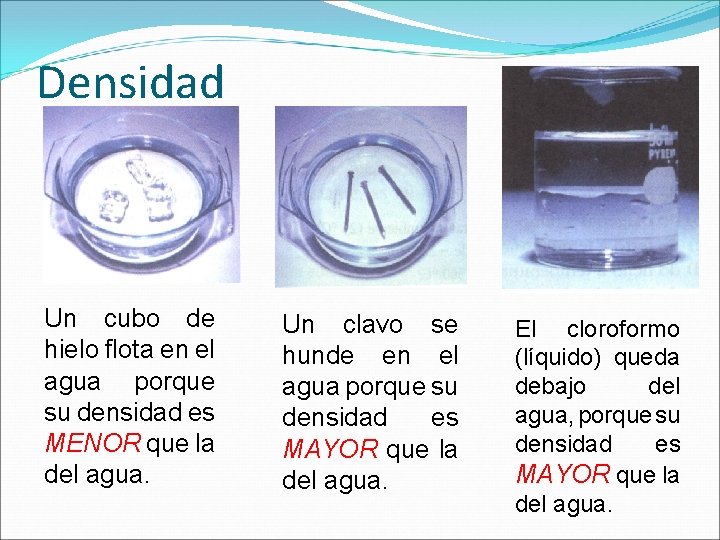
Densidad Un cubo de hielo flota en el agua porque su densidad es MENOR que la del agua. Un clavo se hunde en el agua porque su densidad es MAYOR que la del agua. El cloroformo (líquido) queda debajo del agua, porque su densidad es MAYOR que la del agua.

Expresiones en soluciones Porcentaje masa–masa (% m/m) o (% p/p) Es la masa de soluto que está contenida en 100 g de solución.

Expresiones en soluciones Porcentaje masa/ masa (% m/m) 12 g café + 188 g agua = Solución 6% m/m

Expresiones en soluciones Porcentaje masa/volumen (% m/v) o % p/v Es la masa de soluto que se encuentra en 100 ml de solución.

Expresiones en soluciones Porcentaje Volumen-Volumen (% v/v) 20 ml Ac. acético + 80 ml agua = Solución 20% V/V

Ejercicios

Una solución acuosa de (CH 3 COOH) 0, 4 % m/v tiene: E vinagre A) 0, 4 gramos de vinagre en 1000 solución. B) 0, 4 gramos de vinagre en 1000 solvente. C) 0, 4 moles de vinagre en 100 solución. D) 0, 4 moles de vinagre en 100 solvente. E) 0, 4 gramos de vinagre en 100 solución. ml de ml de

Calcule % p/v si se dispone de 250 ml de una solución que contiene 15 g de HCN A) 6, 0 % p/v B) 0, 6 % p/v C) 60 % p/v D) 66 % p/v E) 0, 06 % p/v A

Molalidad (m) Es la cantidad de moles de soluto que están disueltos en 1000 g (1 kg) de solvente.

Fracción Molar (Xn) La fracción molar o fracción en moles de soluto en una solución, es el cuociente entre la cantidad de moles del soluto y la cantidad total de moles en la solución (soluto + solvente). Moles soluto + moles solvente = moles solución X 1: fracción molar soluto n 1: cantidad de moles del soluto X 2: fracción molar solvente n 2: cantidad de moles del solvente

Ejemplo: Se tienen 2 moles de Na. Cl y 6 moles de H 2 O. ¿Cuál es la fracción molar del soluto? Ø Moles soluto: 2 Ø Moles solvente: 6 Ø Moles solución: 8 Fracción molar soluto:

Preparación de disoluciones acuosas

Dilución de disoluciones Principio en que se basa: “todo el soluto contenido en la disolución inicial más concentrada se encuentra en la disolución diluida final” Representación de la dilución de una disolución

Dilución de disoluciones Siempre se cumple que Disolución concentrada (i) Disolución diluída (f)

10, 0 m. L de disolución concentrada K 2 Cr 2 O 4 0, 250 M 250 m. L de disolución diluida K 2 Cr 2 O 4 0, 0100 M Preparación de una disolución de K 2 Cr 2 O 4 0, 0100 M por dilución de una disolución de K 2 Cr 2 O 4 0, 250 M ni = nf Ci x Vi = Cf x Vf 0, 250 M x 10, 0 x 10 -3 L = 0, 0100 M x 0, 250 L 2, 5 x 10 -3 moles = 2, 5 x 10 -3 moles

Ejercicios

Ejercicio: Una muestra de 25, 0 m. L de HCl(ac) se diluye hasta 500, 0 m. L. Si la concentración de la disolución diluida resulta ser de 0, 085 M, ¿cuál era la concentración de la disolución original? Se disponía de una disolución concentrada 1, 70 M, de esta se tomó un volumen de 25, 0 m. L y se colocó en otro matraz y se le agregó agua (disolvente) hasta que se completó un volumen de 500, 0 m. L, de esta forma se obtuvo una nueva disolución que tiene una concentración 0, 085 M, es decir, hay 0, 085 moles de HCl por cada Litro de disolución, por tanto en 500 m. L hay la mitad de los moles (0, 0425 n)
SOLUBILIDAD Y SUS FACTORES

�Es la cantidad de soluto que a una determinada temperatura se disuelve en una cantidad de solvente dada. �Corresponde a la concentración de una solución saturada

Clasificación de las soluciones según grado de saturación �Solución saturada: son aquellas que presentan una cantidad de soluto disuelta igual a la solubilidad �Solución insaturada: son aquellas que presentan una cantidad de soluto menor que su solubilidad �Solución sobresaturada: son aquellos que presentan una cantidad de soluto disuelta mayor que la solubilidad. Estas soluciones son inestables y solo pueden existir en condiciones especiales.

Solubilidad de líquidos �Líquidos miscibles: son aquellos que se disuelven en cualquier proporción ( solubilidad infinita) es decir no hay limite de saturación. Ejemplo: alcohol y agua.

�Líquidos inmiscibles: son aquellos que no se disuelven unos en otros ( solubilidad prácticamente nula). Ejemplo: aceite y agua.

�Líquidos parcialmente miscibles: son aquellos en que cada uno se disuelve en otro hasta cierto grado, produciendo dos soluciones saturadas. Ejemplo: éter etílico y agua.
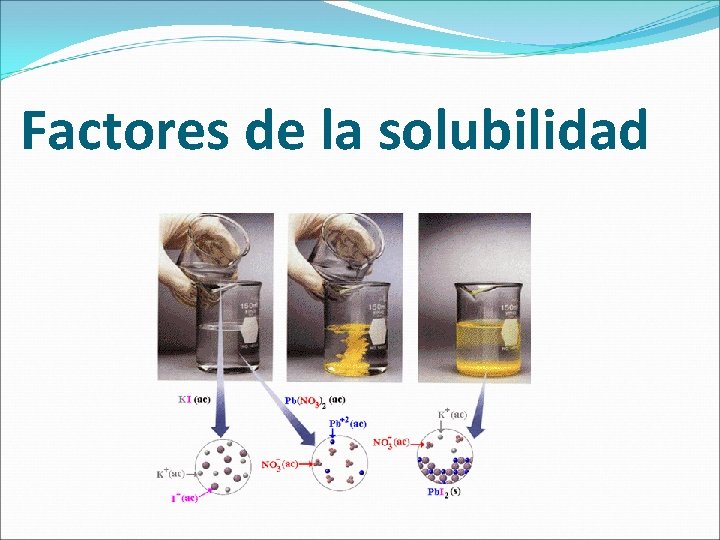
Factores de la solubilidad
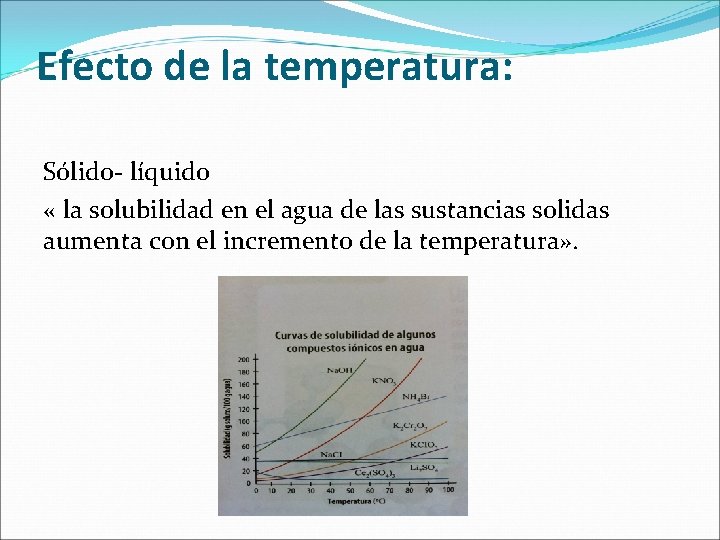
Efecto de la temperatura: Sólido- líquido « la solubilidad en el agua de las sustancias solidas aumenta con el incremento de la temperatura» .
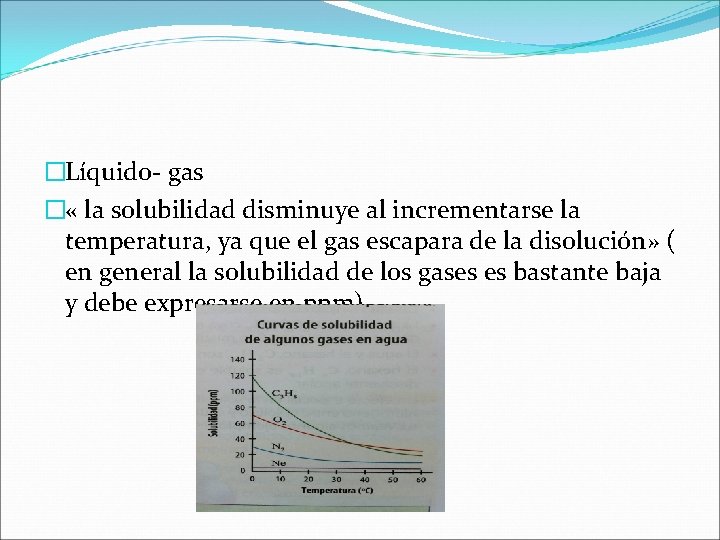
�Líquido- gas � « la solubilidad disminuye al incrementarse la temperatura, ya que el gas escapara de la disolución» ( en general la solubilidad de los gases es bastante baja y debe expresarse en ppm).

Efecto de la presión �Solo afecta a sustancias gaseosas. La solubilidad de un gas sobre cualquier disolvente, aumenta al incrementar la presión del gas, sobre el disolvente, siempre que se mantenga constante la temperatura Al destapar la botella el gas escapa de la solución formando burbujas ( espuma). Al bajar la presión del gas, la solubilidad disminuye.

COLIGATIVAS Y CONSTITUTIVAS “ Cuando se mezcla un soluto y un solvente forman una solución, esta mezcla posee propiedades particulares y diferentes a las del soluto y solvente por separado”
Propiedades de las disoluciones Naturaleza química del soluto Propiedades constitutivas • Densidad • Viscosidad • Conductividad Eléctrica
LAS PROPIEDADES DE LAS DISOLUCIONES PROPIEDADES CONSTITUTIVAS PROPIEDADES COLIGATIVAS

Propiedades Coligativas �Son aquellas propiedades que dependen directamente del numero de partículas de soluto en la solución y no de la naturaleza de las partículas de soluto.
Descenso en la presión de vapor. Aumento del punto de ebullición. Clasificación Disminución del punto de congelación. Presión Osmótica.

Presión de vapor. �Es una medida del número de moléculas que escapan de la superficie de un liquido por unidad de área. Según esto hay líquidos volátiles, como la acetona y el alcohol, que tienen presión de vapor alta, es decir, pasan con facilidad de liquido a gas, y líquidos no volátiles con una presión de vapor baja.

Ø Disminución de la presión de vapor Presión de vapor: Presión que se genera por el vapor de un liquido, cuando el vapor y el liquido están en equilibrio dinámico. “ si tengo un liquido en un recipiente cerrado, la fracción gaseosa ejercerá presión sobre la tapa del recipiente, golpeándola y así provocando la condensación. ”
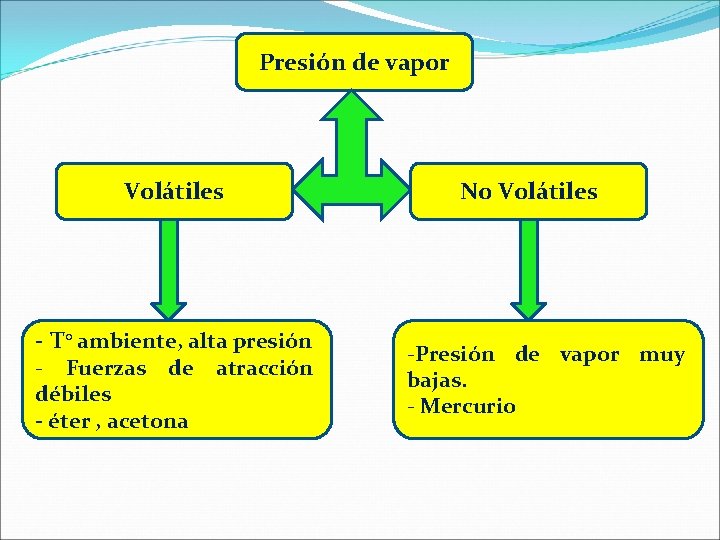
Presión de vapor Volátiles - T° ambiente, alta presión - Fuerzas de atracción débiles - éter , acetona No Volátiles -Presión de vapor muy bajas. - Mercurio
I- Descenso en la Presión de Vapor �Una propiedad característica de los líquidos es su tendencia a evaporarse. �Este proceso fue estudiado por Químico Frances Raoult.

Ley de Raoult “ La adición de un soluto no volátil a un disolvente volátil provocara la disminución de su presión de vapor” Pa = Xa * P°a Ley: al aumentar la fracción molar del soluto no volátil , la presión de vapor disminuirá.

Ley de Raoult : la presión de vapor de una solución diluida, de soluto no volátil y no iónico, es igual al producto de la presión de vapor del solvente puro y la fracción molar del solvente en la solución. Pv =Pºv · Xd Para mezclas de líquidos miscibles P = P A + PB Pv= presión de vapor de la solución. Pºv = presión de vapor del solvente puro. Xd= fracción molar del solvente en la solución. P = presión de vapor de la solución. PA = presión parcial del componente A PB= presión parcial del componente B.

Punto de ebullición (Te) �Es la temperatura a la cual la presión de vapor se iguala a la presión atmosférica.

ØAumento del punto de ebullición �Punto de ebullición: punto donde las moléculas pasan al estado gaseoso, debido a que la presión del liquido se iguala a la presión del medio. ΔTb = Tb – T°b �ΔTb= punto de ebullición ( valor positivo) �Tb= punto de ebullición de la disolución �T°b= Punto ebullición disolvente puro.

¿ Como calculo ΔTb? ΔTb = Kb * m Kb = Constante ebulloscópica o constante molal de elevación del punto de ebullición. Su unidad es °C /m m = Molalidad

Punto de congelación ( Tc) �Es la temperatura a la cual la presión de vapor del líquido y del sólido son iguales. A dicha temperatura el liquido se convierte en sólido.

III- Descenso del punto de congelación �El punto de congelación de una solución es siempre mas bajo que el del solvente puro. Como las moléculas del solvente en una solución están algo mas separadas entre si ( por partículas de soluto) de los que están en el solvente puro, la temperatura de la solución debe disminuir por debajo del punto de congelación del solvente puro para congelarla. TC = T°C-TC TC = KC · M TC = VARIACIÓN DE LA TEMPERATURA DE CO KC= CONSTANTE CRIOSCÓPICA. M= MOLALIDAD TºC= TEMPERATURA DE CONGELACIÓN DEL S TC= TEMPERATURA DE LA DISOLUCIÓN. KC H 2 O= 1. 86 °C/molal

ØDisminución del punto de congelación �Punto de congelación : temperatura a la cual la presión de vapor del liquido coincide con la presión de vapor del solido. ΔTf = T°f – Tf �ΔTf= disminucion del punto de congelación �T°f=punto de congelación disolvente puro �Tf= Punto de congelación de la disolución

¿ Como calculo ΔTf? ΔTf = Kf * m Kf = Constante crioscopica o constante molal de disminución del punto de congelación. su unidad es °C /m m = Molalidad

Aplicando lo aprendido Un químico preparo 1000 g de una disolución anticongelante para automóviles a partir del etilenglicol y agua ¿Cuál será el punto de ebullición y el punto de congelación de la disolución si se tienen 250 g etilenglicol? Datos: m. m etilenglicol: 62 g/mol Kb= 0, 52 °C/m Kf= 1, 86 °C/m

Osmosis Movimiento de un disolvente a través de una membrana de permeabilidad selectiva. “si ponemos en contacto dos soluciones de diferentes concentraciones, a través de una membrana semipermeable se produce el paso desde la solución diluida a la mas concentrada”

Presión Osmótica Es la presión que ejerce la solución mas concentrada sobre la membrana semipermeable, deteniendo la difusión de disolvente. π=M*R*T ü Independiente de la naturaleza del soluto. ü Directamente proporcional a la concentración de la disolución.

Se pueden clasificar… ü Isotónicas: tienen igual concentración, por ende la misma presión osmótica. Si presentan diferente presión osmótica: ü Hipertónicas: con mayor concentración ü Hipotónica: la mas diluida.
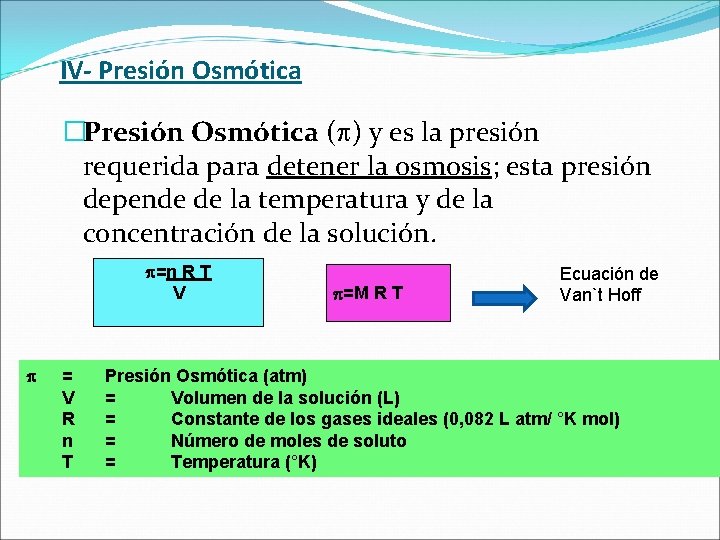
IV- Presión Osmótica �Presión Osmótica ( ) y es la presión requerida para detener la osmosis; esta presión depende de la temperatura y de la concentración de la solución. =n R T V = V R n T =M R T Ecuación de Van`t Hoff Presión Osmótica (atm) = Volumen de la solución (L) = Constante de los gases ideales (0, 082 L atm/ °K mol) = Número de moles de soluto = Temperatura (°K)
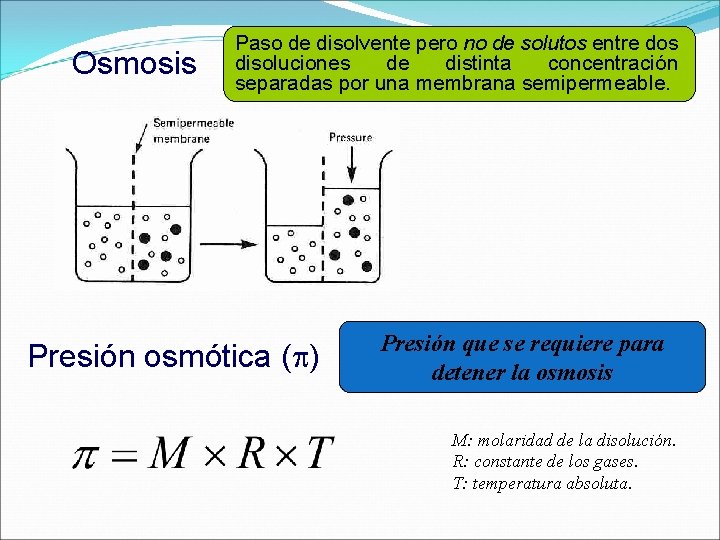
Osmosis Paso de disolvente pero no de solutos entre dos disoluciones de distinta concentración separadas por una membrana semipermeable. Presión osmótica ( ) Presión que se requiere para detener la osmosis M: molaridad de la disolución. R: constante de los gases. T: temperatura absoluta.
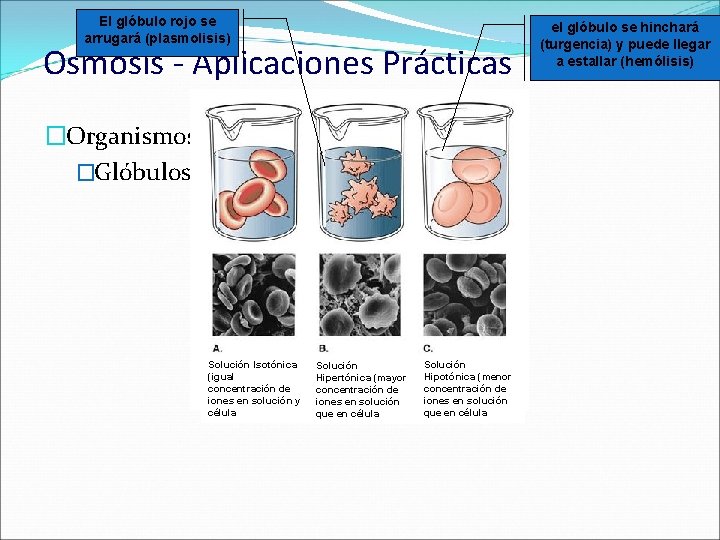
El glóbulo rojo se arrugará (plasmolisis) Osmosis - Aplicaciones Prácticas �Organismos Vivos �Glóbulos rojos de la sangre (Hematíes) Solución Isotónica (igual concentración de iones en solución y célula Solución Hipertónica (mayor concentración de iones en solución que en célula Solución Hipotónica (menor concentración de iones en solución que en célula el glóbulo se hinchará (turgencia) y puede llegar a estallar (hemólisis)

Trabajo en clases Realice un mapa conceptual utilizando los siguientes conceptos: Osmosisdisolventemembrana- solución diluida- solución concentradapresión osmótica- isotonica-hipertonica- hipotonica 2. Calcule la presión osmótica a 25ºC de 2 L de disolución acuosa que contiene 12 g de urea. (mm= 60 g/mol ; R= 0, 082 at L/ k mol) 1.
- Slides: 60