ENLACE COVALENTE ENLACE COVALENTE Se realiza entre NO


- Slides: 15

ENLACE COVALENTE

ENLACE COVALENTE �Se realiza entre NO METALES. �Se realiza para compartir dos o más electrones. �Se clasifican según: la polaridad (polares y apolares), el número de electrones aportados al enlace ( normales y dativos) y el número de pares de electrones compartidos (simple y covalente múltiple).

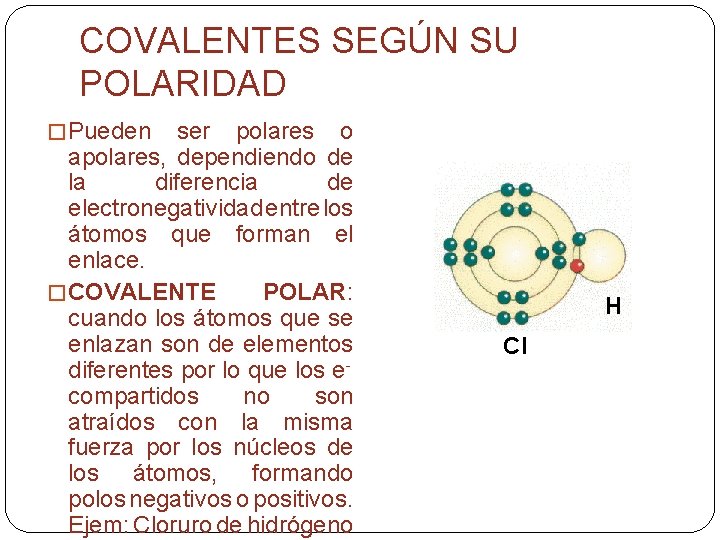
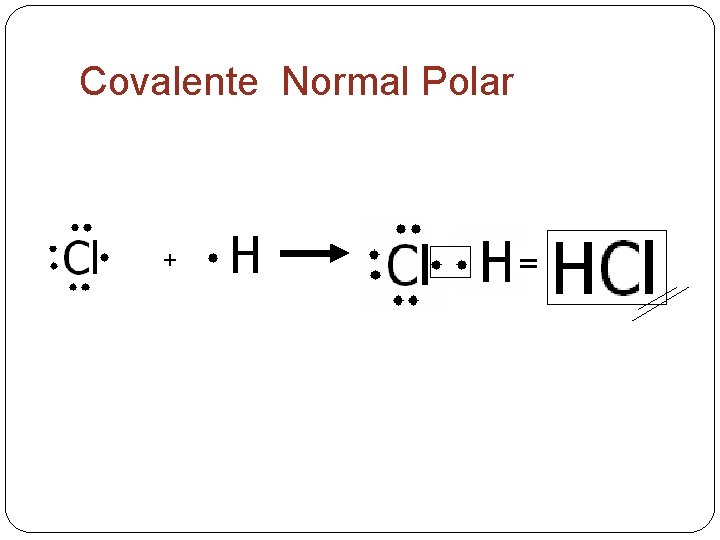
COVALENTES SEGÚN SU POLARIDAD � Pueden ser polares o apolares, dependiendo de la diferencia de electronegatividad entre los átomos que forman el enlace. � COVALENTE POLAR: cuando los átomos que se enlazan son de elementos diferentes por lo que los ecompartidos no son atraídos con la misma fuerza por los núcleos de los átomos, formando polos negativos o positivos. Ejem: Cloruro de hidrógeno H Cl

Covalente Normal Polar +

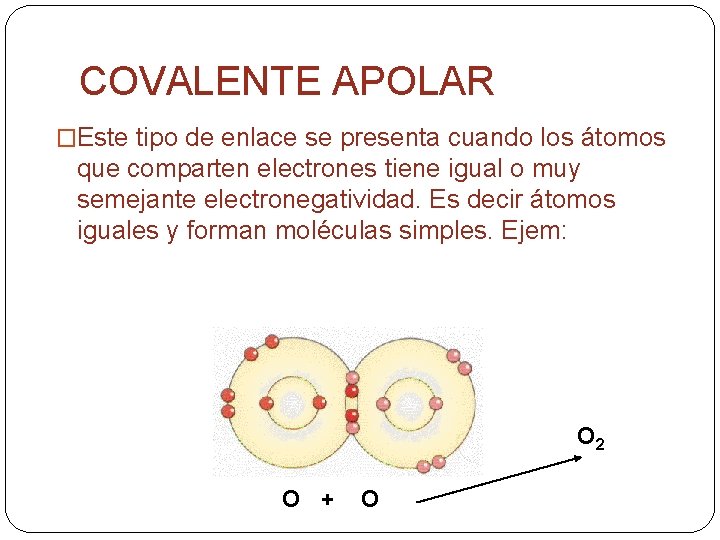
COVALENTE APOLAR �Este tipo de enlace se presenta cuando los átomos que comparten electrones tiene igual o muy semejante electronegatividad. Es decir átomos iguales y forman moléculas simples. Ejem: O 2 O + O

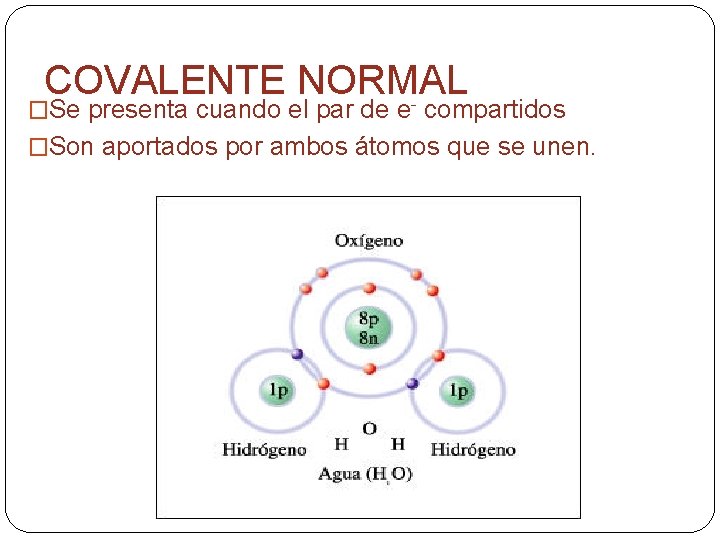
COVALENTE NORMAL - �Se presenta cuando el par de e compartidos �Son aportados por ambos átomos que se unen.

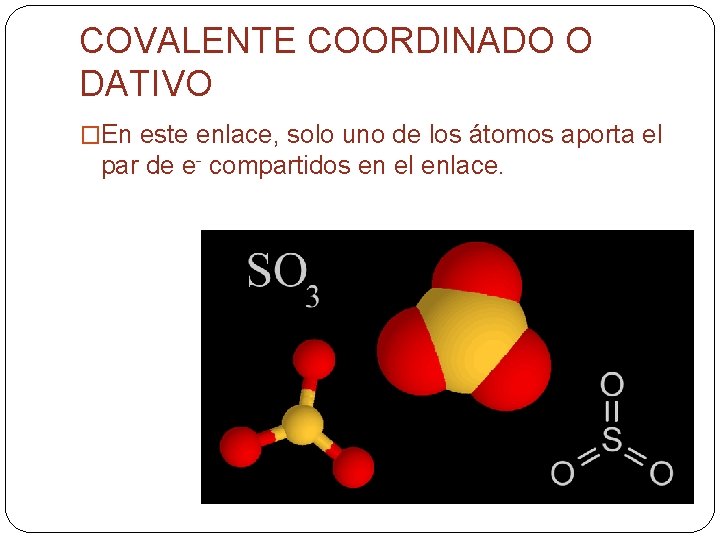
COVALENTE COORDINADO O DATIVO �En este enlace, solo uno de los átomos aporta el par de e- compartidos en el enlace.

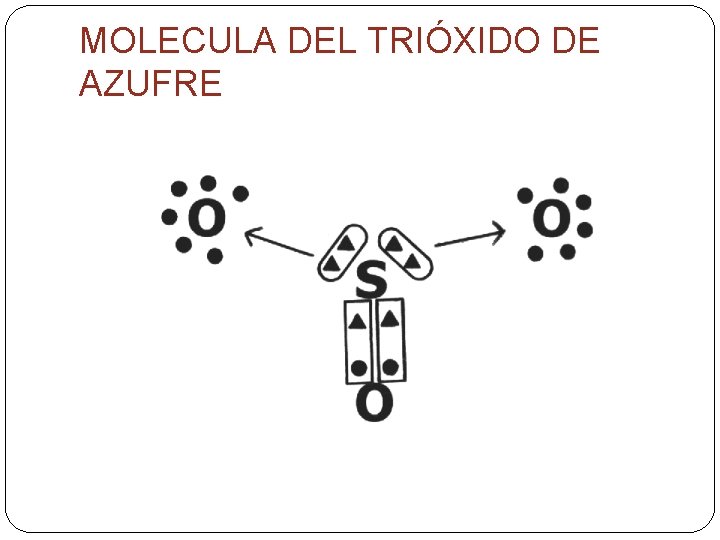
MOLECULA DEL TRIÓXIDO DE AZUFRE

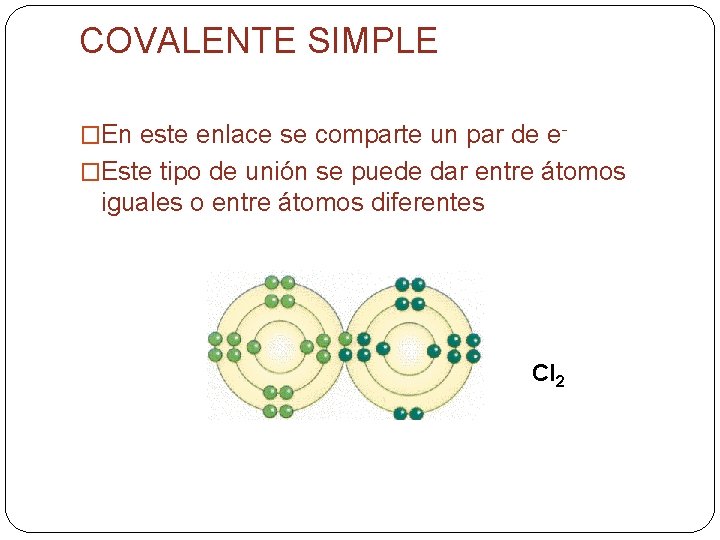
COVALENTE SIMPLE �En este enlace se comparte un par de e�Este tipo de unión se puede dar entre átomos iguales o entre átomos diferentes Cl 2

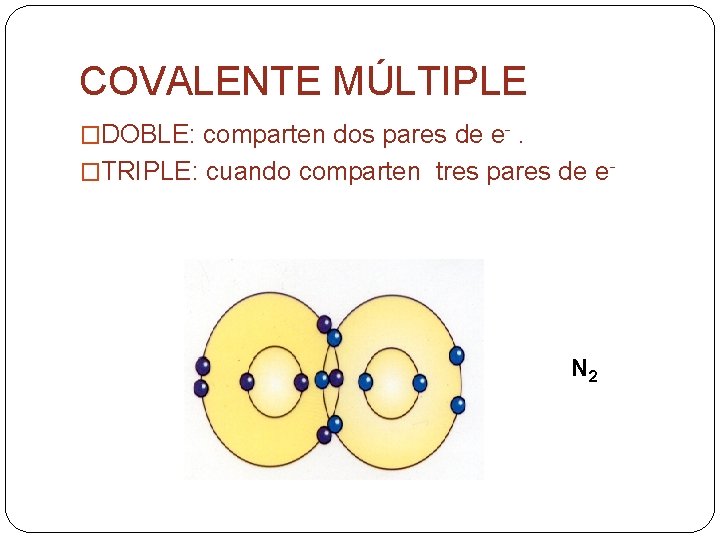
COVALENTE MÚLTIPLE �DOBLE: comparten dos pares de e-. �TRIPLE: cuando comparten tres pares de e- N 2

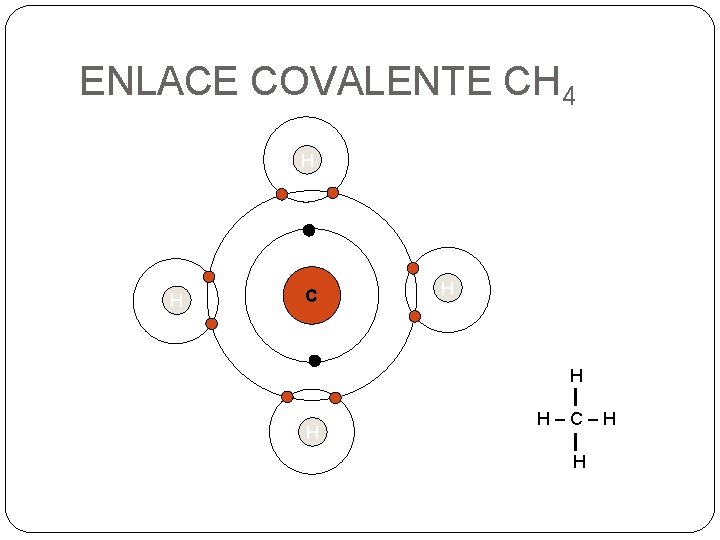
ENLACE COVALENTE CH 4 H H C H H–C–H H

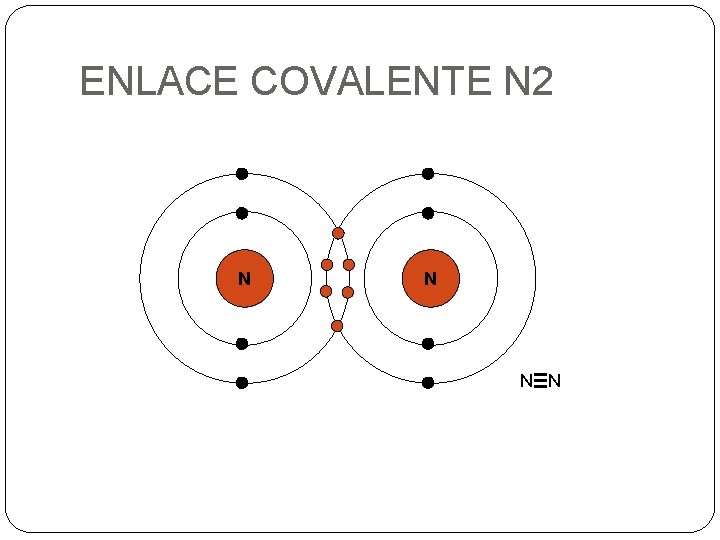
ENLACE COVALENTE N 2 N N

ENLACE COVALENTE

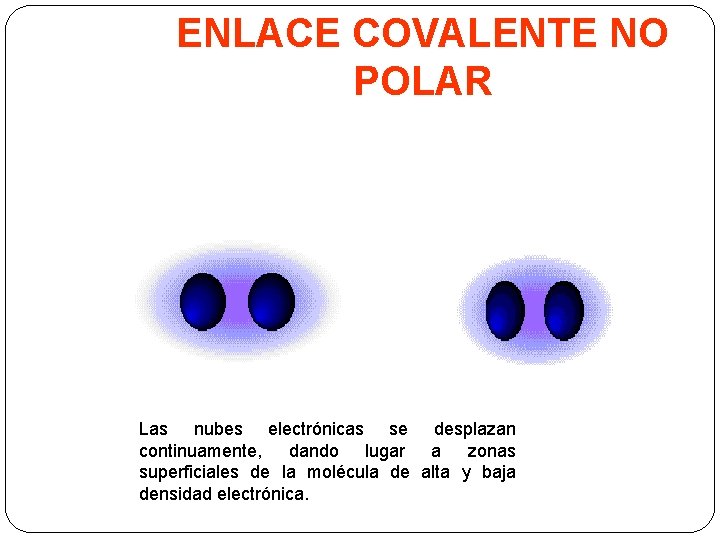
ENLACE COVALENTE NO POLAR Las nubes electrónicas se desplazan continuamente, dando lugar a zonas superficiales de la molécula de alta y baja densidad electrónica.

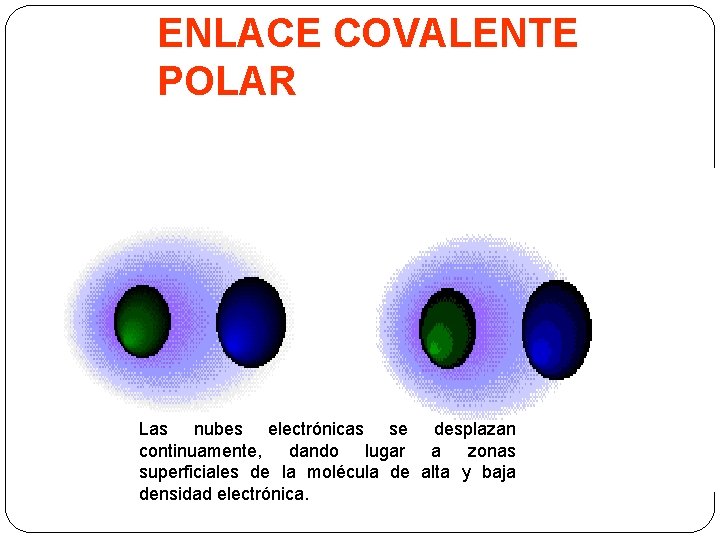
ENLACE COVALENTE POLAR Las nubes electrónicas se desplazan continuamente, dando lugar a zonas superficiales de la molécula de alta y baja densidad electrónica.
 Union covalente e ionica
Union covalente e ionica 10 ejemplos fuerzas de van der waals ejemplos
10 ejemplos fuerzas de van der waals ejemplos Como se clasifican los enlaces covalentes
Como se clasifican los enlaces covalentes Particulas unitarias del enlace ionico
Particulas unitarias del enlace ionico Diferencia de electronegatividad
Diferencia de electronegatividad Sigma orbital
Sigma orbital Covalente apolar
Covalente apolar Polaridad
Polaridad Enlace covalente normal
Enlace covalente normal Enlace ionico
Enlace ionico Hibridacion quimica organica
Hibridacion quimica organica Qumica
Qumica Hio4 lewis
Hio4 lewis Enlace covalente
Enlace covalente Como calcular diferencia de electronegatividad
Como calcular diferencia de electronegatividad Enlace covalente polar ejemplos
Enlace covalente polar ejemplos