ENLACE QUMICO CARMEN LPEZ 1 n Los ENLACES
















































- Slides: 80

ENLACE QUÍMICO CARMEN LÓPEZ 1

n Los ENLACES QUÍMICOS son aquellas interacciones que mantienen a los átomos o a las moléculas unidos entre sí para dar lugar a estructuras más estables que los átomos o las moléculas de partida. 2

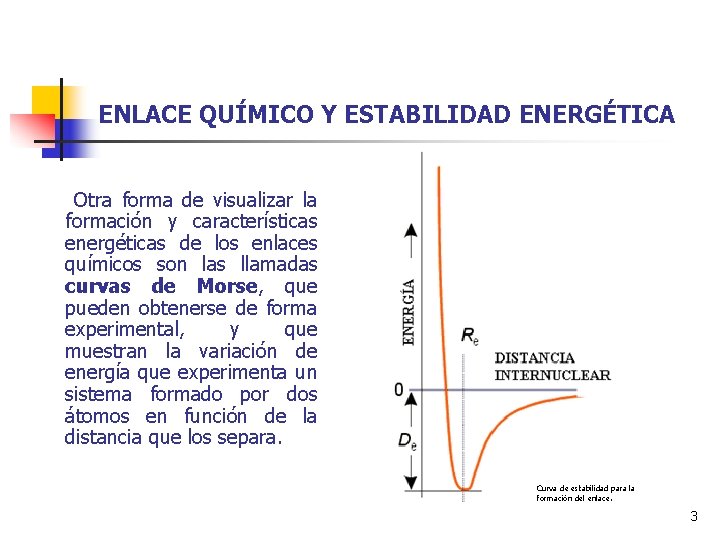
ENLACE QUÍMICO Y ESTABILIDAD ENERGÉTICA Otra forma de visualizar la formación y características energéticas de los enlaces químicos son las llamadas curvas de Morse, que pueden obtenerse de forma experimental, y que muestran la variación de energía que experimenta un sistema formado por dos átomos en función de la distancia que los separa. Curva de estabilidad para la formación del enlace. 3

ENLACES INTERATÓMICOS O INTRAMOLECULARES Enlace Iónico. n Enlace Covalente. n Enlace Metálico. n 4

ENLACES INTERMOLECULARES Fuerzas de Van der Waals. n Puentes de hidrógeno. n 5

ENLACE IÓNICO n n n Este enlace se denomina también ENLACE HETEROPOLAR O ELECTROVALENTE. Este tipo de enlace se presenta entre elementos de electronegatividades opuestas, o lo que es lo mismo con potenciales de ionización muy distintos. El enlace iónico consiste en la unión por fuerzas electrostáticas de dos iones de signos contrarios. 6

ENLACE IÓNICO n n n Na(g) + Potencial de Ionización ----> Na+(g) + 1 e. Cl(g) + 1 e- ------> Cl-(g) + Afinidad electrónica Na+ + Cl- -----> Na+Cl- (red) El enlace iónico es el que se forma entre iones de distinto signo, debido a estas fuerzas electrostáticas 7

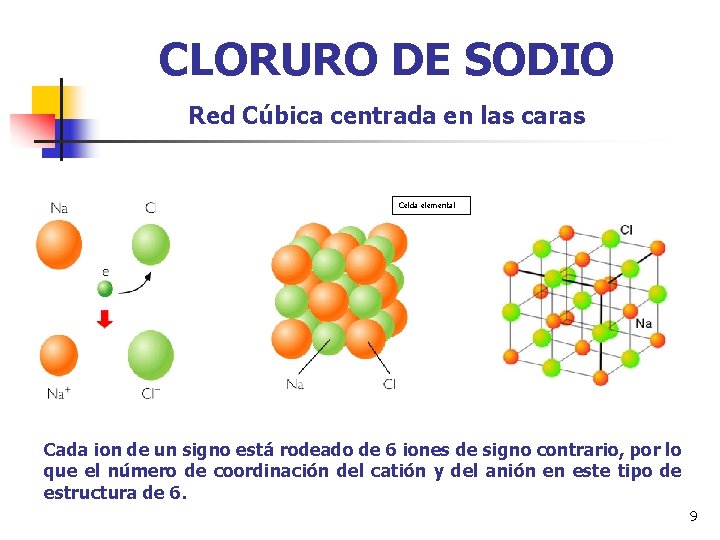
REDES CRISTALINAS Existen varios tipos de redes y cada compuesto cristaliza en una de ellas dependiendo: 1) Del tamaño de los iones del compuesto, de manera que a un cierto ion sólo se aproximarán, hasta la distancia de equilibrio, aquellos iones de signo contrario que tengan suficiente espacio para ello. 2) La necesidad de conservar la neutralidad eléctrica del cristal. Así, en el cloruro de sodio, cada ion de sodio se rodea de seis iones de cloro como máximo, debido a su pequeño tamaño. Para conservar la neutralidad eléctrica cada ion cloro se rodeará, como mucho de seis iones de sodio (aunque podría rodearse de más). La red cristalina que presenta este compuesto se denomina Cúbica centrada en las caras (c. c. c. ). 8

CLORURO DE SODIO Red Cúbica centrada en las caras Celda elemental Cada ion de un signo está rodeado de 6 iones de signo contrario, por lo que el número de coordinación del catión y del anión en este tipo de estructura de 6. 9

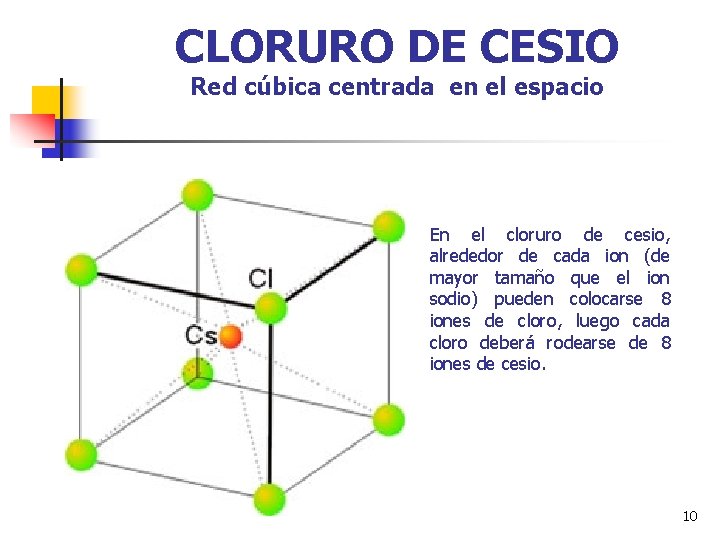
CLORURO DE CESIO Red cúbica centrada en el espacio En el cloruro de cesio, alrededor de cada ion (de mayor tamaño que el ion sodio) pueden colocarse 8 iones de cloro, luego cada cloro deberá rodearse de 8 iones de cesio. 10

Se llama Índice de coordinación al número de iones de un signo que rodean a un ion de signo contrario. En el caso del cloruro sódico el índice de coordinación vale 6 para el catión y 6 para el anión (I. C. 6: 6). En el cloruro de cesio IC 8: 8. 11

ENERGÍA RETICULAR Se llama Energía reticular (U) a la energía que se desprende cuando el número necesario de iones (negativos y positivos), en estado gaseoso, se unen para formar un mol de sustancia iónica en una red cristalina (estado sólido). X-(g) + M+(g) -----> X-M+(s) + U La energía reticular tiene la siguiente expresión: 12

CICLO DE BORN-HABER Está basado en la hipótesis de que la formación de un compuesto iónico puede tener lugar por caminos diferentes. a) Por combinación directa de los elementos: Q M(s) + ½ X 2(g) ----> M+X-(s) Q Na(s) + ½ Cl 2(g) -----> Na+Cl-(s) En este proceso se desprende el calor de formación del compuesto, Q. 13

CICLO DE BORN-HABER b) Por un proceso en etapas que serían: - Sublimación: Na(s) -----> Na(g) se necesita calor, calor de sublimación Sublimación ESublimación. - Disociación: ½ Cl Disociación 2(g) ----> Cl(g) se absorbe la mitad del calor de disociación EDisociación o sea ½ EDisociación. + + 1 e- se necesita el potencial de ionización - Ionización: Na(g) ------> Na Ionización EIonización. -(g) se desprende energía, la afinidad - Ionización: Cl(g) + 1 e----> Cl Ionización electrónica A. e o EElectroafinidad. - Ordenación de los iones para formar el cristal iónico, se desprenderá Ordenación de los iones para formar el cristal iónico energía que será la energía reticular U. 14

CICLO DE BORN-HABER Representando el proceso esquemáticamente tendríamos: QReacción Na(s) + ½ Cl 2(g) Na+Cl -(s) ½ EDisociación Esublimación U Na(g) EElectroafinidad Cl(g) Cl-(g) + Na+(g) EIonización Por los dos caminos la variación total de energía ha de ser la misma: Q = Esublimación+ ½ EDisociación + EIonización + EElectroafinidad + U 15

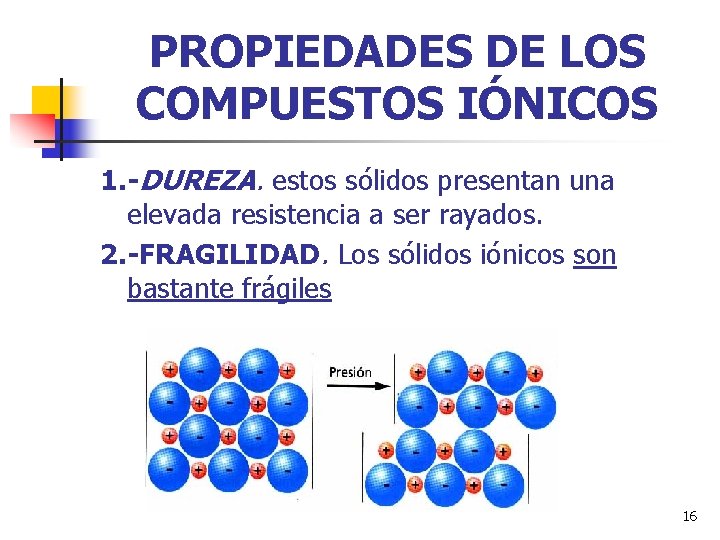
PROPIEDADES DE LOS COMPUESTOS IÓNICOS 1. -DUREZA. estos sólidos presentan una elevada resistencia a ser rayados. 2. -FRAGILIDAD. Los sólidos iónicos son bastante frágiles 16

PROPIEDADES DE LOS COMPUESTOS IÓNICOS 3. -SOLUBILIDAD. Estos compuestos son solubles en disolventes polares como el agua por ejemplo. 17

PROPIEDADES DE LOS COMPUESTOS IÓNICOS 4. -CONDUCTIVIDAD. En estado sólido no son conductores de la electricidad, ya que los iones están fijos dentro de la red, por lo que las cargas de los iones están inmóviles. Sin embargo, cuando están en disolución, o fundidos, los iones quedan libres convirtiéndose en conductores. 5. -PUNTOS DE FUSIÓN Y DE EBULLICIÓN ELEVADOS. Como las fuerzas electrostáticas que mantienen unidos entre sí a los iones son relativamente altas, los compuestos iónicos son siempre sólidos a temperatura ambiente. Únicamente a temperaturas elevadas adquieren los iones energía suficiente para vencer estas fuerzas y conseguir que el cristal se funda. 18

ENLACE COVALENTE n n Este enlace se forma por compartición de electrones entre los distintos átomos que forman la molécula. Este enlace lo forman los elementos más electronegativos del sistema periódico, es decir los no metálicos (derecha del S. P. ). 19

ENLACE IÓNICO-ENLACE COVALENTE ENLACE IÓNICO ENLACE COVALENTE 20

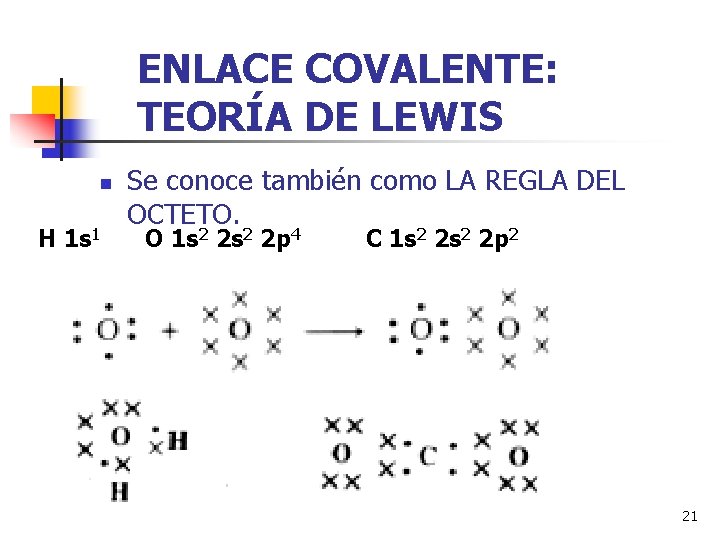
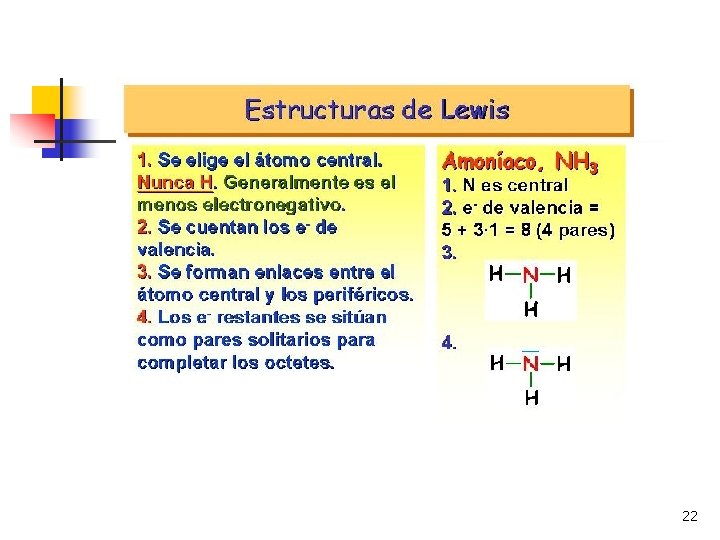
ENLACE COVALENTE: TEORÍA DE LEWIS n Se conoce también como LA REGLA DEL OCTETO. H 1 s 1 O 1 s 2 2 p 4 C 1 s 2 2 p 2 21

22

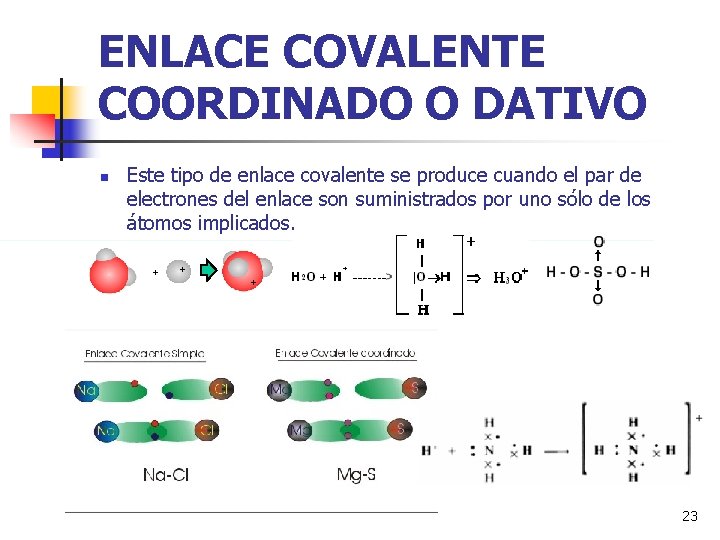
ENLACE COVALENTE COORDINADO O DATIVO n Este tipo de enlace covalente se produce cuando el par de electrones del enlace son suministrados por uno sólo de los átomos implicados. + + + 23

Inconvenientes de la teoría de Lewis 1. Los diagramas Lewis y la estructura de OCTETO no son suficientes para explicar las propiedades de la molécula que se trate de representar. Por ejemplo según Lewis el SO 2 tendría la siguiente estructura: O S=O lo que indica que la molécula tendría dos enlaces diferentes entre el azufre y el oxígeno, pero experimentalmente se demuestra que son equivalentes y que su distancia internuclear es la intermedia entre un enlace sencillo y uno doble. 24

Inconvenientes de la teoría de Lewis El SO 2 en realidad es un híbrido en resonancia de dos estructuras posibles: "Cuando para una molécula se puede escribir varias configuraciones de Lewis correctas (sin cambiar de posición los átomos , la verdadera configuración es una mezcla de todas ellas que se denomina híbrido de resonancia y dónde la importancia de cada estructura contribuyente es proporcional a sus estabilidad. " 25

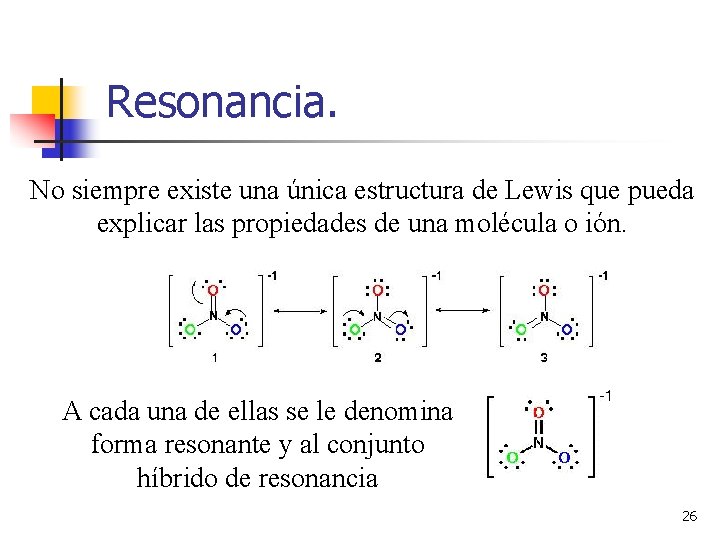
Resonancia. No siempre existe una única estructura de Lewis que pueda explicar las propiedades de una molécula o ión. A cada una de ellas se le denomina forma resonante y al conjunto híbrido de resonancia 26

Resonancia. En el caso del ion CO 32–, se podrían formar tres estructuras de Lewis en las que el doble enlace se forma con cada uno de los átomos de oxigeno, siendo las tres válidas. Cada una de estas formas contribuye por igual al la estructura del ion CO 32–, siendo la verdadera estructura una mezcla de las tres. 27

Inconvenientes de la teoría de Lewis Ejemplo: el dióxido de carbono. 2. Las estructura Lewis tampoco indican la geometría de las moléculas poliatómicas (si es diatómica la geometría se reduce a la distancia intermolecular, longitud de enlace) y es de gran interés conocer los ángulos que forman los enlaces entre sí. No da una explicación lógica de la geometría de las moléculas. Por ejemplo, que el agua sea angular y no lineal. 28

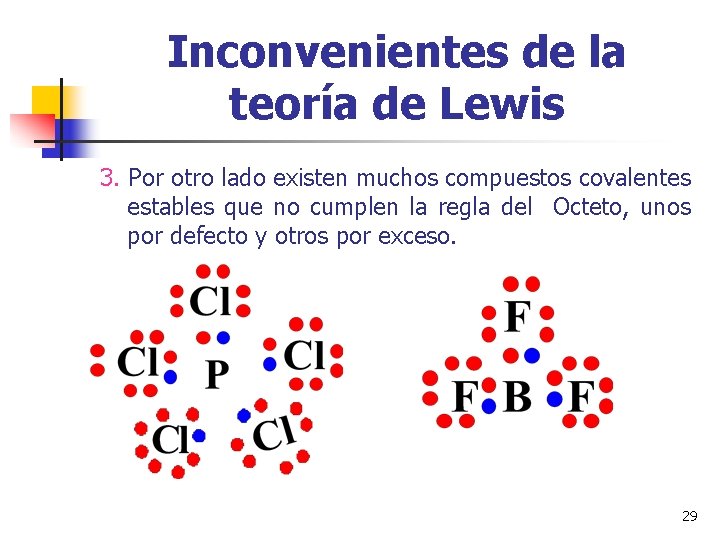
Inconvenientes de la teoría de Lewis 3. Por otro lado existen muchos compuestos covalentes estables que no cumplen la regla del Octeto, unos por defecto y otros por exceso. 29

PARÁMETROS MOLECULARES ENERGÍA DE ENLACE, es aquella que se desprende cuando se forma un enlace entre dos átomos en estado gaseoso y fundamental. LONGITUD DE ENLACE, es la distancia de equilibrio entre los núcleos atómicos correspondiente al valor de la energía de enlace. Se denomina también distancia internuclear. ÁNGULO DE ENLACE, es el ángulo hipotético formado entre el núcleo del átomo central y los núcleos de los átomos enlazados a él. 30

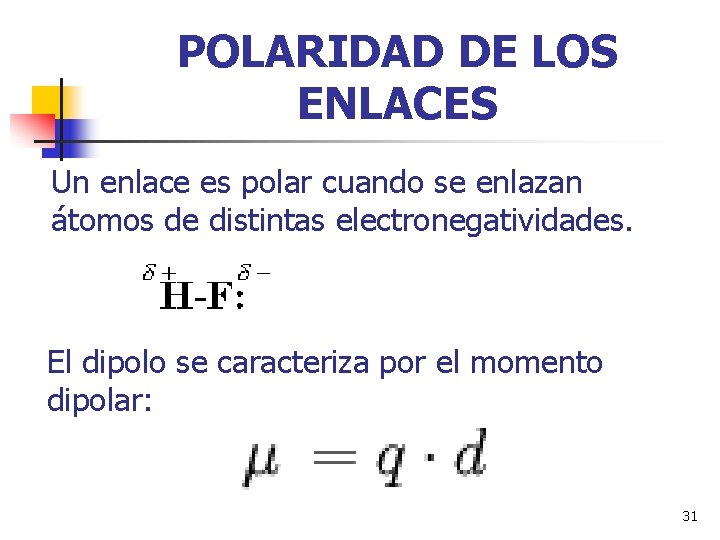
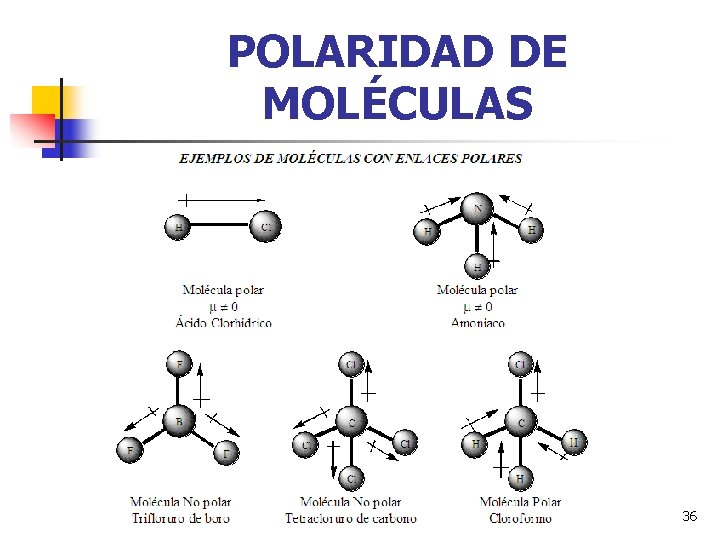
POLARIDAD DE LOS ENLACES Un enlace es polar cuando se enlazan átomos de distintas electronegatividades. El dipolo se caracteriza por el momento dipolar: 31

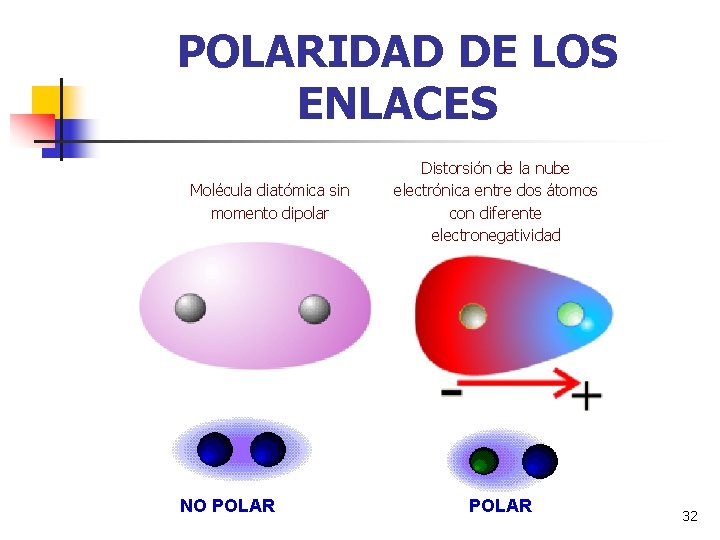
POLARIDAD DE LOS ENLACES Molécula diatómica sin momento dipolar NO POLAR Distorsión de la nube electrónica entre dos átomos con diferente electronegatividad POLAR 32

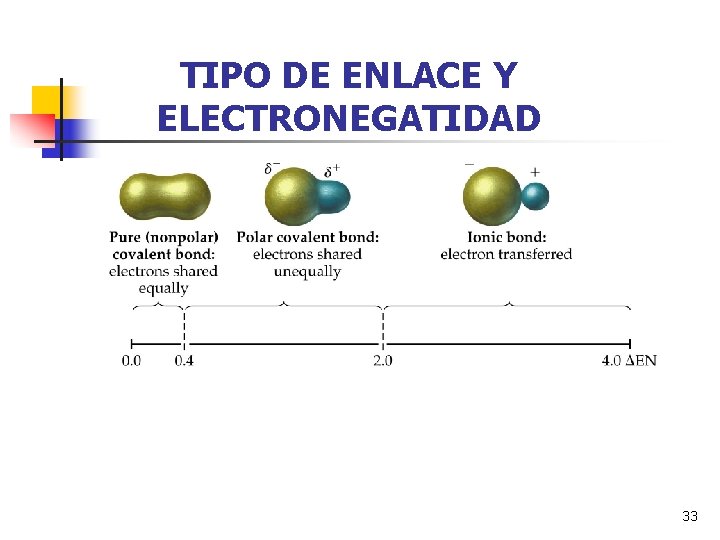
TIPO DE ENLACE Y ELECTRONEGATIDAD 33

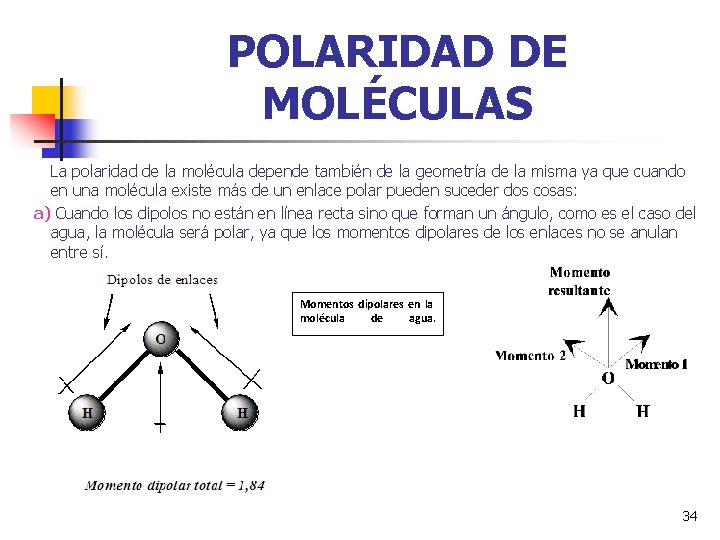
POLARIDAD DE MOLÉCULAS La polaridad de la molécula depende también de la geometría de la misma ya que cuando en una molécula existe más de un enlace polar pueden suceder dos cosas: a) Cuando los dipolos no están en línea recta sino que forman un ángulo, como es el caso del agua, la molécula será polar, ya que los momentos dipolares de los enlaces no se anulan entre sí. Momentos dipolares en la molécula de agua. 34

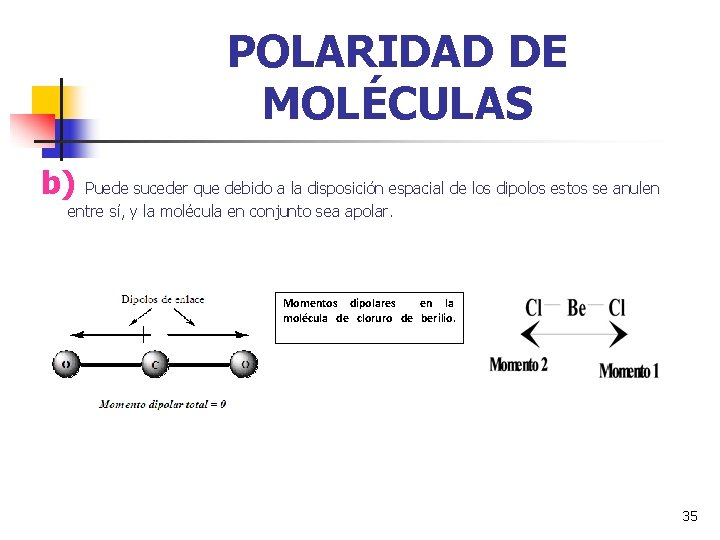
POLARIDAD DE MOLÉCULAS b) Puede suceder que debido a la disposición espacial de los dipolos estos se anulen entre sí, y la molécula en conjunto sea apolar. Momentos dipolares en la molécula de cloruro de berilio. 35

POLARIDAD DE MOLÉCULAS 36

ENLACE COVALENTE: TEORÍA DEL ENLACE DE VALENCIA Esta teoría supone que cuando dos átomos aislados se aproximan, para formar un enlace covalente, se produce un solapamiento de sus orbitales atómicos produciéndose el enlace cuando se aparean los electrones de spines contrarios de cada orbital Aparecen por lo tanto enlaces dirigidos en el espacio. 37

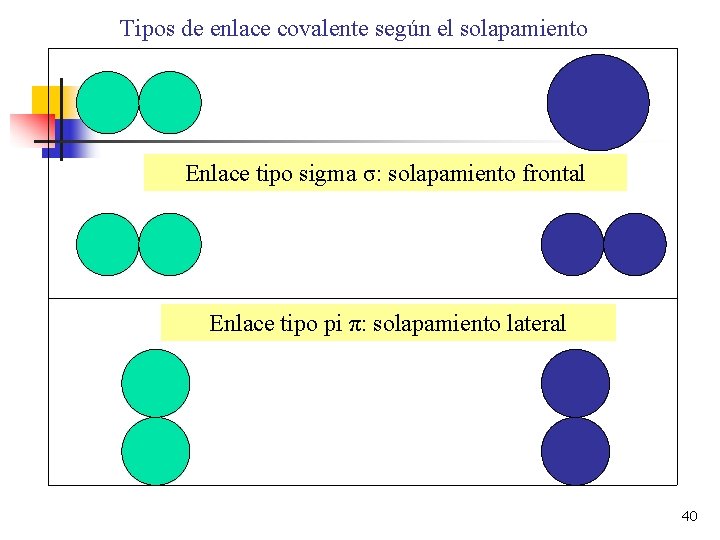
ENLACE COVALENTE: TEORÍA DEL ENLACE DE VALENCIA El solapamiento entre dos orbitales se puede producir de dos formas distintas: a) Por solapamiento frontal. Es decir, sobre la línea de unión imaginaria que une los núcleos. Se dice que se produce un enlace de tipo SIGMA ( ). Se forman enlaces SIGMA cuando solapan dos orbitales de tipo S, uno S y otro P, o dos orbitales P siempre que estén orientados en el mismo eje. ENLACE SIGMA ( ). 38

ENLACE COVALENTE: TEORÍA DEL ENLACE DE VALENCIA b) Por solapamiento lateral. En este caso, hay dos zonas de solapamiento, una a cada lado de la línea de unión de los núcleos atómicos. Cuando esto ocurre, se dice que el enlace es de tipo PI ( ). Se forman enlaces de tipo PI cuando se solapan dos orbitales P que poseen ejes paralelos. La máxima probabilidad de encontrar los electrones es entre los núcleos, ya que así los tiene atraídos venciendo su repulsión eléctrica. ENLACE PI ( ). 39

Tipos de enlace covalente según el solapamiento Enlace tipo sigma σ: solapamiento frontal Enlace tipo pi π: solapamiento lateral 40

ENLACE COVALENTE: TEORÍA DEL ENLACE DE VALENCIA Molécula de H 2: En el caso del hidrógeno gaseoso, H 2, según esta teoría, cuando se produzca el solapamiento de los orbitales atómicos 1 s de cada hidrógeno, se producirá el enlace: 41

ENLACE COVALENTE: TEORÍA DEL ENLACE DE VALENCIA MOLÉCULA DE FLUOR (F 2) ZF = 9 1 s 2 2 p 5 o sea 1 s 2 2(px 1 py 2 pz 2) Queda un electrón libre en el orbital px de cada átomo de flúor, que se aparean solapando los orbitales px. Aparece un enlace de tipo Sigma que mantiene unidos a los átomos de flúor, originando una molécula de flúor de geometría lineal. GEOMETRÍA LINEAL 42

ENLACE COVALENTE: TEORÍA DEL ENLACE DE VALENCIA MOLÉCULA DE OXÍGENO (O 2) ZO=8 1 s 2 2(px 1 py 1 pz 2) En este caso aparecen 2 enlaces, el solapamiento es frontal entre dos orbitales p, por un lado, y lateral, por otro, dando lugar a un enlace y otro , estos dos enlaces juntos dan lugar a lo que se conoce como enlace doble (O=O). GEOMETRÍA LINEAL 43

ENLACE COVALENTE: TEORÍA DEL ENLACE DE VALENCIA MOLÉCULA DE NITRÓGENO Si se unen dos átomos de nitrógeno, lo hace con tres enlaces uno y dos , lo que se conoce como enlace triple. 44

ENLACE COVALENTE: TEORÍA DEL ENLACE DE VALENCIA MOLÉCULA DE AGUA ZO=8 1 s 2 2(px 1 py 1 pz 2) ZH=1 1 s 1 El oxígeno puede formar dos enlaces covalentes, en el caso del agua forma los enlaces con el hidrógeno, enlaces , la geometría de la molécula sería angular, si bien el ángulo observado experimentalmente es de 104º 4’, diferente del teórico que sería de 90º, esta diferencia se interpreta en base a la repulsión que surgiría entre los átomos de los hidrógenos, ya que estos, debido a la gran electronegatividad del oxígeno, tendrían una carga residual positiva. 45

ENLACE COVALENTE: TEORÍA DEL ENLACE DE VALENCIA MOLÉCULA DE AMONIACO ZN= 7 1 s 2 2(px 1 py 1 pz 1) ZH=1 1 s 1 En el caso del nitrógeno, tenemos tres electrones desapareados uno en cada uno de los orbitales p, puede formar tres enlaces covalentes. Si se une a tres átomos de hidrógeno lo hace con tres enlaces , la geometría de la molécula sería piramidal, aunque con ángulos mayores (108º) que los teóricos (90º) por las mismas razones que el caso del agua. 46

ENLACE COVALENTE: TEORÍA DEL ENLACE DE VALENCIA Fallos de esta teoría: n n Así la molécula de Be. F 2 sería angular, cuando experimentalmente se ha comprobado que es lineal con los dos enlaces iguales y equivalentes. En el caso del CH 4, según esta teoría habría tres enlaces equivalentes y otro no, el carbono tiene una configuración electrónica: 1 s 2 2 p 2, con dos electrones sin emparejar, lo que llevaría a pensar en una covalencia 2 para este elemento. Sin embargo, sabemos que el carbono es casi siempre tetravalente. Esta disposición es incompatible con la conocida equivalencia de los cuatro enlaces C—H del metano. La teoría del enlace de valencia es, por lo tanto, incapaz de explicar aquellas geometrías moleculares en las que participen orbitales atómicos, de un mismo átomo, de distinto tipo (s, p, . . . ) 47

ENLACE COVALENTE: TEORÍA DE LA HIBRIDACIÓN DE ORBITALES n Esta teoría, desarrollada por Pauling y Slater en 1931 y basada en la teoría del Enlace de Valencia, supone que cuando dos orbitales atómicos de diferente tipo, pertenecientes a un mismo átomo, intervienen en la formación de enlaces, estos se recombinan, se HIBRIDAN, dando tantos orbitales híbridos como orbitales atómicos de partida se han recombinado. Los orbitales híbridos son parecidos en geometría a los orbitales de tipo p, pero poseen un lóbulo muy grande (el enlazante) mientras que el otro es muy pequeño (el antienlazante). Dependiendo de los tipos de orbitales atómicos que se combinen y de su número aparecen diferentes clases de hibridaciones. En este tema sólo estudiaremos tres: SP, SP 2 y SP 3. 48

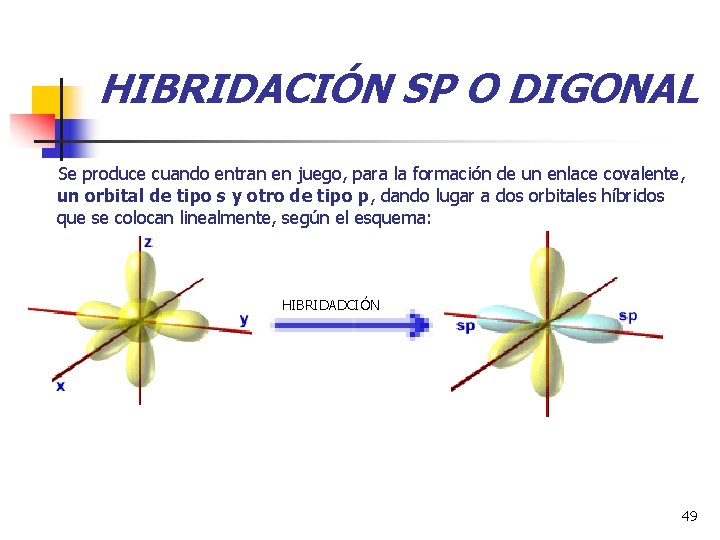
HIBRIDACIÓN SP O DIGONAL Se produce cuando entran en juego, para la formación de un enlace covalente, un orbital de tipo s y otro de tipo p, dando lugar a dos orbitales híbridos que se colocan linealmente, según el esquema: HIBRIDADCIÓN 49

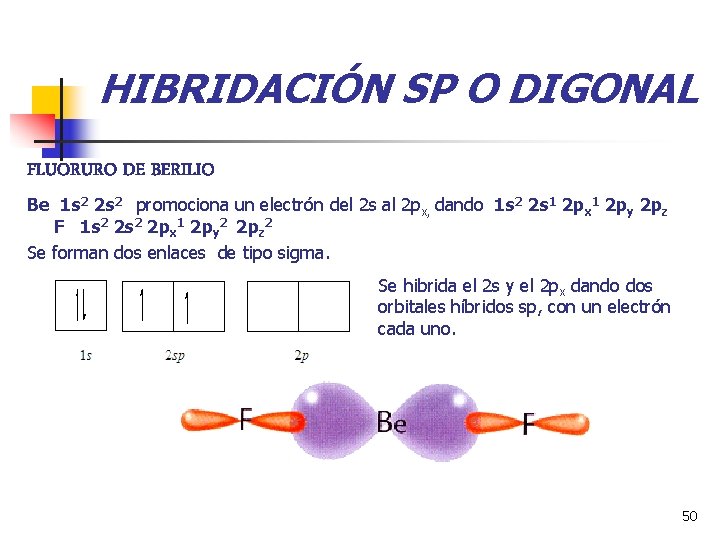
HIBRIDACIÓN SP O DIGONAL FLUORURO DE BERILIO Be 1 s 2 2 s 2 promociona un electrón del 2 s al 2 px, dando 1 s 2 2 s 1 2 px 1 2 py 2 pz F 1 s 2 2 px 1 2 py 2 2 pz 2 Se forman dos enlaces de tipo sigma. Se hibrida el 2 s y el 2 px dando dos orbitales híbridos sp, con un electrón cada uno. 50

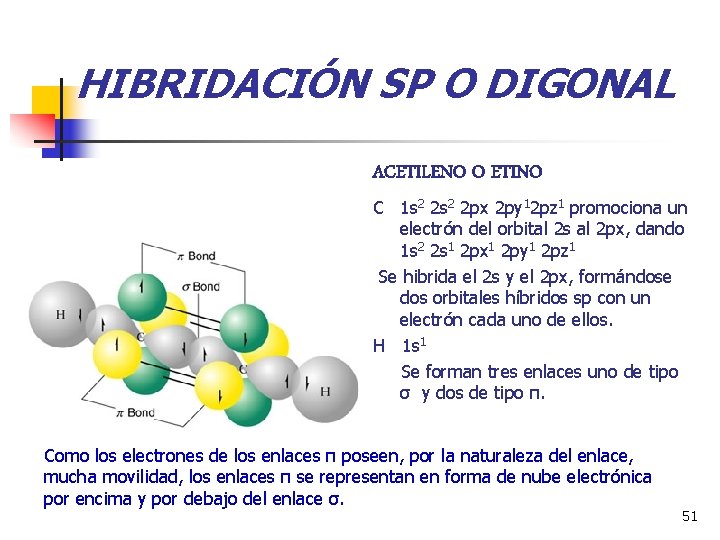
HIBRIDACIÓN SP O DIGONAL ACETILENO O ETINO C 1 s 2 2 px 2 py 12 pz 1 promociona un electrón del orbital 2 s al 2 px, dando 1 s 2 2 s 1 2 px 1 2 py 1 2 pz 1 Se hibrida el 2 s y el 2 px, formándose dos orbitales híbridos sp con un electrón cada uno de ellos. H 1 s 1 Se forman tres enlaces uno de tipo σ y dos de tipo π. Como los electrones de los enlaces π poseen, por la naturaleza del enlace, mucha movilidad, los enlaces π se representan en forma de nube electrónica por encima y por debajo del enlace σ. 51

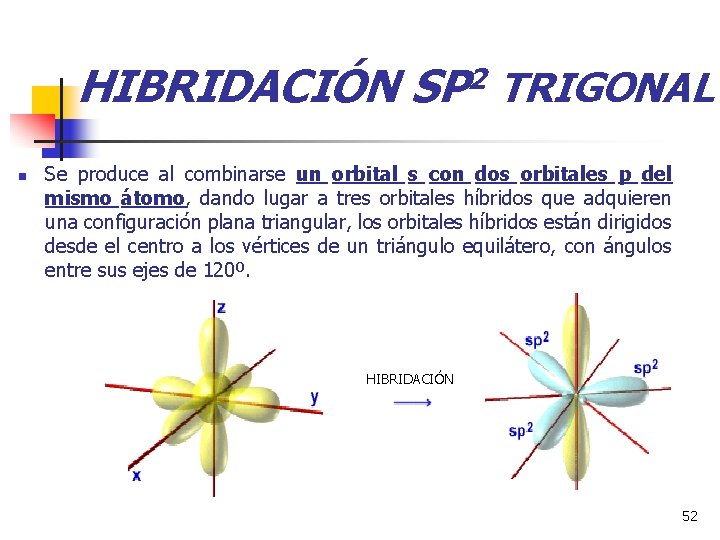
HIBRIDACIÓN SP 2 TRIGONAL n Se produce al combinarse un orbital s con dos orbitales p del mismo átomo, dando lugar a tres orbitales híbridos que adquieren una configuración plana triangular, los orbitales híbridos están dirigidos desde el centro a los vértices de un triángulo equilátero, con ángulos entre sus ejes de 120º. HIBRIDACIÓN 52

HIBRIDACIÓN SP 2 TRIGONAL ETENO C 1 s 2 2 px 2 py 1 2 pz 1, promociona un electrón del orbital 2 s al 2 px, dando 1 s 2 2 s 1 2 px 1 2 py 1 2 pz 1 H 1 s 1 Se forma un enlace sigma por solapamiento de dos orbitales sp 2 y un enlace pi por solapamiento lateral de dos orbitales p. Este tipo de hibridación la presentan las moléculas de trifluoruro de boro, eteno y benceno, en general todos los dobles enlaces en el caso de los compuestos orgánicos. 53

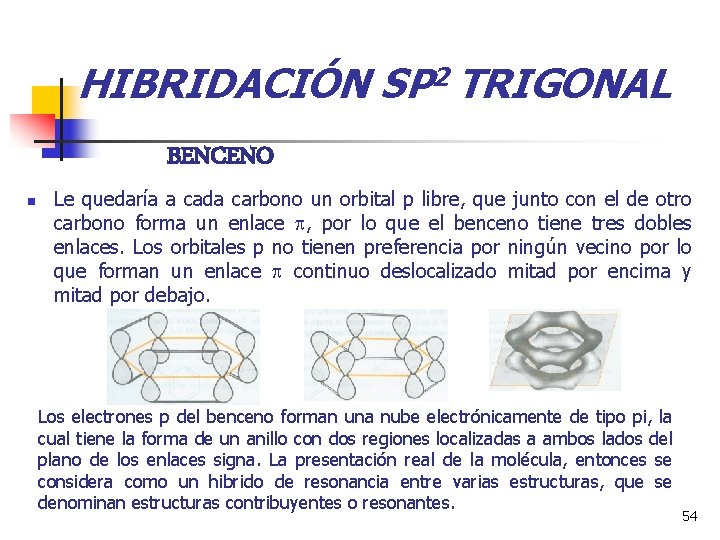
HIBRIDACIÓN SP 2 TRIGONAL BENCENO n Le quedaría a cada carbono un orbital p libre, que junto con el de otro carbono forma un enlace , por lo que el benceno tiene tres dobles enlaces. Los orbitales p no tienen preferencia por ningún vecino por lo que forman un enlace continuo deslocalizado mitad por encima y mitad por debajo. Los electrones p del benceno forman una nube electrónicamente de tipo pi, la cual tiene la forma de un anillo con dos regiones localizadas a ambos lados del plano de los enlaces signa. La presentación real de la molécula, entonces se considera como un hibrido de resonancia entre varias estructuras, que se denominan estructuras contribuyentes o resonantes. 54

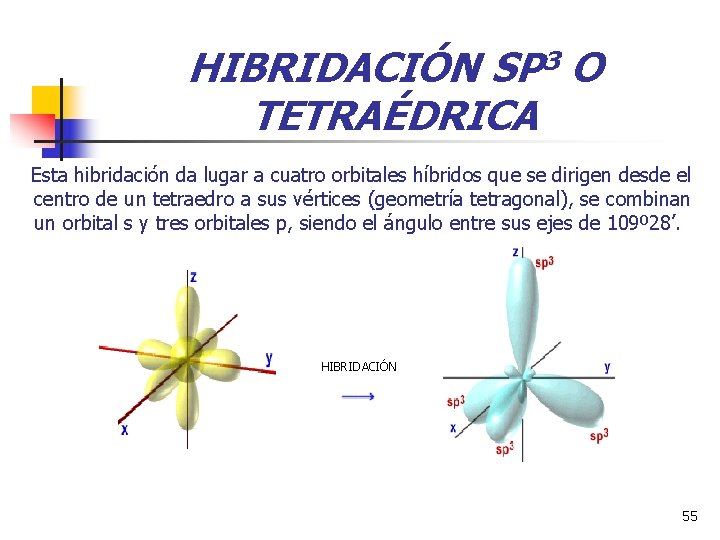
HIBRIDACIÓN SP 3 O TETRAÉDRICA Esta hibridación da lugar a cuatro orbitales híbridos que se dirigen desde el centro de un tetraedro a sus vértices (geometría tetragonal), se combinan un orbital s y tres orbitales p, siendo el ángulo entre sus ejes de 109º 28’. HIBRIDACIÓN 55

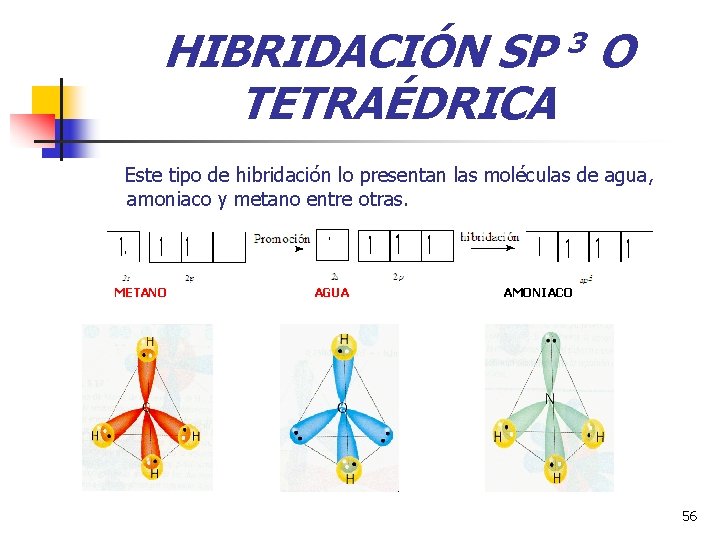
HIBRIDACIÓN SP 3 O TETRAÉDRICA Este tipo de hibridación lo presentan las moléculas de agua, amoniaco y metano entre otras. METANO AGUA AMONIACO 56

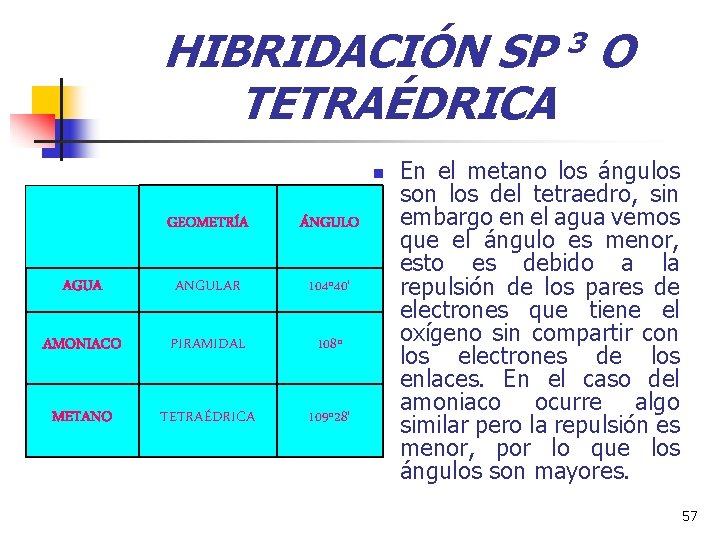
HIBRIDACIÓN SP 3 O TETRAÉDRICA n GEOMETRÍA ÁNGULO AGUA ANGULAR 104º 40' AMONIACO PIRAMIDAL 108º METANO TETRAÉDRICA 109º 28' En el metano los ángulos son los del tetraedro, sin embargo en el agua vemos que el ángulo es menor, esto es debido a la repulsión de los pares de electrones que tiene el oxígeno sin compartir con los electrones de los enlaces. En el caso del amoniaco ocurre algo similar pero la repulsión es menor, por lo que los ángulos son mayores. 57

ENLACE COVALENTE: Método de repulsión de pares electrónicos de la capa de valencia El método RPECV se basa en que los pares electrónicos enlazantes y no enlazantes de la capa de valencia de un átomo en una molécula se disponen en el espacio de manera que la repulsión entre ellos sea la menor posible. Los pares de electrones enlazantes son aquellos que originan los enlaces covalentes y los no enlazantes son pares de electrones que forman parte de capa de valencia del átomo pero no forman un enlace. 58

ENLACE COVALENTE: Método de repulsión de pares electrónicos de la capa de valencia Vamos a estudiar como se aplica este método a los tipos de moléculas más habituales. a) Es el caso de las moléculas diatómicas (tipo AX 2 sin pares de electrones libres). Como sólo hay dos bloques de electrones habrá dos direcciones con un bloque de electrones cada una. La geometría tiene que ser lineal. Hace mínima las repulsiones entre pares de electrones. Un ejemplo es el dióxido de carbono: 59

ENLACE COVALENTE: Método de repulsión de pares electrónicos de la capa de valencia b) Este caso se puede dar con moléculas tetratómicas y triatómicas. En las moléculas tetratómicas (tipo AX 3 sin pares de electrones libres). La distribución sería triangular plana que hace mínima las repulsiones entre los pares electrónicos. Un ejemplo es el trifluoruro de boro: 60

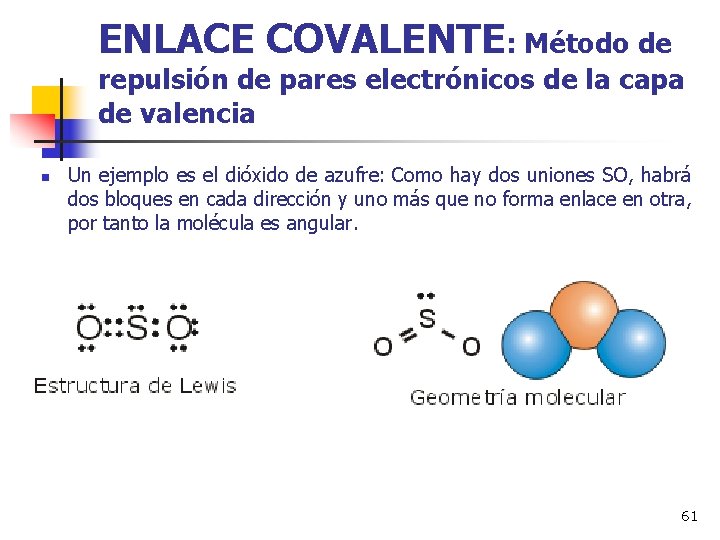
ENLACE COVALENTE: Método de repulsión de pares electrónicos de la capa de valencia n Un ejemplo es el dióxido de azufre: Como hay dos uniones SO, habrá dos bloques en cada dirección y uno más que no forma enlace en otra, por tanto la molécula es angular. 61

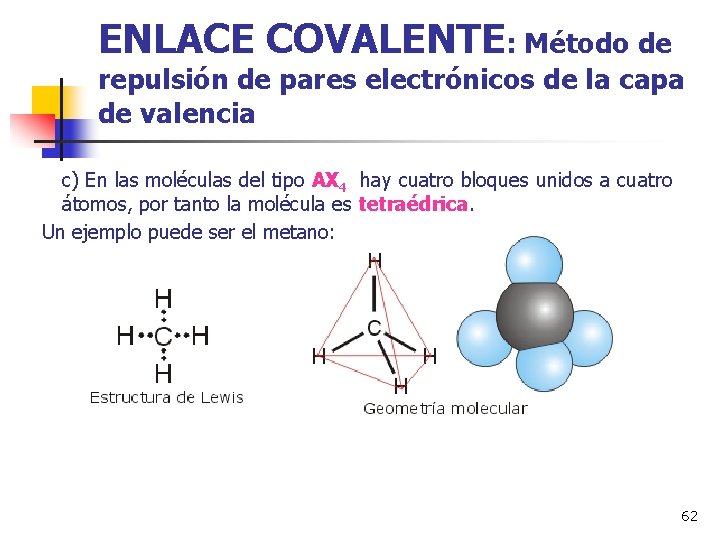
ENLACE COVALENTE: Método de repulsión de pares electrónicos de la capa de valencia c) En las moléculas del tipo AX 4 hay cuatro bloques unidos a cuatro átomos, por tanto la molécula es tetraédrica. Un ejemplo puede ser el metano: 62

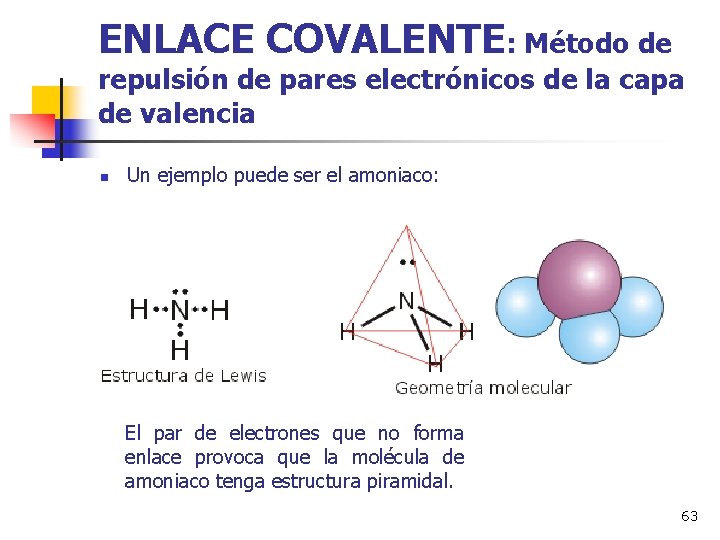
ENLACE COVALENTE: Método de repulsión de pares electrónicos de la capa de valencia n Un ejemplo puede ser el amoniaco: El par de electrones que no forma enlace provoca que la molécula de amoniaco tenga estructura piramidal. 63

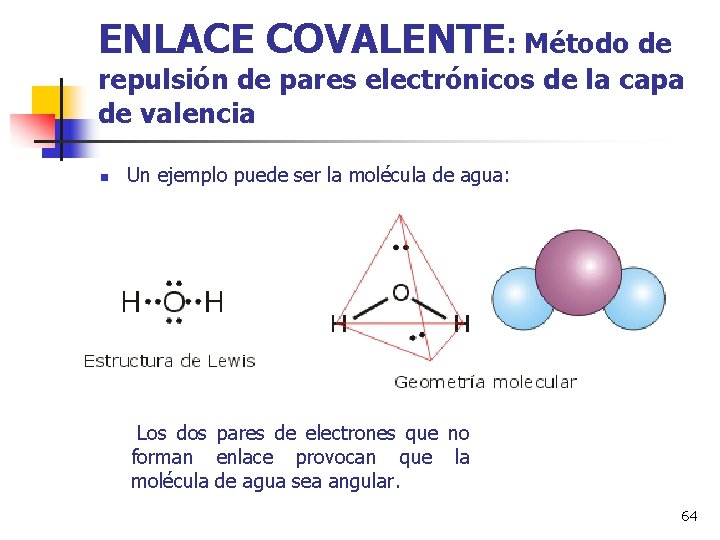
ENLACE COVALENTE: Método de repulsión de pares electrónicos de la capa de valencia n Un ejemplo puede ser la molécula de agua: Los dos pares de electrones que no forman enlace provocan que la molécula de agua sea angular. 64

PROPIEDADES DE LAS SUSTANCIAS COVALENTES 1. - Forman moléculas, siendo las fuerzas de atracción entre ellas débiles, por lo que son sustancias volátiles, de bajos puntos de fusión y de ebullición, en condiciones ordinarias son gaseosos como el O 2, amoniaco, metano, dióxido de nitrógeno, etc. , algunas líquidos como el bromo, agua, etanol, ácido acético, etc. y otras sólidas como el yodo, naftaleno, glucosa, etc. 2. - En cuanto a la solubilidad, los compuestos no polares o poco polares son prácticamente insolubles en disolventes polares como el agua, pero se disuelven bien en disolventes no polares o poco polares como los disolventes orgánicos: éter, benceno, tetracloruro de carbono, etc. 3. - Son malos conductores del calor y de la corriente eléctrica, es decir no tienen electrones libres. 65

PROPIEDADES DE LAS SUSTANCIAS COVALENTES 4. - Es un enlace dirigido y las moléculas tienen una geometría definida. 5. - Es un enlace fuerte, difícil de romper, aunque las fuerzas entre las moléculas sean débiles. 6. - En algunos casos forman redes cristalinas con enlaces covalentes, como es el caso del diamante (carbonos unidos por hibridación sp 3), grafito (carbonos unidos por hibridación sp 2). Si. C, Si. O 2 (sílice). Todos los átomos estarían unidos por enlaces covalentes difícil de romper. Estas sustancias se conocen como macromoléculas. Son de gran dureza, altos puntos de fusión y de ebullición y son insolubles en disolventes comunes. 66

FUERZAS INTERMOLECULARES Entre dos o más moléculas pueden producirse interacciones. Estas interacciones de carácter electrostático se conocen, de forma genérica, como "fuerzas intermoleculares" y son las responsables de que cualquier sustancia, incluidos los gases nobles, puedan condensar. Estas fuerzas se clasifican en dos tipos básicos: Las fuerzas de Van der Waals y los enlaces por puente de hidrógeno. 67

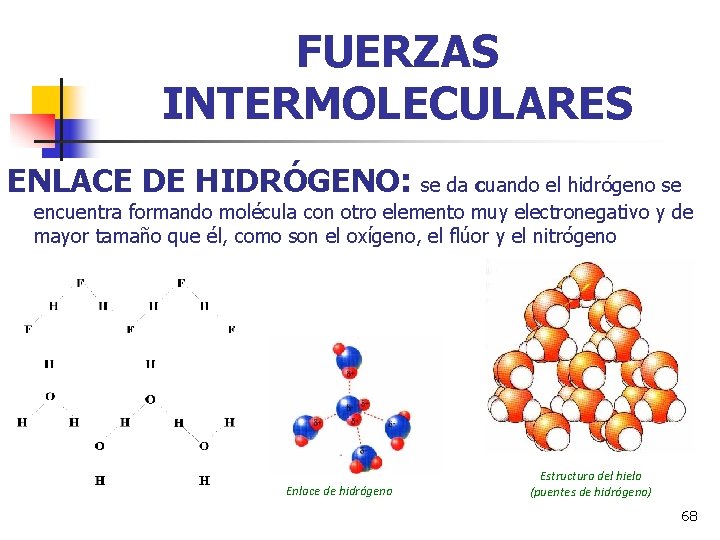
FUERZAS INTERMOLECULARES ENLACE DE HIDRÓGENO: se da cuando el hidrógeno se encuentra formando molécula con otro elemento muy electronegativo y de mayor tamaño que él, como son el oxígeno, el flúor y el nitrógeno Enlace de hidrógeno Estructura del hielo (puentes de hidrógeno) 68

FUERZAS INTERMOLECULARES n La principal anomalía de los compuestos que tienen este enlace se observa en sus puntos de fusión y ebullición y, por tanto, en su estado físico a temperatura ambiente. Gráfica de los puntos de fusión y de ebullición de los hidruros de la familia del oxígeno. 69

FUERZAS INTERMOLECULARES FUERZAS DE VAN DER WAALS: Estas fuerzas se basan en la atracción electrostática que puede surgir entre dos moléculas, tanto polares como apolares. Se caracterizan por ser muy débiles y por aumentar su fortaleza con la masa molecular, ya que las capas electrónicas externas se deforman más fácilmente cuanto más alejadas están del núcleo. Pueden ser de dos tipos: 70

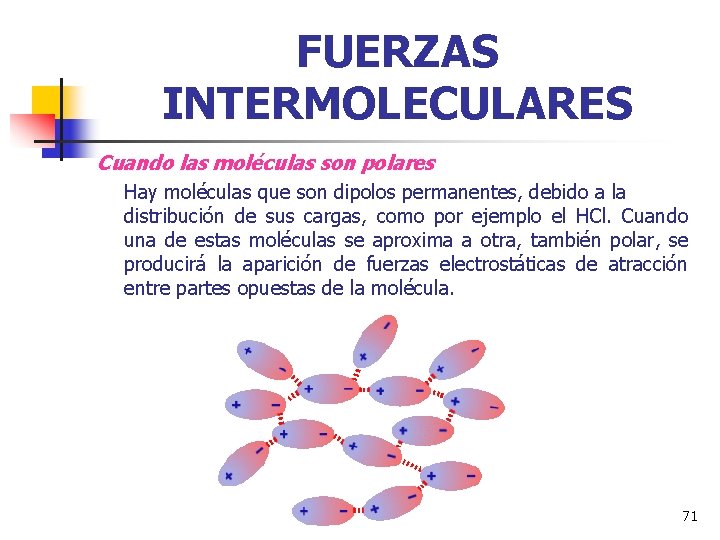
FUERZAS INTERMOLECULARES Cuando las moléculas son polares Hay moléculas que son dipolos permanentes, debido a la distribución de sus cargas, como por ejemplo el HCl. Cuando una de estas moléculas se aproxima a otra, también polar, se producirá la aparición de fuerzas electrostáticas de atracción entre partes opuestas de la molécula. 71

FUERZAS INTERMOLECULARES Cuando las moléculas son apolares Cuando las moléculas no son polares por ejemplo F-F, se sabe que estas moléculas se encuentran en estado de vibración, lo que origina que las respectivas cargas estén en continuo desplazamiento dentro de las moléculas. Esto significa que continuamente se están produciendo dipolos instantáneos, los cuales, a su vez inducen otros dipolos en las moléculas vecinas, con la consiguiente aparición de fuerzas atractivas entre ellos. Este hecho tiene importancia cuando las temperaturas son muy bajas, ya que en estas condiciones los dipolos instantáneos tienen vida suficiente para poder provocar el efecto de unión. Estos enlaces entre dipolos inducidos son más débiles que los que tienen lugar entre moléculas polares. 72

ENLACE METÁLICO El enlace metálico es el que mantiene unidos los átomos de los metales entre sí. Produce estructuras muy compactas. Se trata de redes tridimensionales de tres tipos principalmente: 1 Cúbica centrada en las caras o red cúbica compacta (Cu, Ag, Au, Pt, etc. ) 2. Hexagonal compacta (Mg, Zn, Cd, etc). 3. Cúbica centrada en el cuerpo (metales alcalinos), 73

ENLACE METÁLICO Las propiedades físicas de los metales: 1. Estado natural. Aunque en general todos son sólidos a temperatura ambiente, excepto el mercurio, sus puntos de fusión y ebullición varían notablemente (por ejemplo, el galio funde a 29ºC y el wolframio a 3380ºC). Son duros, cuanto más compacta sea su estructura, mayor es su dureza, su punto de fusión y su punto de ebullición. 2. Conductividad. Las conductividades térmicas y eléctricas son muy elevadas, lo que sugiere una estructura con electrones muy libres, con gran facilidad de movimiento. 74

ENLACE METÁLICO 3. Brillo metálico. Los metales con sus superficies pulidas no absorben prácticamente la luz, sino que la reflejan, de ahí su color plateado; existen unos pocos que sí absorben alguna radiación, por lo que reflejan el color complementario al absorbido. Oro-Amarillo, Cobre-rojo. 4. Ductilidad y maleabilidad. Son fácilmente maleables debido a que cualquier plano del cristal puede deslizarse sobre otro plano, y los electrones deslocalizados evitan que aparezcan fuerzas repulsivas como sucedía con los cristales iónicos. Desplazamientos de láminas metálicas; las vecinas son iguales. 75

ENLACE METÁLICO 5. Emisión de electrones. Debido a la libertad que gozan los electrones de valencia dentro de la estructura cristalina, es muy fácil arrancarlos aportando una cantidad de energía no muy elevada como la que proporciona un haz de luz (efecto fotoeléctrico), o la que proporciona el calor (efecto termoiónico). 6. Densos. Excepto los alcalinos. 7. Altos puntos de fusión y de ebullición. Excepto el mercurio. 8. Insolubles en agua y en disolventes orgánicos. Algunos reaccionan con el agua y desprenden hidrógeno. 9. Existen aleaciones de metales. Mejoran las propiedades útiles de los mismos. Ejemplo el Latón (Cu y Zn), Bronce (Cu y Sn), Acero (Fe y C). 76

ENLACE METÁLICO MODELO DEL GAS ELECTRÓNICO O DEL MAR DE ELECTRONES Los metales están formados por la aglomeración de iones positivos (son los átomos del metal que han perdido sus electrones de valencia) situados a la distancia adecuada que les permita la repulsión electrostática. 77

ENLACE METÁLICO El desplazamiento de las capas iónicas en las estructuras no produce una variación importante en las mismas, por lo que no se rompen. Desplazamientos de láminas metálicas; las vecinas son iguales. 78

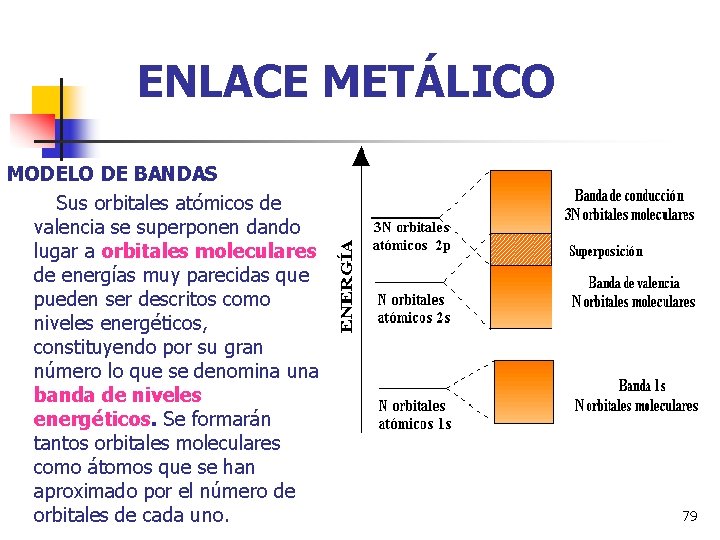
ENLACE METÁLICO MODELO DE BANDAS Sus orbitales atómicos de valencia se superponen dando lugar a orbitales moleculares de energías muy parecidas que pueden ser descritos como niveles energéticos, constituyendo por su gran número lo que se denomina una banda de niveles energéticos. Se formarán tantos orbitales moleculares como átomos que se han aproximado por el número de orbitales de cada uno. 79

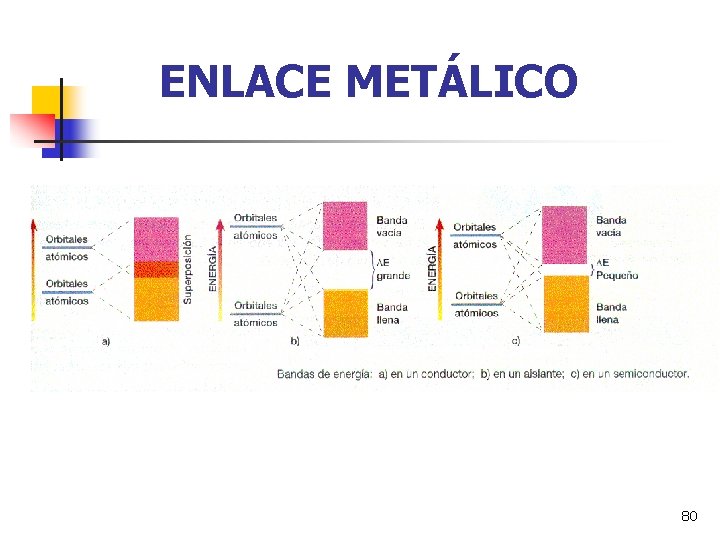
ENLACE METÁLICO 80
 Enlace qumico
Enlace qumico Enlace qumico
Enlace qumico Fqcolindres 2 eso
Fqcolindres 2 eso Que es enlace coordinado
Que es enlace coordinado Enlace qumico
Enlace qumico Enlaces sigma y pi carbono
Enlaces sigma y pi carbono Gabriela lpez
Gabriela lpez Decroly biografia
Decroly biografia Gabriela lpez
Gabriela lpez Cuales son las propiedades de los compuestos ionicos
Cuales son las propiedades de los compuestos ionicos Enlaces quimicos en la naturaleza
Enlaces quimicos en la naturaleza Que es un enlace polar
Que es un enlace polar H6se nomenclatura
H6se nomenclatura Isomeria de carbohidratos
Isomeria de carbohidratos Amorfos
Amorfos Nnn enlaces bc
Nnn enlaces bc Enlaces extraoracionales
Enlaces extraoracionales Enlaces de la estructura terciaria de las proteinas
Enlaces de la estructura terciaria de las proteinas Enlace covalente no polar ejemplos
Enlace covalente no polar ejemplos Que muestra
Que muestra Conectores parecidos a sin embargo
Conectores parecidos a sin embargo Sitios mineduc cl enlaces textos escolares 2do
Sitios mineduc cl enlaces textos escolares 2do Tipos de enlaces quimicos
Tipos de enlaces quimicos Bases piramidicas
Bases piramidicas Ffa enlaces gratuitos para todos
Ffa enlaces gratuitos para todos H-o-h tipo de enlace
H-o-h tipo de enlace (ab)^2
(ab)^2 Cristales covalentes ejemplos
Cristales covalentes ejemplos Particulas unitarias del enlace ionico
Particulas unitarias del enlace ionico Enlaces arn
Enlaces arn Enlaces pi y sigma
Enlaces pi y sigma Que es el estado basal del carbono
Que es el estado basal del carbono Como se produce un enlace covalente dativo
Como se produce un enlace covalente dativo Enlaces quimicos mapa mental
Enlaces quimicos mapa mental Nnn enlaces bc
Nnn enlaces bc Solid
Solid Marianne del carmen bustamante pizarro
Marianne del carmen bustamante pizarro Opera carmen vsebina
Opera carmen vsebina A mi me riza el viento
A mi me riza el viento Carmen castelao cora
Carmen castelao cora Hunc latino declinazione
Hunc latino declinazione Declinazione mens mentis
Declinazione mens mentis Invelisurile celulare
Invelisurile celulare Guinda
Guinda Coplas a la virgen del carmen
Coplas a la virgen del carmen Feliz dia de la madre carmen
Feliz dia de la madre carmen Carmen gamir
Carmen gamir Carmen hidalgo tenorio
Carmen hidalgo tenorio Carmen willings
Carmen willings Carmen sara
Carmen sara Carmen lomas garza quinceanera
Carmen lomas garza quinceanera Carmen cancellatum
Carmen cancellatum Carmen beissner
Carmen beissner Carmen mcclain
Carmen mcclain Carmen fought and karen eisenhauer
Carmen fought and karen eisenhauer Sineresis
Sineresis Carmen lomaz garza
Carmen lomaz garza Carmen coviello
Carmen coviello Carmen mazariegos
Carmen mazariegos Carmen de burgos biografia
Carmen de burgos biografia Ines desea que sus hijos siempre estar sanos
Ines desea que sus hijos siempre estar sanos Escuela parroquial nuestra señora del carmen
Escuela parroquial nuestra señora del carmen Carmen espinoza miranda
Carmen espinoza miranda Maria emília miranda
Maria emília miranda When did carmen lomas garza died
When did carmen lomas garza died Carmen cerda tanatologa
Carmen cerda tanatologa Virgen patrona de chile
Virgen patrona de chile 1 reyes 18 30-40
1 reyes 18 30-40 Escuela vocacional especial
Escuela vocacional especial Voyage by carmen tafolla analysis
Voyage by carmen tafolla analysis Significado del escapulario de la virgen del carmen
Significado del escapulario de la virgen del carmen Carmen mara
Carmen mara No es cierto que paco y daniel nos 1 of 1 (ayudar).
No es cierto que paco y daniel nos 1 of 1 (ayudar). Vad betyder krönika
Vad betyder krönika Philippians 2:6
Philippians 2:6 Carmen says that it's easy to multiply even numbers by 5
Carmen says that it's easy to multiply even numbers by 5 Catullus carmen 2
Catullus carmen 2 Carmen landau
Carmen landau Carmen curvas
Carmen curvas Ana beatriz diana y cecilia
Ana beatriz diana y cecilia Carmen van bussel
Carmen van bussel