Enlace Covalente 6 El Enlace Covalente Estructuras de




- Slides: 9

Enlace Covalente 6. El Enlace Covalente.

Estructuras de Lewis Los gases nobles presentan gran estabilidad química, y existen como moléculas mono-atómicas. Su configuración electrónica es muy estable y contiene 8 e- en la capa de valencia (excepto el He). La idea de enlace covalente fue sugerida en 1916 por G. N. Lewis: G. N. Lewis Los átomos pueden adquirir estructura de gas noble compartiendo electrones para formar un enlace de pares de electrones. 6. El Enlace Covalente. e- de valencia He Ne Ar Kr Xe Rn 8 2 8 8

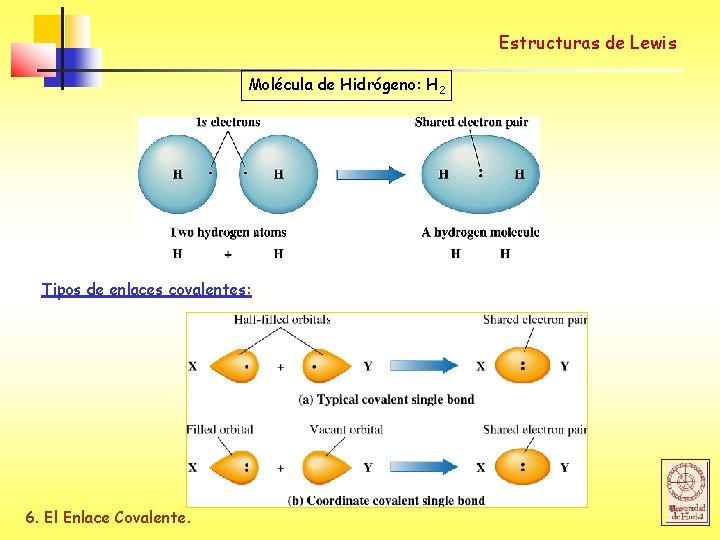
Estructuras de Lewis Molécula de Hidrógeno: H 2 Tipos de enlaces covalentes: 6. El Enlace Covalente.

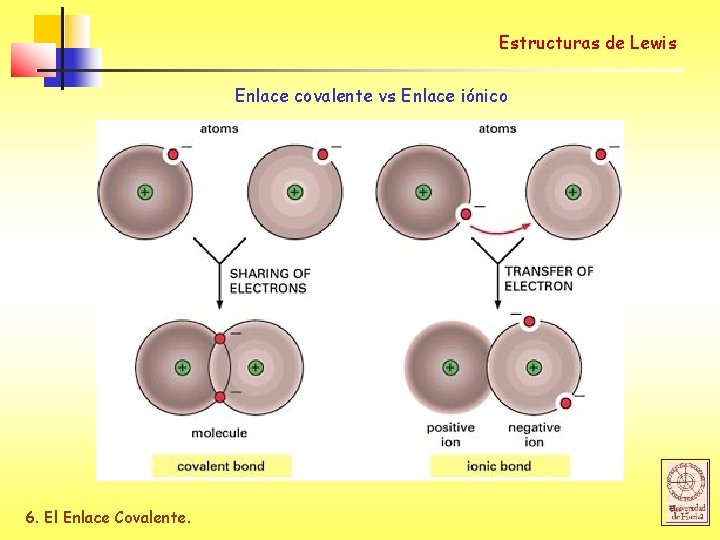
Estructuras de Lewis Enlace covalente vs Enlace iónico 6. El Enlace Covalente.

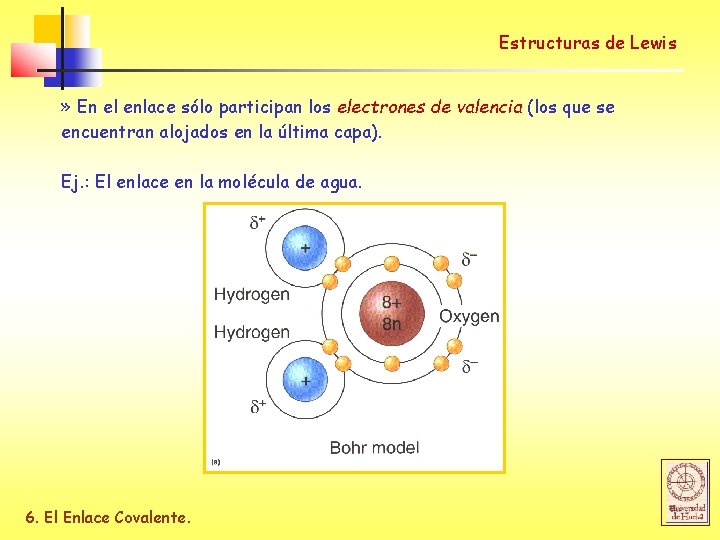
Estructuras de Lewis » En el enlace sólo participan los electrones de valencia (los que se encuentran alojados en la última capa). Ej. : El enlace en la molécula de agua. 6. El Enlace Covalente.

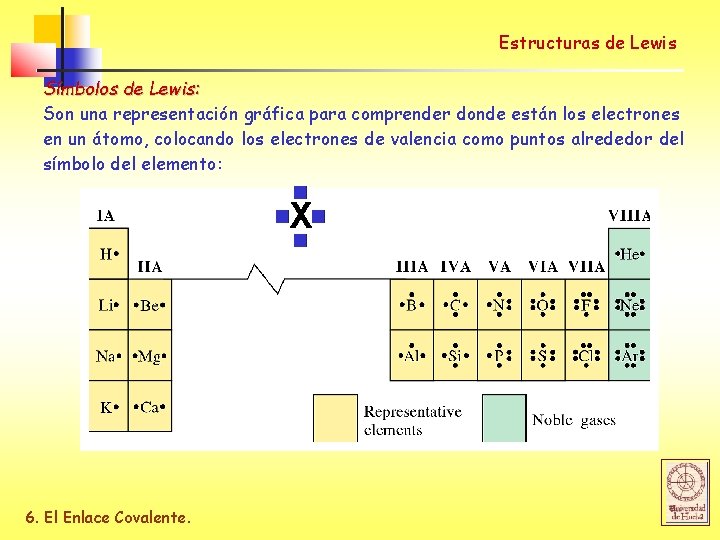
Estructuras de Lewis Símbolos de Lewis: Son una representación gráfica para comprender donde están los electrones en un átomo, colocando los electrones de valencia como puntos alrededor del símbolo del elemento: Xv v 6. El Enlace Covalente.

Estructuras de Lewis Regla del octeto: Los átomos se unen compartiendo electrones hasta conseguir completar la última capa con 8 e- (4 pares de e-) es decir conseguir la configuración de gas noble: s 2 p 6 Tipos de pares de electrones: 1 - Pares de e- compartidos entre dos átomos (representado con una línea entre los at. unidos) · enlaces sencillos · enlaces dobles · enlaces triples 2 - Pares de e- no compartidos (ó par solitario) 6. El Enlace Covalente.

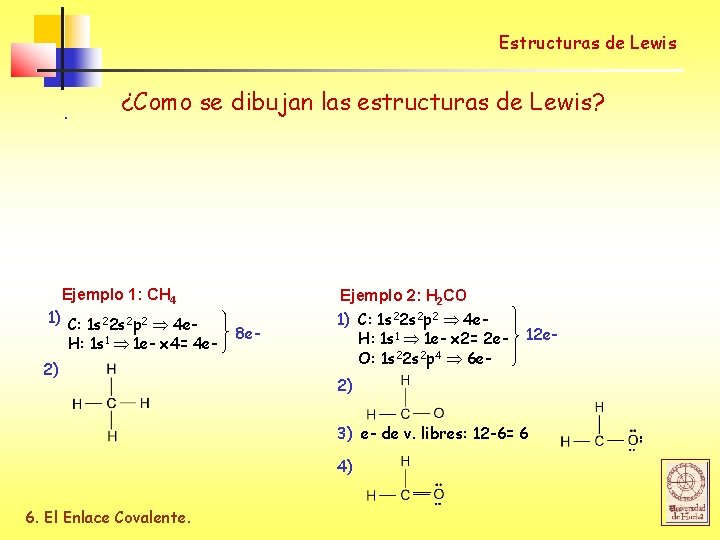
Estructuras de Lewis . ¿Como se dibujan las estructuras de Lewis? Ejemplo 1: CH 4 1) C: 1 s 22 s 2 p 2 4 e. H: 1 s 1 1 e- x 4= 4 e 2) 8 e- Ejemplo 2: H 2 CO 1) C: 1 s 22 s 2 p 2 4 e. H: 1 s 1 1 e- x 2= 2 e. O: 1 s 22 s 2 p 4 6 e- 12 e- 2) 3) e- de v. libres: 12 -6= 6 4) 6. El Enlace Covalente.

ACTIVIDADES HOLT Book 1. 2. 3. 4. 5. Figura 10 p. 184 Sample Problem B p 184 Sample Problem C p. 185 Practice 1, 2, 3, 4 p. 186 Sample Problem D p. 188 + Practice 1, 2 6. El Enlace Covalente.