LIGAO COVALENTE LIGAO COVALENTE o G N Lewis







- Slides: 11

LIGAÇÃO COVALENTE

LIGAÇÃO COVALENTE o G. N. Lewis – 1916 o Teoria dos octetos (compartilhamento de elétrons) o Nível de valência – s 2 p 6 (semelhante aos gases nobres) o H – H 1 s 2 (He)

Estruturas de Lewis pares de elétrons ligantes : pares de elétrons não ligantes

Estruturas de Lewis 1 – Escolher o átomo central (C, N, P, S); 2 – Determinar o número total de elétrons de valência; 3 – Formar ligações covalentes simples entre cada par de átomos; 4 – Colocar os elétrons restantes nos átomos terminais (exceto para H); 5 – Átomo central com menos de 8 elétrons ligações múltiplas (C, N, O, S) . . . O. . C. . O. . . C = 4 elétrons O = 6 (x 2) = 12 elétrons . . O. . C . . . O. C . . O. .

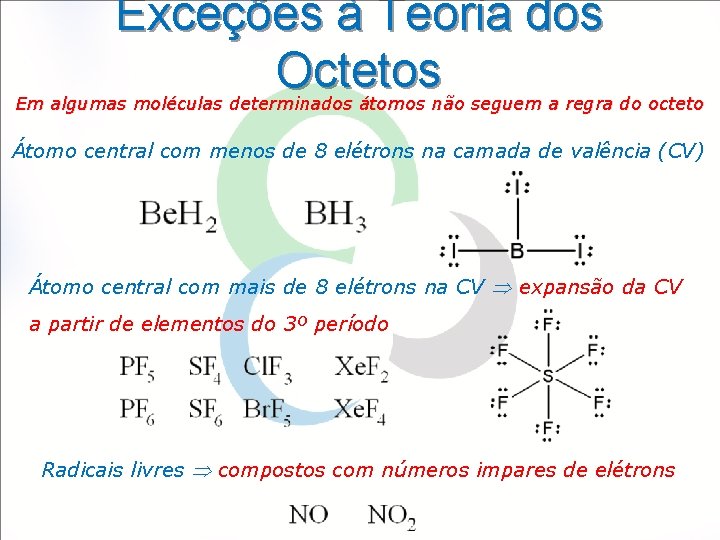
Exceções à Teoria dos Octetos Em algumas moléculas determinados átomos não seguem a regra do octeto Átomo central com menos de 8 elétrons na camada de valência (CV) Átomo central com mais de 8 elétrons na CV expansão da CV a partir de elementos do 3º período Radicais livres compostos com números impares de elétrons

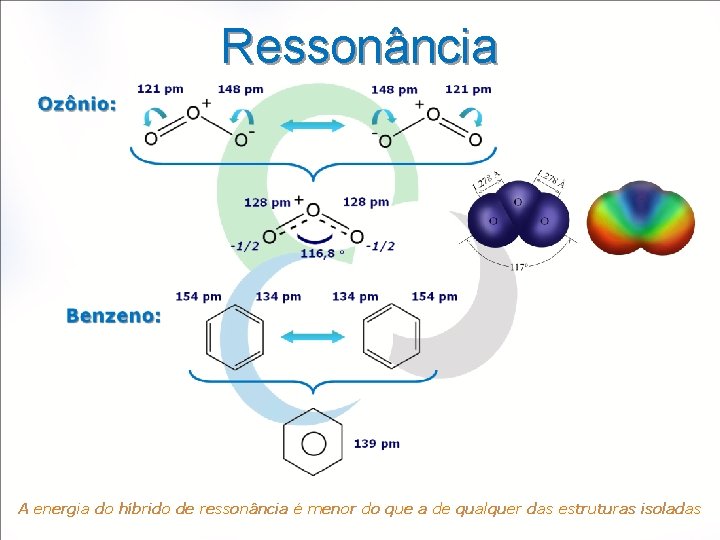
Ressonância A energia do híbrido de ressonância é menor do que a de qualquer das estruturas isoladas

ações Múltiplas – Ordem de Ligação ( OL relacionada ao número de pares de elétrons compartilhados Exemplos: O. L. = 1 Br-Br H-Cl O. L. = 2 O=C=O H 2 C=CH 2 O. L. = 3 N N : C O: H-O-H CH 4 HC CH Ordem de Ligação Fracionária Estruturas Ressonantes O 3 (1, 5) CO 32 - (1, 33) C 6 H 6 (1, 5)

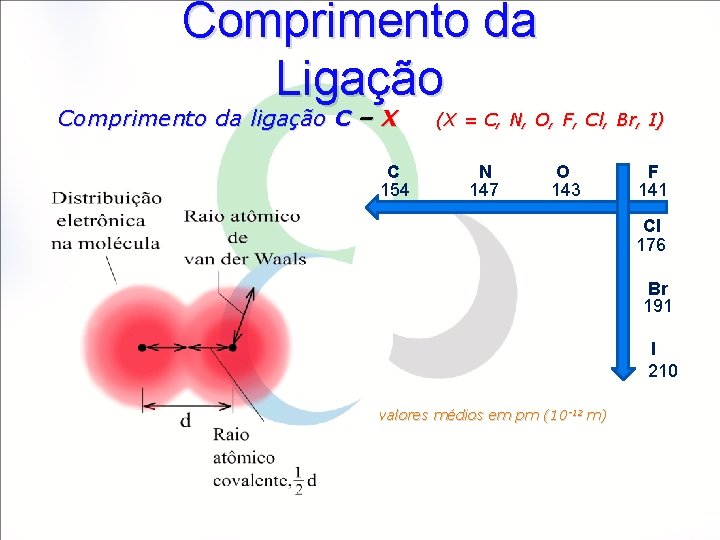
Comprimento da Ligação Comprimento da ligação C – X C 154 (X = C, N, O, F, Cl, Br, I) N 147 O 143 F 141 Cl 176 Br 191 I 210 valores médios em pm (10 -12 m)

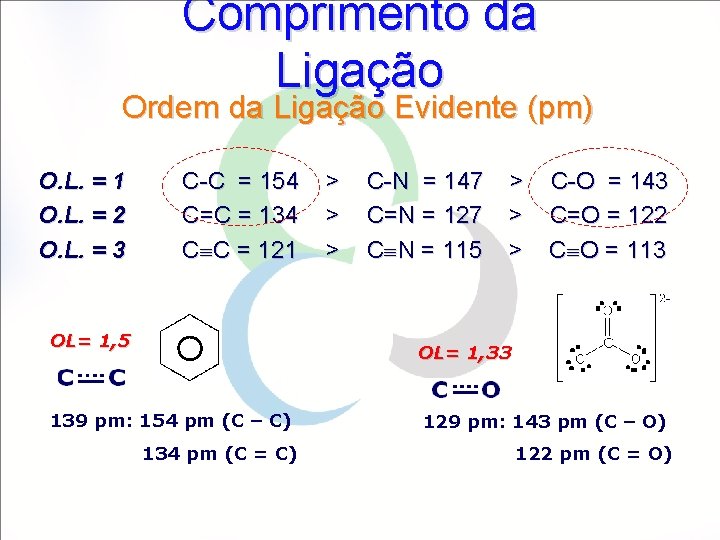
Comprimento da Ligação Ordem da Ligação Evidente (pm) O. L. = 1 O. L. = 2 O. L. = 3 C-C = 154 C=C = 134 C C = 121 OL= 1, 5 > > > C-N = 147 C=N = 127 C N = 115 > > > C-O = 143 C=O = 122 C O = 113 OL= 1, 33 139 pm: 154 pm (C – C) 134 pm (C = C) 129 pm: 143 pm (C – O) 122 pm (C = O)

Energia da Ligação Entalpia de Dissociação de Ligação (D) refere-se à energia necessária para quebrar uma ligação covalente D da molécuxla Cl-Cl é dada pelo H da reação: Cl 2(g) 2 Cl(g) H = 242 k. J Quando mais de uma ligação é quebrada: CH 4(g) C(g) + 4 H(g) H = 1664 k. J D será uma fração do H para a reação de atomização: D(C-H) = ¼ H = ¼(1664 k. J) = 416 k. J