Enlace covalente Introduccin Estructuras de Lewis 1 Enlace












- Slides: 22

Enlace covalente Introducción Estructuras de Lewis 1

Enlace covalente ¢ ¢ Se da entre dos átomos no-metálicos por compartición de e– de valencia. Dos átomos unidos mediante enlace covalente tienen menos energía que los dos átomos aislados. ¢ Al igual que en el enlace iónico la formación de un enlace covalente va acompañada de un desprendimiento de energía. ¢ Se llama energía de enlace a la energía necesaria para romper 1 mol de un energía de enlace determinado tipo de enlace. ¢ Es siempre endotérmica (positiva). ¢ Ejemplo: para romper 1 mol de H 2 (g) en 2 moles de H (g) se precisan 436 k. J, Eenlace(H–H) = + 436 k. J ¢ La distancia a la que se consigue mayor estabilidad se llama “distancia de enlace”. enlace

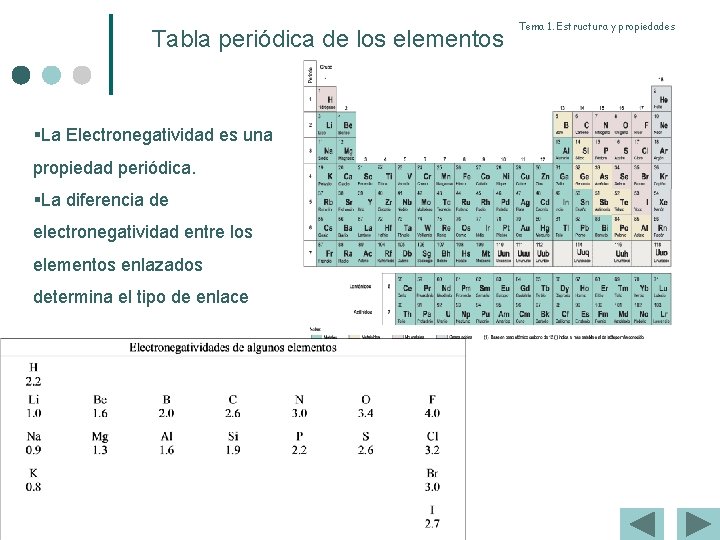
Tabla periódica de los elementos §La Electronegatividad es una propiedad periódica. §La diferencia de electronegatividad entre los elementos enlazados determina el tipo de enlace Tema 1. Estructura y propiedades

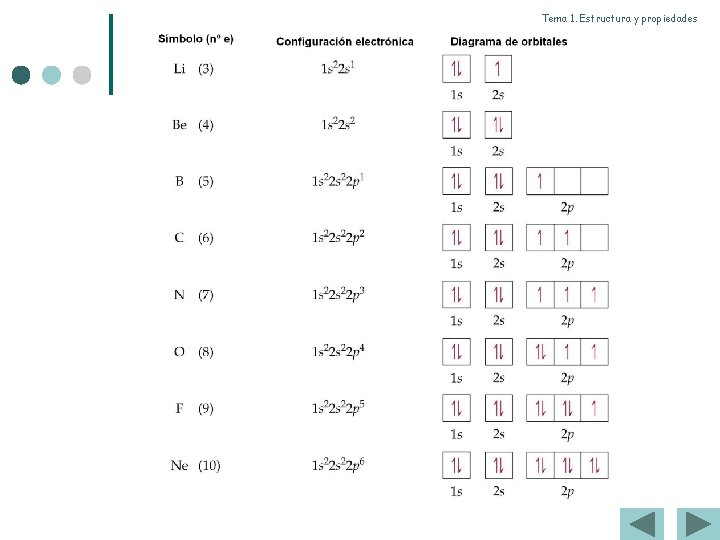
Teoría de Lewis Se basa en las siguientes hipótesis: ¢ Los átomos para conseguir 8 e– en su última capa comparten tantos electrones como le falten para completar su capa (regla del octete). ¢ Cada pareja de e– compartidos forma un enlace. ¢ Se pueden formar enlaces sencillos (los dos átomos comparten un par de e– , dobles (comparten 2 pares de e– y triples (comparten 3 pares de e– )

Estructuras de Lewis: estándares de aprendizaje Sustancias e iones que figuran en el listado de los estándares de aprendizaje ordenados según dificultad creciente (en mi opinión) H 2 Cl 2 O 2 N 2 HCl H 2 O NH 3 CCl 4 CH 4 CO 2 HCN Excepciones a la regla del octete Be. Cl 2 BF 3 C 2 H 6 CH 4 O C 2 H 4 CH 2 O 2 C 2 H 2 SO 2 H 3 O+ NH 4+ CO 32 - NO 3 -

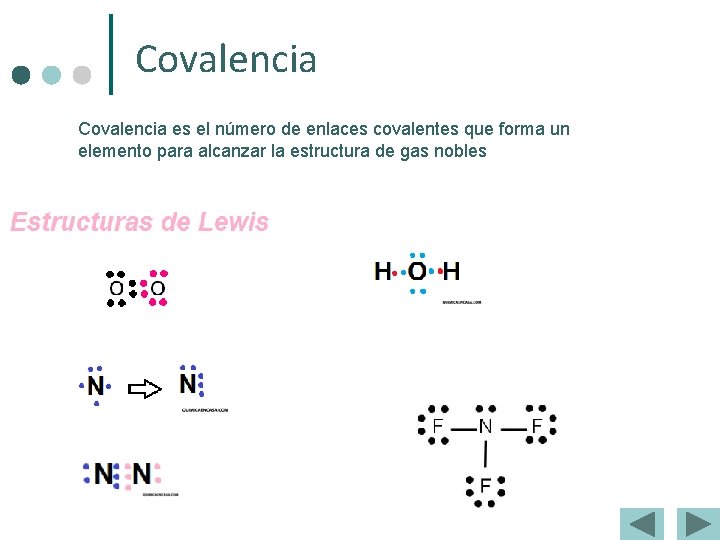
Estructura de Lewis. Consiste en representar con puntos “·” o “x” los electrones de la capa de valencia alrededor del símbolo del elemento correspondiente Ejemplos: ¢ ¢ Grupo: 17 16 15 14 ¢ Átomo: Cl O N C ¢ Nº e– val. 7 6 5 4

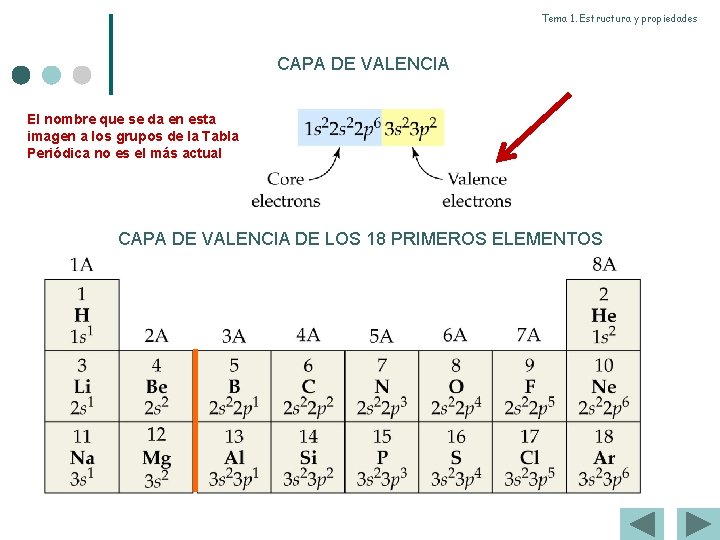
Tema 1. Estructura y propiedades CAPA DE VALENCIA El nombre que se da en esta imagen a los grupos de la Tabla Periódica no es el más actual CAPA DE VALENCIA DE LOS 18 PRIMEROS ELEMENTOS

Tema 1. Estructura y propiedades

Enlace covalente. ¢ Covalente simple: Se comparten una pareja de electrones. ¢ Covalente doble: Se comparten dos parejas de electrones. ¢ Covalente triple: Se comparten tres parejas de electrones. ¢ No es posible un enlace covalente cuádruple entre dos átomos por razones geométricas. ¢ Si uno de los átomos enlazados aporta los 2 e– del enlace y el otro ninguno se denomina ”Enlace covalente coordinado” o “dativo”

Estructuras de Lewis 1. A partir de la fórmula del compuesto sabemos el nº y tipo de átomos de cada elemento presentes en la molécula. 2. Determinar el nº de electrones de valencia a partir de la configuración electrónica de cada elemento. 3. Establecer el nº de electrones que necesita cada elemento para adquirir la configuración de gas noble porque ese número nos indicará el número de enlaces que formará dicho elemento. ¢ Ejemplos: Grupo: 17 16 15 14 Átomo: Cl O N C Nº e– val. 7 6 5 4 nº de enlaces 1 2 3 4


Ejemplo: caso de la molécula de agua ¢ ¢ ¢ Si deseo realizar la estructura de Lewis para el agua (H 2 O), necesito realizar la configuración electrónica del hidrógeno y del oxígeno: H: z = 1 1 s 1 electrones de valencia: 1 O: z = 8 1 s 2 2 p 4 electrones de valencia: 6 Represento las estructuras de Lewis de los átomos: del átomo de oxígeno y de hidrógeno Como el átomo de oxígeno posee dos posibilidades de enlazarse y el hidrógeno solo una, entonces el átomo central será el oxígeno, quedando: Estructura de Lewis de la molécula de agua

Covalencia es el número de enlaces covalentes que forma un elemento para alcanzar la estructura de gas nobles

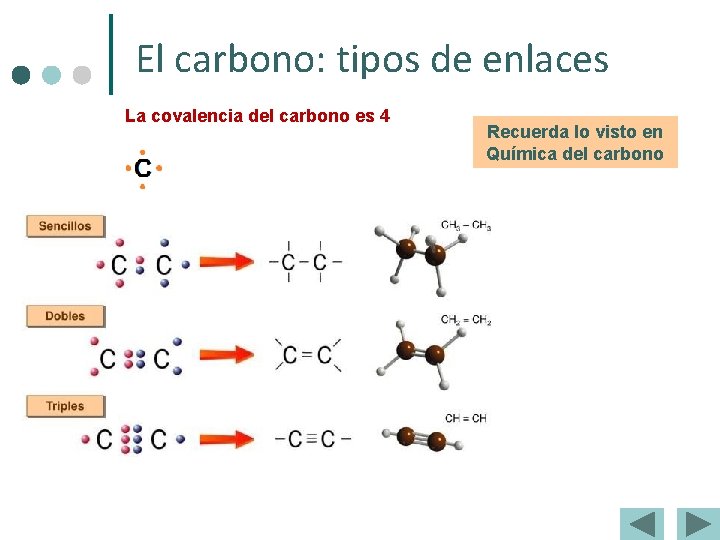
El carbono: tipos de enlaces La covalencia del carbono es 4 Recuerda lo visto en Química del carbono

Pasos para Determinar la estructura de Lewis ¢ En los casos sencillos como los de las moléculas diatómicas la estructura de Lewis se hace prácticamente a ojo. En el caso de moléculas más complejas la cosa ya no es tan evidente. ¢ https: //atomicool. com/estructura-de-lewis/

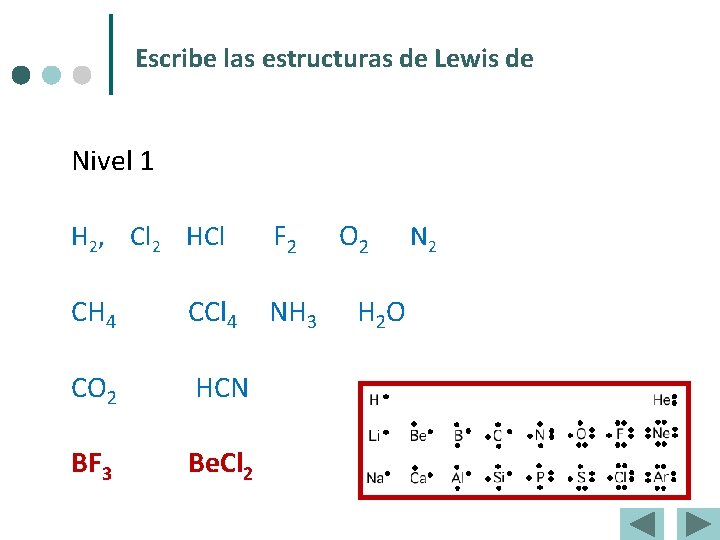
Escribe las estructuras de Lewis de Nivel 1 H 2, Cl 2 HCl F 2 O 2 N 2 CH 4 CCl 4 NH 3 H 2 O CO 2 HCN BF 3 Be. Cl 2

H 2, Cl 2 HCl F 2 O 2 N 2 ¢ Antes de pasar a la siguiente diapositiva trata de representar las estructuras de Lewis de las sustancias que se indica. Son las más sencillas puesto que sólo hay 2 átomos por molécula

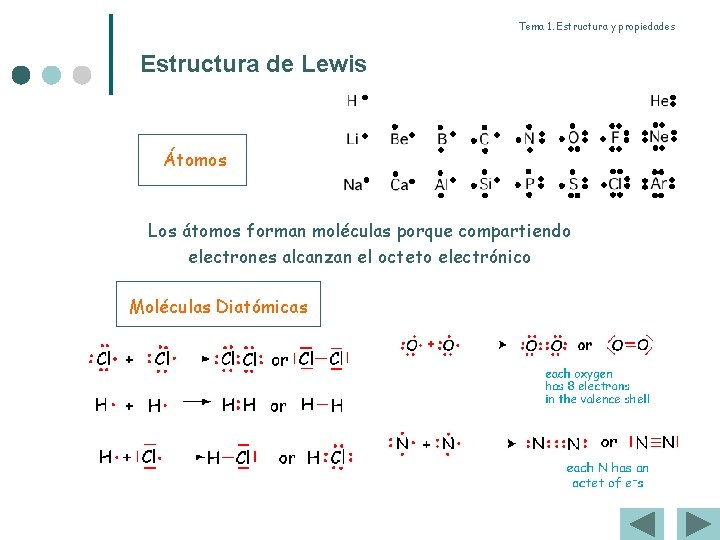
Tema 1. Estructura y propiedades Estructura de Lewis Átomos Los átomos forman moléculas porque compartiendo electrones alcanzan el octeto electrónico Moléculas Diatómicas

Escribe las estructuras de Lewis de CH 4 CCl 4 NH 3 H 2 O CO 2 HCN 1ºPiensa en la covalencia de cada elemento. Si un elemento tiene de covalencia 1 necesariamente estará en un extremo. 2º Si un elemento tiene de covalencia 2 como es el caso del oxígeno podrá hacer dos enlaces sencillos, uno con cada elemento o podrá hacer un enlace doble con un mismo elementos. Las comentaremos y corregiremos en la video llamada

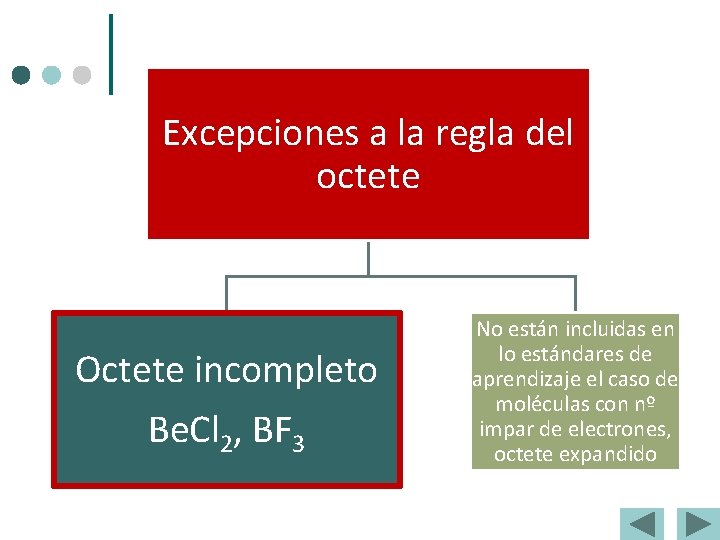
Excepciones a la regla del octete Octete incompleto Be. Cl 2, BF 3 No están incluidas en lo estándares de aprendizaje el caso de moléculas con nº impar de electrones, octete expandido

Octete incompleto

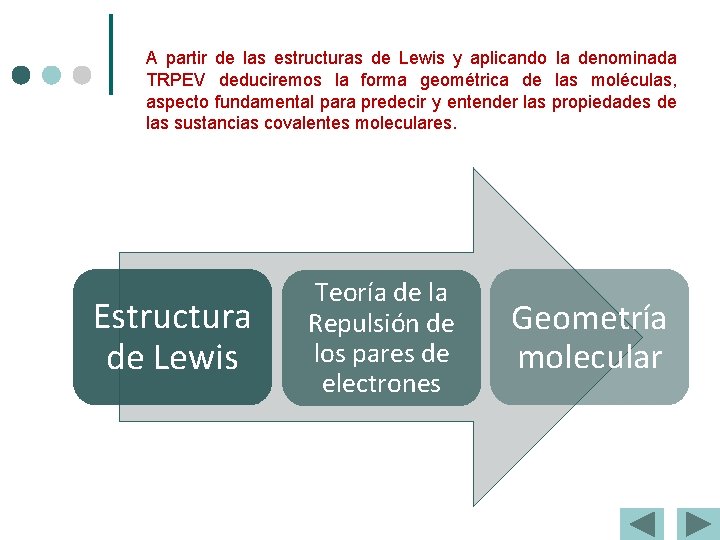
A partir de las estructuras de Lewis y aplicando la denominada TRPEV deduciremos la forma geométrica de las moléculas, aspecto fundamental para predecir y entender las propiedades de las sustancias covalentes moleculares. Estructura de Lewis Teoría de la Repulsión de los pares de electrones Geometría molecular
 Quimica polar
Quimica polar Molecula polar y apolar
Molecula polar y apolar Estructura de lewis de f2
Estructura de lewis de f2 Enlace covalente dativo
Enlace covalente dativo Enlace covalente
Enlace covalente Enlace triple sigma y pi
Enlace triple sigma y pi 10 ejemplos fuerzas de van der waals ejemplos
10 ejemplos fuerzas de van der waals ejemplos Enlace covalente heteronuclear
Enlace covalente heteronuclear Enlaces metalicos
Enlaces metalicos Electrones de valencia ejemplos
Electrones de valencia ejemplos Diatomica
Diatomica Enlace covalente polar
Enlace covalente polar Carga formal formula
Carga formal formula Mgf2 estructura de lewis
Mgf2 estructura de lewis Covalente apolar
Covalente apolar Covalente no polar ejemplos
Covalente no polar ejemplos Enlace qumico
Enlace qumico Enlace covalente homopolar
Enlace covalente homopolar Propiedades fisicas del enlace metalico
Propiedades fisicas del enlace metalico Introducción de las enzimas
Introducción de las enzimas Introduccin
Introduccin Introduccin
Introduccin Introduccin
Introduccin








































