ENLACE COVALENTE 1 Teora de Enlace de Valencia







- Slides: 15

ENLACE COVALENTE (1) Teoría de Enlace de Valencia Geometría: Hibridación de

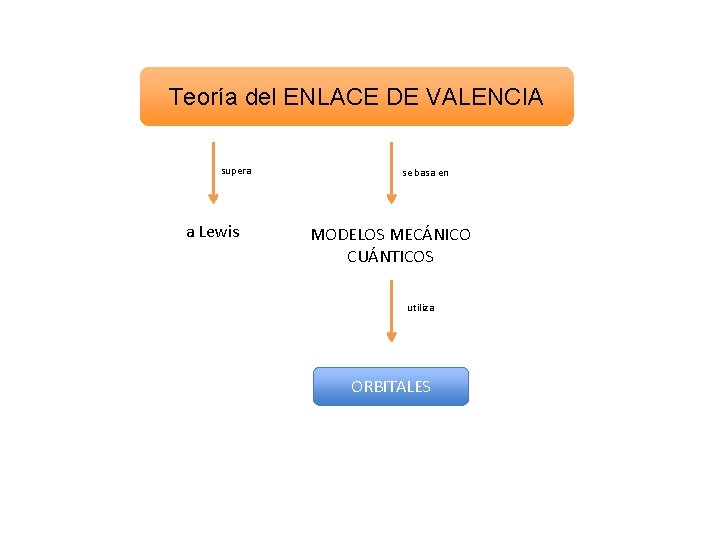
Teoría del ENLACE DE VALENCIA supera a Lewis se basa en MODELOS MECÁNICO CUÁNTICOS utiliza ORBITALES

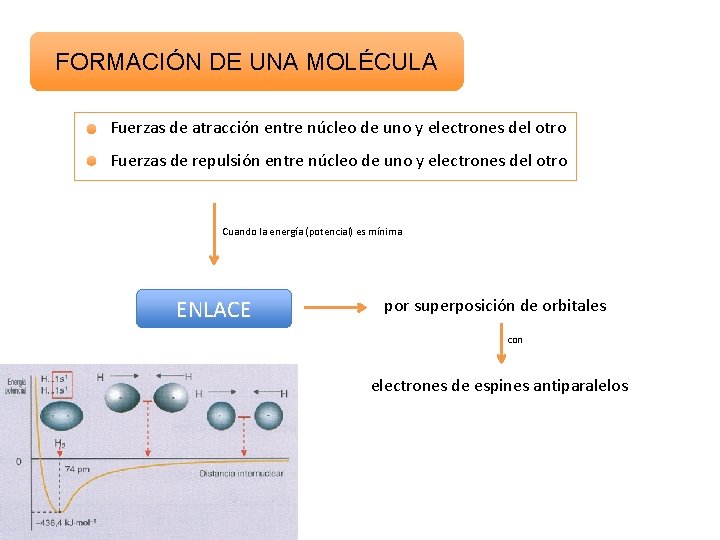
FORMACIÓN DE UNA MOLÉCULA Fuerzas de atracción entre núcleo de uno y electrones del otro Fuerzas de repulsión entre núcleo de uno y electrones del otro Cuando la energía (potencial) es mínima ENLACE por superposición de orbitales con electrones de espines antiparalelos

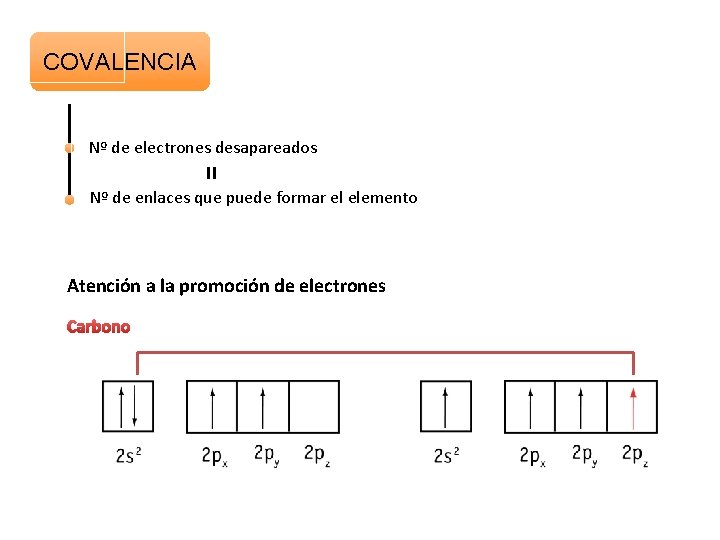
COVALENCIA Nº de electrones desapareados Nº de enlaces que puede formar el elemento Atención a la promoción de electrones Carbono

RECORDANDO ALGUNAS IDEAS SOBRE HIBRIDACIÓN • La geometría de las moléculas viene dada por la dirección de los electrones que se solapan. • Se forman tantos orbitales híbridos como orbitales se solapan. • Todos los orbitales híbridos tienen la misma energía. • En cada orbital híbrido caben dos electrones.

TIPOS DE HIBRIDACIONES DEL CARBONO • Hay que tener en cuenta la promoción de del electrón de 2 s 2 al orbital 2 p 3. • Enlace simple: hibridación sp 3. (ej. metano) • Enlace doble: hibridación sp 2. (ej. eteno) • Enlace triple: hibridación sp (ej. etino). También se produce cuando el carbono tiene dos dobles enlaces. 15/06/2021 3: 47 6

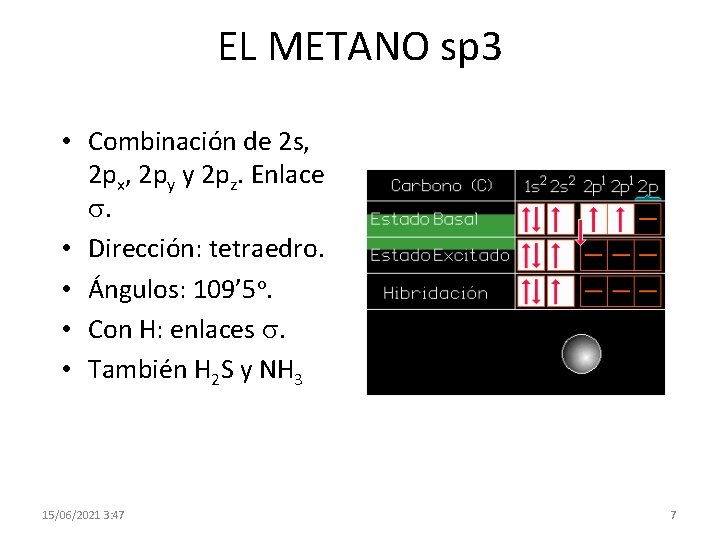
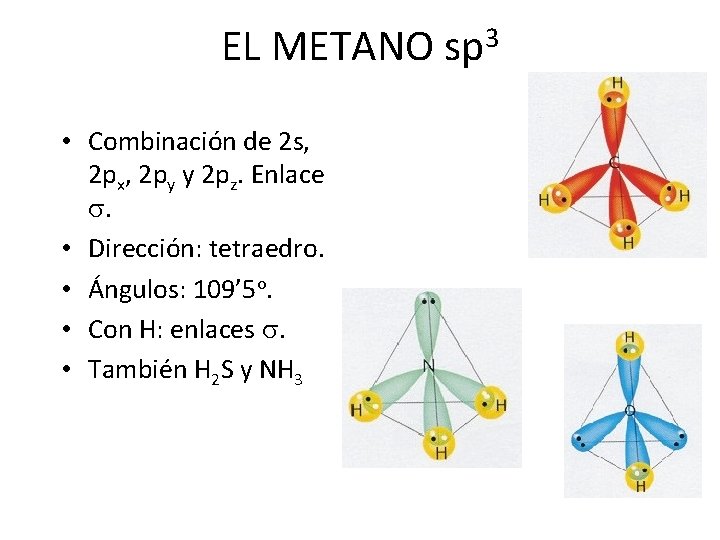
EL METANO sp 3 • Combinación de 2 s, 2 px, 2 py y 2 pz. Enlace s. • Dirección: tetraedro. • Ángulos: 109’ 5 o. • Con H: enlaces s. • También H 2 S y NH 3 15/06/2021 3: 47 7

EL METANO sp 3 • Combinación de 2 s, 2 px, 2 py y 2 pz. Enlace s. • Dirección: tetraedro. • Ángulos: 109’ 5 o. • Con H: enlaces s. • También H 2 S y NH 3

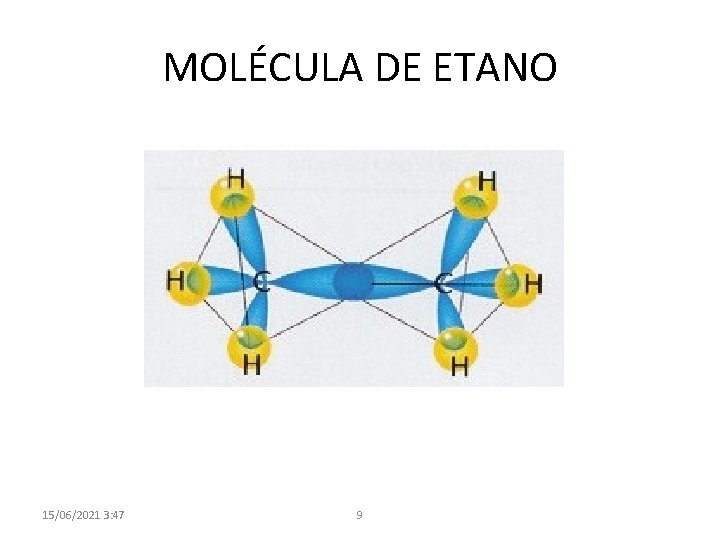
MOLÉCULA DE ETANO 15/06/2021 3: 47 9

EL ETENO sp 2 • Combinación de 2 s y dos orbitales p. • Dirección: vértices de un triángulo equilátero. • Ángulo: 120 o • Un enlace p y otro s. • Con hidrógenos: s

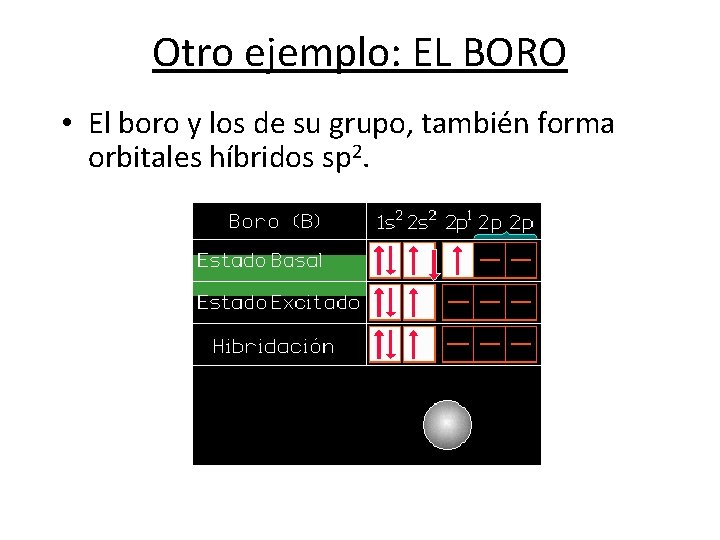
Otro ejemplo: EL BORO • El boro y los de su grupo, también forma orbitales híbridos sp 2.

EL ETINO(acetileno): sp • Combinación de 2 s con un orbital p. • Dirección: lineal. • Ángulo: 180 o • Dos enlaces p y uno s. • Con hidrógenos: s • En el CO 2 también tiene este tipo de hibridación. 15/06/2021 3: 48 12

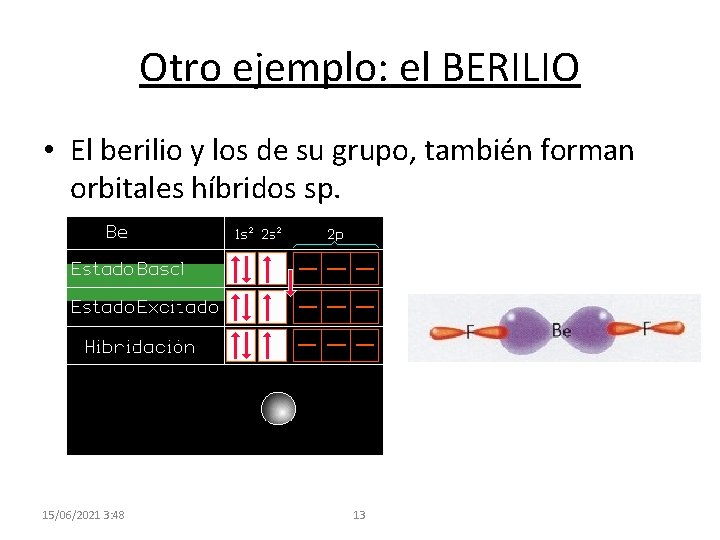
Otro ejemplo: el BERILIO • El berilio y los de su grupo, también forman orbitales híbridos sp. 15/06/2021 3: 48 13

profesorjano

www. profesorjano. org www. profesorjano. com profesorjano@gmail. com
 Electrones de valencia ejemplos
Electrones de valencia ejemplos Hibridación trigonal
Hibridación trigonal Covalente apolar
Covalente apolar Estructura de lewis 2hcl
Estructura de lewis 2hcl Carga formal formula
Carga formal formula Covalente apolar
Covalente apolar Ejemplo de un enlace polar
Ejemplo de un enlace polar Enlace covalente dativo
Enlace covalente dativo Fqcolindres 2 eso
Fqcolindres 2 eso Hio4 lewis
Hio4 lewis Como calcular diferencia de electronegatividad
Como calcular diferencia de electronegatividad Enlaces quimicos mapa mental
Enlaces quimicos mapa mental Enlace covalente normal
Enlace covalente normal Enlace dativo
Enlace dativo Enlace covalente
Enlace covalente Enlaces sigmas
Enlaces sigmas



























